
Сульфатид, также известный как 3-O-сульфогалактозилцерамид , SM4 или сульфатированный галактоцереброзид , представляет собой класс сульфолипидов , в частности класс сульфогликолипидов, которые представляют собой гликолипиды , содержащие сульфатную группу. [1] Сульфатид синтезируется в первую очередь, начиная с эндоплазматического ретикулума и заканчивая аппаратом Гольджи , где церамид преобразуется в галактоцереброзид и позже сульфатируется с образованием сульфатида. Из всех галактолипидов , которые находятся в миелиновой оболочке , пятая часть из них являются сульфатидом. Сульфатид в основном находится на внеклеточном листке миелиновой плазматической мембраны , вырабатываемой олигодендроцитами в центральной нервной системе и в шванновских клетках в периферической нервной системе . Однако сульфатид также присутствует на внеклеточном слое плазматической мембраны многих клеток эукариотических организмов. [2]
Поскольку сульфатид является многофункциональной молекулой, его можно использовать в различных биологических областях. Помимо того, что он является компонентом мембраны, сульфатид функционирует в транспорте белков , агрегации и адгезии клеток , нейронной пластичности , памяти и взаимодействии глии и аксонов. Сульфатид также играет роль в нескольких физиологических процессах и системах, включая нервную систему , иммунную систему , секрецию инсулина , свертывание крови , вирусную инфекцию и бактериальную инфекцию . В результате сульфатид связан, способен связываться и/или присутствует в тканях почек , раковых клетках/тканях, поверхности эритроцитов и тромбоцитов , клетках CD1 ad в иммунной системе, многих бактериальных клетках, нескольких вирусах , миелине, нейронах и астроцитах .
Аномальный метаболизм или изменение экспрессии сульфатида также связаны с различными патологиями, включая нейропатологии, такие как метахроматическая лейкодистрофия , болезнь Альцгеймера и болезнь Паркинсона . Сульфатид также связан с сахарным диабетом , метастазами рака и вирусами, включая ВИЧ-1 , вирус гриппа А , гепатит С и вирус коровьей оспы . Кроме того, повышенная экспрессия сульфатида связана с эпилепсией и аудиогенными припадками, а также другими патологическими состояниями нервной системы .
Прошлые и текущие исследования продолжают прояснять многочисленные биологические функции сульфатида и их многочисленные последствия, а также патологию , связанную с сульфатидом. Большинство исследований используют мышиные модели , но также используются гетерологичные системы экспрессии , включая, но не ограничиваясь, клетки почек собак Madin-Darby и клетки COS-7 . [2] [3]
Сульфатид был первым сульфогликолипидом, выделенным из человеческого мозга . Он был назван сульфатидом в 1884 году Иоганном Людвигом Вильгельмом Тудихумом, когда он опубликовал «Трактат о химической конституции мозга». [1] Первоначально, в 1933 году, Бликс впервые сообщил, что сульфатид содержит амидную связанную жирную кислоту и 4-сфингенин, и что сульфат сульфатида, как предполагалось, присоединен к позиции C6 галактозы . [3] [4] Это снова было подтверждено в 1955 году Таннхаузером и Шмидтом; однако, с помощью газожидкостной хроматографии , Тамио Ямакава обнаружил, что сульфат на самом деле присоединен к позиции C3 галактозы , а не к позиции C6. [4] Таким образом, в 1962 году Ямакава завершил исправленную химическую структуру сульфатида. [5]

Синтез сульфатида начинается с реакции между UDP-галактозой и 2-гидроксилированным или негидроксилированным церамидом . Эта реакция катализируется галактозилтрансферазой (CGT), где галактоза переносится в 2-гидроксилированный или негидроксилированный церамид из UDP-галактозы. [1] Эта реакция происходит в люминальном листке эндоплазматического ретикулума , и ее конечным продуктом является GalCer, или галактоцереброзид, который затем транспортируется в аппарат Гольджи . [1] [2] Здесь GalCer реагирует с 3'-фосфоаденозин-5'-фосфосульфатом ( PAPS ), образуя сульфатид. Эта реакция катализируется цереброзидсульфотрансферазой (CST). [1] CST представляет собой гомодимерный белок, который находится в аппарате Гольджи . [1] Было продемонстрировано, что мышиные модели, у которых отсутствуют CST, CGT или оба, не способны вырабатывать сульфатид, что указывает на то, что CST и CGT являются необходимыми компонентами синтеза сульфатида. [2]
Деградация сульфатида происходит в лизосомах . Здесь арилсульфатаза А гидролизует сульфатную группу. [1] Однако для осуществления этой реакции должен присутствовать белок-активатор сфинголипидов, такой как сапозин В. [2] Сапозин В извлекает сульфатид из мембраны, что делает его доступным для арилсульфатазы А. [1] Затем арилсульфатаза А может гидролизовать сульфатную группу. Накопление сульфатида может вызвать метахроматическую лейкодистрофию , лизосомную болезнь накопления , и может быть вызвано дефектом арилсульфатазы А, что приводит к неспособности деградировать сульфатид. [2] [3]
Сульфатид участвует во многих биологических системах и функциях, включая нервную систему , иммунную систему и гемостаз / тромбоз . Также было показано, что сульфатид играет второстепенную роль в почках .
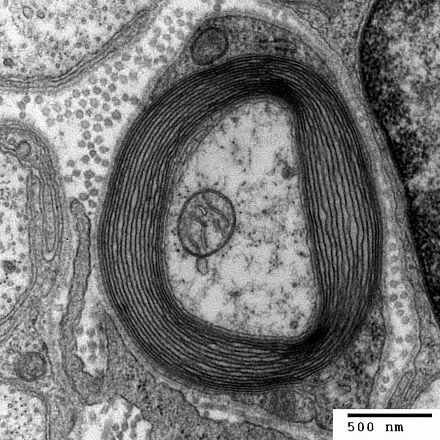
Сульфатид является основным компонентом нервной системы и в больших количествах содержится в миелиновой оболочке как периферической , так и центральной нервной системы . Миелин обычно состоит примерно из 70–75% липидов , а сульфатид составляет 4–7% из этих 70–75%. [2] При недостатке сульфатида миелиновая оболочка все еще образуется вокруг аксонов ; однако при недостатке сульфатида боковые петли и часть перехватов Ранвье дезорганизованы, поэтому миелиновая оболочка не функционирует должным образом. [5] Таким образом, недостаток сульфатида может привести к мышечной слабости, тремору и атаксии . [5]
Повышенные уровни сульфатида также связаны с метахроматической лейкодистрофией , которая приводит к прогрессирующей потере миелина в результате накопления сульфатида в шванновских клетках , олигодендроцитах , астроцитах , макрофагах и нейронах . [1] [2] Повышенные уровни сульфатида также связаны с эпилепсией и аудиогенными припадками (припадками, вызванными звуком), в то время как повышенные уровни антител к сульфатиду в сыворотке связаны с рассеянным склерозом и болезнью Паркинсона . [2]
Как указано выше, сульфатид в основном обнаруживается в олигодендроцитах и шванновских клетках нервной системы . Когда олигодендроциты дифференцируются , сульфатид сначала обнаруживается в незрелых олигодендроцитах. [1] Однако исследования показывают, что сульфатид играет более важную роль, чем просто является структурным компонентом мембраны. [1] Это происходит потому, что сульфатид повышается , т. е. происходит увеличение сульфатида до того, как миелиновая оболочка обернется вокруг аксона , и эксперименты на мышах с дефицитом цереброзидсульфотрансферазы (CST) показали, что сульфатид действует как отрицательный регулятор (ингибитор) дифференциации олигодендроцитов . [1] Соответственно, дальнейшие исследования продемонстрировали, что при дефиците сульфатида наблюдается двух-трехкратное увеличение дифференциации олигодендроцитов , что подтверждает, что сульфатид действует как отрицательный регулятор или ингибитор дифференциации олигодендроцитов . [1] Миелинизация также, по-видимому, стимулируется сульфатидом в шванновских клетках . Считается, что такая стимуляция происходит посредством следующих взаимодействий. Во-первых, сульфатид связывается с тенасцином-R или ламинином во внеклеточном матриксе , который затем связывает сигнальные молекулы, такие как F3 и интегрины в глиальной мембране. [1] Это вызывает передачу сигналов через c-src / fyn киназу. В частности, ламинин α6β1- интегрин образует комплекс с fyn киназой и фокальной адгезионной киназой , что обеспечивает передачу сигналов, что, в свою очередь, вызывает начало миелинизации . [1] Связывание сульфатида с ламинином также вызывает активацию c-src / fyn киназы и инициацию образования базальной мембраны. [1]
Сульфатид также ассоциируется с миелином и лимфоцитарным белком (MAL). Исследования показали, что MAL может участвовать в везикулярном транспорте сульфатида и других миелиновых белков и липидов в миелинизирующую мембрану. [3] Также считается, что MAL образует мембранные микродомены (небольшие области на мембране с различной структурой и функцией), в которых липиды , такие как сульфатид, стабилизируются в липидные плоты , что позволяет стабилизировать глиально-аксонные соединения. [1]
Также было показано, что сульфатид играет роль в поддержании миелина и глиально-аксонной сигнализации, что было выявлено в ходе исследований на старых мышах с дефицитом цереброзидсульфотрансферазы (CST). [3] У этих мышей наблюдалась вакуолярная дегенерация, неуплотненный миелин и умеренная демиелинизация спинного мозга . [1] [3] Это происходит из-за того, что неправильная глиально-аксонная сигнализация и контакт, а также нарушение паранодальных глиально-аксонных соединений вызывают неправильное размещение и поддержание кластеров натриевых и калиевых каналов в аксонах в перехватах Ранвье . [3] В результате нарушается поддержание натриевых кластеров Nav1.6 , поскольку уменьшается количество кластеров натриевых каналов в перехватах Ранвье . [1] Кроме того, каналы Kv1.2 перемещаются из паранодального положения в юкстапаранодальное положение, что приводит к нарушению этих каналов; это также связано с потерей кластеров нейрофасцина 155 и Caspr , которые являются важными компонентами глиально-аксонного соединения. [1]
Сульфатид также важен для глиально-аксональных соединений в периферической нервной системе . В периферических нервах с дефицитом цереброзидсульфотрансферазы (CST) перехваты Ранвье образуют увеличенные аксональные выступы, заполненные увеличенными пузырьками , а кластеры нейрофасцина 155 и Caspr уменьшены или отсутствуют. [1] Для формирования паранодального соединения Caspr и контактин образуют комплекс с нейрофасцином 155. [1] Было показано, что сульфатид может участвовать в наборе и образовании нейрофасцина 155 в липидных плотах ; кластеры белка нейрофасцина 155 затем переносят Caspr и контактин в мембрану для формирования комплекса, который позволяет формировать стабильные глиально-аксональные соединения. [1] Следовательно, сульфатид играет важную роль в поддержании паранодальных глиально-аксональных соединений, что обеспечивает правильное глиально-аксональное взаимодействие и передачу сигналов. [1] [3] Также было показано, что сульфатид является ингибитором миелин-ассоциированного разрастания аксонов, и небольшие количества сульфатида были обнаружены в астроцитах и нейронах , что также указывает на его важность в глиально-аксональных соединениях. [3]
Аномальная экспрессия сульфатида связана с несколькими неврологическими расстройствами . Как уже говорилось, одним из основных неврологических расстройств является метахроматическая лейкодистрофия , которая вызвана повышенным уровнем сульфатида, что приводит к прогрессирующей потере миелина в результате накопления сульфатида. [2] [3] Высокие уровни сульфатида в сером веществе мозжечка и верхней лобной доли связаны с болезнью Паркинсона . [ 2 ] Кроме того, накопление сульфатида в нейронах вызывает аудиогенные припадки , которые, как было показано в мышиных моделях , являются летальными . [2] С другой стороны, пониженные уровни сульфатида в сером и белом веществе мозга связаны с болезнью Альцгеймера . [2] [6]
Различные типы клеток, представляющие антигены на своей поверхности, включают: [3]

Каждый из этих различных типов клеток экспрессируется в кластере молекул дифференцировки 1 (CD1). [3] Существует 5 подтипов молекул CD1 , которые варьируются от a до e. Подтипы от a до d способны связываться с сульфатидом. [2] Подтипы CD1a , CD1b и CD1c представляют липидные антигены Т-клеткам , в то время как клетки CD1d представляют липиды , гликолипиды и липопротеины естественным киллерам Т-клеткам . Подтипы клеток CD1a-c инициируют ответы Т-хелперов типа 1 и типа 2, и они способствуют загрузке сульфатида на поверхность клеток. [3] Существует два типа подтипов клеток, которые взаимодействуют с клетками CD1d : естественные киллеры Т-клеток типа 1 и естественные киллеры Т-клеток типа 2. [2] Естественные киллеры Т-клеток типа 2 способны распознавать сульфатид/ тетрамеры CD1d , и в результате они активируются различными тканевыми специфическими формами сульфатида. Естественные клетки-киллеры Т типа 2, которые реагируют с сульфатидом, помогают защищать от аутоиммунных заболеваний и ишемической реперфузии. [3] Они способны на такую защиту, поскольку естественные клетки-киллеры Т типа 1 могут регулироваться естественными клетками-киллерами Т типа 2, которые реагируют с сульфатидом, изменяя способ функционирования дендритных клеток . [3]
Сульфатид также действует как лиганд L-селектина и P-селектина , но не действует как лиганд E-селектина. [3] Селектины — это молекулы адгезии, которые облегчают захват циркулирующих лейкоцитов . Сульфатид также экспрессируется на поверхности многих типов раковых клеток и тканей. Соответственно, сульфатид может функционировать как лиганд для P-селектина, что облегчает метастазирование рака . [3] Кроме того, когда L-селектин и сульфатид связываются, наблюдается повышение экспрессии хемокинового корецептора ( CXCR4 ) , особенно на поверхности лейкоцитов . [3]
Сульфатид также может функционировать как рецептор для хемокинов , которые являются небольшими хемостатическими цитокинами , и они обеспечивают направленные сигналы для движения лейкоцитов . [3] Хемокины участвуют в: [3]
Сульфатид также способен связываться с белками-мусорщиками, обнаруженными на макрофагах . Такое связывание облегчает способность макрофагов поглощать апоптотические клетки. [3]
Аутоиммунитет также влияет на уровень сульфатида. Когда происходит усиленный ответ антител против миелиновых липидов, включая сульфатид у пациентов с рассеянным склерозом , процесс демиелинизации значительно усиливается. [7] Когда присутствуют сульфатид и ганглиозиды , активируется пролиферация или продукция естественных клеток-киллеров Т, которые продуцируют цитокины . Однако, когда мышей с дефицитом CD1d тестируют на их реакцию на сульфатид, такой же ответ не наблюдается, что указывает на то, что в миелине сульфатид является гликолипидом , обладающим иммунодоминантностью . [7]
Локально разрушение миелина из-за инфильтрации Т-клеток и макрофагов приводит к фагоцитозу миелина микроглией или макрофагами , что позволяет предположить, что Т-клетки презентуют миелиновые липиды молекулами CD1 в местах воспаления. [7]
Сульфатид играет роль как в свертывании крови, так и в антикоагуляции. Сульфатид обладает антикоагуляционной активностью, когда связывается с фибриногеном , что предотвращает превращение фибриногена в фибрин . Сульфатид также оказывает прямое ингибирующее действие на тромбоз . [3] [8] С другой стороны, сульфатид также помогает улучшить свертываемость крови и тромбоз : во-первых, считается, что сульфатид помогает при тромбозе за счет своего участия в факторе свертывания XII ; во-вторых, связывание сульфатида с аннексином V ускоряет коагуляцию; в-третьих, взаимодействия сульфатида и P-селектина, выраженные на тромбоцитах, помогают обеспечить стабильную адгезию и агрегацию тромбоцитов . [3] [8] Однако большинство этих выводов были сделаны с использованием экзогенных форм сульфатида. Следовательно, необходимы дополнительные исследования и эксперименты с эндогенным сульфатидом, чтобы полностью понять роль сульфатида в коагуляции и тромбозе . [8] Сульфатид также присутствует в липопротеинах сыворотки , которые, как полагают, связаны с причиной и развитием сердечно-сосудистых заболеваний . [2]
Сульфатид также может быть обнаружен в почках . Хотя сульфатид не является необходимым для поддержания функции и структуры почек, он играет активную роль в различных аспектах работы почек. [3] Например, сульфатид является лигандом для L-селектина , который является рецептором, который можно обнаружить в почках. В частности, L-селектин является лимфоидным рецептором, а связывание между L-селектином и сульфатидом в интерстиции почек играет важную роль в проникновении моноцитов и инфильтрации в почки. [3] [5] Кроме того, сульфатид также обнаружен в железистом эпителии желудка и в апикальных мембранах дистальных почечных канальцев, где экспрессируются миелин и лимфоцитарный белок (MAL). MAL образует комплексы с сульфатидом и другими гликосфинголипидами , и было показано, что эти комплексы играют роль в апикальной сортировке и стабилизации областей, обогащенных сфингогликолипидами. [1] [3]
Было показано, что сульфатид играет роль или имеет некоторую связь с несколькими заболеваниями и инфекциями. Это включает сахарный диабет , рак и опухоли, метахроматическую лейкодистрофию , различные бактериальные инфекции и вирусы , включая ВИЧ-1 , гепатит С , вирус гриппа А и вирус коровьей оспы .

Метахроматическая лейкодистрофия , также известная как MLD, является рецессивным лизосомным нарушением накопления . Считается, что оно вызвано дефицитом арилсульфатазы A. [ 1] [9] Арилсульфатаза A является лизосомальной сульфатазой , которая способна гидролизовать 3-O-сульфогалактозилцерамид и 3-O-сульфолактозилцерамид. Как 3-O-сульфолактозилцерамид, так и 3-O-сульфогалактозилцерамид могут быть локализованы в основном в центральной нервной системе , а также в периферической нервной системе . [1] При отсутствии лизосомального фермента или мутациях в гене, кодирующем сапозин B, это может привести к накоплению лизосомального сульфатида , который затем развивается в метахроматическую лейкодистрофию . [1] [3]
Сульфатид играет важную роль в миелине . Миелин действует как изолирующая оболочка, которая окружает многие нервные волокна и увеличивает скорость проведения импульсов. Когда сульфатид не распределяется должным образом, он может повлиять на нормальное физиологическое проведение электрических импульсов между нервными клетками . [1] Это затем приводит к демиелинизации из-за накопления сульфатида и является основной причиной метахроматической лейкодистрофии . [1] [3]
Однако то, как накопление сульфатида вызывает демиелинизацию и невральную дегенерацию, до сих пор в основном неизвестно. [1] Метахроматическая лейкодистрофия приводит к неврологическим проявлениям, которые сосредоточены на нарушении центральной нервной системы и периферической нервной системы, включая следующее: судороги , прогрессирующие проблемы с координацией и речью, а также поведенческие нарушения. [10] Лечение все еще изучается и оценивается, но исследования на мышах показывают, что методы лечения, включая генную терапию , клеточную терапию с использованием клеток-предшественников олигодендроцитов , заместительную ферментную терапию или генную терапию, опосредованную аденоассоциированными вирусами и лентивирусами, могут оказаться эффективными в снижении последствий метахроматической лейкодистрофии . [1]
Сульфатид имеет несколько изоформ, включая C16:0, который в основном находится в секреторных гранулах и на поверхности мембраны β-клеток . Секреторные гранулы и β-клетки находятся в островках Лангерганса и в крысиных β-клетках TC3. [3] Исследования показали, что в поджелудочной железе мышей с диабетом II типа наблюдается дефицит C16:0. Дополнительные исследования показали, что C16:0 играет важную роль в улучшении сохранения кристаллов инсулина , и поскольку β-клетки поджелудочной железы секретируют инсулин, сульфатид способствует мономеризации инсулина, которая представляет собой расщепление инсулина на его основные компоненты или мономеры . [3] Следовательно, сульфатид необходим для поддержания нормальной секреции инсулина , которую сульфатид способен опосредовать посредством стимуляции кальций- зависимого экзоцитоза и аденозинтрифосфатных (АТФ) -чувствительных калиевых ионных каналов . [3] Сульфатид также может стимулировать сворачивание проинсулина , поскольку он может служить молекулярным шапероном для инсулина. [3]
При диагностике диабета I типа в сыворотке крови возникают повышенные антисульфатидные антитела . Такие антисульфатидные антитела предотвращают секрецию инсулина и экзоцитоз . [3] Однако исследования показали, что когда мышей с диабетом без ожирения лечат сульфатидом, это снижает возможное возникновение диабета с 85% у контрольных животных до 35% у экспериментальных животных. [3] Также общеизвестно, что сульфатид обладает противовоспалительными свойствами. В результате этих противовоспалительных свойств, которые способствуют блокировке L-селектина , было показано, что сульфатид предотвращает диабет I типа и подавляет инсулит у мышей с диабетом без ожирения. [3] Сульфатид также предотвращает апоптоз в клетках, секретирующих инсулин, предотвращая эффекты интерлейкина-1 бета (lL-1β), интерферона бета 1b (lFN-1β) и фактора некроза опухоли альфа (TNF-α), которые способствуют апоптозу . [3]
Сульфатид может также быть вовлечен не только в диабет I типа , но и диабет II типа . В частности, сульфатид способен ингибировать секрецию TNF-α . Когда у пациентов с диабетом II типа наблюдается низкий уровень сульфатида в сыворотке , а также повышенная продукция TNF-α , это обычно связано с резистентностью к инсулину . [3] Однако сульфатид может опосредовать подавление диабета II типа посредством активации калиевых белковых каналов. [3]
Повышенный уровень сульфатида распространен во многих тканях человеческого организма, включая многочисленные раковые ткани и клетки. [2] [3] К ним относятся:

Уровни сульфатида в этих раковых линиях и тканях могут различаться. Например, уровни сульфатида намного ниже в тканях недифференцированной мелкоклеточной карциномы и первичной плоскоклеточной карциномы легких у людей, чем в первичной аденокарциноме легких у людей. [3] При раке яичников у человека уровни сульфатида намного выше при злокачественном раке яичников, чем при доброкачественном раке яичников. [2] [3] Другие виды рака, такие как опухоль Вильмса, не демонстрируют экспрессии сульфатида. Поэтому, по-видимому, такие повышенные уровни сульфатида не являются универсальными для каждой формы рака, и необходимо провести больше экспериментов, чтобы подтвердить, что повышенные уровни сульфатида не являются просто артефактами культивируемых линий раковых клеток. [3]
Однако эксперименты с использованием линий клеток рака почки дали некоторое представление о механизме повышенного уровня экспрессии сульфатида в раковых клетках. [3] В частности, уровень цереброзидсульфотрансферазы (ЦСТ) повышается, поскольку она проходит по сигнальному пути , который включает: [3]
Этот путь приводит к накоплению сульфатида в клеточных линиях рака почки . [3] Кроме того, сульфатид может накапливаться на поверхности раковых клеток. Это указывает на то, что сульфатид может служить специфическим лигандом для P-селектина . Это будет способствовать увеличению метастазирования рака. [3] Однако необходимы дополнительные исследования для выяснения связи между повышенными уровнями экспрессии сульфатида и механизмами инициации и метастазирования рака, [3] но сульфатид может быть полезным сывороточным биомаркером для раннего обнаружения опухолей. [2]
Эксперименты с сульфатидом показали, что он участвует в ряде вирусных инфекций, включая ВИЧ-1 , вирус гриппа А , гепатит С и вирус коровьей оспы .

Сульфатид участвует в инфекции ВИЧ-1 . [2] gp120 - gp41 - это особые типы комплексов гликопротеинов оболочки , которые обнаруживаются на ВИЧ-1. [3] Эти комплексы гликопротеинов могут взаимодействовать с CD4 , молекулой вирусного рецептора, что вызывает изменение конформации gp120. Это изменение конформации позволяет комплексу gp120 взаимодействовать с корецептором хемокина и вставкой пептида слияния, gp41, в мембрану клетки-хозяина. [3] Это позволяет вирусу ВИЧ-1 проникать в клетку. [3] Gp120 также может связываться с гликолипидами , такими как сульфатид и галактоцереброзид (GalCer). Сульфатид прочно связывается с петлей V3 gp120, которая не взаимодействует с CD4. [3] Следовательно, сульфатид действует как альтернативный рецептор вируса в клетках CD4 и участвует в трансмембранной передаче сигналов. Однако сульфатид не играет существенной роли в инфицировании ВИЧ-1 клеток CD4+. [3]
Связывание gp120 с GalCer может инициировать слияние ВИЧ-1, но связывание gp120 с сульфатидом — нет. [3] Сульфатид не является функциональным рецептором. Однако эксперименты показали, что сульфатид и GalCer конкурируют за способность связываться с gp120, и было показано, что сульфатид имеет самую сильную связывающую аффинность с рекомбинантным gp120 из всех протестированных гликолипидов. [3] Таким образом, это говорит о том, что когда сульфатид присоединяется к ВИЧ-1, он не может взаимодействовать с корецептором хемокина из-за нестабильности комплекса между gp120 и сульфатидом, что, следовательно, предотвращает инициирование процесса слияния. [3] Это указывает на то, что сульфатид может предотвращать заражение ВИЧ-1 , опосредуя связывание gp120, которое, в свою очередь, предотвращает процесс слияния; следовательно, было продемонстрировано, что лечение сульфатидом может привести к ингибированию репликации ВИЧ-1. [3]
Кроме того, пациенты, инфицированные ВИЧ-1, часто страдают от дегенерации миелина в центральной нервной системе . У этих пациентов наблюдается повышенный уровень сульфатида в спинномозговой жидкости (СМЖ) и антисульфатидных антител в сыворотке . [3] Повышенный уровень антисульфатидных антител может вызвать демиелинизацию . Это вызвано связыванием антисульфатидных антител с поверхностью миелиновой оболочки и/или поверхностью шванновских клеток , что затем активирует полный каскад демиелинизации. [3] Кроме того, у пациентов со СПИДом на поздней стадии может развиться синдром Гийена-Барре (СГБ). Синдром Гийена-Барре классифицируется как острая аутоиммунная полинейропатия , которая специфически поражает периферическую нервную систему инфицированного пациента. [3] Эксперименты показали, что аутоиммунные антитела к сульфатиду могут способствовать развитию синдрома Гийена-Барре у пациентов со СПИДом , а также развитию поражения периферической нервной системы у пациентов, инфицированных ВИЧ-1. [3]
У нескольких пациентов с вирусом гепатита С (HCV), связанным со смешанной криоглобулинемией (MC), в плазме крови наблюдается повышенный уровень антител к сульфатиду. [3] Смешанная криоглобулинемия (MC) — это иммунное заболевание, которое обычно проявляется васкулитом мелких сосудов, опосредованным иммунокомплексами . [3] Считается, что существует связь между HCV и MC; однако точная роль HCV в отношении причины MC еще не полностью изучена или обнаружена. Тем не менее, было показано, что синтез сфинголипидов в организме хозяина необходим для репликации HCV , что указывает на то, что сульфатид может быть вовлечен в репликацию HCV. [3]
Вирус гриппа А (IAV) прочно связывается с сульфатидом. [2] Однако рецепторы сульфатида не имеют сиаловой кислоты , которая, как было показано, играет необходимую роль в качестве рецептора вируса, который облегчает связывание вируса гриппа А. [3] Также было показано, что сульфатид ингибирует активность сиалидазы вируса гриппа А. Однако это происходит только в кислых условиях, а не в нейтральных. [3] Чтобы полностью понять роль сульфатида в цикле заражения IAV, исследователи экспрессировали сульфатид в клетках почек собак Madin-Darby, которые могут экспрессировать сульфатид и поддерживать репликацию IAV , и в клетках COS-7 , которые не обладают способностью экспрессировать сульфатид и не поддерживают репликацию IAV в достаточной степени. В результате клетки COS-7 были трансфицированы генами галактозилтрансферазы и цереброзидсульфотрансферазы из клеток почек собак Madin-Darby и использованы для создания двух клонов клеток, способных экспрессировать сульфатид. [3]
Затем эти клетки были инфицированы вирусом IAV, и исследования показали, что клетки, обогащенные сульфатидом, инфицированные IAV, демонстрируют повышенную репликацию IAV в вирусе-потомке, в 500–3000 раз больше, чем родительский вирус. Однако клетки, обогащенные сульфатидом, также демонстрируют небольшое снижение начальной инфекции по сравнению с родительскими клетками. [2] [3] Противоположное показано в клетках почек собак Madin-Darby с сульфатидным нокдауном , демонстрирующих снижение концентрации вируса-потомка по сравнению с концентрацией родительского вируса и увеличение начальной инфекции. В целом, такие эксперименты показывают, что клетки, богатые сульфидом, усиливают репликацию IAV и что сульфатид на поверхности клетки может играть роль в репликации IAV. [2] [3]
Дальнейшие эксперименты продемонстрировали, что обогащенные сульфатидом клетки, в которых сульфатид связывается с гемагглютинином , усиливают репликацию IAV за счет увеличения образования потомства вирусных частиц; это достигается путем стимулирования ядерного экспорта вирусных рибонуклеопротеинов , образованных IAV, из ядра в цитоплазму. [3] Эксперименты также продемонстрировали, что если ингибируется связывание между сульфатидом и гемагглютинином , то ингибируется образование и репликация вирусных частиц, что снова предполагает, что связывание между сульфатидом и гемагглютинином облегчает репликацию IAV. [3]
Вирус коровьей оспы тесно связан с вирусом натуральной оспы , который, как известно, вызывает заболевание оспы . Было показано, что вирус коровьей оспы способен связываться с сульфатидом через мембранные белки L5 и A27 на вирусе. [3] На мышиных моделях было показано , что сульфатид предотвращает прикрепление вируса коровьей оспы к поверхности клетки, а также предотвращает смерть в мышиных моделях , которые обычно летальны. Это говорит о том, что сульфатид может быть одним из рецепторов для вируса коровьей оспы. [2] [3]
Сульфатид связывается со многими бактериями, включая: [3]
Сульфатид действует как гликолипидный рецептор, который помогает этим бактериям прикрепляться к поверхности слизистой оболочки . [3] Mycoplasma hyopneumoniae и Actinobacillus pleuropneumoniae являются патогенами, вызывающими респираторные заболевания у свиней . Haemophilus influenzae , Bordetella pertussis , Mycoplasma pneumoniae , Moraxella catarrhalis и Pseudomonas aeruginosa вызывают респираторные заболевания у людей. Соответственно, сульфатид находится в трахеях как человека, так и свиньи, и благодаря использованию сульфатида, присутствующего в трахее, эти несколько бактерий способны прикрепляться к дыхательным путям . Было также показано, что Hsp-70 на внешней стороне H. influenzae помогает этим бактериям связываться с сульфатидом. [3]
Helicobacter pylori , энтеротоксигенныйштамм E. coli TOP10, 987P-фимбриальная энтеротоксигенная E. coli (штамм E. coli ) и Lactobacillus reuteri — это различные штаммы бактерий, которые, как обнаружено, прилипают кслизистой оболочке желудочно-кишечного тракта . [3] Здесь сульфатид присутствует внутри тракта и загружается извне тракта, помогая бактериям прилипать к слизистой оболочке. [3]
STb — это энтеротоксин типа B, который является термостабильным; кроме того, он секретируется энтеротоксигенным штаммом E. coli и вызывает диарейные заболевания у людей и многих других видов животных. STb также прочно связывается с сульфатидом, что подтверждается его связыванием с сульфатидом, присутствующим на слизистой поверхности тощей кишки свиньи . Дополнительные эксперименты показывают, что сульфатид является функциональным рецептором STb. [3]
Сульфатид также может играть роль в Mycobacterium tuberculosis , который является агентом, вызывающим туберкулез у людей. Эксперименты показывают, что сульфатид может быть вовлечен в инфекцию Mycobacterium tuberculosis , и он может быть элементом клеточной стенки бактерии Mycobacterium tuberculosis . [3]
При болезни Альцгеймера уровень сульфатида в мозговой ткани резко снижается, начиная с ранних стадий заболевания. [6] На легких стадиях болезни Альцгеймера потеря сульфатида может составлять до 50% в белом веществе и до 90% в сером веществе мозга. [6] Концентрация сульфатида в спинномозговой жидкости также ниже у пациентов с болезнью Альцгеймера. [6] Характерная потеря нейронной функции, связанная с болезнью Альцгеймера, происходит через потерю нейронов и синапсов, а дефицит представляет собой класс липидов, специфичный для сульфатидов. [11] При сравнении истощения сульфатида с другими нейродегенеративными заболеваниями болезнь Альцгеймера является единственным случаем, при котором сульфатид истощается столь резко; При деменции не наблюдается выраженного истощения сульфатидов, тогда как при болезни Паркинсона уровни сульфатидов резко повышаются, а у пациентов с рассеянным склерозом наблюдается лишь умеренное истощение сульфатидов. [11] Кроме того, потеря сульфатидов наблюдается только в самом начале заболевания, тогда как на более тяжелых стадиях происходит минимальная дополнительная потеря сульфатидов. [11]

Сульфатиды в мозговой ткани изучались путем изучения аполипопротеина E (apoE), в частности аллеля ε4. Аллель ε4 аполипопротеина E является единственным известным генетическим фактором риска, который достоверно указывает на позднее начало болезни Альцгеймера. [11] Обладание аллелем apoE ε4 было связано с более высоким риском развития болезни Альцгеймера. [11] ApoE — это белок, который участвует в транспорте многих липидов , включая холестерин , и, таким образом, регулирует количество сульфатида в центральной нервной системе и опосредует гомеостаз системы. [6] Было обнаружено, что более высокие уровни apoE положительно коррелируют с большим истощением сульфатида. [6] Белки, связанные с ApoE, забирают сульфатид из миелиновой оболочки , а затем расщепляют сульфатид на различные соединения, такие как сульфат . При повышении уровня апоЕ также увеличивается количество сульфатида, который извлекается из миелиновой оболочки; следовательно, происходит большее истощение сульфатида. [6]
Сульфатид также участвует в клиренсе амилоидного пептида-β . Амилоидные пептиды-β являются одним из признаков болезни Альцгеймера. Когда они не расщепляются должным образом, эти пептиды накапливаются и создают бляшки, которые представляют собой скопления фрагментов амилоидного пептида-β, и они тесно связаны с болезнью Альцгеймера. [6] Клиренс амилоидного пептида-β важен для того, чтобы это накопление не происходило. [6] Сульфатид облегчает удаление амилоидного пептида-β через эндоцитозный путь, поэтому при высоком уровне сульфатида наблюдается меньшее количество амилоидных пептидов-β. [6] Поскольку у пациентов с болезнью Альцгеймера уровень сульфатида ниже, клиренс амилоидных пептидов-β ниже, что позволяет пептидам накапливаться и создавать бляшки в мозге. [6]
Было обнаружено, что витамин К связан с сульфатидом. Не только у животных, но и у бактерий, было замечено, что витамин К влияет на концентрацию сульфатида в мозге. [12] [13] Витамин К в нервной системе отвечает за активацию ферментов , которые необходимы для биосинтеза фосфолипидов мозга , таких как сульфатид. [12] Когда варфарин , антагонист витамина К , добавляется в систему модели животного, синтез сульфатида нарушается. [12] Однако, когда витамин К добавляется обратно в систему, синтез сульфатида продолжается нормально, что позволяет предположить, что витамин К необходим для синтеза сульфатида. [12] [13] [14]