Глюконеогенез ( ГНГ ) — это метаболический путь , который приводит к биосинтезу глюкозы из определенных неуглеводных углеродных субстратов. Это повсеместный процесс, присутствующий у растений, животных, грибов, бактерий и других микроорганизмов. [1] У позвоночных глюконеогенез происходит в основном в печени и, в меньшей степени, в корковом веществе почек . Это один из двух основных механизмов — другой — деградация гликогена ( гликогенолиз ) , — используемый людьми и многими другими животными для поддержания уровня сахара в крови , избегая низких уровней ( гипогликемии ). [2] У жвачных животных , поскольку углеводы, содержащиеся в пище, имеют тенденцию метаболизироваться организмами рубца , глюконеогенез происходит независимо от голодания, низкоуглеводных диет, физических упражнений и т. д. [3] У многих других животных этот процесс происходит в периоды голодания , голодания , низкоуглеводных диет или интенсивных физических упражнений .
У людей субстраты для глюконеогенеза могут поступать из любых неуглеводных источников, которые могут быть преобразованы в пируват или промежуточные продукты гликолиза (см. рисунок). Для расщепления белков эти субстраты включают глюкогенные аминокислоты (хотя и не кетогенные аминокислоты ); для расщепления липидов (таких как триглицериды ) они включают глицерин , жирные кислоты с нечетной цепью (хотя и не жирные кислоты с четной цепью, см. ниже); и из других частей метаболизма , которые включают лактат из цикла Кори . В условиях длительного голодания ацетон, полученный из кетоновых тел , также может служить субстратом, обеспечивая путь от жирных кислот к глюкозе. [4] Хотя большая часть глюконеогенеза происходит в печени, относительный вклад глюконеогенеза почками увеличивается при диабете и длительном голодании. [5]
Путь глюконеогенеза является высоко эндергоническим , пока он не сопряжен с гидролизом АТФ или ГТФ , что фактически делает процесс экзергоническим . Например, путь, ведущий от пирувата к глюкозо-6-фосфату, требует 4 молекул АТФ и 2 молекул ГТФ для спонтанного протекания. Эти АТФ поставляются из катаболизма жирных кислот через бета-окисление . [6]

У людей основными глюконеогенными предшественниками являются лактат , глицерин (который является частью молекулы триглицерида ), аланин и глутамин . В общей сложности они составляют более 90% от общего глюконеогенеза. [8] Другие глюкогенные аминокислоты и все промежуточные продукты цикла лимонной кислоты (через преобразование в оксалоацетат ) также могут функционировать как субстраты для глюконеогенеза. [9] Как правило, потребление человеком глюконеогенных субстратов с пищей не приводит к увеличению глюконеогенеза. [10]
У жвачных животных пропионат является основным субстратом глюконеогенеза. [3] [11] У нежвачных животных, включая людей, пропионат возникает в результате β-окисления жирных кислот с нечетной и разветвленной цепью и является (относительно второстепенным) субстратом для глюконеогенеза. [12] [13]
Лактат транспортируется обратно в печень, где он преобразуется в пируват циклом Кори с использованием фермента лактатдегидрогеназы . Пируват, первый обозначенный субстрат глюконеогенного пути, затем может быть использован для получения глюкозы. [9] Трансаминирование или дезаминирование аминокислот облегчает вхождение их углеродного скелета в цикл напрямую (как пируват или оксалоацетат), или косвенно через цикл лимонной кислоты. Вклад лактата цикла Кори в общее производство глюкозы увеличивается с продолжительностью голодания . [14] В частности, после 12, 20 и 40 часов голодания у людей-добровольцев вклад лактата цикла Кори в глюконеогенез составил 41%, 71% и 92% соответственно. [14]
Могут ли жирные кислоты с четной цепью превращаться в глюкозу у животных, является давним вопросом в биохимии. [15] Жирные кислоты с нечетной цепью могут окисляться с образованием ацетил-КоА и пропионил-КоА , причем последний служит предшественником сукцинил-КоА , который может быть преобразован в оксалоацетат и вступить в глюконеогенез. Напротив, жирные кислоты с четной цепью окисляются с образованием только ацетил-КоА, вступление которого в глюконеогенез требует наличия глиоксилатного цикла (также известного как глиоксилатный шунт) для получения предшественников четырехуглеродных дикарбоновых кислот. [9] Глиоксилатный шунт состоит из двух ферментов, малатсинтазы и изоцитратлиазы, и присутствует в грибах, растениях и бактериях. Несмотря на некоторые сообщения о ферментативной активности глиоксилатного шунта, обнаруженной в тканях животных, гены, кодирующие обе ферментативные функции, были обнаружены только у нематод , у которых они существуют как один бифункциональный фермент. [16] [17] Гены, кодирующие только малатсинтазу (но не изоцитратлиазу), были обнаружены у других животных, включая членистоногих , иглокожих и даже некоторых позвоночных . Млекопитающие, у которых обнаружен ген малатсинтазы, включают однопроходных ( утконос ) и сумчатых ( опоссум ), но не плацентарных млекопитающих . [17]
Существование глиоксилатного цикла у людей не установлено, и широко распространено мнение, что жирные кислоты не могут быть преобразованы в глюкозу у людей напрямую. Было показано, что углерод-14 оказывается в глюкозе, когда он поставляется в жирных кислотах, [18] но этого можно ожидать от включения меченых атомов, полученных из ацетил-КоА, в промежуточные продукты цикла лимонной кислоты , которые взаимозаменяемы с теми, которые получены из других физиологических источников, таких как глюкогенные аминокислоты. [15] При отсутствии других глюкогенных источников 2-углеродный ацетил-КоА, полученный в результате окисления жирных кислот, не может производить чистый выход глюкозы через цикл лимонной кислоты , поскольку эквивалентные два атома углерода выделяются в виде диоксида углерода во время цикла. Однако во время кетоза ацетил-КоА из жирных кислот дает кетоновые тела , включая ацетон , и до ~60% ацетона может окисляться в печени до предшественников пирувата ацетола и метилглиоксаля . [19] [4] Таким образом, кетоновые тела, полученные из жирных кислот, могут составлять до 11% глюконеогенеза во время голодания. Катаболизм жирных кислот также производит энергию в форме АТФ, которая необходима для пути глюконеогенеза.
У млекопитающих глюконеогенез, как полагают, ограничен печенью, [20] почками, [20] кишечником, [21] и мышцами, [22], но недавние данные указывают на то, что глюконеогенез происходит в астроцитах мозга. [23] Эти органы используют несколько разные предшественники глюконеогенеза. Печень преимущественно использует лактат, глицерин и глюкогенные аминокислоты (особенно аланин ), в то время как почки преимущественно используют лактат, глутамин и глицерин. [24] [8] Лактат из цикла Кори является количественно крупнейшим источником субстрата для глюконеогенеза, особенно для почек. [8] Печень использует как гликогенолиз, так и глюконеогенез для производства глюкозы, тогда как почки используют только глюконеогенез. [8] После еды печень переключается на синтез гликогена , тогда как почки усиливают глюконеогенез. [10] Кишечник использует в основном глутамин и глицерин. [21]
Пропионат является основным субстратом для глюконеогенеза в печени жвачных животных, а печень жвачных животных может использовать больше глюконеогенных аминокислот (например, аланина), когда потребность в глюкозе увеличивается. [25] Способность клеток печени использовать лактат для глюконеогенеза снижается от преруминантной стадии к жвачной стадии у телят и ягнят. [26] В почечной ткани овец наблюдались очень высокие показатели глюконеогенеза из пропионата. [26]
У всех видов образование оксалоацетата из пирувата и промежуточных продуктов цикла трикарбоновых кислот ограничено митохондриями, а ферменты, которые преобразуют фосфоенолпировиноградную кислоту (ФЕП) в глюкозо-6-фосфат, находятся в цитозоле. [27] Расположение фермента, который связывает эти две части глюконеогенеза путем преобразования оксалоацетата в ФЕП – ФЕП-карбоксикиназы (ФЕП-карбоксикиназы) – варьируется в зависимости от вида: он может находиться полностью внутри митохондрий , полностью внутри цитозоля или равномерно распределен между ними, как у людей. [27] Транспорт ФЕП через митохондриальную мембрану осуществляется специальными транспортными белками; однако для оксалоацетата таких белков не существует . [27] Таким образом, у видов, у которых отсутствует внутримитохондриальный PEPCK, оксалоацетат должен быть преобразован в малат или аспартат , экспортирован из митохондрии и преобразован обратно в оксалоацетат , чтобы глюконеогенез мог продолжаться. [27]
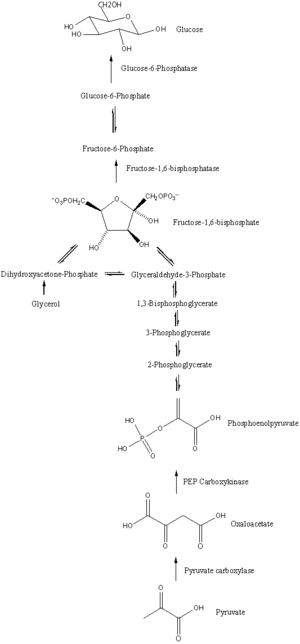
Глюконеогенез — это путь, состоящий из серии одиннадцати ферментативно-катализируемых реакций. Путь начинается либо в печени, либо в почках, в митохондриях или цитоплазме этих клеток, в зависимости от используемого субстрата. Многие из реакций являются обратными шагам, обнаруженным в гликолизе . [ необходима цитата ]
В то время как большинство шагов в глюконеогенезе являются обратными тем, которые обнаружены в гликолизе , три регулируемые и сильно эндергонические реакции заменяются более кинетически благоприятными реакциями. Ферменты гликолиза гексокиназа / глюкокиназа , фосфофруктокиназа и пируваткиназа заменяются на глюкозо-6-фосфатазу , фруктозо-1,6-бисфосфатазу и ФЕП-карбоксикиназу /пируваткарбоксилазу. Эти ферменты обычно регулируются похожими молекулами, но с противоположными результатами. Например, ацетил-КоА и цитрат активируют ферменты глюконеогенеза (пируваткарбоксилазу и фруктозо-1,6-бисфосфатазу соответственно), одновременно ингибируя гликолитический фермент пируваткиназу . Эта система взаимного контроля позволяет гликолизу и глюконеогенезу ингибировать друг друга и предотвращает бесполезный цикл синтеза глюкозы, который только расщепляет ее. Пируваткиназу можно также обойти с помощью 86 путей [28], не связанных с глюконеогенезом, с целью образования пирувата и впоследствии лактата; некоторые из этих путей используют атомы углерода, полученные из глюкозы.
Большинство ферментов , ответственных за глюконеогенез, находятся в цитозоле ; исключениями являются митохондриальная пируваткарбоксилаза и, у животных, фосфоенолпируваткарбоксикиназа . Последняя существует как изофермент, расположенный как в митохондриях , так и в цитозоле . [29] Скорость глюконеогенеза в конечном итоге контролируется действием ключевого фермента, фруктозо-1,6-бисфосфатазы , которая также регулируется посредством передачи сигнала цАМФ и его фосфорилирования.
Глобальный контроль глюконеогенеза опосредован глюкагоном ( выделяется при низком уровне глюкозы в крови ); он запускает фосфорилирование ферментов и регуляторных белков протеинкиназой А (циклическая АМФ-регулируемая киназа), что приводит к ингибированию гликолиза и стимуляции глюконеогенеза. Инсулин противодействует глюкагону, ингибируя глюконеогенез. Диабет 2 типа характеризуется избытком глюкагона и резистентностью к инсулину в организме. [30] Инсулин больше не может ингибировать экспрессию генов ферментов, таких как PEPCK, что приводит к повышению уровня гипергликемии в организме. [31] Противодиабетический препарат метформин снижает уровень глюкозы в крови в первую очередь за счет ингибирования глюконеогенеза, преодолевая неспособность инсулина ингибировать глюконеогенез из-за резистентности к инсулину. [32]
Исследования показали, что отсутствие выработки глюкозы печенью не оказывает существенного влияния на контроль концентрации глюкозы в плазме натощак. Компенсаторная индукция глюконеогенеза происходит в почках и кишечнике, управляемая глюкагоном , глюкокортикоидами и ацидозом. [33]
В печени белок FOX FOXO6 обычно стимулирует глюконеогенез в состоянии голодания, но инсулин блокирует FOXO6 при приеме пищи. [34] В состоянии резистентности к инсулину инсулин не блокирует FOXO6, что приводит к продолжению глюконеогенеза даже при приеме пищи, что приводит к высокому уровню глюкозы в крови ( гипергликемии ). [34]
Инсулинорезистентность является общей чертой метаболического синдрома и диабета 2 типа . По этой причине глюконеогенез является целью терапии диабета 2 типа, например, противодиабетического препарата метформина , который ингибирует образование глюконеогенной глюкозы и стимулирует поглощение глюкозы клетками. [35]
Глюконеогенез считается одним из самых древних анаболических путей и, вероятно, был продемонстрирован у последнего универсального общего предка . [36] Рафаэль Ф. Сэй и Георг Фукс заявили в 2010 году, что «все группы архей, а также глубоко разветвленные бактериальные линии содержат бифункциональную фруктозо-1,6-бисфосфатную (FBP) альдолазу/фосфатазу с активностью как FBP-альдолазы, так и FBP-фосфатазы. Этот фермент отсутствует у большинства других бактерий и эукариот и является термостабильным даже у мезофильных морских кренархеот». Предполагается, что фруктозо-1,6-бисфосфатная альдолаза/фосфатаза была предковым глюконеогенным ферментом и предшествовала гликолизу. [37] Но химические механизмы между глюконеогенезом и гликолизом, будь то анаболическим или катаболическим, схожи, что позволяет предположить, что они оба возникли в одно и то же время. Показано, что фруктозо-1,6-бисфосфат непрерывно синтезируется неферментативно в замораживающем растворе. Синтез ускоряется в присутствии аминокислот, таких как глицин и лизин, что подразумевает, что первыми анаболическими ферментами были аминокислоты. Пребиотические реакции в глюконеогенезе также могут протекать неферментативно в циклах дегидратации-высушивания. Такая химия могла происходить в гидротермальных средах, включая температурные градиенты и циклы замораживания и оттаивания. Минеральные поверхности могли играть роль в фосфорилировании метаболических промежуточных продуктов глюконеогенеза и, как было показано, производят тетрозу, гексозофосфаты и пентозу из формальдегида , глицеральдегида и гликольальдегида. [38] [39] [40]