Множественная миелома ( ММ ), также известная как плазмоклеточная миелома и просто миелома , представляет собой рак плазматических клеток , типа лейкоцитов , которые обычно продуцируют антитела . [6] Часто поначалу никаких симптомов не наблюдается. [10] По мере прогрессирования могут возникать боли в костях , анемия , дисфункция почек и инфекции. [10] Осложнения могут включать гиперкальциемию и амилоидоз . [3]
Причина множественной миеломы неизвестна. [4] Факторы риска включают ожирение , радиационное воздействие, семейный анамнез, возраст и некоторые химические вещества. [5] [11] [12] В некоторых профессиях существует повышенный риск развития множественной миеломы. [13] Это связано с профессиональным воздействием ароматических углеводородных растворителей, которые играют роль в возникновении множественной миеломы. [14] Множественная миелома может развиться из моноклональной гаммапатии неопределенного значения (MGUS), которая прогрессирует до тлеющей миеломы . [15] Аномальные плазматические клетки производят аномальные антитела , которые могут вызвать проблемы с почками и слишком густую кровь . [10] Плазматические клетки также могут образовывать массы в костном мозге или мягких тканях. [10] Если присутствует одна опухоль, ее называют плазмоцитомой ; более одного называется множественной миеломой. [10] Множественная миелома диагностируется на основании анализов крови или мочи, обнаруживающих аномальные белки антител (часто с использованием электрофоретических методов, выявляющих наличие моноклонального всплеска в результатах - называемого м-спайком), биопсии костного мозга, обнаруживающей раковые плазматические клетки, и медицинская визуализация для выявления поражений костей. [6] Еще одним частым признаком является высокий уровень кальция в крови . [6]
Множественная миелома считается излечимой, но, как правило, неизлечимой. [3] Ремиссии можно добиться с помощью стероидов , химиотерапии , таргетной терапии и трансплантации стволовых клеток . [3] Бисфосфонаты и лучевая терапия иногда используются для уменьшения боли при поражениях костей. [3] [6]
В 2020 году во всем мире это заболевание было диагностировано примерно у 175 000 человек, а в том же году от этой болезни умерло около 117 000 человек. По прогнозам, в США в 2023 году это заболевание будет диагностировано около 35 000 человек, а в этом году от этой болезни умрут около 12 000 человек. [16] В 2020 году в США с миеломой проживало около 170 405 человек [17]
Трудно судить о статистике смертности, поскольку методы лечения этого заболевания быстро развиваются. Согласно данным о людях, у которых было диагностировано это заболевание в период с 2013 по 2019 год, около 60% прожили пять лет и более после постановки диагноза, а около 34% прожили десять лет и более. [17] Люди, у которых впервые диагностировано это заболевание, теперь имеют лучший прогноз благодаря улучшению лечения. [18]
Заболевание обычно возникает в возрасте около 60 лет и чаще встречается у мужчин, чем у женщин. [6] В возрасте до 40 лет заболевание встречается редко. [6] Слово «миелома» происходит от греческого myelo- «костный мозг» и -oma «опухоль». [19]
Поскольку миелома может поражать многие органы, симптомы и признаки сильно различаются. Утомляемость и боль в костях являются наиболее распространенными симптомами при поступлении. Критерии CRAB ранее использовались для установления наличия активной множественной миеломы (в отличие от более ранней, обычно бессимптомной, «тлеющей» формы заболевания). Критерии CRAB: [20] [2] [21]
По состоянию на 2014 год [обновлять]диагностические критерии были расширены и обновлены IMWG (Международной рабочей группой по миеломе), добавив три события, определяющих миелому, любое из которых указывает на наличие активной множественной миеломы. Каждое из этих трех событий может произойти до появления любого из критериев CRAB, что дает большему количеству людей право на лечение препаратами от миеломы раньше. [21]

Боль в костях встречается почти у 70% людей с множественной миеломой и является одним из наиболее распространенных симптомов. [2] : 653 [22] Боль в костях при миеломе обычно затрагивает позвоночник и ребра и усиливается при физической активности. Постоянная локализованная боль может указывать на патологический перелом кости . Вовлечение позвонков может привести к сдавлению спинного мозга или кифозу . Миеломная болезнь костей возникает из-за сверхэкспрессии рецептора-активатора лиганда ядерного фактора κ B ( RANKL ) стромой костного мозга . RANKL активирует остеокласты , которые резорбируют кость. Возникающие в результате поражения костей носят литический характер (вызывают разрушение) и лучше всего видны на обычных рентгенограммах, которые могут показывать «перфорированные» резорбтивные поражения (включая вид «дождевой капли» черепа на рентгенограмме). Разрушение костей также приводит к выбросу ионов кальция в кровь, что приводит к гиперкальциемии и связанным с ней симптомам. [23]
Анемия, обнаруживаемая при миеломе, обычно нормоцитарная и нормохромная . Это происходит в результате замены нормального костного мозга инфильтрацией опухолевых клеток и ингибирования нормального производства эритроцитов ( кроветворения ) цитокинами . [24]
Нарушение функции почек может развиваться остро или хронически , любой степени тяжести. [25] [26] Наиболее распространенной причиной почечной недостаточности при множественной миеломе являются белки, секретируемые злокачественными клетками. Клетки миеломы продуцируют моноклональные белки различных типов, чаще всего иммуноглобулины (антитела) и свободные легкие цепи , что приводит к аномально высоким уровням этих белков в крови. В зависимости от размера этих белков они могут выводиться через почки. Почки могут быть повреждены воздействием белков или легких цепей. Повышенная резорбция кости приводит к гиперкальциемии и нефрокальцинозу , тем самым способствуя почечной недостаточности. Амилоидоз занимает третье место в причинно-следственной связи. Люди с амилоидозом имеют высокий уровень амилоидного белка , который может выводиться через почки и вызывать повреждение почек и других органов. [27] [28]
Легкие цепи производят множество эффектов, которые могут проявляться как синдром Фанкони ( почечный канальцевый ацидоз II типа ). [27]
Побочные инфекции часто встречаются при множественной миеломе, поскольку заболевание нарушает функционирование компонентов крови, которые в норме сопротивляются патогенам. Наиболее распространенными инфекциями являются пневмонии, инфекции мочевыводящих путей и сепсис. [29] Период наибольшего риска возникновения инфекции приходится на первые несколько месяцев после начала новой лекарственной терапии, поскольку многие лекарственные методы лечения дополнительно подавляют нормальный иммунный ответ. [30]
Инфекции (и «нежелательные явления» для всех заболеваний) оцениваются по стандартизированной шкале. [31] При некоторых медикаментозных методах лечения миеломы более 30% людей испытывают инфекцию «3 степени» или выше (у многих людей наблюдаются множественные такие инфекции), [32] что требует вмешательства, по крайней мере, с помощью антибиотиков. [31] Из людей, которые умирают в течение 6 месяцев после постановки диагноза миеломы, от 20% до 50% умирают от побочных инфекций. [29]
Клиническая оценка иммунного ответа человека обычно проводится с помощью лабораторного теста, который измеряет уровни различных иммуноглобулинов в крови. Существует пять разновидностей иммуноглобулинов, обозначаемых достаточными буквами -A, -D, -E, -G и -M. [33] В совокупности уровень иммуноглобулинов может повышаться при заболевании, но большинство таких повышенных антител имеют моноклональную разновидность из-за клональных плазматических клеток и, следовательно, неэффективны. Такие неэффективные антитела обычно относятся к разновидностям иммуноглобулинов -A и -G. [33] Когда количество эффективных антител падает ниже порогового значения (состояние, называемое гипогаммаглобулинемией ), [34] дополнительные иммуноглобулины могут вводиться путем периодических инфузий для снижения риска побочных инфекций. [32]
Некоторые симптомы (например, слабость , спутанность сознания и утомляемость ) могут быть следствием анемии или гиперкальциемии. Головная боль , изменения зрения и ретинопатия могут быть следствием повышенной вязкости крови в зависимости от свойств парапротеина . Наконец, могут возникнуть корешковые боли , потеря контроля над кишечником или мочевым пузырем (из-за поражения спинного мозга , приводящего к его сдавлению ) или синдром запястного канала , а также другие нейропатии (из-за инфильтрации периферических нервов амилоидом ). В поздних случаях это может привести к параплегии . [35]
Когда заболевание хорошо контролируется, неврологические симптомы могут возникнуть в результате текущего лечения, некоторые из которых могут вызывать периферическую невропатию, проявляющуюся в виде онемения или боли в руках, ногах и голенях. [ нужна цитата ]
Первоначальные симптомы могут включать боль, онемение, отек, расширение челюсти, подвижность зубов и рентгенопрозрачность . [36] Множественная миелома во рту может имитировать распространенные проблемы с зубами, такие как периапикальный абсцесс или пародонтальный абсцесс , гингивит , пародонтит или другое увеличение или образование десен. [37]
Причина множественной миеломы обычно неизвестна. [4]
Исследования сообщили о семейной предрасположенности к миеломе. [42] [43] Гиперфосфорилирование ряда белков — белков-паратаргов — тенденция, которая наследуется по аутосомно-доминантному типу, кажется распространенным механизмом в этих семьях. Эта тенденция чаще встречается у афроамериканцев с миеломой и может способствовать более высокому уровню заболеваемости миеломой в этой группе. [42]
В исследовании по изучению связи между профессиональным воздействием ароматических углеводородных растворителей ( бензола и его многочисленных производных) данные показали, что эти растворители играют роль в возникновении множественной миеломы. [14] Множественная миелома чаще встречается у представителей определенных профессий. Риск возникновения множественной миеломы выше у профессий пожарных, парикмахеров, а также у работников сельского хозяйства и промышленности. [44] Риск некоторых профессий связан с воздействием различных химических веществ. Повторное воздействие химических веществ увеличивает риск развития множественной миеломы. Было замечено, что использование пестицидов и опасных химикатов в таких профессиях, как пожаротушение и сельское хозяйство, приводит к увеличению риска развития множественной миеломы. [13] Другие профессии, например, промышленные, также подвергаются повышенному риску развития множественной миеломы. Промышленные рабочие подвергаются воздействию химикатов, содержащих ароматические углеводородные растворители. [14] [13]
Воздействие ароматических углеводородных растворителей, бензола , толуола и ксилола может увеличить риск развития множественной миеломы. Увеличение продолжительности, высокая интенсивность воздействия или повторное воздействие были связаны с увеличением риска развития множественной миеломы до 63%. [14] Изучалось время от воздействия до постановки диагноза, а диагноз после воздействия отставал не менее чем на 20 лет. [14] Когда устанавливалось воздействие одного химического вещества, обычно обнаруживалось воздействие другого углеводородного растворителя. [14] Множественная миелома чаще поражает мужчин, пожилых людей и афроамериканцев. Эти группы населения также имеют более высокую частоту воздействия, чем их коллеги-женщины. [14]
Редко вирус Эпштейна-Барра (ВЭБ) связан с множественной миеломой, особенно у людей с иммунодефицитом, например , вследствие ВИЧ/СПИДа , трансплантации органов или хронического воспалительного заболевания, такого как ревматоидный артрит . [45] ВЭБ-положительная множественная миелома классифицируется Всемирной организацией здравоохранения (2016) как одна из форм лимфопролиферативных заболеваний, связанных с вирусом Эпштейна-Барра, и называется плазмоклеточной миеломой, ассоциированной с вирусом Эпштейна-Барра . ВЭБ-положительное заболевание чаще встречается при плазмоцитоме , чем при множественной миеломе плазмоклеточного рака. [46] В тканях, участвующих в заболевании EBV+, обычно наблюдаются очаги EBV+ клеток с появлением быстро пролиферирующих незрелых или плохо дифференцированных плазматических клеток. [46] Клетки экспрессируют продукты генов EBV, таких как EBER1 и EBER2. [47] Хотя ВЭБ способствует развитию и/или прогрессированию большинства лимфопролиферативных заболеваний, связанных с вирусом Эпштейна-Барра, его роль при множественной миеломе неизвестна. [48] Однако у людей с EBV-положительной локализацией плазмоцитомы вероятность развития множественной миеломы выше, чем у людей с EBV-отрицательной плазмоцитомой(ами). Это позволяет предположить, что ВЭБ может играть роль в прогрессировании плазмоцитомы в системную множественную миелому. [47]

В-лимфоциты зарождаются в костном мозге и перемещаются в лимфатические узлы. По мере развития они созревают и отображают на поверхности своих клеток различные белки (антигены клеточной поверхности). Когда они активируются для секреции антител, они называются плазматическими клетками. [ нужна цитата ]
Множественная миелома развивается в В-лимфоцитах после того, как они покинули часть лимфатического узла, известную как зародышевый центр . Тип нормальных клеток, наиболее тесно связанный с клетками ММ, обычно считается либо активированными В-клетками памяти , либо предшественниками плазматических клеток, плазмобластами . [49]
Иммунная система держит под строгим контролем пролиферацию В-клеток и секрецию антител. Когда хромосомы и гены повреждаются, часто в результате перестройки, этот контроль теряется. Часто ген-промотор перемещается (или транслоцируется) в хромосому, где стимулирует ген антитела к перепроизводству. [ нужна цитата ]
Хромосомная транслокация между геном тяжелой цепи иммуноглобулина (на хромосоме 14 , локус q32) и онкогеном (часто 11q13, 4p16.3, 6p21, 16q23 и 20q11 [50] ) часто наблюдается у людей с множественной миеломой. Эта мутация приводит к нарушению регуляции онкогена, что считается важным инициирующим событием в патогенезе миеломы. [51] Результатом является пролиферация клона плазматических клеток и нестабильность генома, что приводит к дальнейшим мутациям и транслокациям. Аномалия 14-й хромосомы наблюдается примерно в 50% всех случаев миеломы. Делеция (частей) хромосомы 13 также наблюдается примерно в 50% случаев.
Продукция цитокинов [52] (особенно IL-6 ) плазматическими клетками вызывает большую часть их локальных повреждений, таких как остеопороз , и создает микросреду, в которой процветают злокачественные клетки. Ангиогенез (образование новых кровеносных сосудов) увеличивается. [ нужна цитата ]
Выработанные антитела откладываются в различных органах, что приводит к почечной недостаточности, полинейропатии и различным другим симптомам, связанным с миеломой.
В исследовании, изучавшем профиль метилирования ДНК клеток множественной миеломы и нормальных плазматических клеток , наблюдалось постепенное деметилирование стволовых клеток в плазматические клетки. Наблюдаемый паттерн метилирования CpG в интронных областях с метками хроматина, связанными с энхансером, при множественной миеломе аналогичен недифференцированным предшественникам и стволовым клеткам. Эти результаты могут представлять собой эпигенетическое перепрограммирование de novo при множественной миеломе, приводящее к приобретению паттерна метилирования, связанного с стволовостью. [53] Другие исследования выявили паттерн молчания генов, специфичный для множественной миеломы, связанный с репрессивным комплексом 2 полигребенков (PRC2). [54] [55] Повышенная экспрессия субъединицы PRC2, EZH2, как было описано, является распространенным признаком множественной миеломы, что приводит к накоплению и перераспределению триметилирования лизина 27 гистона H3, которое прогрессирует с тяжестью заболевания. [56]
Хромосомные аномалии, часто встречающиеся при этом заболевании, такие как трисомия нескольких нечетных хромосом t(11;14) и del(13q), не связаны с худшим прогнозом. Однако около 25% пациентов с впервые диагностированным заболеванием имеют отклонения, связанные с худшим прогнозом, такие как t(4;14), t(14;16) и del(17p). Другие менее распространенные отклонения, связанные с худшим прогнозом, включают t(14;20) и ≥4 копий 1q. [57] : 1730–1730 гг.
Связанные генетические мутации включают ATM , BRAF , CCND1 , DIS3 , FAM46C , KRAS , NRAS и TP53 . [58]
Генетические и эпигенетические изменения происходят постепенно. Первоначальное изменение, часто вовлекающее транслокацию одной хромосомы 14, приводит к образованию клона плазматических клеток костного мозга, вызывающего бессимптомное заболевание MGUS , которое представляет собой предраковое заболевание, характеризующееся увеличением количества плазматических клеток в костном мозге или циркуляцией миеломного белка-иммуноглобулина. . Дальнейшие генетические или эпигенные изменения приводят к появлению нового клона плазматических клеток костного мозга, обычно потомка исходного клона, который вызывает более серьезное, но все еще бессимптомное предраковое заболевание, тлеющую множественную миелому. Эта миелома характеризуется увеличением количества плазматических клеток костного мозга или уровня циркулирующего белка миеломы выше, чем при MGUS. [ нужна цитата ]
Последующие генетические и эпигенетические изменения приводят к появлению нового, более агрессивного клона плазматических клеток, что вызывает дальнейшее повышение уровня циркулирующего белка миеломы, дальнейшее увеличение количества плазматических клеток костного мозга или развитие одного или нескольких специфический набор симптомов «КРАБ», являющийся основой диагностики злокачественной множественной миеломы и лечения заболевания. [ нужна цитата ]
В небольшом проценте случаев множественной миеломы дальнейшие генетические и эпигенетические изменения приводят к развитию клона плазматических клеток, который перемещается из костного мозга в систему кровообращения , проникает в отдаленные ткани и тем самым вызывает наиболее злокачественную из всех дискразий плазматических клеток . плазмоклеточный лейкоз . [39] [59] [60] Таким образом, фундаментальная генетическая нестабильность плазматических клеток или их предшественников приводит к прогрессированию:
Моноклональная гаммапатия неустановленного значения → тлеющая множественная миелома → множественная миелома → плазмоклеточный лейкоз
Бессимптомная моноклональная гаммапатия неустановленной значимости и тлеющая множественная миелома обычно диагностируются случайно путем обнаружения белка миеломы в тестах электрофореза белков сыворотки, проводимых для других целей. MGUS — относительно стабильное заболевание, от которого страдают 3% людей в возрасте 50 лет и 5% людей в возрасте 70 лет; прогрессирует до множественной миеломы со скоростью 0,5–1% случаев в год; при тлеющей множественной миеломе этот показатель составляет 10% в год в течение первых 5 лет, но затем резко падает до 3% в год в течение следующих 5 лет, а затем до 1% в год. [39] [40]
В целом, около 2–4% случаев множественной миеломы в конечном итоге перерастают в плазмоклеточный лейкоз . [59]
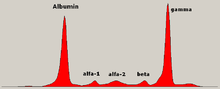
Уровень глобулина может быть нормальным при уже установленном заболевании. Врач может назначить электрофорез белков крови и мочи, который может показать наличие полосы парапротеина (моноклонального белка или белка М ) со снижением или без снижения других (нормальных) иммуноглобулинов (известный как иммунный парез). Одним из типов парапротеина является белок Бенс-Джонса , который представляет собой парапротеин мочи, состоящий из свободных легких цепей. Количественные измерения парапротеина необходимы для установления диагноза и мониторинга заболевания. Парапротеин представляет собой аномальный иммуноглобулин, продуцируемый опухолевым клоном. [ нужна цитата ]
Теоретически, множественная миелома может продуцировать все классы иммуноглобулинов, но наиболее распространены парапротеины IgG , за которыми следуют IgA и IgM . IgD и IgE миеломы встречаются очень редко. Кроме того, легкие и/или тяжелые цепи (строительные блоки антител) могут секретироваться изолированно: κ- или λ-легкие цепи или любой из пяти типов тяжелых цепей (α-, γ-, δ-, ε- или μ-тяжелые цепи). У людей без признаков моноклонального белка может быть «несекреторная» миелома (не продуцирующая иммуноглобулины); это составляет около 3% всех людей с множественной миеломой. [61]
Дополнительные данные могут включать повышенный уровень кальция (когда остеокласты разрушают кость, высвобождая ее в кровоток), повышенный уровень креатинина в сыворотке из-за снижения функции почек , что в основном связано с отложением парапротеина в почках, хотя гипс может также содержат полноценные иммуноглобулины, белок Тамма-Хорсфалла и альбумин . [62]
Другие полезные лабораторные тесты включают количественное измерение IgA, IgG и IgM для выявления иммунного пареза, а также бета-2-микроглобулина, который дает прогностическую информацию. В мазке периферической крови обычно выявляют кольцеобразное образование эритроцитов , хотя это не является специфичным.
Недавнее внедрение коммерческого иммуноанализа для измерения свободных легких цепей потенциально предлагает улучшение мониторинга прогрессирования заболевания и реакции на лечение, особенно там, где парапротеин трудно точно измерить с помощью электрофореза (например, при миеломе легких цепей или когда уровень парапротеина очень низкий). Первоначальные исследования также показывают, что измерение свободных легких цепей также может использоваться в сочетании с другими маркерами для оценки риска прогрессирования MGUS в множественную миелому. [63]
Этот анализ, анализ свободных легких цепей в сыворотке, недавно был рекомендован Международной рабочей группой по миеломе для скрининга, диагностики, прогноза и мониторинга дискразий плазматических клеток . [64]
Биопсия костного мозга обычно проводится для оценки процента костного мозга, занятого плазматическими клетками. Этот процент используется в диагностических критериях миеломы. Иммуногистохимия (окрашивание определенных типов клеток с использованием антител против поверхностных белков) позволяет обнаружить плазматические клетки, экспрессирующие иммуноглобулин в цитоплазме, а иногда и на поверхности клетки; Клетки миеломы часто являются CD56 , CD38 , CD138 и CD319- положительными и CD19 , CD20 и CD45- отрицательными. [20] Проточная цитометрия часто используется для установления клональной природы плазматических клеток, которые обычно экспрессируют только легкую цепь каппа или лямбда. Цитогенетика также может быть выполнена при миеломе в прогностических целях, включая специфичную для миеломы флуоресцентную гибридизацию in situ и виртуальный кариотип . [ нужна цитата ]
Плазматические клетки, наблюдаемые при множественной миеломе, имеют несколько возможных морфологий. Во-первых, они могут выглядеть как нормальные плазматические клетки, крупные клетки, в два или три раза превышающие размер периферических лимфоцитов. Поскольку они активно вырабатывают антитела, аппарат Гольджи обычно образует светлую область, прилегающую к ядру, называемую перинуклеарным ореолом. Единственное ядро (с внутри одного ядрышка с везикулярным ядерным хроматином) эксцентрично, смещено обильной цитоплазмой. Другие распространенные морфологии, которые не являются обычными для нормальных плазматических клеток, включают:
Исторически CD138 использовался для выделения клеток миеломы в диагностических целях. Однако этот антиген быстро исчезает ex vivo . Однако недавно было обнаружено, что поверхностный антиген CD319 (SLAMF7) значительно более стабилен и позволяет надежно изолировать злокачественные плазматические клетки из отсроченных или даже криоконсервированных образцов. [67]
Прогноз широко варьируется в зависимости от различных факторов риска. Клиника Мэйо разработала модель стратификации риска под названием «Стратификация Мэйо для миеломы и терапия, адаптированная к риску» (mSMART), которая делит людей на категории высокого и стандартного риска. [68] Люди с делецией хромосомы 13 или гиподиплоидией по данным традиционной цитогенетики, t(4;14), t(14;16), t(14;20) или 17p - по данным молекулярно-генетических исследований, или с высоким уровнем мечения плазматических клеток. индексом (3% и более) считаются больными с миеломой высокого риска. [69]
Диагностическое обследование человека с подозрением на множественную миелому обычно включает исследование скелета . Это серия рентгеновских снимков черепа, осевого скелета и проксимальных частей длинных костей. Активность миеломы иногда проявляется в виде «литических поражений» (с местным исчезновением нормальной кости вследствие резорбции) или в виде «перфорированных поражений» на рентгенограмме черепа («череп в виде капли дождя»). Поражения также могут быть склеротическими , что рассматривается как радиоплотные . [70] В целом радиоплотность миеломы составляет от -30 до 120 единиц Хаунсфилда (HU). [71] Магнитно-резонансная томография более чувствительна, чем простая рентгенография, при обнаружении литических поражений и может заменить исследование скелета, особенно при подозрении на заболевание позвоночника. Иногда проводят компьютерную томографию для измерения размера плазмоцитом мягких тканей. Ядерная медицина Сканирование костей обычно не имеет никакой дополнительной ценности при обследовании людей с миеломой (нет образования новой кости; литические поражения плохо визуализируются при ядерном сканировании костей).
В 2003 году IMG [20] согласовал диагностические критерии симптоматической миеломы, бессимптомной миеломы и MGUS, которые впоследствии были обновлены в 2009 году: [72]
Примечание. Рецидивирующих инфекций у человека, у которого нет ни одного из признаков CRAB, недостаточно для постановки диагноза миеломы. Людей, у которых отсутствуют признаки CRAB, но имеются признаки амилоидоза, следует рассматривать как амилоидоз, а не миелому. CRAB-подобные аномалии часто встречаются при многих заболеваниях, и следует понимать, что эти аномалии напрямую связаны с соответствующим заболеванием плазматических клеток и каждой попыткой исключить другие основные причины анемии, почечной недостаточности и т. д.
В 2014 году IMWG обновила свои критерии, включив в них биомаркеры злокачественных новообразований. [64] [73] Этими биомаркерами являются >60% клональных плазматических клеток, соотношение вовлеченных/невовлеченных свободных легких цепей в сыворотке ≥ 100 (концентрация задействованных свободных легких цепей должна быть ≥ 100 мг/л) и более одного очагового поражения. ≥ 5 мм по данным МРТ. [64] [73] Вместе эти биомаркеры и критерии CRAB известны как события, определяющие миелому (MDE). Для того чтобы поставить диагноз миеломы, у человека должно быть >10 % клональных плазматических клеток и любой MDE. [64] Критерии биомаркеров были добавлены для того, чтобы у людей с тлеющей множественной миеломой с высоким риском развития множественной миеломы можно было диагностировать до того, как произойдет повреждение органов, и, следовательно, у них был бы лучший прогноз. [73]
Сопутствующие состояния включают одиночную плазмоцитому (единственную опухоль плазматических клеток, обычно лечатую облучением ) , дискразию плазматических клеток (когда только антитела вызывают симптомы, например, AL-амилоидоз ) и периферическую невропатию, органомегалию, эндокринопатию, моноклональное заболевание плазматических клеток и изменения кожи .
При множественной миеломе определение стадии помогает в прогнозировании, но не влияет на принятие решения о лечении. Система стадирования Дьюри-Салмона использовалась исторически и была заменена Международной системой стадирования (ISS), опубликованной Международной рабочей группой по миеломе в 2005 году. [74] Пересмотренная версия ISS (R-ISS) была опубликована в 2015 году и включает цитогенетические и лактатдегидрогеназа (ЛДГ). [57] : 1730–1 [75] [76] : 732–3
Риск развития множественной миеломы можно немного снизить, поддерживая нормальный вес тела. [77]
В большинстве медикаментозных методов лечения используются несколько агентов, например, так называемая «тройная» или «квадруплетная» терапия. Многие такие группы включают одно или несколько моноклональных антител (например, изатуксимаб или даратумумаб ), иммуномодулирующего агента (например, леналидомид или помалидомид ) и ингибитора протеасом (например, бортезомиб , карфилзомиб или иксазомиб ) в комбинации со стероидом. (например, дексаметазон ). [78]
В то время как тройная терапия была стандартом лечения в течение многих лет, в современной практике чаще применяется четверная терапия. [78] Такие комбинированные методы лечения обычно обозначаются инициалами, используя прописные буквы для торговых марок лекарств и строчные буквы для названий непатентованных лекарств, например, VRd для Велкейда (торговая марка бортезомиба ) , Ревлимид (торговая марка леналидомида ) и дексаметазон. Аналогично с DKRd, где буква D представляет Дарзалекс (торговая марка даратумумаба ), а буква K представляет Кипролис (торговая марка карфилзомиба ). [79] (Новая практика не позволяет называть такие препараты « химиотерапией », поскольку они не являются традиционными неспецифическими внутриклеточными ядами, которые действуют классическим «химическим» способом, ингибируя митоз или вызывая повреждение ДНК. [80] [81] ).
Обычно эффективность каждого препарата со временем снижается, поскольку рак развивает механизмы устойчивости к лекарствам, например, в результате клональной эволюции или генетических мутаций. Частично по этой причине исторически множественную миелому не лечили в «тлеющей» стадии, поскольку используемый препарат(ы) может иметь сниженную эффективность, если заболевание переходит в симптоматическую стадию. Таким образом, стандартом лечения было «бдительное ожидание», пока болезнь тлела. [82] Однако все чаще предпринимаются усилия по изучению того, может ли лекарственная терапия, применяемая на стадии тления, предотвратить переход заболевания в активную стадию. Показательными являются клинические исследования GEM-CESAR, [83] ASCENT [84] и Immuno-PRISM [85] .
После того, как лекарственная терапия снизила бремя рака у пациента, некоторым пациентам проводится трансплантация костного мозга (более правильно называемая аутологичной трансплантацией гемопоэтических стволовых клеток или АТСК) для дальнейшего подавления заболевания. Однако эта процедура недоступна для ослабленных пациентов [86] , поскольку она по существу восстанавливает некоторые аспекты иммунной системы и требует восстановления естественной защиты, например, путем введения детских вакцин. [87]
Все чаще изучаются методы точной медицины , причем исследования показывают, что определенные варианты и генетические подтипы заболевания более благоприятно реагируют на одни лекарственные методы лечения, чем на другие. [88] Например, некоторые исследования показывают, что пациенты с генетической транслокацией t(11,14) (присутствующей примерно у 15-20% пациентов с множественной миеломой) могут особенно получить пользу от терапии Венетоклаксом (которая одобрена FDA для лечения других видов рака крови, но пока не доступен для пациентов с множественной миеломой, за исключением клинических испытаний). [88] [89]
В то время как медикаментозная терапия обычно требует месяцев или лет лечения, терапия CAR-T предлагает альтернативу однократному лечению (хотя и предполагающему длительное пребывание в больнице). Более того, лечение CAR-T, по-видимому, обеспечивает более глубокую и длительную ремиссию заболевания, чем существующие лекарства. [90] Однако в настоящее время такая терапия одобрена FDA только для пациентов на поздних стадиях заболевания и доступна только в некоторых медицинских центрах. [91]
Предстоящей терапией, которая также усиливает иммунный ответ Т-клеток, является класс препаратов, называемых биспецифическими ингибиторами Т-клеток (BITE), или иногда просто биспецифическими антителами . Первым препаратом этого класса, одобренным для лечения множественной миеломы, является Теклистамаб , но в настоящее время его использование разрешено только пациентам на более поздних стадиях заболевания. [92] Еще один препарат от BITE, Талкетамаб , находится в стадии изучения; другие находятся в стадии разработки. [93] (В настоящее время проводятся клинические испытания по изучению терапии BITE для пациентов с тлеющим заболеванием и впервые диагностированных пациентов. [85] ) .
Общепринятое мнение заключается в том, что пациенты должны стремиться, где это возможно, к клиническим испытаниям лекарств, поскольку они обеспечивают степень медицинского контроля, отсутствующую в большинстве других клинических условий, не говоря уже о доступе к новым лекарствам, которые, по-видимому, имеют многообещающие преимущества по сравнению с существующими методами лечения. Некоторые пациенты временно переезжают в городские районы, где такие исследования доступны.
Крупнейшие научно-исследовательские институты рака, естественно, предлагают большинство клинических исследований, но некоторые исследования (особенно исследования поздней стадии, фазы 3) доступны в спутниковых сетях, охватывающих сотни больниц. Национальный институт здравоохранения США ведет каталог клинических испытаний. [94] В то время как медицинские Мекки, такие как Нью-Йорк, Бостон, Хьюстон и Рочестер, проводят ведущие исследования множественной миеломы, другие ведущие программы исследования миеломы находятся за рубежом, в том числе в Университете Саламанки, Испания, и в Свободном университете в Брюсселе.
Информация Википедии вскоре устаревает в быстро меняющихся медицинских сферах, таких как методы лечения множественной миеломы. Многие онкологи в сельских медицинских центрах могут быть не в состоянии следить за литературой по всем соответствующим дисциплинам. Это привело к появлению организаций, которые работают над информированием пациентов о последних изменениях в заболевании, например, предлагая вебинары с участием выдающихся исследователей и практиков, занимающихся множественной миеломой. К ним относятся Международный фонд миеломы и Фонд исследования множественной миеломы . Некоторые пациенты, интересующиеся последними разработками, просматривают материалы крупных гематологических онкологических конференций, таких как конференция Американского общества гематологов (ASH), [95] Конференция Американского общества клинической онкологии (ASCO), [96] Саммит IMF IMWG и Ежегодная конференция Европейской гематологической ассоциации (ЕГА). [97]
Лечение показано при наличии симптомов миеломы. Если симптомов нет, но присутствует парапротеин, типичный для миеломы и диагностического костного мозга, без поражения органов-мишеней, лечение обычно откладывают или ограничивают клиническими исследованиями. [98] Лечение множественной миеломы направлено на уменьшение популяции клональных плазматических клеток и, следовательно, на уменьшение симптомов заболевания.
Предпочтительным лечением для лиц в возрасте до 65 лет является высокодозная химиотерапия, обычно с использованием схем на основе бортезомиба и леналидомида -дексаметазона [99] с последующей трансплантацией стволовых клеток. Исследование 2016 года пришло к выводу, что трансплантация стволовых клеток является предпочтительным методом лечения множественной миеломы. [100] Существует два типа трансплантации стволовых клеток для лечения множественной миеломы. [101] При аутологичной трансплантации гемопоэтических стволовых клеток (ТГСК) – собственные стволовые клетки пациента собираются из собственной крови пациента. Пациенту назначают высокие дозы химиотерапии, а затем стволовые клетки пациента трансплантируют обратно пациенту. Этот процесс не является излечивающим, но продлевает общую выживаемость и полную ремиссию. При аллогенной трансплантации стволовых клеток больному человеку пересаживают стволовые клетки здорового донора. Аллогенная трансплантация стволовых клеток имеет потенциал для излечения, но используется у очень небольшого процента людей (и в случае рецидива, а не в рамках первоначального лечения). [50] Кроме того, 5–10% смертности, связанной с лечением, связано с трансплантацией аллогенных стволовых клеток.
Люди старше 65 лет и люди с серьезными сопутствующими заболеваниями часто не переносят трансплантацию стволовых клеток. Для этих людей стандартом лечения была химиотерапия мелфаланом и преднизолоном. Недавние исследования среди этой группы населения показывают улучшение результатов при использовании новых схем химиотерапии, например, бортезомиба. [102] [103] При лечении бортезомибом, мелфаланом и преднизоном общая выживаемость составила 83% через 30 месяцев, леналидомид плюс низкие дозы дексаметазона - 82% выживаемость через 2 года, а мелфалан, преднизон и леналидомид - 90. % выживаемости через 2 года. По состоянию на 2008 год прямых исследований, сравнивающих эти схемы, не проводилось [обновлять]. [104]
Существует поддержка непрерывной терапии с использованием нескольких комбинаций противомиеломных препаратов бортезомиба , леналидомида и талидомида в качестве начального лечения множественной миеломы, не подходящей для трансплантации. [105] Для определения потенциального вреда этих препаратов и их влияния на качество жизни человека необходимы дальнейшие клинические исследования. [105] В обзоре 2009 года отмечалось: «Тромбозы глубоких вен и легочная эмболия являются основными побочными эффектами талидомида и леналидомида. Леналидомид вызывает большую миелосупрессию, а талидомид вызывает больший седативный эффект. Периферическая невропатия и тромбоцитопения, вызванные химиотерапией, являются основными побочными эффектами бортезомиба. " [106] Добавление подкожного даратумумаба к индукционной и консолидационной терапии бортезомибом, леналидомидом и дексаметазоном, а также к поддерживающей терапии леналидомидом обеспечило улучшение выживаемости без прогрессирования среди пациентов с впервые диагностированной множественной миеломой, нуждающихся в трансплантации. [107]
Лечение связанного с ним синдрома повышенной вязкости может потребоваться для предотвращения неврологических симптомов или почечной недостаточности. [108] [109]
У большинства людей, включая тех, кто лечился с помощью ASCT, после первоначального лечения наблюдается рецидив. Для предотвращения рецидива часто применяют поддерживающую терапию с использованием длительного курса малотоксичных препаратов. Метаанализ 2017 года показал, что поддерживающая терапия леналидомидом после ТГСК улучшает выживаемость без прогрессирования и общую выживаемость у людей со стандартным риском. [110] Клиническое исследование 2012 года показало, что людям с заболеваниями среднего и высокого риска выгодна схема поддерживающей терапии на основе бортезомиба. [111]
Причины рецидива включают развитие заболевания либо в результате селективного давления, оказываемого лечением, либо в результате мутаций de novo и/или если заболевание не было адекватно представлено в первоначальной биопсии. [57] Рецидив в течение первых 18 месяцев после постановки диагноза считается функциональной множественной миеломой высокого риска. [57] В зависимости от состояния человека, использованных ранее методов лечения и продолжительности ремиссии варианты рецидива заболевания включают повторное лечение исходным препаратом, использование других препаратов (таких как мелфалан, циклофосфамид, талидомид или дексаметазон, отдельно или в виде таблеток). комбинация) и второй ASCT.
Позже в ходе заболевания он становится рефрактерным (резистентным) к ранее эффективному лечению. Эта стадия называется рецидивирующей/рефрактерной множественной миеломой (RRMM). Методы лечения, которые обычно используются для лечения RRMM, включают дексаметазон, ингибиторы протеасом (например, бортезомиб и карфилзомиб ), иммуномодулирующие имидные препараты (например, талидомид, леналидомид и помалидомид ) и некоторые моноклональные антитела (например, изатуксимаб против CD38 или антитела, нацеленные на CD319 ). В последние годы продолжительность выживаемости возросла [112] , и разрабатываются новые методы лечения. [ нужна медицинская ссылка ]
Почечная недостаточность при множественной миеломе может быть острой (обратимой) или хронической (необратимой). Острая почечная недостаточность обычно проходит, когда уровень кальция и парапротеина находится под контролем. Лечение хронической почечной недостаточности зависит от типа почечной недостаточности и может включать диализ .
Несколько новых вариантов одобрены для лечения поздних стадий заболевания:
Талкетамаб (Талви) и элранатамаб (Элрексфио) были одобрены для медицинского применения в США в августе 2023 года. [124] [125] [126] [127]
Трансплантацию стволовых клеток можно использовать для лечения множественной миеломы. [3] Трансплантация стволовых клеток сопряжена с риском реакции «трансплантат против хозяина» . Мезенхимальные стромальные клетки могут снизить смертность от всех причин, если они используются в терапевтических целях, а терапевтическое использование МСК может увеличить полный ответ на острую и хроническую РТПХ, но доказательства очень неопределенны. [128] Имеющиеся данные свидетельствуют о том, что МСК в профилактических целях практически не приводят к различиям в смертности от всех причин, рецидивах злокачественных заболеваний и частоте острой РТПХ. [128] Имеющиеся данные свидетельствуют о том, что МСК в профилактических целях снижают частоту возникновения хронической РТПХ. [128]
Плериксафор (Мозобил) был одобрен для медицинского применения в США в 2008 году. [129]
Мотиксафортид (Афексда) был одобрен для медицинского применения в США в сентябре 2023 года. [130]
Помимо прямого лечения пролиферации плазматических клеток, для предотвращения переломов обычно назначают бисфосфонаты (например, памидронат или золедроновую кислоту ); также было обнаружено, что они оказывают прямое противоопухолевое действие даже у людей без известных заболеваний скелета. [ нужна цитация ] При необходимости для лечения анемии можно использовать переливание эритроцитов или эритропоэтина .
Химиотерапия и трансплантация стволовых клеток могут вызвать нежелательные кровотечения и могут потребовать переливания тромбоцитов. Было замечено, что переливание тромбоцитов людям, проходящим химиотерапию или трансплантацию стволовых клеток для предотвращения кровотечений, по-разному влияло на количество участников с кровотечением, количество дней, в которые произошло кровотечение, вторичную смертность от кровотечения. и количество трансфузий тромбоцитов в зависимости от способа их применения (терапевтические, в зависимости от порога, различные схемы дозирования или профилактические). [132] [133]
Добавление физических упражнений к стандартному лечению взрослых пациентов со злокачественными новообразованиями крови, такими как множественная миелома, может практически не привести к изменению показателей смертности, качества жизни и физического функционирования. [134] Эти упражнения могут привести к небольшому уменьшению депрессии. [134] Кроме того, аэробные физические упражнения, вероятно, снижают утомляемость. Доказательства очень неопределенны в отношении эффекта и серьезных побочных эффектов [134].
Многие национальные руководства по лечению рака рекомендуют раннюю паллиативную помощь людям с поздней стадией множественной миеломы на момент постановки диагноза и всем, у кого есть серьезные симптомы. [135] [136]
Паллиативная помощь целесообразна на любой стадии множественной миеломы и может оказываться наряду с лечебным лечением. Помимо устранения симптомов рака, паллиативная помощь помогает справиться с нежелательными побочными эффектами, такими как боль и тошнота, вызванными лечением. [137] [138]
Профилактика полости рта, инструкции по гигиене и устранение источников инфекции во рту перед началом лечения рака могут снизить риск инфекционных осложнений. Перед началом терапии бисфосфонатами необходимо оценить состояние зубов человека, чтобы оценить факторы риска и предотвратить развитие медикаментозного остеонекроза челюсти (MRONJ). При наличии каких-либо симптомов или рентгенологических проявлений MRONJ, таких как боль в челюсти, шатающийся зуб, отек слизистой оболочки, рекомендуется раннее обращение к хирургу-стоматологу. Следует избегать удаления зубов в активный период лечения и вместо этого лечить зуб нехирургическим лечением корневых каналов. [139]
В целом 5-летняя выживаемость в США составляет около 54%. [140] При применении высоких доз терапии с последующим ASCT медиана выживаемости, по оценкам, в 2003 году составила около 4,5 лет по сравнению со средним значением около 3,5 лет при «стандартной» терапии. [141]
Международная система стадирования может помочь прогнозировать выживаемость: медиана выживаемости (в 2005 г.) составляла 62 месяца для болезни 1-й стадии, 45 месяцев для болезни 2-й стадии и 29 месяцев для болезни 3-й стадии. [74] Средний возраст на момент постановки диагноза составляет 69 лет. [140]
Кариотипирование с помощью массива SNP может обнаружить изменения числа копий, имеющие прогностическое значение, которые могут быть пропущены целевой панелью FISH. [142]
В следующей таблице представлен прогностический эффект различных генетических признаков при множественной миеломе с хромосомными транслокациями , обозначенными буквой t, с последующей их стандартной номенклатурой: [143]


Во всем мире множественная миелома затронула 488 000 человек и привела к 101 100 смертельным случаям в 2015 году. [8] [9] Это больше, чем 49 000 в 1990 году. [145]
В Соединенных Штатах в 2016 году было зарегистрировано около 30 330 новых случаев заболевания и 12 650 смертей. [7] Эти цифры основаны на предположениях, сделанных с использованием данных за 2011 год, согласно которым число заболевших оценивается в 83 367 человек, количество новых случаев - 6,1 на 100 000 человек в год, а смертность - 3,4 на 100 000 человек в год.
Множественная миелома является вторым по распространенности раком крови (10%) после неходжкинской лимфомы . [146] На него приходится около 1,8% всех новых случаев рака и 2,1% всех случаев смерти от рака. [7]
Множественная миелома поражает несколько чаще мужчин, чем женщин. У афроамериканцев и коренных жителей тихоокеанских островов зарегистрировано наибольшее количество новых случаев этого заболевания в Соединенных Штатах, а у азиатов – наименьшее. Результаты одного исследования показали, что количество новых случаев миеломы составляет 9,5 случаев на 100 000 афроамериканцев и 4,1 случая на 100 000 американцев европеоидной расы. [147] Среди афроамериканцев миелома входит в десятку основных причин смертности от рака. [148]
Миелома является 17-м по распространенности раком в Великобритании: в 2011 году это заболевание было диагностировано около 4800 человек. Это 16-е место по распространенности среди причин смерти от рака: в 2012 году от него умерло около 2700 человек. [149]
Множественная миелома диагностирована у собак, [150] кошек и лошадей. [151]
У собак множественная миелома составляет около 8% всех гемопоэтических опухолей. Множественная миелома встречается у пожилых собак и не особенно связана ни с кобелями, ни с суками. В проведенных обзорах случаев ни одна порода не оказалась чрезмерно представленной. [152] Диагностика у собак обычно задерживается из-за первоначальной неспецифичности и диапазона возможных клинических признаков. Диагноз обычно включает исследование костного мозга, рентгенологическое исследование и исследование белков плазмы. У собак исследования белка обычно выявляют повышение уровня моноклонального гаммаглобулина IgA или IgG в равном числе случаев. [152] В редких случаях повышение уровня глобулина представляет собой IgM, что называется макроглобулинемией Вальденстрема . [153] Прогноз первоначального контроля и возвращения к хорошему качеству жизни у собак хороший; 43% собак, начавших лечение по протоколу комбинированной химиотерапии, достигли полной ремиссии. Долгосрочная выживаемость является нормальной, ее медиана составляет 540 дней. [152] Со временем заболевание рецидивирует, становясь устойчивым к доступным методам лечения. [ нужна медицинская ссылка ] Осложнения в виде почечной недостаточности, сепсиса или боли могут привести к смерти животного, часто в результате эвтаназии . [ нужна медицинская ссылка ]
{{cite journal}}: |author1=имеет общее имя ( справка )CS1 maint: числовые имена: список авторов ( ссылка )