Никель — химический элемент ; его символ — Ni , атомный номер — 28. Это серебристо-белый блестящий металл с легким золотистым оттенком. Никель — твердый и пластичный переходный металл . Чистый никель химически активен, но крупные куски медленно реагируют с воздухом при стандартных условиях , поскольку на поверхности образуется пассивирующий слой оксида никеля , который предотвращает дальнейшую коррозию. Тем не менее, чистый самородный никель встречается в земной коре только в небольших количествах, обычно в ультраосновных породах [7] [8] и внутри более крупных никель-железных метеоритов , которые не подвергались воздействию кислорода за пределами земной атмосферы.
Метеорный никель обнаружен в сочетании с железом , что отражает происхождение этих элементов как основных конечных продуктов нуклеосинтеза сверхновых . Считается, что смесь железа и никеля составляет внешнее и внутреннее ядра Земли . [9]
Использование никеля (как естественного метеоритного сплава никеля и железа) было прослежено еще в 3500 году до нашей эры. Никель был впервые выделен и классифицирован как элемент в 1751 году Акселем Фредриком Кронштедтом , который изначально принял руду за медный минерал , в кобальтовых рудниках Лос, Хельсингланд, Швеция . Название элемента происходит от озорного духа немецкой шахтерской мифологии, Никеля (похожего на Старого Ника ). Никелевые минералы могут быть зелеными, как медные руды, и были известны как купферникель — никелевая медь — потому что они не производили медь.
Хотя большая часть никеля в земной коре существует в виде оксидов, экономически более важными никелевыми рудами являются сульфиды, особенно пентландит . Основные места добычи включают регион Садбери , Канада (который, как полагают, имеет метеоритное происхождение), Новая Каледония в Тихом океане , Западная Австралия и Норильск , Россия. [10]
Никель — один из четырех элементов (другие — железо , кобальт и гадолиний ) [11] , которые являются ферромагнитными при температуре, близкой к комнатной. Постоянные магниты Alnico , частично основанные на никеле, имеют промежуточную прочность между постоянными магнитами на основе железа и редкоземельными магнитами . Металл используется в основном в сплавах и коррозионно-стойком покрытии.
Около 68% мирового производства используется в нержавеющей стали . Еще 10% используется для сплавов на основе никеля и меди, 9% для гальванопокрытия, 7% для легированных сталей, 3% в литейном производстве и 4% в других областях, таких как перезаряжаемые батареи, [12] включая те, что в электромобилях (ЭМ). [13] Никель широко используется в монетах , хотя никелированные предметы иногда вызывают аллергию на никель . Как соединение, никель имеет ряд нишевых применений в химическом производстве, таких как катализатор для гидрогенизации , катоды для перезаряжаемых батарей, пигменты и обработка металлических поверхностей. [14] Никель является важным питательным веществом для некоторых микроорганизмов и растений, которые имеют ферменты с никелем в качестве активного центра . [15]

Никель — серебристо-белый металл с легким золотистым оттенком, который требует тщательной полировки. Это один из четырех элементов, которые являются ферромагнитными при комнатной температуре или около нее; остальные — железо, кобальт и гадолиний . Его температура Кюри составляет 355 °C (671 °F), что означает, что объемный никель немагнитен выше этой температуры. [17] [11] Элементарная ячейка никеля представляет собой гранецентрированный куб ; он имеет параметр решетки 0,352 нм, что дает атомный радиус 0,124 нм. Эта кристаллическая структура устойчива к давлению не менее 70 ГПа. Никель твердый, ковкий и пластичный , а также имеет относительно высокую электро- и теплопроводность для переходных металлов. [18] Высокая прочность на сжатие 34 ГПа, предсказанная для идеальных кристаллов, никогда не достигается в реальном объемном материале из-за образования и движения дислокаций . Однако она была достигнута в наночастицах Ni . [19]
Никель имеет две атомные электронные конфигурации , [Ar] 3d 8 4s 2 и [Ar] 3d 9 4s 1 , которые очень близки по энергии; [Ar] обозначает полную структуру ядра аргона . Существуют некоторые разногласия относительно того, какая конфигурация имеет более низкую энергию. [20] Учебники по химии приводят электронную конфигурацию никеля как [Ar] 4s 2 3d 8 , [21] также пишут [Ar] 3d 8 4s 2 . [22] Эта конфигурация согласуется с правилом упорядочения энергии Маделунга , которое предсказывает, что 4s заполняется раньше 3d. Это подтверждается экспериментальным фактом, что самым низким энергетическим состоянием атома никеля является энергетический уровень 3d 8 4s 2 , в частности уровень 3d 8 ( 3 F) 4s 2 3 F, J = 4. [23] [24]
Однако каждая из этих двух конфигураций распадается на несколько энергетических уровней из-за тонкой структуры , [23] [24] и два набора энергетических уровней перекрываются. Средняя энергия состояний с [Ar] 3d 9 4s 1 на самом деле ниже, чем средняя энергия состояний с [Ar] 3d 8 4s 2 . Поэтому исследовательская литература по атомным расчетам приводит конфигурацию основного состояния как [Ar] 3d 9 4s 1 . [20]
Изотопы никеля имеют атомный вес от 48 u (48
Ni ) до 82 u (82
Ни ). [6]
Природный никель состоит из пяти стабильных изотопов ,58
Ни ,60
Ни ,61
Ни ,62
Ни и64
Ni , из которых58
Ni является наиболее распространенным (68,077% от естественной распространенности ). [6]
Никель-62 имеет самую высокую энергию связи на нуклон среди всех нуклидов : 8,7946 МэВ/нуклон. [25] [26] Его энергия связи больше, чем у обоих56Фе и58Fe , более распространенные нуклиды, часто ошибочно упоминаются как имеющие самую высокую энергию связи. [27] Хотя это, казалось бы, предсказывает, что никель является самым распространенным тяжелым элементом во Вселенной, высокая скорость фотораспада никеля в недрах звезд приводит к тому, что железо является гораздо более распространенным элементом. [27]
Никель-60 является дочерним продуктом вымершего радионуклида 60Fe (период полураспада 2,6 млн лет). Из-за длительного периода полураспада60
Fe , его присутствие в материалах Солнечной системы может приводить к наблюдаемым изменениям в изотопном составе60
Ni . Поэтому обилие60
Никель во внеземном материале может дать представление о происхождении Солнечной системы и ее ранней истории. [28]
Охарактеризовано не менее 26 радиоизотопов никеля; наиболее стабильными являются59
Ni с периодом полураспада 76 000 лет,63
Ни (100 лет) и56
Ni (6 дней). Все остальные радиоизотопы имеют период полураспада менее 60 часов, и большинство из них имеют период полураспада менее 30 секунд. Этот элемент также имеет одно метасостояние . [6]
Радиоактивный никель-56 образуется в процессе горения кремния и позже высвобождается в больших количествах в сверхновых типа Ia . Форма кривой блеска этих сверхновых в промежуточные и поздние времена соответствует распаду через электронный захват56
Ni превращается в кобальт -56 и в конечном итоге в железо-56. [29] Никель-59 — долгоживущий космогенный радионуклид ; период полураспада 76 000 лет.59
Никель нашел широкое применение в изотопной геологии .59
Ni использовался для датирования земного возраста метеоритов и определения содержания внеземной пыли во льду и осадках . Никель-78 с периодом полураспада 110 миллисекунд считается важным изотопом в нуклеосинтезе сверхновых элементов тяжелее железа. [30] 48 Ni, открытый в 1999 году, является самым богатым протонами изотопом тяжелого элемента из известных. Имея 28 протонов и 20 нейтронов , 48 Ni является « вдвойне магическим », как и 78 Ni с 28 протонами и 50 нейтронами. Поэтому оба они необычайно стабильны для ядер с таким большим протон-нейтронным дисбалансом . [6] [31]
Никель-63 — загрязняющее вещество, обнаруженное в опорной конструкции ядерных реакторов. Он образуется в результате захвата нейтронов никелем-62. Небольшие количества также были обнаружены вблизи полигонов для испытаний ядерного оружия в южной части Тихого океана. [32]

Никелевые руды классифицируются как оксиды или сульфиды. Оксиды включают латерит , где основными минеральными смесями являются никелевый лимонит , (Fe,Ni)O(OH) и гарниерит (смесь различных гидросиликатов никеля и богатых никелем силикатов). [33] Никелевые сульфиды обычно существуют в виде твердых растворов с железом в таких минералах, как пентландит и пирротин с формулой Fe 9-x Ni x S 8 и Fe 7-x Ni x S 6 , соответственно. Другими распространенными минералами, содержащими Ni, являются миллерит и арсенид никколит . [34] [35]
Выявленные наземные ресурсы по всему миру, в среднем содержащие 1% никеля или более, включают не менее 130 миллионов тонн никеля (примерно вдвое больше известных запасов). Около 60% находится в латеритах и 40% в сульфидных месторождениях. [36]
По геофизическим данным, большая часть никеля на Земле, как полагают, находится во внешних и внутренних ядрах Земли . Камасит и тэнит — это природные сплавы железа и никеля. Для камасита сплав обычно находится в пропорции от 90:10 до 95:5, хотя могут присутствовать примеси (такие как кобальт или углерод ). Тэнит содержит от 20% до 65% никеля. Камасит и тэнит также встречаются в метеоритах из никелевого железа . [37]
Никель обычно встречается в железных метеоритах в виде сплавов камасита и тэнита . Никель в метеоритах был впервые обнаружен в 1799 году Жозефом-Луи Прустом , французским химиком, который тогда работал в Испании. Пруст проанализировал образцы метеорита из Кампо-дель-Сьело (Аргентина), которые были получены в 1783 году Мигелем Рубином де Селисом, обнаружив в них присутствие никеля (около 10%) вместе с железом. [38]
Наиболее распространенная степень окисления никеля — +2, но соединения Ni 0 , Ni + и Ni 3+ хорошо известны, а экзотические степени окисления Ni 2− и Ni − были охарактеризованы. [39]

Тетракарбонил никеля (Ni(CO) 4 ), открытый Людвигом Мондом , [40] является летучей, высокотоксичной жидкостью при комнатной температуре. При нагревании комплекс разлагается обратно на никель и оксид углерода:
Это поведение используется в процессе Монда для очистки никеля, как описано выше. Связанный комплекс никеля(0) бис(циклооктадиен)никель(0) является полезным катализатором в химии органического никеля, поскольку лиганды циклооктадиена (или COD ) легко замещаются.

Комплексы никеля(I) встречаются редко, но одним из примеров является тетраэдрический комплекс NiBr(PPh 3 ) 3 . Многие комплексы никеля(I) имеют связь Ni–Ni, например, темно-красный диамагнитный K 4 [Ni 2 (CN) 6 ], полученный восстановлением K 2 [Ni 2 (CN) 6 ] амальгамой натрия . Это соединение окисляется в воде, выделяя H 2 . [41]
Считается, что степень окисления никеля (I) важна для никельсодержащих ферментов, таких как [NiFe]-гидрогеназа , которая катализирует обратимое восстановление протонов до H 2 . [42]
_complexes_in_aqueous_solution.jpg/440px-Color_of_various_Ni(II)_complexes_in_aqueous_solution.jpg)
-sulfate-hexahydrate-sample.jpg/440px-Nickel(II)-sulfate-hexahydrate-sample.jpg)
Никель(II) образует соединения со всеми распространенными анионами, включая сульфид , сульфат , карбонат, гидроксид, карбоксилаты и галогениды. Сульфат никеля(II) производится в больших количествах путем растворения металлического никеля или оксидов в серной кислоте , образуя как гекса-, так и гептагидрат [43], полезный для гальванопокрытия никелем. Распространенные соли никеля, такие как хлорид, нитрат и сульфат, растворяются в воде, давая зеленые растворы металлического аквокомплекса [Ni(H 2 O) 6 ] 2+ . [44]
Четыре галогенида образуют соединения никеля, которые являются твердыми веществами с молекулами с октаэдрическими центрами Ni. Хлорид никеля(II) является наиболее распространенным, и его поведение иллюстрирует поведение других галогенидов. Хлорид никеля(II) получают путем растворения никеля или его оксида в соляной кислоте . Обычно он встречается в виде зеленого гексагидрата, формула которого обычно записывается как NiCl2 · 6H2O . При растворении в воде эта соль образует металлический аквокомплекс [Ni(H2O ) 6 ] 2+ . Дегидратация NiCl2 · 6H2O дает желтый безводный NiCl2 . [ 45 ]
Некоторые тетракоординированные комплексы никеля(II), например, хлорид бис(трифенилфосфин)никеля , существуют как в тетраэдрической, так и в квадратно-плоской геометрии. Тетраэдрические комплексы являются парамагнитными ; квадратно-плоские комплексы являются диамагнитными . Имея свойства магнитного равновесия и образования октаэдрических комплексов, они контрастируют с двухвалентными комплексами более тяжелых металлов группы 10, палладия(II) и платины(II), которые образуют только квадратно-плоскую геометрию. [39]
Число электронов в никелоцене равно 20. Многие химические реакции никелоцена имеют тенденцию давать продукты с 18 электронами. [46]

Известно много соединений Ni(III). Ni(III) образует простые соли с фторидными [47] или оксидными ионами. Ni(III) может быть стабилизирован σ-донорными лигандами, такими как тиолы и органофосфины . [41]
Ni(III) встречается в гидроксиде оксида никеля , который используется в качестве катода во многих перезаряжаемых батареях , включая никель-кадмиевые , никель-железные , никель-водородные и никель-металлгидридные , а также используется некоторыми производителями в литий-ионных батареях . [48]
Ni(IV) остается редким состоянием окисления, и известно очень мало соединений. Ni(IV) встречается в смешанном оксиде BaNiO 3 . [49] [50] [51] [52]
Непреднамеренное использование никеля можно проследить вплоть до 3500 г. до н. э. Было обнаружено, что бронзы из нынешней Сирии содержат до 2% никеля. [53] Некоторые древние китайские рукописи предполагают, что «белая медь» ( медно-никелевый сплав , известный как baitong ) использовалась там в 1700–1400 гг. до н. э. Эта белая медь Paktong экспортировалась в Британию еще в 17 веке, но содержание никеля в этом сплаве не было обнаружено до 1822 года. [54] Монеты из сплава никеля и меди чеканились бактрийскими царями Агафоклом , Евтидемом II и Пантелеимоном во 2 веке до н. э., возможно, из китайского медно-никелевого сплава. [55]

В средневековой Германии в Рудных горах был найден металлический желтый минерал, напоминающий медную руду. Но когда шахтеры не смогли получить из него медь, они обвинили злого духа немецкой мифологии, Никеля (похожего на Старого Ника ), в том, что он осаждает медь. Они назвали эту руду Купферникелем от немецкого Kupfer «медь». [56] [57] [58] [59] Эта руда теперь известна как минерал никель (ранее никколит [60] ), арсенид никеля . В 1751 году барон Аксель Фредрик Кронштедт попытался извлечь медь из купферникеля на кобальтовой шахте в деревне Лос, Швеция , и вместо этого получил белый металл, который он назвал никелем в честь духа, давшего название минералу. [61] В современном немецком языке Купферникель или Купфер-никель обозначает сплав купроникель . [18]
Первоначально единственным источником никеля был редкий купферникель. Начиная с 1824 года никель получали как побочный продукт производства кобальтовой синевы . Первая крупномасштабная выплавка никеля началась в Норвегии в 1848 году из богатого никелем пирротина . Внедрение никеля в производство стали в 1889 году увеличило спрос на никель; месторождения никеля Новой Каледонии , открытые в 1865 году, обеспечивали большую часть мировых поставок между 1875 и 1915 годами. Открытие крупных месторождений в бассейне Садбери в Канаде в 1883 году, в Норильске -Талнахе в России в 1920 году и на рифе Меренского в Южной Африке в 1924 году сделало возможным крупномасштабное производство никеля. [54]

За исключением вышеупомянутых бактрийских монет, никель не входил в состав монет до середины 19 века. [62]
Пятицентовые монеты с содержанием никеля 99,9% чеканились в Канаде (крупнейшем производителе никеля в мире в то время) в невоенные годы с 1922 по 1981 год; содержание металла делало эти монеты магнитными. [63] В военные годы 1942–1945 годов большая часть или весь никель был удален из канадских и американских монет, чтобы сохранить его для изготовления брони. [57] Канада использовала 99,9% никеля с 1968 года до 2000 года в своих монетах более высокой стоимости. [64]
Монеты из почти чистого никеля впервые были использованы в 1881 году в Швейцарии. [65]
Бирмингем подделывал никелевые монеты примерно в 1833 году для торговли в Малайзии. [66]
В Соединенных Штатах термин «никель» или «ник» первоначально применялся к медно-никелевому центу Flying Eagle , который заменил медь на 12% никеля в 1857–58 годах, затем к центу Indian Head из того же сплава с 1859 по 1864 год. Еще позже, в 1865 году, термин обозначал трехцентовый никель , в котором содержание никеля увеличилось до 25%. В 1866 году пятицентовый щитовой никель (25% никеля, 75% меди) присвоил себе обозначение, которое с тех пор используется для последующих 5-центовых монет. Эта пропорция сплава не является ферромагнитной .
Американская никелевая монета содержит 0,04 унции (1,1 г) никеля, что по цене апреля 2007 года стоило 6,5 центов, а также 3,75 грамма меди стоимостью около 3 центов, с общей стоимостью металла более 9 центов. Поскольку номинальная стоимость никеля составляет 5 центов, это сделало его привлекательной целью для переплавки людьми, желающими продать металлы с прибылью. Монетный двор США , предвидя эту практику, ввел новые временные правила 14 декабря 2006 года, подлежащие общественному обсуждению в течение 30 дней, которые криминализировали переплавку и экспорт центов и никелей. [67] Нарушители могут быть наказаны штрафом в размере до 10 000 долларов США и/или максимальным сроком в пять лет тюремного заключения. [68] По состоянию на 19 сентября 2013 года стоимость переплавки американского никеля (включая медь и никель) составляет 0,045 доллара США (90% от номинала). [69]
В 21 веке высокая цена на никель привела к некоторой замене металла в монетах по всему миру. Монеты, которые все еще изготавливаются из никелевых сплавов, включают монеты в один и два евро , 5¢, 10¢, 25¢, 50¢ и 1 доллар США , [70] и 20p, 50p, £1 и £2 монеты Великобритании . С 2012 года никелевый сплав, используемый для 5p и 10p монет Великобритании, был заменен никелированной сталью. Это вызвало публичную полемику относительно проблем людей с аллергией на никель . [65]


По оценкам, во всем мире добывается 3,3 миллиона тонн (т) никеля в год; Индонезия (1 600 000 т), Филиппины (330 000 т), Россия (220 000 т), Новая Каледония ( Франция ) (190 000 т), Австралия (160 000 т) и Канада (130 000 т) являются крупнейшими производителями по состоянию на 2022 год. [72] Крупнейшие месторождения никеля в нероссийской Европе находятся в Финляндии и Греции . Выявленные наземные источники со средним содержанием никеля не менее 1% содержат не менее 130 миллионов тонн никеля. Около 60% находится в латеритах, а 40% - в сульфидных месторождениях. Кроме того, обширные источники никеля обнаружены в глубинах Тихого океана , особенно в районе, называемом зоной Кларион-Клиппертон, в виде полиметаллических конкреций, усеивающих морское дно на глубине 3,5–6 км ниже уровня моря . [73] [74] Эти конкреции состоят из многочисленных редкоземельных металлов и, по оценкам, содержат 1,7% никеля. [75] Благодаря достижениям в области науки и техники , в настоящее время Международный орган по морскому дну устанавливает правила, гарантирующие, что эти конкреции собираются экологически ответственным образом, соблюдая при этом Цели устойчивого развития Организации Объединенных Наций . [76]
Единственное место в Соединенных Штатах, где никель был прибыльно добыт, — это Риддл, штат Орегон , с несколькими квадратными милями никельсодержащих гарниеритовых поверхностных залежей. Шахта была закрыта в 1987 году. [77] [78] Проект шахты Eagle — это новая никелевая шахта на Верхнем полуострове Мичигана . Строительство было завершено в 2013 году, а эксплуатация началась в третьем квартале 2014 года. [79] За первый полный год эксплуатации шахта Eagle произвела 18 000 тонн. [79]

Никель получают путем извлечения металлургии : он извлекается из руды с помощью обычных процессов обжига и восстановления, которые дают металл чистотой более 75%. Во многих применениях нержавеющей стали 75% чистого никеля может использоваться без дальнейшей очистки, в зависимости от примесей. [43]
Традиционно большинство сульфидных руд перерабатываются с использованием пирометаллургических методов для получения штейна для дальнейшей переработки. Также используются гидрометаллургические методы . Большинство сульфидных месторождений традиционно перерабатываются путем концентрирования с помощью процесса пенной флотации с последующей пирометаллургической экстракцией. Никелевый штейн далее перерабатывается с помощью процесса Шерритта-Гордона . Сначала медь удаляется путем добавления сероводорода , оставляя концентрат кобальта и никеля. Затем экстракция растворителем используется для разделения кобальта и никеля, при этом конечное содержание никеля превышает 86%. [80]
Вторым распространенным процессом очистки является выщелачивание металлического штейна в растворе соли никеля с последующим электролизом никеля из раствора путем нанесения его на катод в качестве электролитического никеля. [81]

Самый чистый металл получается из оксида никеля по процессу Монда , который дает чистоту более 99,99%. Процесс был запатентован Людвигом Мондом и использовался в промышленности еще до начала 20-го века. [82] В этом процессе никель обрабатывается оксидом углерода в присутствии серного катализатора при температуре около 40–80 °C для образования карбонила никеля . В аналогичной реакции с железом может образовываться пентакарбонил железа , хотя эта реакция медленная. При необходимости никель можно отделить перегонкой. Октакарбонил дикобальта также образуется при перегонке никеля в качестве побочного продукта, но он разлагается до додекакарбонила тетракобальта при температуре реакции, давая нелетучее твердое вещество. [10]
Никель получают из карбонила никеля одним из двух способов. Его можно пропустить через большую камеру при высоких температурах, в которой постоянно перемешиваются десятки тысяч никелевых сфер (гранул). Карбонил разлагается и осаждает чистый никель на сферах. В альтернативном процессе карбонил никеля разлагается в меньшей камере при 230 °C для создания тонкого никелевого порошка. Побочный продукт оксид углерода рециркулируется и используется повторно. Высокочистый никель известен как «карбонильный никель». [83]
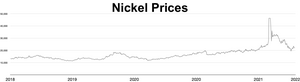
Рыночная цена на никель резко возросла в течение 2006 года и в первые месяцы 2007 года; по состоянию на 5 апреля 2007 года [обновлять]металл торговался по цене 52 300 долларов США за тонну или 1,47 доллара США за унцию. [84] Позже цена резко упала; по состоянию на сентябрь 2017 года [обновлять]металл торговался по цене 11 000 долларов США за тонну или 0,31 доллара США за унцию. [85] Во время российского вторжения в Украину в 2022 году опасения по поводу санкций в отношении экспорта российского никеля спровоцировали короткое сжатие , в результате чего цена на никель выросла в четыре раза всего за два дня, достигнув 100 000 долларов США за тонну. [86] [87] Лондонская биржа металлов аннулировала контракты на сумму 3,9 миллиарда долларов США и приостановила торговлю никелем более чем на неделю. [88] Аналитик Энди Хоум утверждал, что такие ценовые шоки усугубляются требованиями к чистоте, предъявляемыми рынками металлов: только металл класса I (чистота 99,8%) может использоваться в качестве товара на биржах, но большая часть мировых поставок представлена либо сплавами ферроникеля , либо металлами более низкой чистоты. [89]

В настоящее время 68% мирового использования никеля приходится на нержавеющую сталь, 10% на цветные сплавы , 9% на гальванопокрытие , 7% на легированную сталь, 3% на литейное производство и 4% на другие нужды (включая батареи). [12]
Никель используется во многих узнаваемых промышленных и потребительских товарах, включая нержавеющую сталь , магниты алнико , чеканку монет, аккумуляторные батареи (например, никель-железо ), струны электрогитар, микрофонные капсюли, покрытие сантехнических приборов [90] и специальные сплавы, такие как пермаллой , элинвар и инвар . Он используется для покрытия и в качестве зеленого оттенка в стекле. Никель является преимущественно легированным металлом, и его основное применение - в никелевых сталях и никелевых чугунах, в которых он обычно увеличивает прочность на разрыв, ударную вязкость и предел упругости. Он широко используется во многих других сплавах, включая никелевые латуни и бронзы и сплавы с медью, хромом, алюминием, свинцом, кобальтом, серебром и золотом ( инконель , инколой , монель , нимоник ). [81]

Поскольку никель устойчив к коррозии, его иногда использовали в качестве замены декоративному серебру. Никель также иногда использовался в некоторых странах после 1859 года как дешевый металл для чеканки монет (см. выше), но в более поздние годы 20-го века его заменили более дешевые сплавы нержавеющей стали (то есть железа), за исключением Соединенных Штатов и Канады. [62]
Никель является прекрасным легирующим агентом для некоторых драгоценных металлов и используется в пробирном анализе в качестве коллектора элементов платиновой группы (ЭПГ). Таким образом, никель может полностью собирать все шесть ЭПГ из руды и может частично собирать золото. Высокопроизводительные никелевые рудники также могут извлекать ЭПГ (в основном платину и палладий ); примерами являются Норильск, Россия и бассейн Садбери, Канада. [91]
Никелевая пена или никелевая сетка используется в газодиффузионных электродах для щелочных топливных элементов . [92] [93]
Никель и его сплавы часто используются в качестве катализаторов для реакций гидрирования . Никель Ренея , мелкодисперсный сплав никеля и алюминия, является одной из распространенных форм, хотя также используются родственные катализаторы, включая катализаторы типа Ренея. [94]
Никель по своей природе является магнитострикционным: в присутствии магнитного поля материал претерпевает небольшое изменение длины. [95] [96] Магнитострикция никеля составляет порядка 50 ppm и является отрицательной, что указывает на то, что он сжимается. [97]
Никель используется в качестве связующего в промышленности по производству цементированного карбида вольфрама или твердого сплава и используется в пропорциях от 6% до 12% по весу. Никель делает карбид вольфрама магнитным и добавляет коррозионную стойкость цементированным деталям, хотя твердость меньше, чем у деталей с кобальтовым связующим. [98]
63
Ni , период полураспада которого составляет 100,1 года, полезен в устройствах Krytron в качестве излучателя бета-частиц (высокоскоростных электронов ), чтобы сделать ионизацию с помощью поддерживающего электрода более надежной. [99] Он исследуется в качестве источника питания для бета-вольтаических батарей . [100] [101]
Около 27% всего производства никеля используется в машиностроении, 10% — в строительстве, 14% — в трубной продукции, 20% — в металлических изделиях, 14% — в транспорте, 11% — в электронных товарах и 5% — в других целях. [12]
Никель Ренея широко используется для гидрогенизации ненасыщенных масел для производства маргарина , а некачественный маргарин и остатки масла могут содержать никель в качестве загрязняющей примеси . Форте и др. обнаружили, что у пациентов с диабетом 2 типа в крови содержится 0,89 нг/мл Ni по сравнению с 0,77 нг/мл у контрольных субъектов. [102]
Никель-титан — это сплав с примерно равным атомным процентным содержанием входящих в его состав металлов, который проявляет два тесно связанных и уникальных свойства: эффект памяти формы и сверхэластичность .
Это не было признано до 1970-х годов, но известно, что никель играет важную роль в биологии некоторых растений, бактерий , архей и грибов . [103] [104] [105] Никелевые ферменты, такие как уреаза, считаются факторами вирулентности у некоторых организмов. [106] [107] Уреаза катализирует гидролиз мочевины с образованием аммиака и карбамата . [104] [103] NiFe-гидрогеназы могут катализировать окисление H2 с образованием протонов и электронов; а также обратную реакцию, восстановление протонов с образованием газообразного водорода. [104] [103] Никель-тетрапиррольный кофермент, кофактор F430 , присутствует в метилкоферменте М- редуктазе, которая может катализировать образование метана или обратную реакцию в метаногенных археях (в степени окисления +1). [108] Один из ферментов дегидрогеназы оксида углерода состоит из кластера Fe -Ni- S . [109] Другие ферменты, содержащие никель, включают редкий бактериальный класс ферментов супероксиддисмутазы [110] и глиоксалазу I в бактериях и нескольких эукариотических трипаносомных паразитах [111] (в других организмах, включая дрожжи и млекопитающих, этот фермент содержит двухвалентный Zn2 + ). [112] [113] [114] [115] [116]
Пищевой никель может влиять на здоровье человека через инфекции, вызванные бактериями, зависящими от никеля, но никель также может быть необходимым питательным веществом для бактерий, живущих в толстом кишечнике, по сути, функционируя как пребиотик . [117] Институт медицины США не подтвердил, что никель является необходимым питательным веществом для человека, поэтому ни Рекомендуемая суточная норма (RDA), ни Адекватное потребление не были установлены. Допустимый верхний уровень потребления пищевого никеля составляет 1 мг/день в виде растворимых солей никеля. Расчетное диетическое потребление составляет от 70 до 100 мкг/день; усваивается менее 10%. То, что усваивается, выводится с мочой. [118] Относительно большое количество никеля — сопоставимое с расчетным средним потреблением выше — выщелачивается в пищу, приготовленную в нержавеющей стали. Например, количество никеля, выщелачиваемого после 10 циклов приготовления в одну порцию томатного соуса, составляет в среднем 88 мкг. [119] [120]
Предполагается, что никель, выброшенный в результате вулканических извержений Сибирских траппов, способствовал росту Methanosarcina , рода эвриархеотных архей, которые вырабатывали метан во время пермско-триасового вымирания , самого крупного известного массового вымирания . [121]
Основным источником воздействия никеля является пероральное потребление, так как никель необходим для растений. [123] Типичные фоновые концентрации никеля не превышают 20 нг/м3 в воздухе, 100 мг/кг в почве, 10 мг/кг в растительности, 10 мкг/л в пресной воде и 1 мкг/л в морской воде. [124] Концентрации в окружающей среде могут быть увеличены из-за загрязнения человеком . Например, никелированные краны могут загрязнять воду и почву; горнодобывающая и плавильная промышленность может сбрасывать никель в сточные воды ; кухонная посуда из сплава никеля и стали и окрашенная никелем посуда могут выделять никель в пищу. Воздух может быть загрязнен переработкой никелевой руды и сжиганием ископаемого топлива . Люди могут поглощать никель непосредственно из табачного дыма и при контакте кожи с ювелирными изделиями, шампунями , моющими средствами и монетами . Менее распространенной формой хронического воздействия является гемодиализ , поскольку следы ионов никеля могут поглощаться плазмой из-за хелатирующего действия альбумина . [ необходима ссылка ]
Среднесуточное воздействие не представляет угрозы для здоровья человека. Большая часть никеля, поглощаемого человеком, удаляется почками и выводится из организма через мочу или выводится через желудочно-кишечный тракт без всасывания. Никель не является кумулятивным ядом, но большие дозы или хроническое вдыхание могут быть токсичными, даже канцерогенными , и представлять собой профессиональную опасность . [125]
Соединения никеля классифицируются как канцерогены для человека [126] [127] [128] [129] на основании повышенного риска возникновения рака дыхательных путей, наблюдаемого в эпидемиологических исследованиях рабочих завода по переработке сульфидной руды. [130] Это подтверждается положительными результатами биопроб NTP с субсульфидом Ni и оксидом Ni у крыс и мышей. [131] [132] Данные по человеку и животным последовательно указывают на отсутствие канцерогенности при пероральном пути воздействия и ограничивают канцерогенность соединений никеля опухолями дыхательных путей после вдыхания. [133] [134] Металлический никель классифицируется как предполагаемый канцероген; [126] [127] [128] существует соответствие между отсутствием повышенного риска возникновения рака дыхательных путей у рабочих, преимущественно подвергавшихся воздействию металлического никеля [130] и отсутствием опухолей дыхательных путей в исследовании канцерогенности при вдыхании на крысах в течение жизни с использованием металлического никеля. [135] В исследованиях на грызунах с вдыханием различных соединений никеля и металлического никеля наблюдалось усиление воспаления легких с гиперплазией или фиброзом бронхиальных лимфатических узлов и без них. [129] [131] [135] [136] В исследованиях на крысах пероральный прием водорастворимых солей никеля может вызвать перинатальную смертность у беременных животных. [137] Неясно, имеют ли эти эффекты отношение к людям, поскольку эпидемиологические исследования женщин-работниц, подвергавшихся сильному воздействию, не показали неблагоприятных токсических эффектов для развития. [138]
Люди могут подвергаться воздействию никеля на рабочем месте путем вдыхания, проглатывания и контакта с кожей или глазами. Управление по охране труда и промышленной гигиене (OSHA) установило допустимый предел ( допустимый предел воздействия ) для рабочего места на уровне 1 мг/м3 за 8-часовой рабочий день, без учета карбонила никеля. Национальный институт охраны труда и промышленной гигиене (NIOSH) устанавливает рекомендуемый предел воздействия (REL) на уровне 0,015 мг/м3 за 8-часовой рабочий день. При 10 мг/м3 никель становится непосредственно опасным для жизни и здоровья . [139] Карбонил никеля [Ni(CO) 4 ] является чрезвычайно токсичным газом. Токсичность карбонилов металлов зависит как от токсичности металла, так и от выделения оксида углерода из карбонильных функциональных групп; карбонил никеля также взрывоопасен на воздухе. [140] [141]
У сенсибилизированных лиц может проявиться аллергия на никель при контакте с кожей, известная как контактный дерматит . У лиц с высокой степенью сенсибилизации также может возникнуть реакция на продукты с высоким содержанием никеля. [142] Пациенты с помфоликсом также могут быть чувствительны к никелю. Никель является основным подтвержденным контактным аллергеном во всем мире, отчасти из-за его использования в украшениях для проколотых ушей . [143] Аллергия на никель, поражающая проколотые уши, часто характеризуется зудом и покраснением кожи. Многие серьги теперь изготавливаются без никеля или с низким содержанием никеля [144] для решения этой проблемы. Количество, разрешенное в продуктах, которые контактируют с кожей человека, теперь регулируется Европейским союзом . В 2002 году исследователи обнаружили, что никель, выделяемый монетами в 1 и 2 евро, намного превышает эти стандарты. Считается, что это происходит из-за гальванической реакции. [145] В 2008 году Американское общество контактного дерматита признало никель аллергеном года . [146] В августе 2015 года Американская академия дерматологии приняла заявление о безопасности никеля: «По оценкам, контактный дерматит, включающий сенсибилизацию к никелю, обходится примерно в 1,918 млрд долларов и поражает около 72,29 млн человек». [142]
Отчеты показывают, что как вызванная никелем активация гипоксией-индуцируемого фактора (HIF-1), так и повышение регуляции гипоксией-индуцируемых генов вызваны истощением внутриклеточного аскорбата . Добавление аскорбата в культуральную среду увеличило уровень внутриклеточного аскорбата и обратило вспять как вызванную металлом стабилизацию HIF-1-, так и HIF-1α-зависимой экспрессии генов. [147] [148]
Во второй книге о стране Оз, « Чудесная страна Оз» (автор Л. Фрэнк Баум, издательство Reilly & Britton , 1904), Железный Дровосек утверждает, что он покрыл свое оловянное тело никелем. После этого он очень осторожен, чтобы не допустить царапин, зазубрин или повреждений никелевого покрытия. [149]
В этой таблице Ni I = нейтральный атом Ni, Ni II = Ni+ и т. д.
С 1968 по 1999 год канадские четвертаки и десятицентовики чеканились из 99,9% никеля, а пятицентовики — из 25–99,9% никеля.
Этот скачок никеля позволил метаногенам взлететь.
{{cite web}}: CS1 maint: бот: исходный статус URL неизвестен ( ссылка )