Пептидогликан или муреин — это уникальная крупная макромолекула, полисахарид , состоящий из сахаров и аминокислот , который образует сетчатый слой (саккулюс), окружающий бактериальную цитоплазматическую мембрану. [1] Сахарный компонент состоит из чередующихся остатков β-(1,4) связанного N -ацетилглюкозамина (NAG) и N -ацетилмурамовой кислоты (NAM). К N -ацетилмурамовой кислоте прикреплена олигопептидная цепь, состоящая из трех-пяти аминокислот. Пептидная цепь может быть поперечно сшита с пептидной цепью другой нити, образуя трехмерный сетчатый слой. [1] [2] Пептидогликан выполняет структурную роль в бактериальной клеточной стенке, придавая структурную прочность, а также противодействуя осмотическому давлению цитоплазмы . Это повторяющееся связывание приводит к образованию плотного слоя пептидогликана, который имеет решающее значение для поддержания формы клетки и выдерживания высокого осмотического давления, и он регулярно заменяется производством пептидогликана. Гидролиз и синтез пептидогликана — это два процесса, которые должны происходить для того, чтобы клетки росли и размножались, метод, осуществляемый в три этапа: отсечение текущего материала, вставка нового материала и повторное сшивание существующего материала с новым материалом. [3]
Слой пептидогликана значительно толще у грамположительных бактерий (от 20 до 80 нанометров), чем у грамотрицательных бактерий (от 7 до 8 нанометров). [4] В зависимости от условий роста pH пептидогликан составляет около 40–90% сухого веса клеточной стенки грамположительных бактерий, но только около 10% грамотрицательных штаммов. Таким образом, наличие высоких уровней пептидогликана является основным фактором, определяющим характеристику бактерий как грамположительных. [5] У грамположительных штаммов он важен для функций прикрепления и целей серотипирования . [6] Как для грамположительных, так и для грамотрицательных бактерий частицы размером около 2 нм могут проходить через пептидогликан. [7]
С помощью микроскопа трудно определить, является ли организм грамположительным или грамотрицательным; требуется окраска по Граму , созданная Гансом Христианом Грамом в 1884 году. Бактерии окрашиваются красителями кристаллическим фиолетовым и сафранином . Грамположительные клетки после окрашивания становятся фиолетовыми, а грамотрицательные — розовыми. [8]
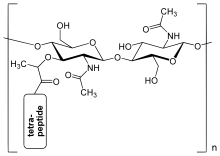
Пептидогликановый слой в клеточной стенке бактерий представляет собой кристаллическую решетчатую структуру, образованную линейными цепями двух чередующихся аминосахаров , а именно N -ацетилглюкозамина (GlcNAc или NAG) и N -ацетилмурамовой кислоты (MurNAc или NAM). Чередующиеся сахара соединены β-(1,4) -гликозидной связью . Каждый MurNAc прикреплен к короткой (4-5 остатков) аминокислотной цепи, содержащей L - аланин , D - глутаминовую кислоту , мезо- диаминопимелиновую кислоту и D -аланин в случае Escherichia coli (грамотрицательная бактерия); или L -аланин, D - глутамин , L - лизин и D -аланин с 5- глициновым мостиком между тетрапептидами в случае Staphylococcus aureus (грамположительная бактерия). Пептидогликан является одним из важнейших источников D -аминокислот в природе. [ необходима цитата ]
Охватывая внутреннюю мембрану, слой пептидогликана защищает клетку от лизиса , вызванного тургорным давлением клетки. Когда клеточная стенка растет, она сохраняет свою форму на протяжении всей жизни, поэтому стержневая форма останется стержневой формой, а сферическая форма останется сферической формой на всю жизнь. Это происходит потому, что свежедобавленный септальный материал синтеза трансформируется в полусферическую стенку для клеток-потомков. [9]
Сшивание между аминокислотами в различных линейных аминосахаридных цепях происходит с помощью фермента DD -транспептидазы и приводит к образованию прочной и жесткой трехмерной структуры. Конкретная последовательность аминокислот и молекулярная структура различаются в зависимости от вида бактерий . [10]
Были описаны различные типы пептидогликана клеточных стенок бактерий и их таксономическое значение. [11] Археи ( домен Archaea ) [12] не содержат пептидогликан (муреин). [13] Некоторые археи содержат псевдопептидогликан (псевдомуреин, см. ниже). [14]
Пептидогликан участвует в бинарном делении во время размножения бактериальных клеток. Бактерии L-формы и микоплазмы , у которых отсутствуют клеточные стенки из пептидогликана, размножаются не путем бинарного деления, а с помощью механизма почкования . [15] [16]
В ходе ранней эволюции последовательное развитие границ (мембран, стенок), защищающих первые структуры жизни от окружающей среды, должно было иметь решающее значение для образования первых клеток ( клеточности ).
Изобретение жестких пептидогликановых (муреиновых) клеточных стенок у бактерий (домен Бактерии [12] ), вероятно, стало предпосылкой для их выживания, обширной радиации и колонизации практически всех местообитаний геосферы и гидросферы. [17] [18]
Мономеры пептидогликана синтезируются в цитозоле и затем прикрепляются к мембранному носителю бактопренол . Бактопренол переносит мономеры пептидогликана через клеточную мембрану, где они встраиваются в существующий пептидогликан. [19]
Каждая из этих реакций требует источника энергии АТФ. [20] Все это называется первым этапом.
Вторая стадия происходит в цитоплазматической мембране. Именно в мембране липидный носитель, называемый бактопренолом, переносит предшественников пептидогликана через клеточную мембрану.
У некоторых архей , т. е. у представителей Methanobacteriales и рода Methanopyrus , был обнаружен псевдопептидогликан (псевдомуреин). [14] В псевдопептидогликане остатки сахара представляют собой β-(1,3) связанный N -ацетилглюкозамин и N -ацетилталозаминуроновую кислоту . Это делает клеточные стенки таких архей нечувствительными к лизоциму . [23] Описан биосинтез псевдопептидогликана. [24]
Распознавание пептидогликана является эволюционно консервативным процессом. [25] Общая структура у всех видов бактерий схожа, но различные модификации могут увеличить разнообразие. К ним относятся модификации длины полимеров сахара, модификации структур сахара, изменения в сшивании или замены аминокислот (в основном в третьей позиции). [25] [26] Целью этих модификаций является изменение свойств клеточной стенки, которая играет жизненно важную роль в патогенезе . [25]
Пептидогликаны могут расщепляться несколькими ферментами ( лизоцим , глюкозаминидаза, эндопептидаза ... [25] ), образуя иммуностимулирующие фрагменты (иногда называемые муропептидами [27] ), которые имеют решающее значение для опосредования взаимодействий хозяина и патогена . [26] К ним относятся MDP ( мурамилдипептид ), NAG ( N-ацетилглюкозамин ) или iE-DAP (γ-d-глутамил-мезо-диаминопимелиновая кислота). [25] [27]
Пептидогликан кишечных бактерий (как патогенных, так и комменсальных) проникает через кишечный барьер даже в физиологических условиях. [27] Механизмы, посредством которых пептидогликан или его фрагменты проникают в клетки хозяина, могут быть прямыми (независимыми от носителя) или косвенными (зависимыми от носителя), и они либо опосредованы бактериями (системы секреции, мембранные везикулы ), либо опосредованы клеткой хозяина (опосредованные рецепторами, пептидные транспортеры). [27] Бактериальные системы секреции представляют собой белковые комплексы, используемые для доставки факторов вирулентности через оболочку бактериальной клетки во внешнюю среду. [28] Внутриклеточные бактериальные патогены проникают в эукариотические клетки (что может привести к образованию фаголизосом и/или активации аутофагии ), или бактерии могут быть поглощены фагоцитами ( макрофагами , моноцитами , нейтрофилами ...). Фагосома , содержащая бактерии, может затем сливаться с эндосомами и лизосомами , что приводит к деградации бактерий и образованию полимерных фрагментов пептидогликана и муропептидов. [27]
Врожденная иммунная система распознает неповрежденный пептидогликан и его фрагменты с помощью многочисленных PRR ( рецепторов распознавания образов ), которые секретируются, экспрессируются внутриклеточно или экспрессируются на поверхности клетки. [25]
PGLYRP сохраняются от насекомых до млекопитающих . [27] Млекопитающие производят четыре секретируемых растворимых белка распознавания пептидогликана ( PGLYRP-1 , PGLYRP-2 , PGLYRP-3 и PGLYRP-4 ), которые распознают мурамилпентапептид или тетрапептид. [25] Они также могут связываться с ЛПС и другими молекулами, используя сайты связывания за пределами пептидогликан-связывающей канавки. [28] После распознавания пептидогликана PGLYRP активируют молекулы полифенолоксидазы (PPO), Toll или сигнальные пути иммунодефицита (IMD). Это приводит к образованию антимикробных пептидов (AMP). [28]
Каждый из PGLYRP млекопитающих демонстрирует уникальные паттерны экспрессии в тканях. PGLYRP-1 в основном экспрессируется в гранулах нейтрофилов и эозинофилов . [25] PGLYRP-3 и 4 экспрессируются несколькими тканями, такими как кожа, потовые железы, глаза или кишечный тракт. [27] PGLYRP-1, 3 и 4 образуют связанные дисульфидом гомодимеры и гетеродимеры, необходимые для их бактерицидной активности. [27] Их связывание с пептидогликанами бактериальной клеточной стенки может вызывать гибель бактериальных клеток путем взаимодействия с различными бактериальными транскрипционными регуляторными белками. [25] PGLYRP, вероятно, способствуют уничтожению бактерий, взаимодействуя с другими PRR для улучшения распознавания бактерий фагоцитами. [25]
PGLYRP-2 в первую очередь экспрессируется печенью и секретируется в кровоток. [25] Кроме того, его экспрессия может быть вызвана в кератиноцитах кожи , эпителиальных клетках полости рта и кишечника. [27] В отличие от других PGLYRP, PGLYRP-2 не обладает прямой бактерицидной активностью. Он обладает пептидогликанамидазной активностью, он гидролизует лактиламидную связь между MurNAc и первой аминокислотой стволового пептида пептидогликана. [25] [27] Предполагается, что функция PGLYRP-2 заключается в предотвращении чрезмерной активации иммунной системы и вызванного воспалением повреждения тканей в ответ на лиганды NOD2 (см. ниже), поскольку эти муропептиды больше не могут распознаваться NOD2 после отделения пептидного компонента от MurNAc. [27] Растущее количество данных свидетельствует о том, что члены семейства белков распознавания пептидогликана играют доминирующую роль в толерантности эпителиальных клеток кишечника к комменсальной микробиоте. [28] [29] Было показано, что экспрессия PGLYRP-2 и 4 может влиять на состав микробиоты кишечника . [28]
Недавно было обнаружено, что PGLYRP (а также NOD-подобные рецепторы и транспортеры пептидогликана) высоко экспрессируются в развивающемся мозге мыши . [30] PGLYRP-2 высоко экспрессируется в нейронах нескольких областей мозга, включая префронтальную кору , гиппокамп и мозжечок , что указывает на потенциальное прямое воздействие пептидогликана на нейроны. PGLYRP-2 также высоко экспрессируется в коре головного мозга маленьких детей, но не в большинстве взрослых корковых тканей. PGLYRP-1 также экспрессируется в мозге и продолжает экспрессироваться во взрослом возрасте. [30]
Вероятно, наиболее известными рецепторами пептидогликана являются NOD-подобные рецепторы (NLR), в основном NOD1 и NOD2 . Рецептор NOD1 активируется после связывания iE-DAP (γ-d-глутамил-мезо-диаминопимелиновая кислота), в то время как NOD2 распознает MDP (мурамилдипептид) своими доменами LRR . [28] Активация приводит к самоолигомеризации, что приводит к активации двух сигнальных каскадов. Один запускает активацию NF-κB (через RIP2, TAK1 и IKK [31] ), второй приводит к сигнальному каскаду MAPK . Активация этих путей вызывает выработку воспалительных цитокинов и хемокинов . [25]
NOD1 экспрессируется различными типами клеток, включая миелоидные фагоциты, эпителиальные клетки [25] и нейроны. [30] NOD2 экспрессируется в моноцитах и макрофагах, эпителиальных клетках кишечника, клетках Панета , дендритных клетках , остеобластах , кератиноцитах и других типах эпителиальных клеток. [27] Как цитозольные сенсоры, NOD1 и NOD2 должны либо обнаруживать бактерии, которые попадают в цитозоль, либо пептидогликан должен быть деградирован для образования фрагментов, которые должны транспортироваться в цитозоль для функционирования этих сенсоров. [25]
Недавно было продемонстрировано, что NLRP3 активируется пептидогликаном посредством механизма, который не зависит от NOD1 и NOD2. [27] Было обнаружено, что в макрофагах N-ацетилглюкозамин, образующийся при деградации пептидогликана, ингибирует активность гексокиназы и вызывает ее высвобождение из митохондриальной мембраны . Он способствует активации инфламмасомы NLRP3 посредством механизма, запускаемого повышенной проницаемостью митохондриальной мембраны. [27]
NLRP1 также считается цитоплазматическим сенсором пептидогликана. Он может чувствовать MDP и способствовать секреции IL-1 посредством связывания NOD2. [28] [26]
Лектины C-типа представляют собой разнообразное суперсемейство в основном Ca 2+ -зависимых белков, которые связывают различные углеводы (включая гликановый скелет пептидогликана) и функционируют как врожденные иммунные рецепторы. [27] Белки CLR, которые связываются с пептидогликаном, включают MBL ( маннозосвязывающий лектин ), фиколины , Reg3A (белок семейства генов регенерации 3A) и PTCLec1. [28] У млекопитающих они инициируют лектиновый путь каскада комплемента . [ 27]
Роль TLR в прямом распознавании пептидогликана является спорной. [25] В некоторых исследованиях сообщалось, что пептидогликан воспринимается TLR2 . [32] Но эта индуцирующая TLR2 активность может быть обусловлена липопротеинами клеточной стенки и липотейхоевыми кислотами , которые обычно очищаются вместе с пептидогликаном. Также различия в структуре пептидогликана у бактерий от вида к виду могут способствовать различным результатам по этой теме. [25] [27]
Пептидогликан иммунологически активен, он может стимулировать иммунные клетки к повышению экспрессии цитокинов и усилению антителозависимого специфического ответа при сочетании с вакциной или в качестве отдельного адъюванта . [28] MDP, который является основной единицей пептидогликана, изначально использовался в качестве активного компонента адъюванта Фрейнда . [28] Пептидогликан из Staphylococcus aureus использовался в качестве вакцины для защиты мышей, что показало, что после инъекции вакцины в течение 40 недель мыши выживали после заражения S. aureus при повышенной летальной дозе . [33]
Некоторые антибактериальные препараты , такие как пенициллин, мешают образованию пептидогликана, связываясь с бактериальными ферментами, известными как пенициллинсвязывающие белки или DD -транспептидазы . [6] Пенициллинсвязывающие белки образуют связи между олигопептидными сшивками в пептидогликане. Для размножения бактериальной клетки путем бинарного деления необходимо присоединить более миллиона субъединиц пептидогликана (NAM-NAG+олигопептид) к существующим субъединицам. [34] Мутации в генах, кодирующих транспептидазы, которые приводят к снижению взаимодействия с антибиотиком, являются существенным источником возникновения устойчивости к антибиотикам . [35] Поскольку пептидогликан также отсутствует у бактерий L-формы и у микоплазм, обе эти бактерии устойчивы к пенициллину.
Другие этапы синтеза пептидогликана также могут быть направлены. Местный антибиотик бацитрацин нацелен на использование C55-изопренилпирофосфата . Лантибиотики , в том числе пищевой консервант низин , атакуют липид II. [36]
Лизоцим , который содержится в слезах и является частью врожденной иммунной системы организма, оказывает антибактериальное действие, разрывая β-(1,4)-гликозидные связи в пептидогликане (см. выше). Лизоцим более эффективен против грамположительных бактерий , у которых клеточная стенка пептидогликана обнажена, чем против грамотрицательных бактерий , у которых внешний слой ЛПС покрывает слой пептидогликана. [31] Несколько модификаций бактериального пептидогликана могут привести к устойчивости к деградации лизоцимом. Восприимчивость бактерий к деградации также значительно зависит от воздействия антибиотиков . Подвергнутые воздействию бактерии синтезируют пептидогликан, который содержит более короткие сахарные цепи, которые плохо сшиты, и этот пептидогликан затем легче деградирует лизоцимом. [28]