Почечноклеточная карцинома ( ПКР ) — это рак почки , который возникает в слизистой оболочке проксимального извитого канальца , части очень маленьких трубочек в почке, которые транспортируют первичную мочу. ПКР — наиболее распространенный тип рака почки у взрослых, отвечающий примерно за 90–95% случаев. [1] Чаще встречается у мужчин (соотношение мужчин и женщин составляет до 2:1). [2] Чаще всего диагностируется у пожилых людей (особенно у людей старше 75 лет). [3]
Первоначальное лечение чаще всего заключается в частичном или полном удалении пораженной почки(почек). [4] Если рак не метастазировал (не распространился на другие органы) или не проник глубже в ткани почки, пятилетняя выживаемость составляет 65–90% [5] , но она значительно снижается, когда рак распространился.
Организм удивительно хорошо скрывает симптомы, и в результате люди с ПКР часто имеют запущенную форму заболевания к моменту его обнаружения. [6] Первоначальные симптомы ПКР часто включают кровь в моче (встречается у 40% больных при первом обращении за медицинской помощью), боль в боку (40%), массу в животе или боку (25%), потерю веса (33%), лихорадку (20%), высокое кровяное давление (20%), ночную потливость и общее плохое самочувствие . [1] Когда ПКР метастазирует, он чаще всего распространяется на лимфатические узлы , легкие , печень , надпочечники , мозг или кости. [7] Иммунотерапия и таргетная терапия улучшили прогноз метастатического ПКР. [8] [9]
RCC также связан с рядом паранеопластических синдромов (PNS), которые являются состояниями, вызванными либо гормонами, вырабатываемыми опухолью, либо атакой организма на опухоль и присутствуют примерно у 20% людей с RCC. [1] Эти синдромы чаще всего поражают ткани, которые не были поражены раком. [1] Наиболее распространенными PNS, наблюдаемыми у людей с RCC, являются: высокий уровень кальция в крови , высокий уровень эритроцитов , высокий уровень тромбоцитов и вторичный амилоидоз . [7]
Традиционно врачи ожидали, что у человека будет три признака. Эта классическая триада [10] включает 1: гематурию , когда в моче присутствует кровь, 2: боль в боку, которая представляет собой боль сбоку тела между бедром и ребрами, и 3: брюшную массу, похожую на вздутие живота, но большего размера. Сейчас известно, что эта классическая триада симптомов встречается только в 10–15% случаев и обычно указывает на то, что почечно-клеточный рак (ПКР) находится на поздней стадии. [10] Сегодня почечно-клеточный рак (ПКР) часто протекает бессимптомно, то есть не имеет симптомов и обычно обнаруживается случайно во время обследований по поводу не связанных с ним заболеваний. Процент бессимптомных и случайно диагностированных случаев ПКР, особенно небольших опухолей, продолжает расти в последние годы. [11]
Другие признаки и симптомы могут включать гематурию ; [10] боль в пояснице; [10] опухоль в животе; [12] недомогание , что является общим чувством плохого самочувствия; [12] потерю веса и/или потерю аппетита; [13] анемию, вызванную снижением уровня эритропоэтина ; [10] эритроцитоз (повышенное производство красных кровяных клеток ) из-за повышенной секреции эритропоэтина; [10] варикоцеле , которое у мужчин наблюдается как расширение лозовидного сплетения вен, дренирующих яичко (чаще левое яичко) [12] гипертония (высокое кровяное давление) в результате секреции ренина опухолью; [14] гиперкальциемия , что является повышением уровня кальция в крови; [15] нарушение сна или ночная потливость; [13] рецидивирующие лихорадки ; [13] и хроническая усталость. [16]
Наибольшие факторы риска для рака почки связаны с образом жизни: курение, ожирение и гипертония (высокое кровяное давление) составляют, по оценкам, до 50% случаев. [17] Профессиональное воздействие некоторых химических веществ, таких как асбест, кадмий, свинец, хлорированные растворители, нефтехимические продукты и ПАУ ( полициклические ароматические углеводороды ), было изучено в многочисленных исследованиях с неубедительными результатами. [18] [19] [20] Другим предполагаемым фактором риска является длительное использование нестероидных противовоспалительных препаратов (НПВП). [21]
Наконец, исследования показали, что женщины, перенесшие гистерэктомию, подвержены более чем в два раза большему риску развития рака почки, чем те, кому ее не проводили. [22] С другой стороны, было показано, что умеренное употребление алкоголя оказывает защитный эффект. [23]
Наследственные факторы оказывают незначительное влияние на индивидуальную восприимчивость, при этом у ближайших родственников людей с ПКР риск развития этого заболевания увеличивается в два-четыре раза. [24] Другие генетически связанные состояния также увеличивают риск ПКР, включая наследственную папиллярную карциному почек, наследственный лейомиоматоз , синдром Бирта-Хогга-Дюбе , синдром гиперпаратиреоза-опухоли челюсти, семейную папиллярную карциному щитовидной железы , болезнь фон Гиппеля-Линдау [25] и серповидноклеточную анемию . [26]
Однако наиболее значимое заболевание, влияющее на риск, не связано с генетикой: у пациентов с приобретенным кистозным заболеванием почек, которым требуется диализ, вероятность развития почечно-клеточного рака в 30 раз выше, чем у населения в целом. [27]
Опухоль возникает из клеток проксимального эпителия почечных канальцев . [1] Она считается аденокарциномой . [7] Существует два подтипа: спорадический (то есть ненаследственный) и наследственный. [1] Оба таких подтипа связаны с мутациями в коротком плече хромосомы 3 , при этом вовлеченные гены являются либо генами-супрессорами опухолей ( VHL и TSC ), либо онкогенами (например, c-Met ). [1]
Первые шаги, предпринимаемые для диагностики этого состояния, включают рассмотрение признаков и симптомов, а также истории болезни (подробный медицинский обзор прошлого состояния здоровья) для оценки любых факторов риска. На основе представленных симптомов ряд биохимических тестов (с использованием образцов крови и/или мочи) также могут рассматриваться как часть процесса скрининга для обеспечения достаточного количественного анализа любых различий в электролитах , функции почек и печени, а также времени свертывания крови. [26] При физическом осмотре пальпация живота может выявить наличие массы или увеличение органа. [28]
Хотя эта болезнь не имеет характеристики на ранних стадиях развития опухоли, соображения, основанные на разнообразных клинических проявлениях, а также на устойчивости к радиации и химиотерапии, важны. Основными диагностическими инструментами для выявления почечно-клеточного рака являются ультразвук , компьютерная томография (КТ) и магнитно-резонансная томография (МРТ) почек. [29]
Почечно-клеточная карцинома (ПКР) — это не единое целое, а скорее совокупность различных типов опухолей , каждая из которых происходит из различных частей нефрона ( эпителия или почечных канальцев ) и обладает различными генетическими характеристиками, гистологическими особенностями и, в некоторой степени, клиническими фенотипами. [26]
Кариотипирование на основе массива может использоваться для выявления характерных хромосомных аберраций в почечных опухолях со сложной морфологией. [35] [36] Кариотипирование на основе массива хорошо работает на залитых парафином опухолях [37] и подходит для рутинного клинического использования. См. также Virtual Karyotype для сертифицированных CLIA лабораторий, предлагающих кариотипирование на основе массива солидных опухолей.
Классификация опухолей мочеполовой системы Всемирной организации здравоохранения (ВОЗ) 2004 года признает более 40 подтипов почечных новообразований . С момента публикации последней версии классификации ВОЗ в 2004 году было описано несколько новых подтипов почечных опухолей: [38]
Лабораторные тесты обычно проводятся, когда у пациента проявляются признаки и симптомы, которые могут быть характерны для почечной недостаточности. Они не используются в первую очередь для диагностики рака почки из-за его бессимптомной природы и обычно обнаруживаются случайно во время тестов на другие заболевания, такие как заболевание желчного пузыря . [40] Другими словами, эти виды рака обычно не обнаруживаются, потому что они не вызывают боли или дискомфорта при обнаружении. Лабораторный анализ может дать оценку общего состояния здоровья пациента и может предоставить информацию для определения стадии и степени метастазирования в другие части тела (если было выявлено поражение почек) до начала лечения. [ необходима цитата ]
Наличие крови в моче является распространенным предполагаемым признаком почечноклеточной карциномы. Гемоглобин крови делает мочу ржавой, коричневой или красной. В качестве альтернативы анализ мочи может проверить на сахар , белок и бактерии , которые также могут служить индикаторами рака . Полный анализ крови также может предоставить дополнительную информацию относительно тяжести и распространения рака. [41]
Общий анализ крови обеспечивает количественную оценку различных клеток в образце цельной крови пациента. Такие клетки, исследуемые в этом тесте, включают красные кровяные клетки ( эритроциты ), белые кровяные клетки ( лейкоциты ) и тромбоциты ( тромбоциты ). Распространенным признаком почечноклеточной карциномы является анемия , при которой у пациента наблюдается дефицит красных кровяных клеток. [42] Анализы общего анализа крови жизненно важны в качестве скринингового инструмента для обследования здоровья пациента перед операцией. Несоответствия с количеством тромбоцитов также распространены среди этих онкологических пациентов, и следует рассмотреть дополнительные тесты на коагуляцию, включая скорость оседания эритроцитов (СОЭ), протромбиновое время (ПВ), активированное частичное тромбопластиновое время (АЧТВ). [ необходима цитата ]
Анализы на биохимию крови проводятся, если подозревается почечноклеточная карцинома, поскольку рак может повышать уровень определенных химических веществ в крови. Например, ферменты печени, такие как аспартатаминотрансфераза (АСТ) и аланинаминотрансфераза (АЛТ), обнаруживаются на аномально высоком уровне. [43] Стадию рака также можно определить по аномально повышенному уровню кальция, что предполагает, что рак мог метастазировать в кости. [44] В этом случае врачу следует предложить провести КТ. Анализы на биохимию крови также оценивают общую функцию почек и могут позволить врачу принять решение о дальнейших радиологических исследованиях. [ необходима цитата ]
Характерный вид почечноклеточного рака (ПКР) представляет собой солидное поражение почек, которое нарушает контур почки. Он часто имеет неровный или дольчатый край и может выглядеть как уплотнение в нижней части таза или брюшной полости. Традиционно, 85–90% солидных почечных масс оказываются ПКР, но кистозные почечные массы также могут быть вызваны ПКР. [45] Однако, достижения диагностических методов позволяют случайно диагностировать большую часть пациентов с поражениями почек, которые могут казаться небольшими по размеру и доброкачественными. Десять процентов ПКР будут содержать кальцификаты , а некоторые содержат макроскопический жир (вероятно, из-за инвазии и инкапсуляции околопочечного жира). [46]
Решение о доброкачественной или злокачественной природе почечной массы на основе ее локализованного размера является проблемой, поскольку почечно-клеточная карцинома также может быть кистозной. Поскольку существует несколько доброкачественных кистозных поражений почек (простая почечная киста, геморрагическая почечная киста, многокамерная кистозная нефрома , поликистоз почек ), рентгенологу иногда может быть трудно отличить доброкачественное кистозное поражение от злокачественного. [47] Система классификации Bosniak для кистозных поражений почек классифицирует их на группы, которые являются доброкачественными, и те, которые требуют хирургической резекции , на основе определенных характеристик визуализации. [48]
Основными визуальными тестами, проводимыми для выявления почечноклеточной карциномы, являются КТ органов малого таза и брюшной полости, ультразвуковые исследования почек (УЗИ), МРТ, внутривенная пиелограмма (ВВП) или почечная ангиография. [49] Среди этих основных диагностических тестов другие радиологические тесты, такие как экскреторная урография , позитронно-эмиссионная томография (ПЭТ), ультрасонография , артериография , венография и сканирование костей, также могут использоваться для оценки стадии почечных масс и для дифференциации доброкачественных опухолей от злокачественных. [ необходима цитата ]
Контрастное компьютерное томографическое сканирование (КТ) обычно используется для определения стадии почечноклеточной карциномы в брюшной и тазовой областях. КТ имеет потенциал для различения твердых масс от кистозных масс и может предоставить информацию о локализации, стадии или распространении рака на другие органы пациента. Ключевые части человеческого тела, которые исследуются на метастатическое поражение почечноклеточной карциномой, могут включать почечную вену , лимфатический узел и поражение нижней полой вены . [50] Согласно исследованию, проведенному Сауком и соавторами, характеристики мультидетекторной КТ-визуализации применяются при диагностике пациентов с чистой почечноклеточной карциномой, отображая различия этих клеток на цитогенетическом уровне. [51]
Ультрасонографическое исследование может быть полезным при оценке сомнительных бессимптомных опухолей почек и кистозных поражений почек , если компьютерная томография не дает окончательных результатов. Эта безопасная и неинвазивная радиологическая процедура использует высокочастотные звуковые волны для создания внутреннего изображения тела на мониторе компьютера. Изображение, полученное с помощью ультразвука, может помочь диагностировать почечноклеточную карциному на основе различий в отражениях звука на поверхности органов и аномальных массах тканей. По сути, ультразвуковые исследования могут определить, является ли состав почечной массы в основном твердым или заполненным жидкостью. [49]
Чрескожная биопсия может быть выполнена рентгенологом с использованием ультразвука или компьютерной томографии для контроля за взятием образцов опухоли с целью диагностики по патологии . Однако это не выполняется обычно, поскольку при наличии типичных признаков визуализации почечно-клеточного рака возможность ошибочно отрицательного результата вместе с риском медицинского осложнения для пациента может сделать его неблагоприятным с точки зрения соотношения риска и пользы. [52] Однако биопсийные тесты для молекулярного анализа, позволяющие отличить доброкачественные опухоли почек от злокачественных, представляют исследовательский интерес. [52]
Магнитно-резонансная томография (МРТ) позволяет получить изображение мягких тканей тела с помощью радиоволн и сильных магнитов. МРТ можно использовать вместо КТ, если у пациента наблюдается аллергия на контрастное вещество, вводимое для теста. [53] [54] Иногда перед МРТ-сканированием делается внутривенная инъекция контрастного вещества под названием гадолиний , чтобы получить более детальное изображение. Пациентам, находящимся на диализе, или тем, у кого почечная недостаточность, следует избегать этого контрастного вещества, поскольку оно может вызвать редкий, но серьезный побочный эффект, известный как нефрогенный системный фиброз. [55] Сканирование костей или мозга обычно не выполняется, если только признаки или симптомы не указывают на потенциальное метастатическое поражение этих областей. МРТ также следует рассматривать для оценки распространения опухоли , которая выросла в крупных кровеносных сосудах, включая полую вену , в брюшной полости. МРТ можно использовать для наблюдения за возможным распространением рака на головной или спинной мозг , если у пациента есть симптомы, указывающие на то, что это может быть так. [ необходима цитата ]
Внутривенная пиелограмма (IVP) является полезной процедурой для обнаружения наличия аномальной почечной массы в мочевыводящих путях . Эта процедура включает инъекцию контрастного красителя в руку пациента. Краситель перемещается из кровотока в почки, которые со временем попадают в почки и мочевой пузырь. Этот тест не является необходимым, если было проведено КТ или МРТ. [56]
Почечная ангиография использует тот же принцип, что и IVP, так как этот тип рентгена также использует контрастный краситель. Этот радиологический тест важен для диагностики почечноклеточной карциномы как вспомогательное средство для исследования кровеносных сосудов в почках. Этот диагностический тест основан на контрастном веществе, которое вводится в почечную артерию, чтобы быть поглощенным раковыми клетками. [57] Контрастный краситель обеспечивает более четкий контур аномально ориентированных кровеносных сосудов, которые, как полагают, связаны с опухолью. Это крайне важно для хирургов, так как позволяет картировать кровеносные сосуды пациента до операции. [50]
Стадирование почечно - клеточного рака является наиболее важным фактором в прогнозировании его прогноза. [58] Стадирование может следовать системе стадирования TNM , где размер и распространенность опухоли (T), поражение лимфатических узлов (N) и метастазы (M) классифицируются отдельно. Также может использоваться общая группировка стадий на стадии I–IV с пересмотром AJCC 1997 года, описанным ниже: [58]
На момент постановки диагноза 30% почечноклеточных карцином распространились на ипсилатеральную почечную вену, а 5–10% продолжили свое развитие в нижнюю полую вену. [59]
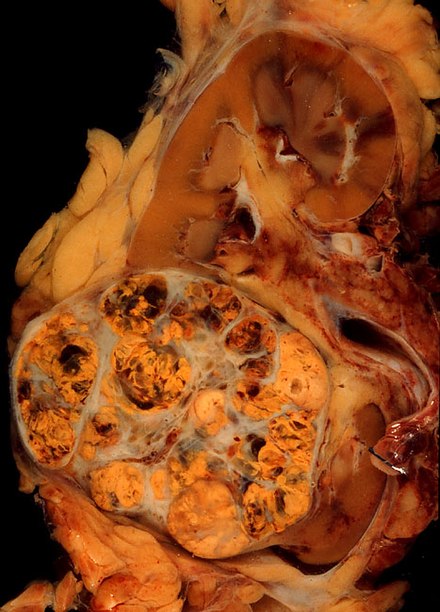


Макроскопический и микроскопический вид почечноклеточного рака сильно варьируется. Почечноклеточный рак может представлять собой покрасневшие области, где кровеносные сосуды кровоточили, и кисты, содержащие водянистые жидкости. [60] Тело опухоли показывает крупные кровеносные сосуды, стенки которых состоят из раковых клеток. Макроскопическое исследование часто показывает желтоватую, многодольчатую опухоль в почечной коре , которая часто содержит зоны некроза , кровоизлияния и рубцевания . В микроскопическом контексте существует четыре основных гистологических подтипа почечноклеточного рака: светлоклеточный (обычный почечноклеточный рак, 75%), папиллярный (15%), хромофобный (5%) и собирательный канальцевый (2%). Саркоматоидные изменения (морфология и паттерны IHC, которые имитируют саркому, веретенообразные клетки) могут наблюдаться в пределах любого подтипа почечноклеточного рака и связаны с более агрессивным клиническим течением и худшим прогнозом. Под световым микроскопом эти опухолевые клетки могут иметь сосочки , трубочки или гнезда и являются довольно крупными, атипичными и полигональными. [ необходима цитата ]
Недавние исследования привлекли внимание к тесной связи типа раковых клеток с агрессивностью состояния. Некоторые исследования предполагают, что эти раковые клетки накапливают гликоген и липиды, их цитоплазма выглядит «чистой», ядра остаются в середине клеток, а клеточная мембрана очевидна. [61] Некоторые клетки могут быть меньше, с эозинофильной цитоплазмой, напоминающей нормальные трубчатые клетки. Строма уменьшена, но хорошо васкуляризирована. Опухоль сдавливает окружающую паренхиму , образуя псевдокапсулу. [62]
Наиболее распространенным типом клеток, проявляемым почечноклеточной карциномой, является прозрачная клетка , которая получила свое название из-за растворения высокого содержания липидов в цитоплазме клеток. Считается, что прозрачные клетки наименее склонны к распространению и обычно более благоприятно реагируют на лечение. Однако большинство опухолей содержат смесь клеток. Наиболее агрессивной стадией почечного рака считается та, на которой опухоль смешанная, содержащая как прозрачные, так и зернистые клетки. [63]
Рекомендуемая гистологическая схема классификации для RCC — это система Fuhrman (1982), которая представляет собой оценку, основанную на микроскопической морфологии новообразования с гематоксилином и эозином ( окрашивание H&E). Эта система классифицирует почечноклеточную карциному по степеням 1, 2, 3, 4 на основе ядерных характеристик. Детали системы классификации Fuhrman для RCC приведены ниже: [64]
Ядерная степень злокачественности считается одним из наиболее важных прогностических факторов у пациентов с почечноклеточной карциномой. [26] Однако исследование Делаханта и др. (2007) показало, что классификация Фурмана идеальна для светлоклеточной карциномы, но может не подходить для хромофобной почечноклеточной карциномы, и что стадирование рака (выполняемое с помощью КТ) является более благоприятным предиктором прогноза этого заболевания. [65] Что касается стадирования почечного рака, то в 1976 году была введена Гейдельбергская система классификации почечных опухолей как средство более полной корреляции гистопатологических особенностей с выявленными генетическими дефектами. [66]
Риск почечно-клеточного рака можно снизить, поддерживая нормальный вес тела. [67]

Тип лечения зависит от множества факторов и индивидуальных особенностей человека, некоторые из которых включают стадию почечно-клеточной карциномы (органы и части тела, пораженные/не пораженные), тип почечно-клеточной карциномы, имеющиеся или сопутствующие заболевания, а также общее состояние здоровья и возраст человека. [10] [68] Каждая форма лечения имеет как риски, так и преимущества; медицинский работник предоставит наилучшие варианты, соответствующие индивидуальным обстоятельствам.
Если рак распространился за пределы почек, часто в лимфатические узлы , легкие или главную вену почки, то применяются множественные методы лечения, включая хирургию и медикаментозное лечение. В большинстве случаев рак почечно-клеточной карциномы устойчив к химиотерапии и радиотерапии, но хорошо поддается иммунотерапии интерлейкином-2 или интерфероном-альфа, биологической или таргетной терапии. На ранних стадиях предпочтительными вариантами являются криотерапия и хирургическое вмешательство.
Активное наблюдение или «бдительное ожидание» становится все более распространенным, поскольку обнаруживаются небольшие почечные массы или опухоли, а также среди старшего поколения, когда операция не всегда подходит. [69] Активное наблюдение включает в себя выполнение различных диагностических процедур, тестов и визуализации для мониторинга прогрессирования почечно-клеточного рака перед тем, как приступить к более рискованному варианту лечения, такому как операция. [69] Это особенно полезно для пожилых пациентов, пациентов с сопутствующими заболеваниями и плохих кандидатов на хирургическое вмешательство.
В зависимости от обстоятельств могут оказаться наиболее подходящими различные процедуры.
Рекомендуемым лечением почечноклеточного рака может быть нефрэктомия или частичная нефрэктомия , хирургическое удаление всей или части почки. [4] Это может включать некоторые из окружающих органов или тканей или лимфатических узлов. Если рак только в почках, что составляет около 60% случаев, его можно вылечить примерно в 90% случаев с помощью хирургического вмешательства .
Небольшие почечные опухоли (< 4 см) все чаще лечатся частичной нефрэктомией, когда это возможно. [70] [71] [72] Большинство этих небольших почечных масс проявляют вялотекущий биологический характер с отличным прогнозом. [73] Нефронсберегающая частичная нефрэктомия применяется, когда опухоль небольшая (менее 4 см в диаметре) или когда у пациента есть другие медицинские проблемы, такие как диабет или гипертония . [10] Частичная нефрэктомия включает удаление только пораженной ткани, сохраняя остальную часть почки, фасцию Героты и региональные лимфатические узлы. Это позволяет лучше сохранить почку по сравнению с радикальной нефрэктомией, и это может иметь положительные долгосрочные преимущества для здоровья. [74] Более крупные и более сложные опухоли также могут лечиться частичной нефрэктомией хирургами с большим опытом хирургии почек. [75]
Хирургическая нефрэктомия может быть «радикальной», если процедура удаляет всю пораженную почку, включая фасцию Героты , надпочечник, который находится на той же стороне, что и пораженная почка, и региональные забрюшинные лимфатические узлы, все одновременно. [10] Этот метод, хотя и тяжелый, эффективен. Но он не всегда подходит, так как это серьезная операция, которая содержит риск осложнений как во время, так и после операции и может иметь более длительное время восстановления. [76] Важно отметить, что другая почка должна быть полностью функциональной, и этот метод чаще всего используется, когда большая опухоль присутствует только в одной почке.

В случаях, когда опухоль распространилась на почечную вену, нижнюю полую вену и, возможно, на правое предсердие, эта часть опухоли также может быть удалена хирургическим путем. Когда опухоль затронула нижнюю полую вену, важно классифицировать, какие части полой вены затронуты, и планировать соответствующим образом, так как иногда полная резекция будет включать разрез в груди с повышенной заболеваемостью. По этой причине доктор Гаэтано Чианчио адаптировал методы мобилизации печени из трансплантации печени для решения проблемы ретрогепатического или даже супрагепатического тромба нижней полой вены, связанного с опухолями почек. [77] С помощью этой техники можно мобилизовать всю брюшную нижнюю полую вену . Это облегчает выдаивание опухоли ниже основных печеночных вен пальцами хирурга, минуя необходимость в торакоабдоминальном разрезе или сердечно-легочном шунтировании . [78] В случаях известных метастазов хирургическая резекция почки («циторедуктивная нефрэктомия») может улучшить выживаемость, [79] а также резекция одиночного метастатического поражения. Иногда почки эмболизируют перед операцией, чтобы минимизировать потерю крови. [80]
Хирургия все чаще выполняется с помощью лапароскопических методов. Обычно называемая хирургией замочной скважины, эта операция не имеет больших разрезов, которые можно увидеть при классической радикальной или частичной нефрэктомии, но все же успешно удаляет либо всю, либо часть почки. Лапароскопическая операция связана с более коротким пребыванием в больнице и более быстрым временем восстановления, но все еще существуют риски, связанные с хирургической процедурой. Они имеют преимущество в том, что менее обременительны для пациента, а безрецидивная выживаемость сопоставима с таковой при открытой операции. [4] При небольших экзофитных поражениях, которые не сильно затрагивают основные сосуды или мочевыделительную систему, может быть выполнена частичная нефрэктомия (также называемая «нефронсберегающей операцией»). Это может включать временную остановку притока крови к почке, пока удаляется масса, а также охлаждение почки ледяной кашей. Также может быть введен маннитол , чтобы помочь ограничить повреждение почки. Обычно это делается через открытый разрез, хотя небольшие поражения можно сделать лапароскопически с помощью робота или без него.
Лапароскопическая криотерапия также может применяться для небольших поражений. Обычно во время лечения берется биопсия. Интраоперационное УЗИ может использоваться для помощи в размещении замораживающих зондов. Затем выполняются два цикла замораживания/оттаивания для уничтожения опухолевых клеток. Поскольку опухоль не удаляется, последующее наблюдение становится более сложным (см. ниже), а общие показатели отсутствия заболеваний не так хороши, как при хирургическом удалении.
Хирургия метастатического заболевания: Если метастатическое заболевание присутствует, хирургическое лечение все еще может быть жизнеспособным вариантом. Радикальная и частичная нефрэктомия все еще может иметь место, и в некоторых случаях, если метастаз небольшой, его также можно удалить хирургическим путем. [10] Это зависит от того, на какой стадии роста и насколько далеко распространилось заболевание.
Перкутанная абляция использует визуализацию под контролем рентгенологов для лечения локализованных опухолей, если хирургическая операция не является хорошим вариантом. Хотя использование лапароскопических хирургических методов для полной нефрэктомии снизило некоторые риски, связанные с хирургией, [81] в некоторых случаях хирургическое вмешательство любого рода все равно будет невыполнимо. Например, пожилым людям, людям, у которых уже есть тяжелая почечная дисфункция, или людям, у которых есть несколько сопутствующих заболеваний , хирургическое вмешательство любого рода не оправдано. [82]
Зонд вводится через кожу в опухоль с использованием визуализации в реальном времени как кончика зонда, так и опухоли с помощью компьютерной томографии , ультразвука или даже магнитно-резонансной томографии , а затем опухоль разрушается с помощью тепла ( радиочастотная абляция ) или холода ( криотерапия ). Эти методы находятся в невыгодном положении по сравнению с традиционной хирургией, поскольку патологическое подтверждение полного разрушения опухоли невозможно. Поэтому долгосрочное наблюдение имеет решающее значение для оценки полноты абляции опухоли. [83] [84] В идеале чрескожная абляция ограничивается опухолями размером менее 3,5 см и для руководства лечением. Однако в некоторых случаях абляция может использоваться и для опухолей большего размера. [82]
Два основных типа методов абляции, которые используются при почечно-клеточной карциноме, — это радиочастотная абляция и криоабляция . [82]
Радиочастотная абляция использует электродный зонд, который вводится в пораженную ткань, чтобы посылать радиочастоты в ткань для генерации тепла посредством трения молекул воды. Тепло разрушает опухолевую ткань. [10] Гибель клеток обычно происходит в течение нескольких минут после воздействия температур выше 50 °C.
Криоабляция также подразумевает введение зонда в пораженную область, [10] однако для уничтожения опухоли используется холод вместо тепла. Зонд охлаждается химическими жидкостями, которые очень холодные. Температура замерзания заставляет опухолевые клетки погибать, вызывая осмотическое обезвоживание , которое вытягивает воду из клетки, разрушая фермент , органеллы , клеточную мембрану и замораживая цитоплазму . [82]
Рак часто растет неконтролируемым образом, поскольку он способен уклоняться от иммунной системы. [9] Иммунотерапия — это метод, который активирует иммунную систему человека и использует ее в своих интересах. [9] Он был разработан после наблюдения, что в некоторых случаях наблюдалась спонтанная регрессия. [85] Иммунотерапия извлекает выгоду из этого явления и направлена на создание иммунного ответа человека на раковые клетки. [85] Другие препараты таргетной терапии подавляют факторы роста, которые, как было показано, способствуют росту и распространению опухолей. [86] [87] Большинство из этих препаратов были одобрены в течение последних десяти лет. [88] Эти методы лечения: [89]
У пациентов с метастатическим раком сунитиниб, вероятно, приводит к большему прогрессированию рака, чем пембролизумаб, акситиниб и авелумаб. [ 95] По сравнению с пембролизумабом и акситинибом, он, вероятно, приводит к большему количеству смертей, но может немного снизить серьезные нежелательные эффекты. [95] По сравнению с комбинациями иммунотерапии (ниволумаб и ипилимумаб), сунитиниб может привести к большему прогрессированию и серьезным эффектам. [95] Между пазопанибом и сунитинибом может быть небольшая или нулевая разница в прогрессировании, выживании и серьезных эффектах. [95]
Также сообщалось об активности ипилимумаба [96] , но он не является одобренным лекарством для лечения рака почки. [97]
Ожидается, что в ближайшем будущем появятся новые лекарственные препараты, поскольку в настоящее время проводятся несколько клинических испытаний новых целевых методов лечения, [98] включая: атезолизумаб , варлилумаб , дурвалумаб , авелумаб , LAG525 , MBG453, TRC105 и саволитиниб .
Химиотерапия и радиотерапия не столь успешны в случае почечно-клеточного рака. Почечно-клеточный рак в большинстве случаев устойчив, но показатель успеха составляет около 4–5%, но он часто кратковременный, и позже развиваются новые опухоли и новообразования. [10]
Адъювантная терапия , которая относится к терапии, проводимой после первичной операции, долгое время не считалась полезной при раке почки. [99] Однако в 2021 году пембролизумаб был одобрен для адъювантной терапии после того, как показал многообещающие улучшения безрецидивной выживаемости. [100]
Наоборот, неоадъювантная терапия назначается перед предполагаемым первичным или основным лечением. В некоторых случаях было показано, что неоадъювантная терапия уменьшает размер и стадию почечно-клеточного рака, что позволяет затем удалить его хирургическим путем. [87] Это новая форма лечения, и эффективность этого подхода все еще оценивается в клинических испытаниях .
Метастатическая почечно-клеточная карцинома (мПКР) — это распространение первичной почечно-клеточной карциномы из почки в другие органы. Примерно у 25–30% людей к моменту постановки диагноза почечно-клеточной карциномы наблюдается такое метастатическое распространение . [101] Такая высокая доля объясняется тем, что клинические признаки обычно слабо выражены, пока болезнь не перейдет в более тяжелую стадию. [102] Наиболее распространенными местами метастазирования являются лимфатические узлы, легкие, кости, печень и мозг. [12] То, как это распространение влияет на стадию заболевания и, следовательно, на прогноз, обсуждается в разделах «Диагностика» и «Прогноз».
MRCC имеет плохой прогноз по сравнению с другими видами рака, хотя среднее время выживания увеличилось за последние несколько лет из-за достижений в лечении. Среднее время выживания в 2008 году для метастатической формы заболевания было менее года, [103] а к 2013 году оно улучшилось до среднего значения в 22 месяца. [104] Несмотря на это улучшение, пятилетняя выживаемость для mRCC остается ниже 10% [105] и 20–25% пациентов остаются невосприимчивыми ко всем видам лечения, и в этих случаях заболевание быстро прогрессирует. [104]
Доступные методы лечения почечно-клеточного рака, обсуждаемые в разделе «Лечение», также актуальны для метастатической формы заболевания. Варианты включают интерлейкин-2, который является стандартной терапией при прогрессирующей почечно-клеточной карциноме. [99] С 2007 по 2013 год было одобрено семь новых методов лечения специально для мПКК (сунитиниб, темсиролимус, бевацизумаб, сорафениб, эверолимус, пазопаниб и акситиниб). [8] Эти новые методы лечения основаны на том факте, что почечно-клеточные карциномы являются очень сосудистыми опухолями — они содержат большое количество кровеносных сосудов. Препараты направлены на подавление роста новых кровеносных сосудов в опухолях, следовательно, замедляя рост и в некоторых случаях уменьшая размер опухолей. [106] Побочные эффекты, к сожалению, довольно распространены при этих методах лечения и включают: [107]
Радиотерапия и химиотерапия чаще используются при метастатической форме ПКР для воздействия на вторичные опухоли в костях, печени, мозге и других органах. Хотя эти методы лечения не являются излечивающими, они облегчают симптомы, связанные с распространением опухолей. [104]
Прогноз зависит от нескольких факторов, включая размер опухоли, степень инвазии и метастазирования, гистологический тип и ядерную степень злокачественности. [26] Стадия является наиболее важным фактором в исходе почечноклеточного рака. Следующие цифры основаны на пациентах, впервые диагностированных в 2001 и 2002 годах Национальной базой данных по раку: [108]
Корейское исследование оценило общую пятилетнюю выживаемость, связанную с заболеванием , в 85%. [109] В целом, если заболевание ограничивается почкой, только у 20–30% развивается метастатическое заболевание после нефрэктомии. [110] Более конкретные подгруппы показывают пятилетнюю выживаемость около 90–95% для опухолей размером менее 4 см. Для более крупных опухолей, ограниченных почкой без венозной инвазии, выживаемость все еще относительно хороша и составляет 80–85%. [ необходима цитата ] Для опухолей, которые распространяются через почечную капсулу и выходят за пределы местных фасциальных оболочек, выживаемость снижается почти до 60%. [ необходима цитата ] Такие факторы, как общее состояние здоровья и физическая форма или тяжесть их симптомов, влияют на показатели выживаемости. Например, у молодых людей (в возрасте 20–40 лет) лучший результат, несмотря на большее количество симптомов при поступлении, возможно, из-за более низких показателей распространения рака на лимфатические узлы (стадия III).
Гистологическая степень злокачественности связана с агрессивностью рака и подразделяется на 4 степени, где 1 имеет наилучший прогноз (пятилетняя выживаемость более 89%), а 4 — наихудший прогноз (46% пятилетней выживаемости).
У некоторых людей рак почечных клеток обнаруживается до того, как у них появляются симптомы (случайно) из-за КТ (компьютерная томография) или УЗИ . Случайно диагностированный рак почечных клеток (без симптомов) отличается по прогнозу от тех, которые диагностируются после появления симптомов почечно-клеточной карциномы или метастазов. Пятилетняя выживаемость была выше для случайных, чем для симптоматических опухолей: 85,3% против 62,5%. Случайные поражения были значительно более низкой стадии, чем те, которые вызывают симптомы, поскольку 62,1% пациентов со случайной почечно-клеточной карциномой наблюдались с поражениями I стадии, против 23% с симптоматической почечно-клеточной карциномой. [111]
Если он метастазировал в лимфатические узлы, пятилетняя выживаемость составляет около 5% - 15%. Для метастатической почечно-клеточной карциномы факторы, которые могут представлять плохой прогноз, включают низкий показатель статуса работоспособности по шкале Карновского (стандартный способ измерения функциональных нарушений у пациентов с раком), низкий уровень гемоглобина , высокий уровень сывороточной лактатдегидрогеназы и высокий скорректированный уровень сывороточного кальция. [112] [113] Для неметастатических случаев алгоритм оценки Лейбовича может использоваться для прогнозирования послеоперационного прогрессирования заболевания. [114]
Почечно-клеточная карцинома является одним из видов рака, наиболее тесно связанных с паранеопластическими синдромами , чаще всего из-за эктопической продукции гормонов опухолью. Лечение этих осложнений почечно-клеточной карциномы, как правило, ограничивается лечением основного рака.
Частота возникновения заболевания варьируется в зависимости от географических, демографических и, в меньшей степени, наследственных факторов. Существуют некоторые известные факторы риска, однако значимость других потенциальных факторов риска остается более спорной. Частота возникновения рака увеличивалась во всем мире со скоростью примерно 2–3% за десятилетие [103] до последних нескольких лет, когда число новых случаев стабилизировалось. [18]
Частота возникновения RCC различается в зависимости от пола, возраста, расы и географического положения по всему миру. У мужчин заболеваемость выше, чем у женщин (примерно 1,6:1) [99] , и подавляющее большинство диагностируется после 65 лет. [99] Сообщается, что у азиатов заболеваемость RCC значительно ниже, чем у белых, и хотя в африканских странах зарегистрированы самые низкие показатели заболеваемости, у афроамериканцев самая высокая заболеваемость среди населения Соединенных Штатов. [18] В развитых странах заболеваемость выше, чем в развивающихся, при этом самые высокие показатели наблюдаются в Северной Америке, Европе и Австралии/Новой Зеландии. [115]
Даниэль Сеннерт сделал первое упоминание об опухоли , возникающей в почке , в своем труде Practicae Medicinae , впервые опубликованном в 1613 году. [116]
Мирил опубликовал самый ранний недвусмысленный случай почечной карциномы в 1810 году. [117] Он описал случай Франсуазы Левелли, 35-летней женщины, которая поступила в Брестскую городскую больницу 6 апреля 1809 года, предположительно на поздних стадиях беременности. [116]
Кёниг опубликовал первую классификацию опухолей почек, основанную на макроскопической морфологии, в 1826 году. Кёниг разделил опухоли на скиррозные, стеатомные, грибовидные и медуллярные формы. [118]
После классификации опухоли исследователи попытались определить ткань, из которой возникла карцинома почки.
Патогенез опухолей почечного эпителия обсуждался десятилетиями. Дебаты были начаты Полом Гравитцем , когда в 1883 году он опубликовал свои наблюдения по морфологии небольших желтых опухолей почек. Гравитц пришел к выводу, что только альвеолярные опухоли имеют надпочечниковое происхождение, тогда как папиллярные опухоли происходят из почечной ткани. [116]
В 1893 году Пол Судек бросил вызов теории, постулированной Гравитцем, опубликовав описания опухолей почек, в которых он выявил атипичные особенности в почечных канальцах и отметил градацию этих атипичных особенностей между канальцами и соседней злокачественной опухолью . В 1894 году Отто Любарш , поддержавший теорию, постулированную Гравитцем, ввел термин «гипернефроидная опухоль» , который был изменен на гипернефрому Феликсом Виктором Бирх-Хиршфельдом для описания этих опухолей. [119]
Решительная критика Гравитца была представлена Оскаром Штерком в 1908 году, который считал, что надпочечниковое происхождение почечных опухолей недоказано. Несмотря на убедительные аргументы против теории, постулированной Гравитцем, термин гипернефрома, с его сопутствующим надпочечниковым оттенком, сохранился в литературе. [116]
Фут и Хамфрис, а также Фут и др. ввели термин « почечно-клеточная карцинома» , чтобы подчеркнуть почечно-канальцевое происхождение этих опухолей . Их обозначение было слегка изменено Феттером на теперь широко принятый термин «почечно-клеточная карцинома» . [120]
Убедительные доказательства для разрешения спора были предложены Оберлингом и соавторами в 1959 году, которые изучали ультраструктуру прозрачных клеток из восьми почечных карцином . Они обнаружили, что цитоплазма опухолевых клеток содержала многочисленные митохондрии и отложения гликогена и жира. Они идентифицировали цитоплазматические мембраны, вставленные перпендикулярно в базальную мембрану , с редкими клетками, содержащими микроворсинки вдоль свободных границ. Они пришли к выводу, что эти особенности указывают на то, что опухоли возникли из эпителиальных клеток почечных извитых канальцев , таким образом, окончательно разрешив один из самых обсуждаемых вопросов в опухолевой патологии. [116] [121]
{{cite web}}: CS1 maint: архивная копия как заголовок ( ссылка )