Псорален (также называемый псораленом ) является исходным соединением семейства встречающихся в природе органических соединений, известных как линейные фуранокумарины . Он структурно связан с кумарином добавлением конденсированного фуранового кольца и может рассматриваться как производное умбеллиферона . Псорален в природе встречается в семенах Psoralea corylifolia , а также в инжире обыкновенном , сельдерее , петрушке , атласном дереве Вест-Индии и во всех цитрусовых . Он широко используется в ПУВА- терапии (псорален + УФА ) при псориазе , экземе , витилиго и кожной Т-клеточной лимфоме ; эти применения обычно осуществляются с помощью таких лекарств, как метоксален . Многие фуранокумарины чрезвычайно токсичны для рыб, а некоторые из них сбрасываются в ручьи Индонезии для ловли рыбы. [1]
Псорален является мутагеном и используется с этой целью в исследованиях молекулярной биологии. Псорален интеркалируется в ДНК и под воздействием ультрафиолетового (УФА) излучения может образовывать моноаддукты и ковалентные межцепочечные поперечные связи (ICL) с тиминами, преимущественно в участках 5'-TpA в геноме, индуцируя апоптоз . Псорален плюс УФА-терапия (ПУВА) может использоваться для лечения гиперпролиферативных заболеваний кожи, таких как псориаз и некоторые виды рака кожи . [2] К сожалению, ПУВА-терапия сама по себе приводит к более высокому риску развития рака кожи. [3]
Важным применением псоралена является ПУВА-терапия кожных проблем, таких как псориаз и, в меньшей степени, экзема и витилиго . При этом используется высокое поглощение УФ- излучения псоралена. Сначала наносится псорален для повышения чувствительности кожи, затем для устранения заболевания применяется УФА-излучение. Псоралены также используются при фотоферезе , когда их смешивают с экстрагированными лейкоцитами перед применением УФ-излучения.
Несмотря на фотоканцерогенные свойства псоралена, [4] [5] он использовался в качестве активатора загара в солнцезащитных кремах до 1996 года. [6] Псорален используется в ускорителях загара, поскольку псорален увеличивает чувствительность кожи к свету. У некоторых пациентов наблюдалось серьезное поражение кожи после принятия солнечных ванн с активаторами загара, содержащими псорален. [7] Пациенты со светлой кожей страдают в четыре раза больше от меланомообразующих свойств псораленов, чем пациенты с более темной кожей. [6] Кратковременные побочные эффекты псораленов включают тошноту, рвоту, эритему, зуд, ксероз, кожные боли из-за фототоксического повреждения дермального нерва и могут вызывать злокачественные новообразования кожи и половых органов. [8]
Дополнительным применением оптимизированных псораленов является инактивация патогенов в продуктах крови. Синтетический аминопсорален амотосален HCl разработан для инактивации возбудителей инфекционных заболеваний (бактерий, вирусов, простейших) в тромбоцитах и компонентах плазмы крови, приготовленных для трансфузионного обеспечения больных. Перед клиническим использованием тромбоциты, обработанные амотосаленом, были протестированы и признаны неканцерогенными при использовании установленной мышиной модели с нокаутом р53 . [9] В настоящее время эта технология широко используется в некоторых европейских центрах крови и недавно была одобрена в США. [10] [11] [12] [13]
Псорален внедряется в двойную спираль ДНК, где он идеально расположен для образования одного или нескольких аддуктов с соседними пиримидиновыми основаниями, предпочтительно тимином, при возбуждении ультрафиолетовым фотоном.
Для получения констант связывания для взаимодействий псоралена и ДНК было использовано несколько физико-химических методов. Традиционно две камеры с псораленом и буферным раствором ДНК разделены полупроницаемой мембраной ; сродство псоралена к ДНК напрямую связано с концентрацией псоралена в камере ДНК после равновесия. Растворимость в воде важна по двум причинам: фармакокинетика , связанная с растворимостью лекарственного средства в крови, и необходимость использования органических растворителей (например, ДМСО ). Псоралены также можно активировать путем облучения длинноволновым ультрафиолетовым светом. Хотя свет диапазона UVA является клиническим стандартом, исследования, показывающие, что UVB более эффективен при образовании фотоаддуктов, позволяют предположить, что его использование может привести к более высокой эффективности и сокращению времени лечения. [14]
Фотохимически активными центрами псораленов являются алкеноподобные двойные углерод-углеродные связи в фурановом кольце (пятичленное кольцо) и пироновом кольце (шестичленное кольцо). При соответствующей интеркалации рядом с пиримидиновым основанием реакция четырехцентрового фотоциклоприсоединения может привести к образованию любого из двух моноаддуктов циклобутильного типа. Обычно моноаддукты фурановой стороны образуются в более высокой пропорции. Фурановый моноаддукт может поглощать второй фотон UVA, что приводит ко второму четырехцентровому фотоциклоприсоединению на пироновом конце молекулы и, следовательно, к образованию диаддукта или поперечной связи. Моноаддукты пирона не поглощают УФА-диапазон и, следовательно, не могут образовывать поперечные связи при дальнейшем УФА-облучении. [15]
Другой важной особенностью этого класса соединений является их способность генерировать синглетный кислород , хотя этот процесс находится в прямой конкуренции с образованием аддукта и может быть альтернативным путем диссипации энергии возбужденного состояния.
Исследования псоралена исторически были сосредоточены на взаимодействии с ДНК и РНК (в частности, на образовании ICL). Однако также было показано, что псорален блокирует передачу сигналов рецептора ErbB2 , который сверхэкспрессируется при некоторых агрессивных типах рака молочной железы. [16] Синтетическое производное бергаптена , 5-(4-феноксибутокси)псорален, перспективно в качестве иммунодепрессанта, ингибируя специфический калиевый канал . Его структура предотвращает интеркаляцию в ДНК, и он очень слабо производит синглетный кислород, что значительно снижает нежелательную токсичность и мутагенность in vivo . Это имеет значение для лечения различных аутоиммунных заболеваний (например, рассеянного склероза , диабета 1 типа и ревматоидного артрита ). [17] Хотя модификация клеточной поверхности и блокировка ионных каналов являются двумя недавно открытыми механизмами действия, еще предстоит провести много исследований.
Большинство фуранокумаринов можно рассматривать как производные псоралена или ангелицина . Псорален и его производные часто называют линейными фуранокумаринами , названными так потому, что они обладают линейной химической структурой. Важные линейные фуранокумарины включают ксантотоксин (также называемый метоксален ), бергаптен , императорин и нодакенетин .

Структура псоралена первоначально была установлена путем идентификации продуктов реакций его деградации. Он демонстрирует нормальные реакции лактона кумарина , такие как раскрытие кольца щелочью с образованием кумариновой кислоты или производного кумариновой кислоты . Перманганат калия вызывает окисление фуранового кольца, тогда как другие методы окисления приводят к образованию фуран-2,3-карбоновой кислоты.
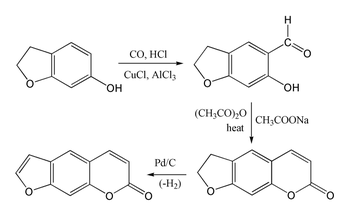
Псорален трудно синтезировать, поскольку умбеллиферон подвергается замещению в 8-м положении, а не в желаемом 6-м положении. Бензофуран реагирует преимущественно в фурановом кольце, а не в бензольном кольце. Однако 7-гидроксипроизводное 2,3-дигидробензофурана (также называемое кумараном) подвергается замещению в желаемом положении 6, что позволяет осуществить следующий синтез кумариновой системы посредством реакции Гаттермана-Коха с последующей конденсацией Перкина с использованием уксусного ангидрида . Затем синтез завершается дегидрированием пятичленного кольца с образованием фуранового кольца.
Псорален образуется из кумаринов шикиматного пути ; его биосинтез показан на рисунке ниже. Ароматическое кольцо в 6 активируется в орто-положениях по отношению к гидроксильной группе и алкилируется 5, алкилирующим агентом . Диметилаллильная группа в 7 затем подвергается циклизации с фенольной группой с образованием 8. Это преобразование катализируется цитохром P-450-зависимой монооксигеназой17 (псорален-5-монооксигеназа), а также кофакторами ( НАДФН ) и молекулярным кислородом. [18]
Путь биосинтеза, в котором образуется псорален, показан на рисунке ниже. Второй P-450 -зависимый фермент монооксигеназы ( псораленсинтаза ) затем отщепляет 10 (в форме 11) от 8 до 1. Этот путь не включает в себя какой-либо гидроксилированный промежуточный продукт, и предполагается, что расщепление инициируется радикальной реакцией. . [18]

Ficus carica (инжир), вероятно, является наиболее распространенным источником псораленов. Они также обнаружены в небольших количествах в Ammi visnaga (биснага), Pastinaca sativa (пастернак), Petroselinum cripsum ( петрушка ), Levisticum officinale (любисток), Foeniculum vulgare (плоды, например, семена фенхеля), Daucus carota (морковь), Psoralea. corylifolia (бабчи), Apium Graveolens (сельдерей), масло бергамота ( бергаптен , бергамоттин ). [19]
ПУВА-обработка приводит к образованию как межцепочечных сшивок ДНК (ICL), так и моноаддуктов. ICL, введенные псораленом, обладают высокой генотоксичностью для активно реплицирующихся клеток. Ковалентная связь препятствует развитию репликационной вилки . Таким образом, прежде чем репликация сможет возобновиться, необходимо отсоединить ICL. Начальные этапы восстановления обычно включают разрезы одной родительской цепи по обе стороны от сшивки. [20] Впоследствии восстановление поражения может происходить с помощью точного или неточного процесса.
Точный процесс восстановления поперечных связей — это гомологичная рекомбинационная репарация (HRR). Это предполагает замену поврежденной информации неповрежденной информацией из другой гомологичной хромосомы в той же клетке. Клетки Escherichia coli, дефицитные по HRR, более чувствительны к PUVA по сравнению с клетками дикого типа. [21] HRR представляется эффективным. В E. coli , хотя одной или двух невосстановленных поперечных связей достаточно для инактивации клетки, клетка дикого типа может репарировать и, следовательно, восстанавливать от 53 до 71 псораленовой поперечной связи. [21] В дрожжах Saccharomyces cerevisiae HRR является основным путем точного удаления псораленовых сшивок. [22] У дрожжей дикого типа события рекомбинации, связанные с удалением перекрестных связей с помощью HRR, преимущественно представляют собой события конверсии генов, не связанные с кроссовером . Поперечные связи псоралена в вирусной ДНК также, по-видимому, удаляются в результате процесса рекомбинационной репарации, что происходит в клетках, инфицированных вирусом SV40 [23] и в клетках, инфицированных вирусом простого герпеса. [24]
Один неточный процесс восстановления поперечных связей псоралена, по-видимому, предполагает использование ДНК-полимеразы для заполнения пробела, образовавшегося в цепи с помощью двух надрезов. Этот процесс является неточным, поскольку комплементарная неразрезанная цепь все еще сохраняет часть поперечной связи и, таким образом, не может служить адекватной матрицей для точного синтеза репарации. Неправильный синтез репарации может вызвать мутацию . Моноаддукты псоралена в цепи матричной ДНК также могут вызывать неправильный обход репликации ( синтез транслейкоза ), что может привести к мутации. Было обнаружено, что в фаге Т4 увеличение мутаций, наблюдаемое после обработки PUVA, отражает синтез транслейкоза с помощью ДНК-полимеразы дикого типа, вероятно, из-за несовершенной способности чтения корректуры.
Псоралены могут обратимо сшивать двойные спирали нуклеиновых кислот и поэтому широко используются для анализа взаимодействий и структур как ДНК, так и РНК. [25] [26]