В биологии любая группа рыб , которая держится вместе по социальным причинам, называется стаей , а если группа плывет в одном направлении скоординированно, то она называется стаей . [1] В обиходе эти термины иногда используются довольно свободно. [1] Около четверти видов рыб всю жизнь держатся стаей, а около половины — часть своей жизни. [2]
Рыбы получают много преимуществ от поведения в стае, включая защиту от хищников (благодаря лучшему обнаружению хищников и снижению вероятности индивидуального захвата), более успешную добычу пищи и более успешный поиск партнера. Также вероятно, что рыбы получают выгоду от членства в стае за счет повышения гидродинамической эффективности.
Рыбы используют множество признаков для выбора сородичей. Обычно они предпочитают более крупные сородичи, сородичей своего вида, сородичей, похожих по размеру и внешнему виду на себя, здоровую рыбу и родственников (если они распознаны).
Эффект странности утверждает, что любой член стаи, который выделяется внешне, будет предпочтительно объектом нападения хищников. Это может объяснить, почему рыбы предпочитают собираться в стаи с особями, похожими на них самих. Таким образом, эффект странности имеет тенденцию гомогенизировать стаи.

Скопление рыб — это общий термин для любого скопления рыб, которые собрались вместе в некоторой местности. Скопления рыб могут быть структурированными или неструктурированными. Неструктурированное скопление может быть группой смешанных видов и размеров, которые собрались случайным образом около некоторого локального ресурса, такого как еда или места гнездования.
Если, кроме того, агрегация объединяется интерактивным, социальным образом, их можно назвать стайными . [ 1] [a] Хотя стайные рыбы могут общаться друг с другом свободным образом, при этом каждая рыба плавает и ищет пищу несколько независимо, они, тем не менее, знают о других членах группы, как показано в том, как они корректируют свое поведение, например плавание, чтобы оставаться рядом с другими рыбами в группе. Стайные группы могут включать рыб разного размера и могут включать подгруппы смешанных видов.
Если стая становится более тесно организованной, и рыбы синхронизируют свое плавание, так что все они движутся с одинаковой скоростью и в одном направлении, то можно сказать, что рыба стайная . [1] [3] [b] Стайные рыбы обычно принадлежат к одному виду и имеют одинаковый возраст/размер. Стаи рыб движутся с отдельными членами, точно расположенными друг от друга. Стаи предпринимают сложные маневры, как будто у стаи есть свой собственный разум. [4]
Сложности стайного образа жизни далеки от полного понимания, особенно энергетика плавания и питания. Было предложено много гипотез, объясняющих функцию стайного образа жизни, таких как лучшая ориентация, синхронизированная охота, замешательство хищников и снижение риска быть обнаруженным. Стайный образ жизни также имеет недостатки, такие как накопление выделений в дыхательной среде и истощение кислорода и пищи. То, как рыбы располагаются в стае, вероятно, дает преимущества в экономии энергии, хотя это спорно. [5]

Рыбы могут быть облигатными или факультативными (необязательными) косячными. [6] Облигатные косячные, такие как тунец , сельдь и анчоус , проводят все свое время, сбившись в стаю или держась в стае, и становятся беспокойными, если их отделить от группы. Факультативные косячные, такие как атлантическая треска , сайды и некоторые ставриды , держатся в стае только некоторое время, возможно, в репродуктивных целях. [7]
Стайная рыба может переходить в дисциплинированную и скоординированную стаю, а затем в течение нескольких секунд снова переходить в аморфную стаю. Такие переходы вызываются изменениями активности от кормления, отдыха, перемещения или избегания хищников. [4]
Когда стайные рыбы останавливаются, чтобы поесть, они распадаются и становятся косяками. Косяки более уязвимы для нападения хищников. Форма, которую принимает стая или стая, зависит от вида рыбы и того, что она делает. Движущиеся косяки могут образовывать длинные тонкие линии, квадраты, овалы или амебовидные формы. Быстро движущиеся косяки обычно образуют клиновидную форму, в то время как косяки, которые питаются, имеют тенденцию становиться круглыми. [4]
Кормовые рыбы — это мелкие рыбы, на которых охотятся более крупные хищники. Хищники включают других крупных рыб, морских птиц и морских млекопитающих . Типичные океанские кормовые рыбы — это мелкие фильтрующие рыбы, такие как сельдь , анчоусы и менхаден . Кормовые рыбы компенсируют свой небольшой размер, образуя стаи. Некоторые плавают синхронизированными сетками с открытым ртом, чтобы эффективно фильтровать корм из планктона . [8] Эти стаи могут стать огромными, перемещаясь вдоль береговых линий и мигрируя через открытые океаны. Косяки являются концентрированными пищевыми ресурсами для крупных морских хищников.

Эти иногда огромные скопления питают океаническую пищевую сеть . Большинство кормовых рыб являются пелагическими рыбами , что означает, что они формируют свои стаи в открытой воде, а не на дне или около него ( донные рыбы ). Кормовые рыбы живут недолго и в основном остаются незамеченными людьми. Хищники пристально следят за косяками, остро осознают их численность и местонахождение и совершают миграции сами, часто в собственных стаях, которые могут охватывать тысячи миль, чтобы присоединиться к ним или оставаться связанными с ними. [9]
Сельдь относится к наиболее впечатляющим стайным рыбам. Они собираются вместе в огромных количествах. Самые большие косяки часто образуются во время миграций, сливаясь с более мелкими косяками. «Цепи» косяков длиной в сто километров (60 миль) были замечены у кефали, мигрирующей в Каспийском море . Радаков подсчитал, что косяки сельди в Северной Атлантике могут занимать до 4,8 кубических километров (1,2 кубических мили) с плотностью рыбы от 0,5 до 1,0 рыбы/кубический метр ( от 3 ⁄ 8 до 3 ⁄ 4 рыбы на кубический ярд), что в общей сложности составляет около трех миллиардов рыб в одной стае. [10] Эти косяки движутся вдоль береговых линий и пересекают открытые океаны. Стаи сельди в целом имеют очень точные механизмы, которые позволяют стае поддерживать относительно постоянную скорость движения. У сельди отличный слух, и ее косяки очень быстро реагируют на хищника. Сельдь держится на определенном расстоянии от движущегося аквалангиста или крейсерского хищника, например, косатки, образуя вакуоль, которая с самолета-корректировщика выглядит как пончик. [11]
Многие виды крупных хищных рыб также сбиваются в стаи, включая многих далеко мигрирующих рыб , таких как тунец и некоторые океанские акулы . Китообразные, такие как дельфины, морские свиньи и киты, действуют в организованных социальных группах, называемых стаями .
«Поведение стайности обычно описывается как компромисс между преимуществами жизни в группах в борьбе с хищниками и издержками возросшей конкуренции за пропитание». [12] Ланда (1998) утверждает, что совокупные преимущества стайности, как подробно описано ниже, являются сильными селективными стимулами для рыб присоединяться к стайкам. [13] Пэрриш и др. (2002) аналогичным образом утверждают, что стайность является классическим примером возникновения , когда есть свойства, которыми обладает стая, но не отдельные рыбы. Возникающие свойства дают эволюционное преимущество членам стаи, которое не получают не члены. [14]
Поддержка социальной и генетической функции скоплений, особенно тех, которые образованы рыбами, может быть замечена в нескольких аспектах их поведения. Например, эксперименты показали, что отдельные рыбы, удаленные из стаи, будут иметь более высокую частоту дыхания, чем те, которые находятся в стае. [15] Этот эффект был приписан стрессу, и поэтому эффект пребывания с сородичами, по-видимому, является успокаивающим и мощной социальной мотивацией для того, чтобы оставаться в скоплении. [16] Сельдь, например, станет очень возбужденной, если ее изолировать от сородичей. [7] Из-за их адаптации к стайному поведению они редко выставляются в аквариумах . Даже при наличии лучших условий, которые может предложить аквариум, они становятся хрупкими и вялыми по сравнению с их дрожащей энергией в диких стаях. [ необходима цитата ]

Также было высказано предположение, что плавание в группах повышает успешность добычи пищи. Эта способность была продемонстрирована Питчером и другими в их исследовании поведения добычи пищи у стайных карповых . [17] В этом исследовании было количественно определено время, необходимое группам пескарей и золотых рыбок, чтобы найти участок пищи. Количество рыб в группах варьировалось, и было установлено статистически значимое уменьшение количества времени, необходимого для поиска пищи большими группами. Дальнейшее подтверждение улучшенной способности добычи пищи стай наблюдается в структуре стай хищных рыб. Партридж и другие проанализировали структуру стай атлантического голубого тунца по аэрофотоснимкам и обнаружили, что стая приняла параболическую форму, факт, который предполагал кооперативную охоту у этого вида. [18]
«Причиной этого является наличие множества глаз, ищущих пищу. Рыбы в стаях «делятся» информацией, внимательно следя за поведением друг друга. Пищевое поведение у одной рыбы быстро стимулирует пищевое поведение у других. [19]
Плодородные места кормления для кормовой рыбы обеспечиваются океанскими подъемами глубинных вод. Океанические круговороты — это крупномасштабные океанские течения , вызванные эффектом Кориолиса . Ветровые поверхностные течения взаимодействуют с этими круговоротами и подводным рельефом, таким как подводные горы , рыбные банки и край континентальных шельфов , чтобы производить даунвеллинги и апвеллинги . [20] Они могут переносить питательные вещества, на которых процветает планктон. Результатом могут быть богатые места кормления, привлекательные для кормовой рыбы, питающейся планктоном. В свою очередь, кормовая рыба сама становится местом кормления для более крупных хищных рыб. Большинство подъемов глубинных вод являются прибрежными, и многие из них поддерживают некоторые из самых продуктивных рыбных промыслов в мире. Регионы заметного апвеллинга включают прибрежные районы Перу , Чили , Аравийского моря , западной части Южной Африки , восточной части Новой Зеландии и побережья Калифорнии . [ необходима ссылка ]
Веслоногие рачки , основной зоопланктон , являются основным пунктом в меню кормовой рыбы. Это группа мелких ракообразных, обитающих в океане и пресноводных местообитаниях . Веслоногие рачки обычно имеют длину от одного миллиметра (0,04 дюйма) до двух миллиметров (0,08 дюйма) и каплевидное тело. Некоторые ученые говорят, что они образуют самую большую биомассу животных на планете. [21] Веслоногие рачки очень бдительны и уклончивы. У них большие усики (см. фото ниже слева). Когда они расправляют свои усики, они могут чувствовать волну давления от приближающейся рыбы и прыгать с большой скоростью на несколько сантиметров. Если концентрация веслоногих рачков достигает высоких уровней, стайная сельдь принимает метод, называемый кормлением таранами . На фото ниже сельдевый таран питается стаей веслоногих рачков . Они плавают с широко открытым ртом и полностью раскрытыми жаберными крышками . [ требуется ссылка ]
Рыбы плавают в сетке, где расстояние между ними такое же, как длина прыжка их добычи, как показано на анимации выше справа. В анимации молодь сельди охотится на веслоногих рачков таким синхронным образом. Веслоногие рачки чувствуют своими усиками волну давления приближающейся сельди и реагируют быстрым прыжком для спасения. Длина прыжка довольно постоянна. Рыбы выстраиваются в сетку с этой характерной длиной прыжка. Веслоногий рачок может рвануть примерно 80 раз, прежде чем устанет. После прыжка ему требуется 60 миллисекунд, чтобы снова расправить свои усики, и эта задержка времени становится его погибелью, поскольку почти бесконечный поток сельди позволяет сельди в конечном итоге схватить веслоногих рачков. Одна молодая сельдь никогда не сможет поймать большого веслоногих рачков. [8]
Третье предполагаемое преимущество групп рыб заключается в том, что они выполняют репродуктивную функцию. Они обеспечивают расширенный доступ к потенциальным партнерам, поскольку поиск партнера в стае не требует много энергии. А для мигрирующих рыб, которые преодолевают большие расстояния для нереста, вполне вероятно, что навигация стаи, при участии всех членов стаи, будет лучше, чем та, которую осуществляет отдельная рыба. [4] [ нужна страница ]
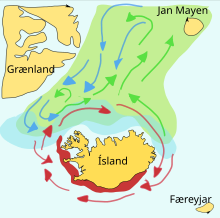
Кормовая рыба часто совершает большие миграции между местами нереста, кормления и нагула. Стаи определенного стада обычно перемещаются в треугольнике между этими местами. Например, у одной стаи сельди нерест в южной Норвегии , место кормления в Исландии , а место нагула в северной Норвегии. Такие широкие треугольные перемещения могут быть важны, поскольку кормовая рыба во время кормления не может различать собственное потомство. [ требуется ссылка ]
Мойва — кормовая рыба семейства корюшковых , обитающая в Атлантическом и Северном Ледовитом океанах. Летом она питается густыми скоплениями планктона на краю шельфового ледника. Более крупная мойва также питается крилем и другими ракообразными . Мойва движется к берегу большими стаями, чтобы метать икру, и мигрирует весной и летом, чтобы питаться в богатых планктоном районах между Исландией , Гренландией и Ян-Майеном . На миграцию влияют океанские течения . Вокруг Исландии созревающая мойва совершает большие кормовые миграции на север весной и летом. Обратная миграция происходит в сентябре-ноябре. Нерестовая миграция начинается к северу от Исландии в декабре или январе. [22]
Эта теория утверждает, что группы рыб могут экономить энергию, когда плавают вместе, во многом так же, как велосипедисты могут тянуть друг друга в пелотоне . Гуси, летящие в форме V, также, как полагают, экономят энергию, летя в восходящем потоке вихря на кончиках крыльев, созданном предыдущим животным в форме. [23] [24] Повышение эффективности плавания в группах было предложено для стай рыб и антарктического криля . [ требуется ссылка ]
Казалось бы, разумно полагать, что регулярное расположение и однородность размеров рыб в стаях приведут к гидродинамической эффективности. [12] Хотя ранние лабораторные эксперименты не смогли обнаружить гидродинамические преимущества, создаваемые соседями рыб в стае, [19] считается, что повышение эффективности происходит в дикой природе. Более поздние эксперименты с группами рыб, плавающих в лотках, подтверждают это, при этом рыбы снижают свои затраты на плавание на целых 20% по сравнению с тем, когда те же рыбы плавают в изоляции. [25] Ланда (1998) утверждал, что лидер стаи постоянно меняется, потому что, хотя нахождение в теле стаи дает гидродинамическое преимущество, лидер будет первым, кто получит пищу. [13] Более поздние работы показывают, что после того, как особи в передней части стаи сталкиваются и потребляют больше пищи, они затем перемещаются дальше в пределах стаи из-за локомоторных ограничений, возникающих во время переваривания пищи. [26]

.jpg/440px-Red_Fish_at_Papahānaumokuākea_(cropped).jpg)

Обычно наблюдается, что стайные рыбы подвергаются особой опасности быть съеденными, если они отделены от стаи. [4] Было предложено несколько функций стай рыб против хищников .
Одним из потенциальных методов, с помощью которого косяки рыб могут помешать хищникам, является «эффект замешательства хищника», предложенный и продемонстрированный Милински и Хеллером (1978). [29] Эта теория основана на идее, что хищникам становится трудно выбирать индивидуальную добычу из групп, поскольку множество движущихся целей создают сенсорную перегрузку зрительного канала хищника. Выводы Милински и Хеллера были подтверждены как в эксперименте [30] [31] , так и в компьютерном моделировании. [32] [33] «Стайные рыбы имеют одинаковый размер и серебристый цвет, поэтому визуально ориентированному хищнику трудно выделить отдельную особь из массы извивающихся, сверкающих рыб, а затем иметь достаточно времени, чтобы схватить свою добычу, прежде чем она исчезнет в стае». [4]
Стайное поведение сбивает с толку орган боковой линии (LLO) , а также электросенсорную систему (ESS) хищников. [34] [35] [36] Движения плавников одной рыбы действуют как точечный источник волны, испуская градиент, по которому хищники могут его локализовать. Поскольку поля многих рыб будут перекрываться, стайность должна скрывать этот градиент, возможно, имитируя волны давления более крупного животного, и, скорее всего, сбивать с толку восприятие боковой линии. [34] LLO имеет важное значение на последних стадиях атаки хищника. [37] Электрорецепторные животные могут локализовать источник поля, используя пространственные неоднородности. Чтобы производить отдельные сигналы, отдельные жертвы должны находиться на расстоянии примерно пяти ширин тела друг от друга. Если объекты находятся слишком близко друг к другу, чтобы их можно было различить, они сформируют размытое изображение. [38] На основании этого было высказано предположение, что стайность может сбивать с толку ЭСС хищников. [34]
Третий потенциальный эффект агрегации животных против хищников — гипотеза «множества глаз». Эта теория утверждает, что по мере увеличения размера группы задача сканирования окружающей среды на предмет хищников может быть распределена между многими особями. Это массовое сотрудничество не только предположительно обеспечивает более высокий уровень бдительности, но и может дать больше времени для индивидуального питания. [39] [40]
Четвертая гипотеза антихищного эффекта рыбных стай — эффект «разбавления при столкновении». Эффект разбавления — это разработка безопасности в числах и взаимодействует с эффектом замешательства. [19] При определенной атаке хищник съест меньшую часть большой стаи, чем маленькой. [41] Гамильтон предположил, что животные объединяются из-за «эгоистичного» избегания хищника и, таким образом, это является формой поиска укрытия. [42] Другая формулировка теории была дана Тернером и Питчером и рассматривалась как комбинация вероятностей обнаружения и нападения. [43] В компоненте обнаружения теории предполагалось, что потенциальная добыча может выиграть, живя вместе, поскольку хищник с меньшей вероятностью случайно натолкнется на одну группу, чем на разбросанное распределение. В компоненте нападения считалось, что нападающий хищник с меньшей вероятностью съест конкретную рыбу, когда присутствует большее количество рыб. Подводя итог, можно сказать, что рыба имеет преимущество, если она находится в большей из двух групп, при условии, что вероятность обнаружения и нападения не увеличивается непропорционально размеру группы. [44]
Стайные кормовые рыбы подвергаются постоянным нападениям хищников. Примером являются нападения, которые происходят во время хода африканских сардин . Ход африканских сардин представляет собой впечатляющую миграцию миллионов серебристых сардин вдоль южного побережья Африки. С точки зрения биомассы ход сардин может соперничать с великой миграцией гну в Восточной Африке . [45] У сардин короткий жизненный цикл, они живут всего два или три года. Взрослые сардины, возрастом около двух лет, собираются на банке Агульяс , где они нерестятся весной и летом, выпуская десятки тысяч икринок в воду. Затем взрослые сардины сотнями косяков направляются к субтропическим водам Индийского океана . Более крупный косяк может быть 7 километров (4,3 мили) в длину, 1,5 километра (0,93 мили) в ширину и 30 метров (98 футов) в глубину. Огромное количество акул, дельфинов, тунцов, парусников, морских котиков и даже косаток собираются вместе и следуют за косяками, создавая ажиотаж вдоль береговой линии. [46]

При опасности сардины (и другие кормовые рыбы) инстинктивно группируются и создают огромные шары-приманки . Шары-приманки могут достигать 20 метров (66 футов) в диаметре. Они недолговечны, редко длятся дольше 20 минут. Икра рыб, оставленная на отмелях Агульяс, дрейфует на северо-запад по течению в воды у западного побережья, где личинки развиваются в молодь рыб. Когда они становятся достаточно взрослыми, они собираются в плотные косяки и мигрируют на юг, возвращаясь к отмелям Агульяс, чтобы перезапустить цикл. [46]
Развитие стайного поведения, вероятно, было связано с повышением качества восприятия, хищным образом жизни и механизмами сортировки по размеру для избежания каннибализма. [36] У предков, питающихся фильтрацией, до того, как развились зрение и октаволатеральная система (OLS), риск хищничества был ограничен и в основном из-за беспозвоночных хищников. Следовательно, в то время безопасность в численности, вероятно, не была основным стимулом для сбора в косяки или стаи. Развитие зрения и OLS позволило бы обнаруживать потенциальную добычу. Это могло привести к повышению потенциала каннибализма внутри косяка. С другой стороны, повышение качества восприятия дало бы мелким особям шанс убежать или никогда не присоединиться к стае с более крупной рыбой. Было показано, что мелкая рыба избегает присоединения к группе с более крупной рыбой, хотя крупная рыба не избегает присоединения к мелким особям своего вида. [47] Этот механизм сортировки, основанный на повышении качества восприятия, мог привести к однородности размера рыб в косяках, что увеличило бы способность к синхронному движению. [36]
.JPG/440px-School_of_blackfin_barracuda_(sphyraena_qenie).JPG)
Хищники разработали различные контрмеры, чтобы подорвать оборонительные маневры стайных и косячных групп кормовых рыб. Парусник поднимает свой парус, чтобы казаться намного больше, чтобы он мог пасти косяк рыб или кальмаров. Меч-рыба на высокой скорости прорывается через косяки кормовых рыб, рубя своими мечами, чтобы убить или оглушить добычу. Затем они поворачиваются и возвращаются, чтобы съесть свою «добычу». Лисьи акулы используют свои длинные хвосты, чтобы оглушить косяки рыб. Перед тем как напасть, акулы сжимают косяки добычи, плавая вокруг них и разбрызгивая воду хвостами, часто парами или небольшими группами. Лисьи акулы плавают кругами, чтобы загнать стайную добычу в компактную массу, прежде чем резко ударить ее верхней частью хвоста, чтобы оглушить ее. [48] [49] Акулы-спиннеры прорываются вертикально через косяки, вращаясь вокруг своей оси с открытым ртом и щелкая всем вокруг. В конце этих спиральных забегов акула часто благодаря импульсу взлетает в воздух. [50] [51]
Некоторые хищники, такие как дельфины, охотятся группами. Одним из методов, используемых многими видами дельфинов, является стадное поведение , когда стая контролирует косяк рыб, в то время как отдельные члены по очереди пробираются сквозь более плотную стаю и питаются ею (формация, обычно известная как приманочный шар ). Загон в загон — это метод, при котором рыбу загоняют на мелководье, где ее легче поймать. В Южной Каролине атлантический дельфин-афалина делает еще один шаг вперед, используя то, что стало известно как кормление на берегу, когда рыбу загоняют на илистые отмели и оттуда вытаскивают. [53]
Обычные дельфины-афалины наблюдались с использованием другой техники. Один дельфин действует как «водитель» и гонит косяк рыб к нескольким другим дельфинам, которые образуют барьер. Дельфин-водитель шлепает по своему хвостовому плавнику, что заставляет рыбу подпрыгивать в воздух. Когда рыба подпрыгивает, дельфин-водитель движется вместе с дельфинами-барьерами и ловит рыбу в воздухе. [52] Этот тип кооперативной специализации ролей, по-видимому, более распространен у морских животных , чем у наземных , возможно, потому, что океаны имеют большую изменчивость в разнообразии добычи, биомассе и подвижности хищников. [52]
Во время хода сардин около 18 000 дельфинов, ведущих себя как овчарки, сгоняют сардин в шары-приманки или загоняют их в загон на мелководье. Как только шары-приманки собраны, дельфины и другие хищники по очереди пробираются сквозь них, пожирая рыбу, пока она проносится сквозь них. Морские птицы также нападают на них сверху, стаи олуш , бакланов , крачек и чаек . Некоторые из этих морских птиц падают с высоты 30 метров (100 футов), ныряя в воду, оставляя за собой паровые следы, похожие на следы истребителей. [46] Олуши ныряют в воду со скоростью до 100 километров в час (60 миль в час). У них есть воздушные мешки под кожей на лице и груди, которые действуют как пузырчатая пленка , смягчая удар о воду.
Известно, что подгруппы популяций дельфинов-афалин в Мавритании занимаются межвидовой совместной рыбалкой с людьми-рыбаками. Дельфины гонят стаю рыб к берегу, где люди ждут их со своими сетями. В суматохе забрасывания сетей дельфины также ловят большое количество рыбы. Также наблюдались внутривидовые совместные методы добычи пищи, и некоторые предполагают, что это поведение передается через культурные средства. Ренделл и Уайтхед предложили структуру для изучения культуры у китообразных. [54]
Некоторые киты выпадают, чтобы поесть приманки. [55] Выпадное кормление — это экстремальный метод кормления, при котором кит ускоряется снизу приманки до высокой скорости, а затем открывает рот под большим углом. Это создает давление воды, необходимое для расширения его рта, чтобы поглотить и отфильтровать огромное количество воды и рыбы. Выпадное кормление огромных полосатиков считается крупнейшим биомеханическим событием на Земле. [56]

Стаи рыб плавают дисциплинированными фалангами, причем некоторые виды, такие как сельдь, способны подниматься и опускаться с впечатляющей скоростью, извиваясь так и этак и внося поразительные изменения в форму стаи, не сталкиваясь. Как будто их движения отрепетированы, хотя это не так. Должны быть очень быстрые системы реагирования, позволяющие рыбе делать это. Молодые рыбы отрабатывают методы стайного плавания парами, а затем в больших группах по мере созревания их методов и чувств. Поведение стайного плавания развивается инстинктивно и не передается от более взрослых рыб. Чтобы стайное плавание происходило так, как они это делают, рыбам требуются сенсорные системы, которые могут быстро реагировать на небольшие изменения в их положении относительно соседа. Большинство стай теряют способность к стайному плаванию с наступлением темноты и просто сбиваются в стаю. Это указывает на то, что зрение важно для стайного плавания. О важности зрения также свидетельствует поведение рыб, которые временно ослепли. У стайных видов глаза расположены по бокам головы, что означает, что они могут легко видеть своих соседей. Кроме того, стайные виды часто имеют «стайные метки» на плечах или основании хвоста, или визуально заметные полосы, которые обеспечивают ориентиры при стайном образе жизни, [57] аналогичные по своей функции пассивным маркерам в искусственном захвате движения. Однако рыбы без этих маркеров все равно будут участвовать в стайном поведении, [58] хотя, возможно, не так эффективно. [ необходима цитата ]
Также используются и другие чувства. Феромоны или звук также могут играть свою роль, но подтверждающих доказательств пока не найдено. Боковая линия — это линия, проходящая вдоль каждой стороны рыбы от жаберных крышек до основания хвоста. В лабораторных экспериментах боковые линии стайных рыб удалялись. Они подплывали ближе, что привело к теории о том, что боковые линии обеспечивают дополнительный стимул, когда рыба подходит слишком близко. [57] Система боковой линии очень чувствительна к изменениям течения воды и вибрации в воде. Она использует рецепторы, называемые невромастами , каждый из которых состоит из группы волосковых клеток. Волоски окружены выступающей желеобразной купулой , обычно длиной от 0,1 до 0,2 мм. Волосковые клетки в боковой линии похожи на волосковые клетки внутри внутреннего уха позвоночных, что указывает на то, что боковая линия и внутреннее ухо имеют общее происхождение. [4]
Трудно наблюдать и описывать трехмерную структуру реальных косяков рыб из-за большого количества вовлеченных рыб. Методы включают использование последних достижений в акустике рыболовства . [59]
Параметры, определяющие косяк рыбы, включают в себя:
The observational approach is complemented by the mathematical modelling of schools. The most common mathematical models of schools instruct the individual animals to follow three rules:
An example of such a simulation is the boids program created by Craig Reynolds in 1986.[65] Another is the self-propelled particle model introduced by Vicsek et al. in 1995[66] Many current models use variations on these rules. For instance, many models implement these three rules through layered zones around each fish.
The shape of these zones will necessarily be affected by the sensory capabilities of the fish. Fish rely on both vision and on hydrodynamic signals relayed through its lateral line. Antarctic krill rely on vision and on hydrodynamic signals relayed through its antennae.
In a masters thesis published in 2008, Moshi Charnell produced schooling behaviour without using the alignment matching component of an individual's behaviour.[67] His model reduces the three basic rules to the following two rules:
In a paper published in 2009, researchers from Iceland recount their application of an interacting particle model to the capelin stock around Iceland, successfully predicting the spawning migration route for 2008.[68]
In order to gain insight into why animals evolve swarming behaviour, scientists have turned to evolutionary models that simulate populations of evolving animals. Typically these studies use a genetic algorithm to simulate evolution over many generations in the model. These studies have investigated a number of hypotheses explaining why animals evolve swarming behaviour, such as the selfish herd theory,[69][70][71][72] the predator confusion effect,[33][73] the dilution effect,[74][75] and the many eyes theory.[76]
In 2009, building on recent advances in acoustic imaging,[59][77] a group of MIT researchers observed for "the first time the formation and subsequent migration of a huge shoal of fish."[78] The results provide the first field confirmation of general theories about how large groups behave, from locust swarms to bird flocks.[79]
The researchers imaged spawning Atlantic herring off Georges Bank. They found that the fish come together from deeper water in the evening, shoaling in a disordered way. A chain reaction triggers when the population density reaches a critical value, like an audience wave travelling around a sport stadium. A rapid transition then occurs, and the fish become highly polarised and synchronized in the manner of schooling fish. After the transition, the schools start migrating, extending up to 40 kilometres (25 mi) across the ocean, to shallow parts of the bank. There they spawn during the night. In the morning, the fish school back to deeper water again and then disband. Small groups of leaders were also discovered that significantly influenced much larger groups.[79]
Fish schools are faced with decisions they must make if they are to remain together. For example, a decision might be which direction to swim when confronted by a predator, which areas to stop and forage, or when and where to migrate.[80]
Quorum sensing can function as a collective decision-making process in any decentralised system. A quorum response has been defined as "a steep increase in the probability of group members performing a given behaviour once a threshold minimum number of their group mates already performing that behaviour is exceeded".[81] A recent investigation showed that small groups of fish used consensus decision-making when deciding which fish model to follow. The fish did this by a simple quorum rule such that individuals watched the decisions of others before making their own decisions. This technique generally resulted in the 'correct' decision but occasionally cascaded into the 'incorrect' decision. In addition, as the group size increased, the fish made more accurate decisions in following the more attractive fish model.[82] Consensus decision-making, a form of collective intelligence, thus effectively uses information from multiple sources to generally reach the correct conclusion. Such behaviour has also been demonstrated in the shoaling behaviour of threespine sticklebacks.[81]
Other open questions of shoaling behaviour include identifying which individuals are responsible for the direction of shoal movement. In the case of migratory movement, most members of a shoal seem to know where they are going. Observations on the foraging behaviour of captive golden shiner (a kind of minnow) found they formed shoals which were led by a small number of experienced individuals who knew when and where food was available.[83] If all golden shiners in a shoal have similar knowledge of food availability, there are a few individuals that still emerge as natural leaders (being at the front more often) and behavioural tests suggest they are naturally bolder.[84] Smaller golden shiners appear more willing than larger ones to be near the front of the shoal, perhaps because they are hungrier.[85] Observations on the common roach have shown that food-deprived individuals tend to be at the front of a shoal, where they obtain more food[86][87] but where they may also be more vulnerable to ambush predators.[88] Individuals that are wary of predation tend to seek more central positions within shoals.[89]

Experimental studies of shoal preference are relatively easy to perform. An aquarium containing a choosing fish is sandwiched between two aquaria containing different shoals, and the choosing fish is assumed to spend more time next to the shoal it prefers. Studies of this kind have identified several factors important for shoal preference.[citation needed]
Fish generally prefer larger shoals.[90][91] This makes sense, as larger shoal usually provide better protection against predators. Indeed, the preference for larger shoals seems stronger when predators are nearby,[92][93] or in species that rely more on shoaling than body armour against predation.[94] Larger shoals may also find food faster, though that food would have to be shared amongst more individuals. Competition may mean that hungry individuals might prefer smaller shoals or exhibit a lesser preference for very large shoals, as shown in sticklebacks.[95][96]
Fish prefer to shoal with their own species. Sometimes, several species may become mingled in one shoal, but when a predator is presented to such shoals, the fish reorganize themselves so that each individual ends up being closer to members of its own species.[97]
Fish tend to prefer shoals made up of individuals that match their own size.[98][99][100] This makes sense as predators have an easier time catching individuals that stand out in a shoal. Some fish may even prefer shoals of another species if this means a better match in current body size.[101] As for shoal size however, hunger can affect the preference for similarly sized fish; large fish, for example, might prefer to associate with smaller ones because of the competitive advantage they will gain over these shoalmates. In golden shiner, large satiated fish prefer to associate with other large individuals, but hungry ones prefer smaller shoalmates.[102]
Fish prefer to shoal with individuals with which the choosing fish is already familiar. This has been demonstrated in guppies,[103][104] threespine stickleback,[105] banded killifish,[106] the surfperch Embiotoca jacksoni,[107] Mexican tetra,[108] and various minnows.[109][110] A study with the White Cloud Mountain minnow has also found that choosing fish prefer to shoal with individuals that have consumed the same diet as themselves.[111]
Sticklebacks and killifish have been shown to prefer shoals made up of healthy individuals over parasitized ones, on the basis of visual signs of parasitism and abnormal behaviour by the parasitized fish.[112][113][114][115] Zebrafish prefer shoals that consist of well-fed (greater stomach width) fish over food-deprived ones.[116]
Threespine stickleback prefer to join a shoal made up of bold individuals rather than shy ones.[117] Angelfish prefer shoals made up of subordinate rather than dominant individuals.[118] European minnow can discriminate between shoals composed of good versus poor competitors, even in the absence of obvious cues such as differences in aggressiveness, size, or feeding rate; they prefer to associate with the poor competitors.[119] All of this suggests a strategy to obtain food, as bolder individuals should be more likely to find food, while subordinates would offer less competition for the discovered food.[citation needed]
Fish prefer to join shoals that are actively feeding.[120][121] Golden shiner can also detect the anticipatory activity of shoals that expect to be fed soon, and preferentially join such shoals.[122] Zebrafish also choose shoals that are more active.[123]
The schooling behaviour of fish is exploited on an industrial scale by the commercial fishing industry. Huge purse seiner vessels use spotter planes to locate schooling fish, such as tuna, cod, mackerel and forage fish. They can capture huge schools by rapidly encircling them with purse seine nets with the help of fast auxiliary boats and sophisticated sonar, which can track the shape of the shoal.[citation needed]

Blacksmith fish live in loose shoals. They have a symbiotic relationship with the parasite eating senorita fish. When they encounter a shoal of senorita fish, they stop and form a tight ball and hang upside down (pictured), each fish waiting its turn to be cleaned. The senorita fish pick dead tissues and external parasites, like parasitic copecods and isocods, from the skin of other fishes.[citation needed]
Some shoals engage in mobbing behaviour. For example, bluegills form large nesting colonies and sometimes attack snapping turtles. This may function to advertise their presence, drive the predator from the area, or aid in cultural transmission of predator recognition.[124]
Piranha have a reputation as fearless fish that hunt in ferocious packs. However, recent research, which "started off with the premise that they school as a means of cooperative hunting", discovered that they were in fact rather fearful fish, like other fish, which schooled for protection from their predators, such as cormorants, caimans and dolphins. Piranhas are "basically like regular fish with large teeth".[125]
Humboldt squid are large carnivorous marine invertebrates that move in schools of up to 1,200 individuals. They swim at speeds of up to 24 kilometres per hour (15 mph or 13 kn) propelled by water ejected through a siphon and by two triangular fins. Their tentacles bear suckers lined with sharp teeth with which they grasp prey and drag it towards a large, sharp beak. During the day the Humboldt squid behave similar to mesopelagic fish, living at depths of 200 to 700 m (660 to 2,300 ft). Electronic tagging has shown that they also undergo diel vertical migrations which bring them closer to the surface from dusk to dawn.[126] They hunt near the surface at night, taking advantage of the dark to use their keen vision to feed on more plentiful prey. The squid feed primarily on small fish, crustaceans, cephalopods, and copepod, and hunt for their prey in a cooperative fashion, the first observation of such behaviour in invertebrates.[127] The Humboldt squid is also known to quickly devour larger prey when cooperatively hunting in groups. Humboldt squid are known for their speed in feasting on hooked fish, sharks, and squid, even from their own species and shoal,[128] and have been known to attack fishermen and divers.[129]