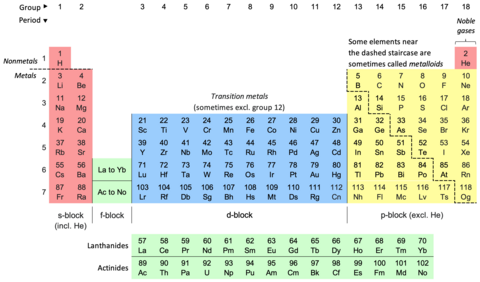
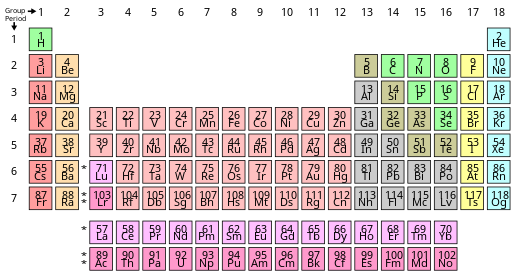
В периодической таблице , также известной как периодическая таблица элементов , химические элементы располагаются в ряды (« периоды ») и столбцы (« группы »). Это символ химии , широко используемый в физике и других науках. Это изображение периодического закона , который гласит, что, когда элементы расположены в порядке их атомных номеров, очевидна приблизительная повторяемость их свойств . Таблица разделена на четыре примерно прямоугольные области, называемые блоками . Элементы одной группы имеют тенденцию проявлять схожие химические характеристики.
Таблицу Менделеева характеризуют вертикальные, горизонтальные и диагональные тенденции . Металлический характер увеличивается при движении вниз по группе и уменьшается слева направо в течение периода. Неметаллический характер увеличивается от нижнего левого угла таблицы Менделеева к правому верхнему углу.
Первой периодической таблицей, ставшей общепринятой, была таблица русского химика Дмитрия Менделеева , составленная в 1869 году; он сформулировал периодический закон как зависимость химических свойств от атомной массы . Поскольку не все элементы тогда были известны, в его таблице Менделеева были пробелы, и Менделеев успешно использовал периодический закон, чтобы предсказать некоторые свойства некоторых недостающих элементов . Периодический закон был признан фундаментальным открытием в конце 19 века. Это было объяснено в начале 20-го века, когда были открыты атомные номера и связанные с ними новаторские работы в области квантовой механики. Обе идеи помогли пролить свет на внутреннюю структуру атома. Узнаваемая современная форма таблицы была достигнута в 1945 году, когда Гленн Т. Сиборг открыл, что актиниды на самом деле представляют собой элементы f-блока, а не d-блока. Таблица Менделеева и закон теперь являются центральной и неотъемлемой частью современной химии.
Таблица Менделеева продолжает развиваться вместе с прогрессом науки. В природе существуют только элементы с атомным номером до 94; [а] чтобы идти дальше, необходимо было синтезировать новые элементы в лаборатории. Сегодня, хотя известны все первые 118 элементов, что завершает первые семь строк таблицы, для самых тяжелых элементов по-прежнему необходима химическая характеристика, чтобы подтвердить, что их свойства соответствуют их положению. Пока неизвестно, насколько далеко таблица выйдет за пределы этих семи строк и продолжатся ли закономерности известной части таблицы в эту неизвестную область. Продолжаются также научные дискуссии относительно того, правильно ли расположены некоторые элементы в сегодняшней таблице. Существует множество альтернативных представлений периодического закона, и ведутся дискуссии о том, существует ли оптимальная форма таблицы Менделеева.
Каждый химический элемент имеет уникальный атомный номер ( Z ) , обозначающий количество протонов в его ядре . [3] Большинство элементов имеют несколько изотопов , варианты с одинаковым количеством протонов, но разным количеством нейтронов . Например, углерод имеет три встречающихся в природе изотопа: все его атомы имеют шесть протонов и большинство из них также имеют шесть нейтронов, но около одного процента имеют семь нейтронов, а очень небольшая часть имеет восемь нейтронов. Изотопы никогда не разделяются в периодической таблице; они всегда группируются под одним элементом. Когда указывается атомная масса, это обычно средневзвешенное значение природных изотопов; но если их нет, обычно указывается масса наиболее стабильного изотопа, часто в скобках. [4]
В стандартной периодической таблице элементы перечислены в порядке возрастания атомного номера Z. Новый ряд ( период ) начинается, когда в новой электронной оболочке появляется первый электрон. Столбцы ( группы ) определяются электронной конфигурацией атома; элементы с одинаковым количеством электронов в определенной подоболочке попадают в одни и те же столбцы (например, кислород , сера и селен находятся в одном столбце, потому что все они имеют четыре электрона во внешней p-подоболочке). Элементы со схожими химическими свойствами обычно попадают в одну и ту же группу периодической таблицы, хотя в f-блоке и, в некоторой степени, в d-блоке элементы одного и того же периода также имеют схожие свойства. Таким образом, относительно легко предсказать химические свойства элемента, если знать свойства окружающих его элементов. [5]
Первые 94 элемента встречаются в природе; [а] остальные 24, от америция до оганессона (95–118), встречаются только при синтезе в лабораториях. Из 94 встречающихся в природе элементов 83 являются первичными , а 11 встречаются только в цепочках распада первичных элементов. Некоторые из последних настолько редки, что не были обнаружены в природе, а были синтезированы в лаборатории до того, как было установлено, что они все-таки существуют в природе: технеций (элемент 43), прометий (элемент 61), астат (элемент 61). 85), нептуний (элемент 93) и плутоний (элемент 94). [6] Ни один элемент тяжелее эйнштейния (элемент 99) никогда не наблюдался в макроскопических количествах в чистом виде, равно как и астат; франций (элемент 87) был сфотографирован только в виде света, излучаемого микроскопическими количествами (300 000 атомов). [7]
Согласно международному соглашению об именах, группы нумеруются от 1 до 18 от крайнего левого столбца (щелочные металлы) до крайнего правого столбца (благородные газы). Группы f-блоков в этой нумерации игнорируются. [8] Группы также могут быть названы по их первому элементу, например, «группа скандия» для группы 3. [8] Ранее группы были известны римскими цифрами . В Америке за римскими цифрами следовала либо «А», если группа находилась в s- или p-блоке , либо «B», если группа находилась в d-блоке . Используемые римские цифры соответствуют последней цифре сегодняшнего соглашения об именах (например, элементы группы 4 относились к группе IVB, а элементы группы 14 - к группе IVA). В Европе буквы были аналогичными, за исключением того, что «А» использовалась для групп с 1 по 7, а «В» использовалась для групп с 11 по 17. Кроме того, группы 8, 9 и 10 раньше рассматривались как одна тройка. группа размера, известная в обоих обозначениях как группа VIII. В 1988 году была введена в действие новая система именования IUPAC (Международный союз теоретической и прикладной химии) (1–18), а старые названия групп (I–VIII) были признаны устаревшими. [9]
32 столбца
18 столбцов
Из соображений экономии места [16] [17] периодическая таблица обычно представлена с вырезанными элементами f-блока и расположенными как отдельная часть под основным корпусом. [18] [16] [9] Это уменьшает количество столбцов элементов с 32 до 18. [16]
Обе формы представляют одну и ту же периодическую таблицу. [19] Форму с f-блоком, включенным в основную часть, иногда называют 32-колоночной [19] или длинной формой; [20] форма с f-блоком вырезала 18-колонную [19] или среднедлинную форму. [20] Преимущество формы из 32 столбцов состоит в том, что все элементы отображаются в правильной последовательности, но у нее есть недостаток: требуется больше места. [21] Выбранная форма является выбором редакции и не предполагает каких-либо изменений научных утверждений или утверждений. Например, при обсуждении состава группы 3 варианты могут быть показаны одинаково (непредвзято) в обеих формах. [22]
В периодических таблицах обычно хотя бы показаны символы элементов; многие также предоставляют дополнительную информацию об элементах либо посредством цветового кодирования, либо в виде данных в ячейках. В приведенной выше таблице показаны названия и атомные номера элементов, а также их блоки, природные явления и стандартные атомные веса . Для короткоживущих элементов без стандартных атомных весов вместо этого используется массовое число наиболее стабильного известного изотопа. Другие таблицы могут включать такие свойства, как состояние вещества, температуры плавления и кипения, плотности, а также давать различные классификации элементов. [б]

Наименьшие составляющие всей нормальной материи известны как атомы . Атомы чрезвычайно малы: около одной десятимиллиардной метра в поперечнике; таким образом, их внутренняя структура регулируется квантовой механикой . [23] Атомы состоят из небольшого положительно заряженного ядра , состоящего из положительно заряженных протонов и незаряженных нейтронов , окруженного облаком отрицательно заряженных электронов ; заряды компенсируются, поэтому атомы нейтральны. [24] Электроны участвуют в химических реакциях , а ядро — нет. [24] Когда атомы участвуют в химических реакциях, они либо приобретают, либо теряют электроны, образуя положительно или отрицательно заряженные ионы ; или делиться электронами друг с другом. [18]
Атомы можно разделить на разные типы в зависимости от количества имеющихся в них протонов (а значит, и электронов). [24] Это называется атомным номером , часто обозначаемым Z [25] (от «Zahl» — по-немецки «число»). Таким образом, каждый отдельный атомный номер соответствует классу атомов: эти классы называются химическими элементами . [26] Химические элементы – это то, что систематизирует и классифицирует периодическая таблица. Водород — это элемент с атомным номером 1; гелий , атомный номер 2; литий , атомный номер 3; и так далее. Каждое из этих названий может быть дополнительно сокращено одно- или двухбуквенным химическим символом ; для водорода, гелия и лития — соответственно H, He и Li. [19] Нейтроны не влияют на химическую идентичность атома, но влияют на его вес. Атомы с одинаковым числом протонов, но разным числом нейтронов называются изотопами одного и того же химического элемента. [19] Природные элементы обычно встречаются в виде смесей различных изотопов; поскольку каждый изотоп обычно встречается в определенном количестве, встречающиеся в природе элементы имеют четко определенный атомный вес , определяемый как средняя масса встречающегося в природе атома этого элемента. [27]
Сегодня известно 118 элементов, первые 94 из которых, как известно, встречаются на Земле в природе в настоящее время. [28] [a] Из 94 природных элементов восемьдесят имеют стабильный изотоп и еще один ( висмут ) имеет почти стабильный изотоп (с периодом полураспада 2,01×10 19 лет, что более чем в миллиард раз превышает возраст вселенная ). [31] [c] Еще два, торий и уран , имеют изотопы, подвергающиеся радиоактивному распаду с периодом полураспада, сравнимым с возрастом Земли . Стабильные элементы плюс висмут, торий и уран составляют 83 первичных элемента, сохранившихся с момента формирования Земли. [d] Остальные одиннадцать природных элементов распадаются достаточно быстро, поэтому их дальнейшее присутствие в следах зависит главным образом от постоянной регенерации в качестве промежуточных продуктов распада тория и урана. [д] Все 24 известных искусственных элемента радиоактивны. [19]
Таблица Менделеева представляет собой графическое описание периодического закона, [37] который гласит, что свойства и атомные структуры химических элементов являются периодической функцией их атомного номера . [38] Элементы размещаются в таблице Менделеева в соответствии с их электронными конфигурациями , [39] периодическое повторение которых объясняет тенденции в свойствах по всей таблице Менделеева. [40]
Электрон можно рассматривать как населяющий атомную орбиталь , которая характеризует вероятность его нахождения в любой конкретной области вокруг атома. Их энергии квантованы , то есть они могут принимать только дискретные значения. Более того, электроны подчиняются принципу запрета Паули : разные электроны всегда должны находиться в разных состояниях. Это позволяет классифицировать возможные состояния, которые электрон может принимать на различных энергетических уровнях, известных как оболочки, разделенных на отдельные подоболочки, каждая из которых содержит одну или несколько орбиталей. Каждая орбиталь может содержать до двух электронов: они различаются величиной, известной как спин , условно обозначаемой «вверх» или «вниз». [41] [f] В холодном атоме (один в основном состоянии) электроны располагаются таким образом, что общая энергия, которую они имеют, минимизируется за счет занятия орбиталей с самой низкой энергией. [43] Только самые внешние электроны (так называемые валентные электроны ) обладают достаточной энергией, чтобы вырваться из ядра и участвовать в химических реакциях с другими атомами. Остальные называются остовными электронами . [44]
Известны элементы, у которых занято до семи первых оболочек. Первая оболочка содержит только одну орбиталь — сферическую s-орбиталь. Как и в первой оболочке, она называется 1s-орбиталью. Он может удерживать до двух электронов. Вторая оболочка также содержит 2s-орбиталь, а также три 2p-орбитали в форме гантели и, таким образом, может заполнить до восьми электронов (2×1 + 2×3 = 8). Третья оболочка содержит одну 3s-орбиталь, три 3p-орбитали и пять 3d-орбиталей и, таким образом, имеет емкость 2×1 + 2×3 + 2×5 = 18. Четвертая оболочка содержит одну 4s-орбиталь, три 4p-орбитали, пять 4d-орбитали и семь 4f-орбиталей, что приводит к емкости 2×1 + 2×3 + 2×5 + 2×7 = 32. [16] Высшие оболочки содержат больше типов орбиталей, которые продолжают шаблон, но такие типы орбиталей не заполнены в основных состояниях известных элементов. [46] Типы подоболочек характеризуются квантовыми числами . Четыре числа полностью описывают орбиталь в атоме: главное квантовое число n , азимутальное квантовое число ℓ (тип орбитали), магнитное квантовое число m ℓ и спиновое квантовое число s . [40]

Последовательность заполнения подоболочек в большинстве случаев задается принципом Ауфбау , также известным как правило Маделунга или Клечковского (в честь Эрвина Маделунга и Всеволода Клечковского соответственно). Это правило впервые эмпирически наблюдал Маделунг, а Клечковский и более поздние авторы дали ему теоретическое обоснование. [47] [48] [49] [50] Оболочки перекрываются по энергиям, а правило Маделунга определяет последовательность заполнения согласно: [48]
Здесь знак ≪ означает «намного меньше чем», в отличие от знака <, означающего просто «меньше чем». [48] Другими словами, электроны выходят на орбитали в порядке возрастания n + ℓ, и если доступны две орбитали с одинаковым значением n + ℓ, первой занимает та, у которой n меньше. [46] [50] В общем, орбитали с одинаковым значением n + ℓ схожи по энергии, но в случае s-орбиталей (с ℓ = 0) квантовые эффекты повышают их энергию, чтобы приблизиться к энергии следующей n + ℓ группа. Следовательно, таблица Менделеева обычно рисуется так, чтобы каждая строка (часто называемая периодом) начиналась с заполнения новой s-орбитали, которая соответствует началу новой оболочки. [48] [49] [16] Таким образом, за исключением первой строки, каждая длина периода появляется дважды: [48]
Перекрытия становятся довольно близкими в той точке, где d-орбитали входят в картину [51] , и порядок может немного меняться в зависимости от атомного номера [52] и атомного заряда. [53] [г]
Начиная с простейшего атома, это позволяет нам строить периодическую таблицу по одному в порядке атомного номера, рассматривая случаи отдельных атомов. В водороде есть только один электрон, который должен перейти на орбиталь с самой низкой энергией 1s. Эта электронная конфигурация записывается 1s 1 , где верхний индекс указывает количество электронов в подоболочке. Гелий добавляет второй электрон, который также переходит в 1s, полностью заполняя первую оболочку и давая конфигурацию 1s 2 . [40] [59] [ч]
Начиная с третьего элемента, лития , первая оболочка заполнена, поэтому его третий электрон занимает 2s-орбиталь, что дает конфигурацию 1s 2 2s 1 . Электрон 2s — единственный валентный электрон лития, поскольку подоболочка 1s теперь слишком прочно связана с ядром, чтобы участвовать в химической связи с другими атомами. Таким образом, заполненная первая оболочка для этого и всех более тяжелых элементов называется « оболочкой ядра ». Подоболочку 2s завершает следующий элемент бериллий (1s 2 2s 2 ). Затем следующие элементы приступают к заполнению подоболочки 2p. Бор (1s 2 2s 2 2p 1 ) помещает свой новый электрон на 2p-орбиталь; углерод (1s 2 2s 2 2p 2 ) заполняет вторую 2p-орбиталь; а с азотом (1s 2 2s 2 2p 3 ) все три 2p-орбитали становятся по отдельности занятыми. Это согласуется с правилом Хунда , которое гласит, что атомы обычно предпочитают по отдельности занять каждую орбиталь одного и того же типа, прежде чем заполнить их вторым электроном. Кислород (1s 2 2s 2 2p 4 ), фтор (1s 2 2s 2 2p 5 ) и неон (1s 2 2s 2 2p 6 ) затем завершают уже однократно заполненные 2p-орбитали; последний из них полностью заполняет вторую оболочку. [40] [59]
Начиная с элемента 11, натрия , вторая оболочка является полной, что делает вторую оболочку основной оболочкой для этого и всех более тяжелых элементов. Одиннадцатый электрон начинает заполнение третьей оболочки, занимая 3s-орбиталь, давая для натрия конфигурацию 1s 2 2s 2 2p 6 3s 1 . Эта конфигурация сокращенно обозначается [Ne] 3s 1 , где [Ne] представляет собой конфигурацию неона. Магний ([Ne] 3s 2 ) завершает эту 3s-орбиталь, а следующие шесть элементов: алюминий , кремний , фосфор , сера , хлор и аргон заполняют три 3p-орбитали (от [Ne] 3s 2 3p 1 до [Ne] 3s 2 3p. 6 ). [40] [59] Это создает аналогичную серию, в которой структуры внешней оболочки от натрия до аргона аналогичны структурам от лития до неона, и является основой периодичности химических свойств, которую иллюстрирует таблица Менделеева: [40] при регулярные, но меняющиеся интервалы атомных номеров, свойства химических элементов примерно повторяют. [37]
Таким образом, первые восемнадцать элементов можно расположить как начало периодической таблицы. Элементы в одном столбце имеют одинаковое количество валентных электронов и аналогичную конфигурацию валентных электронов: эти столбцы называются группами. Единственным исключением является гелий, который имеет два валентных электрона, как бериллий и магний, но обычно его помещают в столбец неона и аргона, чтобы подчеркнуть, что его внешняя оболочка заполнена. (Некоторые современные авторы подвергают сомнению даже это единственное исключение, предпочитая последовательно следовать валентным конфигурациям и помещать гелий над бериллием.) В этом фрагменте таблицы Менделеева восемь столбцов, соответствующих не более восьми электронам внешней оболочки. [18] Период начинается, когда начинает заполняться новая оболочка. [16] Наконец, раскраска иллюстрирует блоки : элементы в s-блоке (красный цвет) заполняют s-орбитали, а элементы в p-блоке (желтый цвет) заполняют p-орбитали. [16]
Начиная со следующего ряда, для калия и кальция подоболочка 4s имеет наименьшую энергию, и поэтому они ее заполняют. [40] [59] Калий добавляет один электрон к 4s-оболочке ([Ar] 4s 1 ), а кальций затем дополняет его ([Ar] 4s 2 ). Однако, начиная со скандия ([Ar] 3d 1 4s 2 ), подоболочка 3d становится следующей по энергии. Подоболочки 4s и 3d имеют примерно одинаковую энергию и конкурируют за заполнение электронов, поэтому заполнение 3d-орбиталей по одной за раз не совсем последовательно. Точный энергетический порядок 3d и 4s меняется вдоль ряда, а также меняется в зависимости от того, сколько электронов удалено из атома. Например, из-за отталкивания между 3d-электронами и 4s-электронами у хрома энергетический уровень 4s становится несколько выше, чем 3d, и поэтому становится выгоднее иметь конфигурацию [Ar] 3d 5 4s 1 , чем [Ar] 3д 4 4с 2 один. Аналогичная аномалия наблюдается и у меди . [40] Это нарушение правила Маделунга. Такие аномалии, однако, не имеют никакого химического значения: [53] большая часть химии не связана с изолированными газообразными атомами, [61] и различные конфигурации настолько близки по энергии друг к другу [51] , что присутствие соседнего атома может сместить баланс. [40] Поэтому таблица Менделеева их игнорирует и рассматривает только идеализированные конфигурации. [39]
У цинка ([Ar] 3d 10 4s 2 ) 3d-орбитали полностью заполнены десятью электронами. [40] [59] Далее идут 4p-орбитали, завершающие ряд, которые постепенно заполняются галлием ([Ar] 3d 10 4s 2 4p 1 ) через криптон ([Ar] 3d 10 4s 2 4p 6 ), таким образом аналогично предыдущим элементам p-блока. [40] [59] Начиная с галлия, 3d-орбитали составляют часть электронного ядра и больше не участвуют в химии. [58] Элементы s- и p-блока, которые заполняют их внешние оболочки, называются элементами основной группы ; элементы d-блока (окрашены синим цветом ниже), которые заполняют внутреннюю оболочку, называются переходными элементами (или переходными металлами, поскольку все они являются металлами). [62]
Следующие восемнадцать элементов заполняют орбитали 5s ( рубидий и стронций ), затем 4d ( от иттрия через кадмий , опять же с несколькими аномалиями по пути), а затем 5p ( от индия через ксенон ). [16] [59] Опять же, начиная с индия, 4d-орбитали находятся в ядре. [59] [63] Следовательно, пятая строка имеет ту же структуру, что и четвертая. [16]
Шестая строка таблицы также начинается с двух элементов s-блока: цезия и бария . [59] После этого начинают появляться первые элементы f-блока (зеленые ниже), начиная с лантана . Их иногда называют внутренними переходными элементами. [62] Поскольку теперь существуют не только 4f, но также 5d и 6s подоболочки с одинаковыми энергиями, конкуренция снова возникает со многими нерегулярными конфигурациями; [51] это привело к спору о том, где именно должен начинаться f-блок, но большинство изучающих этот вопрос сходятся во мнении, что в соответствии с принципом Ауфбау он начинается в лантане. [13] Несмотря на то, что лантан сам по себе не заполняет подоболочку 4f как отдельный атом, из-за отталкивания между электронами, [53] его 4f-орбитали имеют достаточно низкую энергию, чтобы участвовать в химических процессах. [64] [54] [65] У иттербия семь 4f-орбиталей полностью заполнены четырнадцатью электронами; после этого следует серия из десяти переходных элементов ( от лютеция до ртути ), [59] [66] [67] [68] и, наконец, шесть элементов основной группы ( от таллия до радона ) завершают период. [59] [69] Начиная с лютеция, 4f-орбитали находятся в ядре, [59] [65] и начиная с таллия, так же находятся 5d-орбитали. [59] [58] [70]
Седьмой ряд аналогичен шестому ряду: заполняется 7s ( франций и радий ), затем 5f ( актиний в нобелий ), затем 6d ( лауренсий в коперниций ) и, наконец, 7p ( нихоний в оганессон ). [59] Начиная с лоуренсия, 5f-орбитали находятся в ядре, [59] и, вероятно, 6d-орбитали присоединяются к ядру, начиная с нихония. [59] [71] [i] Опять же, на этом пути есть несколько аномалий: [16] например, поскольку отдельные атомы ни актиний, ни торий на самом деле не заполняют подоболочку 5f, а лоуренсий не заполняет оболочку 6d, но все эти подоболочки все еще могут заполняться в химической среде. [73] [74] [75] Очень долгое время седьмой ряд был неполным, так как большинство его элементов не встречаются в природе. Недостающие элементы, помимо урана, начали синтезировать в лаборатории в 1940 году, когда был получен нептуний. [76] Ряд завершился синтезом теннессина в 2010 г. [77] (последний элемент оганессон уже был получен в 2002 г.), [78] а последние элементы в этом седьмом ряду получили названия в 2016 г. [79]
Это завершает современную таблицу Менделеева, все семь рядов которой заполнены до отказа. [79]
В следующей таблице показана электронная конфигурация нейтрального атома газовой фазы каждого элемента. В разных химических средах могут быть предпочтительны разные конфигурации. [53] Элементы основной группы имеют полностью регулярные электронные конфигурации; переходный и внутренний переходные элементы имеют двадцать неровностей из-за упомянутой выше конкуренции между близкими по уровню энергии подоболочками. Для последних десяти элементов (109–118) экспериментальные данные отсутствуют [80] , поэтому вместо них показаны расчетные конфигурации. [81] Полностью заполненные подоболочки выделены серым цветом.
Хотя современная таблица Менделеева сегодня является стандартной, размещение элементов периода 1, водорода и гелия, остается открытым вопросом, обсуждаемым, и можно найти некоторые вариации. [58] [82] В соответствии с их соответствующими электронными конфигурациями s 1 и s 2 водород будет помещен в группу 1, а гелий будет помещен в группу 2. [58] Расположение водорода в группе 1 является обычным, но гелий почти всегда помещается в группу 18 вместе с другими благородными газами. [19] Дебаты ведутся вокруг противоречивого понимания того, в какой степени химические или электронные свойства должны определять размещение в таблице Менделеева. [82]
Как и металлы группы 1, водород имеет один электрон во внешней оболочке [83] и обычно теряет свой единственный электрон в химических реакциях. [84] Водород обладает некоторыми металлоподобными химическими свойствами и способен вытеснять некоторые металлы из их солей . [84] Но при стандартных условиях он образует двухатомный неметаллический газ, в отличие от щелочных металлов, которые являются химически активными твердыми металлами. Это, а также образование гидридов водородом , в которых он приобретает электрон, приближает его по свойствам к галогенам , которые делают то же самое [84] (хотя водород реже образует H −, чем H + ). [85] Более того, два самых легких галогена ( фтор и хлор ) при стандартных условиях являются газообразными, как водород. [84] Некоторые свойства водорода не подходят ни для одной из групп: водород не является ни сильным окислителем, ни сильным восстановителем и не вступает в реакцию с водой. [85] Таким образом, водород имеет свойства, соответствующие свойствам как щелочных металлов, так и галогенов, но не соответствует ни одной из групп идеально, и поэтому его трудно определить по химическому составу. [84] Таким образом, хотя электронное размещение водорода в группе 1 преобладает, некоторые более редкие схемы показывают либо водород в группе 17, [86] дублируют водород в обеих группах 1 и 17, [87] [88] или плавают отдельно от всех группы. [88] [89] [58] Тем не менее, этот последний вариант подвергся критике со стороны химика и философа науки Эрика Шерри на том основании, что он, по-видимому, подразумевает, что водород вообще находится над периодическим законом, в отличие от всех других элементов. [90]
Гелий — единственный элемент, который обычно занимает в таблице Менделеева положение, не соответствующее его электронной структуре. На внешней оболочке у него два электрона, тогда как у других благородных газов их восемь; и это элемент s-блока, тогда как все остальные благородные газы являются элементами p-блока. Однако он инертен в стандартных условиях и имеет полную внешнюю оболочку: эти свойства аналогичны свойствам благородных газов группы 18, но совсем не свойственны химически активным щелочноземельным металлам группы 2. По этим причинам гелий почти всегда относят к группе 18 [19] , которому лучше всего соответствуют его свойства; [58] предложение о переводе гелия в группу 2 было отклонено ИЮПАК в 1988 г. по этим причинам. [9] Тем не менее, гелий до сих пор иногда относят к группе 2, [91] и некоторые из его физических и химических свойств ближе к элементам группы 2 и поддерживают электронное расположение. [83] [58] Твердый гелий кристаллизуется в гексагональную плотноупакованную структуру, которая соответствует бериллию и магнию в группе 2, но не другим благородным газам в группе 18. [92] Последние теоретические разработки в области химии благородных газов, в которых гелий Ожидается, что он будет проявлять немного меньшую инертность, чем неон, и образовывать (HeO)(LiF) 2 со структурой, аналогичной аналогичному соединению бериллия (но без ожидаемого аналога неона), что привело к тому, что все больше химиков выступают за отнесение гелия к группе 2. Это относится к электронному аргументу, поскольку причиной большей инертности неона является отталкивание от его заполненной p-оболочки, которой нет у гелия, хотя на самом деле маловероятно, что гелийсодержащие молекулы будут стабильны вне экстремально низких температур (около 10 К) . ). [93] [94] [95] [96]
Аномалия первого ряда в таблице Менделеева также была указана в пользу перехода гелия в группу 2. Она возникает из-за того, что первая орбиталь любого типа необычно мала, поскольку, в отличие от своих более высоких аналогов, она не испытывает межэлектронного отталкивания от меньшей орбитали. того же типа. Это делает первый ряд элементов в каждом блоке необычно маленьким, и такие элементы имеют тенденцию демонстрировать характерные для своей группы виды аномалий. Некоторые химики, выступающие за изменение положения гелия, отмечают, что гелий проявляет эти аномалии, если его поместить в группу 2, но не в том случае, если его поместить в группу 18: с другой стороны, неон, который был бы первым элементом группы 18, если бы он был помещен в группу 18. гелий, удаленный из этого места, действительно демонстрирует эти аномалии. [93] Затем утверждается, что отношения между гелием и бериллием напоминают отношения между водородом и литием, и это положение гораздо более общепринято. [94] Например, из-за такой тенденции в размерах орбиталей в группах 1 и 13–17 наблюдается большая разница в атомных радиусах между первыми и вторыми членами каждой основной группы: она существует между неоном и аргоном, а между гелием и бериллием, но не между гелием и неоном. Это аналогичным образом влияет на температуру кипения и растворимость благородных газов в воде, где гелий слишком близок к неону, а большая разница, характерная для первых двух элементов группы, проявляется только между неоном и аргоном. Перемещение гелия в группу 2 делает эту тенденцию последовательной и в группах 2 и 18, делая гелий элементом первой группы 2, а неон - элементом первой группы 18: оба проявляют характерные свойства кайносимметричного первого элемента группы. [97] [98] Тем не менее размещение гелия в 18-й группе остается почти универсальным из-за его чрезвычайной инертности. [99] Кроме того, редко можно встретить таблицы, в которых водород и гелий находятся вне всех групп. [89] [58] [59]
Во многих таблицах Менделеева f-блок сдвинут на один элемент вправо, так что лантан и актиний становятся элементами d-блока в группе 3, а Ce-Lu и Th-Lr образуют f-блок. Таким образом, d-блок разделен на две очень неровные части. Это пережиток ранних ошибочных измерений электронных конфигураций; современные измерения более согласуются с формой с лютецием и лоуренсием в группе 3, а также с La–Yb и Ac–No в качестве f-блока. [11] [100]
Оболочка 4f полностью заполнена иттербием, и по этой причине Лев Ландау и Евгений Лифшиц в 1948 году посчитали неправильным относить лютеций к элементу f-блока. [12] Они еще не предприняли шаг по удалению лантана из d-блока, но в 1963 году Дзюн Кондо понял, что низкотемпературная сверхпроводимость лантана подразумевает активность его 4f-оболочки. [101] В 1965 году Дэвид К. Гамильтон связал это наблюдение с его положением в таблице Менделеева и утверждал, что f-блок должен состоять из элементов La–Yb и Ac–No. [64] С тех пор физические, химические и электронные доказательства подтвердили это назначение. [11] [9] [100] Этот вопрос был привлечен к широкому вниманию Уильямом Б. Дженсеном в 1982 году, [11] и отнесение лютеция и лоуренция к группе 3 было поддержано отчетами ИЮПАК, датируемыми 1988 годом (когда 1– Было рекомендовано 18 номеров групп) [9] и 2021 год. [10] Тем не менее, вариация все еще существует, поскольку большинство авторов учебников не знают об этой проблеме. [11]
Иногда можно встретить третью форму, в которой места ниже иттрия в группе 3 остаются пустыми, как, например, в таблице, размещенной на веб-сайте IUPAC [19] , но это создает несоответствие с квантовой механикой, поскольку f-блок состоит из 15 элементов. шириной (La–Lu и Ac–Lr), хотя в f-подоболочке могут поместиться только 14 электронов. [10] Более того, в литературе существует некоторая путаница относительно того, какие элементы тогда подразумеваются в группе 3. [10] [20] [102] [103] [104] Хотя в отчете IUPAC 2021 года отмечается, что f-блоки поддерживаются некоторыми практиками специализированной отрасли релятивистской квантовой механики, специализирующейся на свойствах сверхтяжелых элементов . По мнению проекта, такие зависящие от интересов проблемы не должны иметь никакого отношения к тому, как периодическая таблица представляется «общему химическое и научное сообщество». [10] Фактически, релятивистские квантово-механические расчеты соединений Lu и Lr не обнаружили валентных f-орбиталей ни в одном элементе. [75] Другие авторы, сосредоточившие внимание на сверхтяжелых элементах, с тех пор пояснили, что «15-я запись f-блока представляет собой первый слот d-блока, который остается свободным, чтобы указать место вставок f-блока», что означало бы, что в этой форме все еще есть лютеций и лоуренсий (15-е рассматриваемые записи) в качестве элементов d-блока в группе 3. [105] Действительно, когда публикации IUPAC расширяют таблицу до 32 столбцов, они проясняют это и помещают лютеций и лоуренсий под иттрием в группа 3. [106] [107]
В литературе можно встретить несколько аргументов в пользу Sc-Y-La-Ac, [108] [109] , но они были оспорены как логически противоречивые. [13] [14] [15] Например, утверждалось, что лантан и актиний не могут быть элементами f-блока, потому что, как отдельные атомы газовой фазы, они еще не начали заполнять f-подоболочки. [110] Но то же самое верно и в отношении тория, который никогда не оспаривается как элемент f-блока, [10] [11] и этот аргумент упускает из виду проблему с другой стороны: что f-оболочки полностью заполняют иттербий и нобелий, соответствующий форме Sc-Y-Lu-Lr, а не лютецию и лоуренция, как это было бы в форме Sc-Y-La-Ac. [111] Мало того, что таких исключительных конфигураций меньшинство, [111] они также в любом случае никогда не рассматривались как имеющие отношение к позиционированию каких-либо других элементов в таблице Менделеева: в газообразных атомах d-оболочки завершают свое заполнение при медь, палладий и золото, но химики повсеместно признают, что эти конфигурации являются исключительными и что d-блок действительно заканчивается в соответствии с правилом Маделунга на цинке, кадмии и ртути. [20] Важным фактом для размещения [39] [66] является то, что лантан и актиний (как и торий) имеют валентные f-орбитали, которые могут быть заняты в химической среде, тогда как лютеций и лоуренсий этого не делают: [59] [112] их f-оболочки находятся в ядре и не могут использоваться для химических реакций. [65] [113] Таким образом, связь между иттрием и лантаном является лишь вторичной связью между элементами с одинаковым количеством валентных электронов, но разными типами валентных орбиталей, например, между хромом и ураном; тогда как связь между иттрием и лютецием является первичной, поскольку они имеют общее как количество валентных электронов, так и тип валентной орбитали. [59]
Поскольку в химических реакциях участвуют валентные электроны, можно ожидать, что [18] элементы со схожими внешними электронными конфигурациями будут реагировать аналогичным образом и образовывать соединения с одинаковыми пропорциями элементов в них. [114] Такие элементы помещаются в одну и ту же группу, и поэтому при движении вниз по группе, как правило, наблюдаются явные сходства и тенденции в химическом поведении. [115] Поскольку аналогичные конфигурации возникают через равные промежутки времени, свойства элементов таким образом демонстрируют периодическую повторяемость, отсюда и название таблицы Менделеева и периодического закона. Эти периодические повторения были замечены задолго до того, как была разработана основная теория, объясняющая их. [116] [117]
Исторически физический размер атомов был неизвестен до начала 20 века. Первая расчетная оценка атомного радиуса водорода была опубликована физиком Артуром Хаасом в 1910 году с точностью до порядка (в 10 раз) принятого значения - радиуса Бора (~ 0,529 Å). В своей модели Хаас использовал одноэлектронную конфигурацию, основанную на классической атомной модели, предложенной Дж. Дж. Томсоном в 1904 году, часто называемой моделью сливового пудинга . [118]
Атомные радиусы (размеры атомов) зависят от размеров их крайних орбиталей. [97] Они обычно уменьшаются при движении слева направо вдоль элементов главной группы, потому что заряд ядра увеличивается, но внешние электроны все еще остаются в той же оболочке. Однако при движении вниз по столбцу радиусы обычно увеличиваются, поскольку самые внешние электроны находятся в более высоких оболочках, которые, следовательно, находятся дальше от ядра. [18] [119] Первый ряд каждого блока аномально мал из-за эффекта, называемого кайносимметрией или примогенным отталкиванием: [120] подоболочки 1s, 2p, 3d и 4f не имеют внутренних аналогов. Например, 2p-орбитали не испытывают сильного отталкивания от 1s- и 2s-орбиталей, которые имеют совершенно разные угловые распределения заряда и, следовательно, не очень велики; но 3p-орбитали испытывают сильное отталкивание от 2p-орбиталей, которые имеют аналогичное распределение углового заряда. Таким образом, более высокие s-, p-, d- и f-подоболочки испытывают сильное отталкивание от своих внутренних аналогов, которые имеют примерно такое же угловое распределение заряда, и должны расширяться, чтобы избежать этого. Это приводит к возникновению существенных различий между небольшими 2p-элементами, которые предпочитают множественные связи , и более крупными 3p-элементами и более высокими p-элементами, которые этого не делают. [97] Аналогичные аномалии возникают для элементов 1s, 2p, 3d, 4f и гипотетического 5g: [121] степень этой аномалии первого ряда наибольшая для s-блока, умеренная для p-блока и менее выражен для d- и f-блоков. [122]
У переходных элементов внутренняя оболочка заполняется, но размер атома по-прежнему определяется внешними электронами. Увеличение заряда ядра в серии и увеличение количества внутренних электронов для экранирования несколько компенсируют друг друга, поэтому уменьшение радиуса меньше. [119] Атомы 4p и 5d, возникающие сразу после появления новых типов переходных рядов, меньше, чем можно было бы ожидать, [123] поскольку добавленные основные подоболочки 3d и 4f обеспечивают лишь неполную защиту ядерного заряда для атомов 4p и 5d. внешние электроны. Следовательно, например, атомы галлия немного меньше атомов алюминия. [97] Вместе с кайносимметрией это приводит к четно-нечетной разнице между периодами (за исключением s-блока) [j] , которую иногда называют вторичной периодичностью: элементы в четных периодах имеют меньшие атомные радиусы и предпочитают терять меньшее количество атомов. электроны, тогда как элементы в нечетных периодах (кроме первого) различаются в противоположном направлении. Так, например, многие свойства в p-блоке демонстрируют зигзагообразную, а не плавную тенденцию вдоль группы. Например, фосфор и сурьма в нечетные периоды 15-й группы легко достигают степени окисления +5, тогда как азот, мышьяк и висмут в четные периоды предпочитают оставаться при +3. [122] [124] Аналогичная ситуация наблюдается и для d-блока: лютеций за счет атомов вольфрама немного меньше, чем иттрий за счет атомов молибдена соответственно. [125] [126]

Атомы таллия и свинца примерно такого же размера, как атомы индия и олова соответственно, но от висмута до радона атомы 6p больше, чем аналогичные атомы 5p. Это происходит потому, что когда атомные ядра становятся сильно заряженными, возникает необходимость в специальной теории относительности , чтобы оценить влияние ядра на электронное облако. Эти релятивистские эффекты приводят к тому, что тяжелые элементы все чаще имеют свойства, отличающиеся от их более легких гомологов в таблице Менделеева. Спин-орбитальное взаимодействие расщепляет p-подоболочку: одна p-орбиталь релятивистски стабилизируется и сжимается (она заполняется таллием и свинцом), а две другие (заполняются висмутом через радон) релятивистски дестабилизируются и расширяются. [97] Релятивистские эффекты также объясняют, почему золото является золотым, а ртуть — жидкостью при комнатной температуре. [127] [128] Ожидается, что они станут очень сильными в конце седьмого периода, что потенциально может привести к коллапсу периодичности. [129] Электронные конфигурации четко известны только до элемента 108 ( хассий ), а экспериментальная химия за пределами 108 проводилась только для 112 ( коперниций ), 113 ( нихоний ) и 114 ( флеровий ), поэтому химическая характеристика самых тяжелых элементов остается темой текущих исследований. [130]
Тенденция уменьшения атомных радиусов слева направо также присутствует в ионных радиусах , хотя ее сложнее исследовать, поскольку наиболее распространенные ионы последовательных элементов обычно различаются по заряду. Ионы с той же электронной конфигурацией уменьшаются в размерах по мере увеличения их атомного номера из-за увеличения притяжения со стороны более положительно заряженного ядра: так, например, ионные радиусы уменьшаются в ряду Se 2− , Br − , Rb + , Sr 2+ , Y 3+ , Zr 4+ , Nb 5+ , Mo 6+ , Tc 7+ . Ионы одного и того же элемента становятся меньше по мере удаления большего количества электронов, потому что притяжение ядра начинает перевешивать отталкивание между электронами, что приводит к расширению электронных облаков: так, например, ионные радиусы уменьшаются в ряду V 2+ , V 3+ , В 4+ , В 5+ . [131]

Первая энергия ионизации атома — это энергия, необходимая для отрыва от него электрона. Это зависит от радиуса атома: энергия ионизации увеличивается слева направо и вниз вверх, поскольку электроны, находящиеся ближе к ядру, удерживаются крепче и их труднее удалить. Таким образом, энергия ионизации минимизируется в первом элементе каждого периода – водороде и щелочных металлах – и затем обычно возрастает, пока не достигнет благородного газа на правом краю периода. [18] Есть некоторые исключения из этой тенденции, например кислород, где удаляемый электрон спарен, и, таким образом, межэлектронное отталкивание облегчает удаление, чем ожидалось. [132]
В переходной серии внешние электроны преимущественно теряются, хотя внутренние орбитали заполняются. Например, в 3d-серии первыми теряются 4s-электроны, хотя 3d-орбитали заполняются. Экранирующий эффект добавления дополнительного 3d-электрона примерно компенсирует рост заряда ядра, и поэтому энергии ионизации остаются в основном постоянными, хотя наблюдается небольшое увеличение, особенно в конце каждой серии переходов. [133]
Поскольку атомы металлов имеют тенденцию терять электроны в химических реакциях, энергия ионизации обычно коррелирует с химической реакционной способностью, хотя есть и другие факторы. [133]
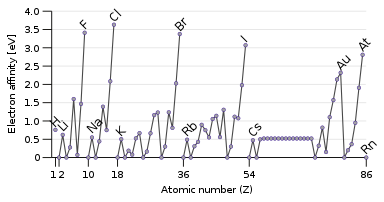
Свойством, противоположным энергии ионизации, является сродство к электрону , которое представляет собой энергию, выделяющуюся при присоединении электрона к атому. [134] Пролетающий электрон будет легче притягиваться к атому, если он сильнее чувствует притяжение ядра, и особенно если имеется доступная частично заполненная внешняя орбиталь, которая может вместить его. Следовательно, сродство к электрону имеет тенденцию увеличиваться сверху вниз и слева направо. Исключение составляет последний столбец — благородные газы, имеющие полную оболочку и не имеющие места для другого электрона. Это дает галогенам в предпоследнем столбце самое высокое сродство к электрону. [18]
Некоторые атомы, например благородные газы, не имеют сродства к электрону: они не могут образовывать стабильные анионы в газовой фазе. [135] Благородные газы, имеющие высокие энергии ионизации и не имеющие сродства к электрону, мало склонны к приобретению или потере электронов и, как правило, нереакционноспособны. [18]
Встречаются некоторые исключения из этих тенденций: кислород и фтор имеют более низкое сродство к электрону, чем их более тяжелые гомологи, сера и хлор, поскольку они представляют собой маленькие атомы, и, следовательно, вновь добавленный электрон будет испытывать значительное отталкивание от уже имеющихся. Для неметаллических элементов сродство к электрону также в некоторой степени коррелирует с реакционной способностью, но не идеально, поскольку здесь задействованы и другие факторы. Например, фтор имеет более низкое сродство к электрону, чем хлор (из-за сильного межэлектронного отталкивания очень маленького атома фтора), но более реакционноспособен. [134]
Валентность элемента можно определить либо как число атомов водорода, которые могут объединиться с ним с образованием простого бинарного гидрида, либо как удвоенное количество атомов кислорода, которые могут объединиться с ним с образованием простого бинарного оксида (т. е . не пероксид и не супероксид ). [111] Валентность элементов основной группы напрямую связана с номером группы: гидриды в основных группах 1–2 и 13–17 подчиняются формулам MH, MH 2 , MH 3 , MH 4 , MH 3 , MH 2 и, наконец, МХ. Вместо этого высшие оксиды увеличивают валентность по формулам M 2 O, MO, M 2 O 3 , MO 2 , M 2 O 5 , MO 3 , M 2 O 7 . [k] Сегодня понятие валентности было расширено понятием степени окисления , которая представляет собой формальный заряд, остающийся на элементе, когда все другие элементы в соединении удалены в виде своих ионов. [114]
Электронная конфигурация предполагает готовое объяснение количества электронов, доступных для связи; [114] действительно, количество валентных электронов начинается с 1 в группе 1, а затем увеличивается к правой части таблицы Менделеева, сбрасываясь на 3 только каждый раз, когда начинается каждый новый блок. Таким образом, в период 6 Cs–Ba имеет 1–2 валентных электрона; У La–Yb 3–16; Lu–Hg — 3–12; а у Tl–Rn – 3–8. [113] Однако ближе к правой стороне d- и f-блоков теоретический максимум, соответствующий использованию всех валентных электронов, вообще не достижим; [136] такая же ситуация наблюдается с кислородом, фтором и легкими благородными газами вплоть до криптона. [137]
Полное объяснение требует рассмотрения энергии, которая будет высвобождена при образовании соединений с различной валентностью, а не просто рассмотрения только электронных конфигураций. [138] Например, магний при растворении в воде образует Mg 2+ , а не катионы Mg + , поскольку последний будет самопроизвольно диспропорционироваться на катионы Mg 0 и Mg 2+ . Это связано с тем, что энтальпия гидратации (окружения катиона молекулами воды) увеличивается по величине с увеличением заряда и радиуса иона. В Mg + самая внешняя орбиталь (определяющая ионный радиус) по-прежнему равна 3s, поэтому энтальпия гидратации мала и недостаточна для компенсации энергии, необходимой для удаления электрона; но повторная ионизация до Mg 2+ раскрывает подоболочку ядра 2p, делая энтальпию гидратации достаточно большой, чтобы позволить образоваться соединениям магния (II). По тем же причинам общие состояния окисления более тяжелых элементов p-блока (где ns-электроны имеют меньшую энергию, чем np) имеют тенденцию меняться с шагом 2, потому что это необходимо для раскрытия внутренней подоболочки и уменьшения ионного радиуса. (например, Tl + открывает 6s, а Tl3 + открывает 5d, поэтому, как только таллий теряет два электрона, он имеет тенденцию терять и третий). Аналогичные аргументы, основанные на орбитальной гибридизации, можно использовать для менее электроотрицательных элементов p-блока. [139] [л]
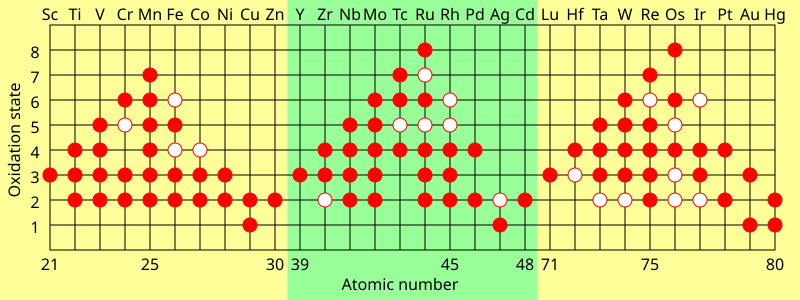
Для переходных металлов обычные степени окисления почти всегда составляют не менее +2 по тем же причинам (открытие следующей подоболочки); это справедливо даже для металлов с аномальной конфигурацией d x+1 s 1 или d x+2 s 0 (кроме серебра ), поскольку отталкивание между d-электронами означает перемещение второго электрона из s- в d- подоболочка существенно не меняет свою энергию ионизации. [141] Поскольку дальнейшая ионизация переходных металлов не открывает никаких новых внутренних подоболочек, вместо этого их степени окисления имеют тенденцию меняться с шагом 1. [139] Лантаниды и поздние актиниды обычно демонстрируют стабильную степень окисления +3, удаляя внешние s-электроны, а затем (обычно) один электрон с (n-2)f-орбиталей, которые по энергии аналогичны ns. [142] Общие и максимальные степени окисления элементов d- и f-блока обычно зависят от энергии ионизации. Поскольку разница в энергии между (n-1)d и ns-орбиталями увеличивается вдоль каждой серии переходов, ионизация дальнейших электронов становится менее энергетически выгодной. Таким образом, группы ранних переходных металлов имеют тенденцию отдавать предпочтение более высоким степеням окисления, но степень окисления +2 становится более стабильной для групп поздних переходных металлов. Таким образом, высшая формальная степень окисления увеличивается от +3 в начале каждой строки d-блока до +7 или +8 в середине (например, OsO 4 ), а затем снижается до +2 в конце. [141] Лантаниды и поздние актиниды обычно имеют высокую энергию четвертой ионизации и, следовательно, редко превышают степень окисления +3, тогда как ранние актиноиды имеют низкую энергию четвертой ионизации, и поэтому, например, нептуний и плутоний могут достигать +7. [111] [141] [142] Самые последние актиниды идут дальше, чем лантаноиды, в сторону низких степеней окисления: менделевий легче восстанавливается до состояния +2, чем тулий или даже европий, а нобелий явно отдает предпочтение +2, а не +3, в в отличие от иттербия. [55]
Поскольку элементы одной группы имеют одинаковые валентные конфигурации, они обычно демонстрируют схожее химическое поведение. Например, все щелочные металлы первой группы имеют один валентный электрон и образуют очень однородный класс элементов: все они мягкие и химически активные металлы. Однако здесь задействовано множество факторов, и группы часто могут быть довольно разнородными. Например, водород также имеет один валентный электрон и принадлежит к той же группе, что и щелочные металлы, но его химическое поведение совершенно иное. К стабильным элементам 14-й группы относятся неметалл ( углерод ), два полупроводника ( кремний и германий ) и два металла ( олово и свинец ); тем не менее, они объединены наличием четырех валентных электронов. [143] Это часто приводит к сходству максимальных и минимальных степеней окисления (например, сера и селен в группе 16 имеют максимальную степень окисления +6, как в SO 3 и SeO 3 , и минимальную степень окисления -2, как в сульфидах и селенидах ). ); но не всегда (например, неизвестно, что кислород образует степень окисления +6, несмотря на то, что он находится в той же группе, что и сера и селен). [59]

Еще одним важным свойством элементов является их электроотрицательность . Атомы могут образовывать ковалентные связи друг с другом, разделяя электроны парами, создавая перекрытие валентных орбиталей. Степень, в которой каждый атом притягивает общую электронную пару, зависит от электроотрицательности атома [144] – склонности атома к приобретению или потере электронов. [18] Более электроотрицательный атом будет иметь тенденцию притягивать электронную пару больше, а менее электроотрицательный (или более электроположительный) будет притягивать ее меньше. В крайних случаях электрон можно считать полностью перешедшим от более электроположительного атома к более электроотрицательному, хотя это упрощение. Тогда связь связывает два иона: один положительный (отдавший электрон) и один отрицательный (принявший его), и называется ионной связью . [18]
Электроотрицательность зависит от того, насколько сильно ядро может притягивать пару электронов, поэтому она демонстрирует вариацию, аналогичную другим уже обсуждавшимся свойствам: электроотрицательность имеет тенденцию падать сверху вниз и повышаться слева направо. Щелочные и щелочноземельные металлы относятся к наиболее электроположительным элементам, а халькогены, галогены и благородные газы — к наиболее электроотрицательным. [144]
Электроотрицательность обычно измеряется по шкале Полинга, по которой наиболее электроотрицательному реакционноспособному атому ( фтору ) присвоена электроотрицательность 4,0, а наименее электроотрицательному атому ( цезию ) присвоена электроотрицательность 0,79. [18] На самом деле неон является наиболее электроотрицательным элементом, но шкала Полинга не может измерить его электроотрицательность, поскольку он не образует ковалентных связей с большинством элементов. [145]
Электроотрицательность элемента зависит от характера и количества атомов, с которыми он связан, а также от того, сколько электронов он уже потерял: атом становится более электроотрицательным, когда он потерял больше электронов. [144] Иногда это имеет большое значение: свинец в степени окисления +2 имеет электроотрицательность 1,87 по шкале Полинга, тогда как свинец в степени окисления +4 имеет электроотрицательность 2,33. [146]

Простое вещество – это вещество, образованное из атомов одного химического элемента. Простые вещества с более электроотрицательными атомами имеют тенденцию делиться электронами (образовать ковалентные связи) друг с другом. Они образуют либо маленькие молекулы (например, водород или кислород, атомы которых связаны парами), либо гигантские структуры, простирающиеся до бесконечности (например, углерод или кремний). Благородные газы просто остаются отдельными атомами, поскольку у них уже есть полная оболочка. [18] Вещества, состоящие из отдельных молекул или отдельных атомов, удерживаются вместе более слабыми силами притяжения между молекулами, такими как дисперсионная сила Лондона : когда электроны движутся внутри молекул, они создают мгновенный дисбаланс электрического заряда, который вызывает аналогичные дисбалансы в соседних молекулах. молекулы и создают синхронизированные движения электронов между многими соседними молекулами. [148]

Однако более электроположительные атомы имеют тенденцию вместо этого терять электроны, создавая «море» электронов, поглощающее катионы. [18] Внешние орбитали одного атома перекрываются, разделяя электроны со всеми его соседями, создавая гигантскую структуру молекулярных орбиталей, охватывающую все атомы. [149] Это отрицательно заряженное «море» притягивает все ионы и удерживает их вместе в металлической связи . Элементы, образующие такие связи, часто называют металлами ; те, которые этого не делают, часто называют неметаллами . [18] Некоторые элементы могут образовывать несколько простых веществ с разной структурой: их называют аллотропами . Например, алмаз и графит — две аллотропы углерода. [143] [м]
Металличность элемента можно предсказать по электронным свойствам. Когда атомные орбитали перекрываются во время металлической или ковалентной связи, они создают как связывающие, так и разрыхляющие молекулярные орбитали одинаковой емкости, причем разрыхляющие орбитали имеют более высокую энергию. Чистый характер связи возникает, когда на связывающих орбиталях больше электронов, чем на разрыхляющих. Таким образом, металлическая связь возможна, когда количество электронов, делокализованных каждым атомом, менее чем в два раза превышает количество орбиталей, способствующих перекрытию. Так обстоит дело с элементами групп с 1 по 13; у них также слишком мало валентных электронов, чтобы образовывать гигантские ковалентные структуры, в которых все атомы занимают эквивалентные положения, и поэтому почти все они металлизуются. Исключением являются водород и бор, которые имеют слишком высокую энергию ионизации. Таким образом, водород образует ковалентную молекулу H 2 , а бор образует гигантскую ковалентную структуру на основе икосаэдрических кластеров B 12 . В металле связывающая и разрыхляющая орбитали имеют перекрывающиеся энергии, создавая единую зону, через которую электроны могут свободно проходить, обеспечивая электрическую проводимость. [151]
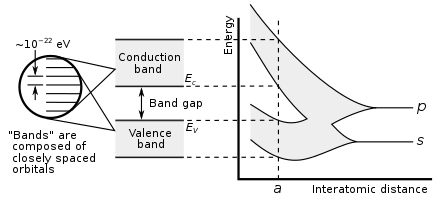
В группе 14 становится возможной как металлическая, так и ковалентная связь. В кристалле алмаза ковалентные связи между атомами углерода прочные, поскольку они имеют небольшой атомный радиус и, следовательно, ядро сильнее удерживает электроны. Следовательно, образующиеся в результате связывающие орбитали имеют гораздо меньшую энергию, чем разрыхляющие орбитали, и перекрытия нет, поэтому электропроводность становится невозможной: углерод является неметаллом. Однако ковалентная связь становится слабее для более крупных атомов, и энергетическая щель между связывающими и разрыхляющими орбиталями уменьшается. Следовательно, кремний и германий имеют меньшую запрещенную зону и в условиях окружающей среды являются полупроводниками : электроны могут пересекать запрещенную зону при термическом возбуждении. (Бор также является полупроводником в условиях окружающей среды.) В олове исчезает запрещенная зона, так что олово и свинец становятся металлами. [151] При повышении температуры все неметаллы приобретают некоторые полупроводниковые свойства, в большей или меньшей степени в зависимости от размера запрещенной зоны. Таким образом, металлы и неметаллы можно отличить по температурной зависимости их электропроводности: проводимость металла снижается с повышением температуры (поскольку тепловое движение затрудняет свободное движение электронов), тогда как проводимость неметаллов возрастает (поскольку может быть больше электронов). с нетерпением жду возможности преодолеть пропасть). [152]
Элементы в группах с 15 по 17 имеют слишком много электронов, чтобы образовывать гигантские ковалентные молекулы, растягивающиеся во всех трех измерениях. Для более легких элементов связи в небольших двухатомных молекулах настолько сильны, что конденсированная фаза нежелательна: так, азот (N 2 ), кислород (О 2 ), белый фосфор и желтый мышьяк (P 4 и As 4 ), сера и красный селен (S 8 и Se 8 ) и стабильные галогены (F 2 , Cl 2 , Br 2 и I 2 ) легко образуют ковалентные молекулы с небольшим количеством атомов. Более тяжелые имеют тенденцию образовывать длинные цепочки (например, красный фосфор, серый селен, теллур) или слоистые структуры (например, углерод в виде графита, черный фосфор, серый мышьяк, сурьма, висмут), которые простираются только в одном или двух измерениях, а не в трех измерениях. Оба типа структур можно обнаружить в виде аллотропов фосфора, мышьяка и селена, хотя аллотропы с длинной цепью более стабильны во всех трех. Поскольку эти структуры не используют все свои орбитали для связывания, в конечном итоге у них появляются связывающие, несвязывающие и разрыхляющие полосы в порядке возрастания энергии. Как и в группе 14, у более тяжелых элементов ширина запрещенной зоны сокращается и становится возможным свободное перемещение электронов между цепочками или слоями. Так, например, черный фосфор, черный мышьяк, серый селен, теллур и йод являются полупроводниками; серый мышьяк, сурьма и висмут — полуметаллы (обладают квазиметаллической проводимостью, с очень небольшим перекрытием зон); а полоний и, вероятно, астат — настоящие металлы. [151] Наконец, все элементы естественной группы 18 остаются отдельными атомами. [151] [н]
Разделительная линия между металлами и неметаллами проходит примерно по диагонали сверху слева вниз справа, при этом серия переходов появляется слева от этой диагонали (поскольку у них есть много доступных орбиталей для перекрытия). Это ожидаемо, поскольку металличность имеет тенденцию коррелировать с электроположительностью и готовностью терять электроны, которая увеличивается справа налево и вверх-вниз. Таким образом, количество металлов значительно превышает количество неметаллов. Элементы вблизи границы трудно классифицировать: они, как правило, обладают свойствами, промежуточными между свойствами металлов и неметаллов, и могут иметь некоторые свойства, характерные для обоих. Их часто называют полуметаллами или металлоидами . [18] Термин «полуметалл», используемый в этом смысле, не следует путать с его строгим физическим смыслом, связанным с зонной структурой: висмут физически является полуметаллом, но химики обычно считают его металлом. [154]
В следующей таблице рассмотрены наиболее стабильные аллотропы в стандартных условиях. Элементы, окрашенные в желтый цвет, образуют простые вещества, для которых хорошо характерны металлические связи. Элементы, окрашенные в голубой цвет, образуют гигантские сетевые ковалентные структуры, тогда как элементы, окрашенные в темно-синий цвет, образуют небольшие ковалентно связанные молекулы, которые удерживаются вместе более слабыми силами Ван-дер-Ваальса . Благородные газы окрашены в фиолетовый цвет: их молекулы состоят из одиночных атомов и ковалентной связи не возникает. Затененные серым цветом ячейки предназначены для элементов, которые не были получены в достаточных количествах для того, чтобы их наиболее стабильные аллотропы можно было охарактеризовать таким образом. Теоретические соображения и современные экспериментальные данные позволяют предположить, что все эти элементы металлизировались бы, если бы могли образовывать конденсированные фазы, [151] за исключением, возможно, оганессона. [155] [о]
МеталликКовалентная сетьМолекулярный ковалентныйОдиночные атомыНеизвестныйЦвет фона показывает связь простых веществ в таблице Менделеева. Если их несколько, считается наиболее стабильный аллотроп.
Обычно металлы блестящие и плотные. [18] Они обычно имеют высокие температуры плавления и кипения из-за прочности металлической связи и часто являются податливыми и пластичными (легко растягиваются и формируются), поскольку атомы могут перемещаться относительно друг друга, не разрывая металлическую связь. [165] Они проводят электричество, поскольку их электроны могут свободно перемещаться во всех трех измерениях. Точно так же они проводят тепло, которое передается электронами в виде дополнительной кинетической энергии : они движутся быстрее. Эти свойства сохраняются и в жидком состоянии, так как хотя кристаллическая структура и разрушается при плавлении, атомы все равно соприкасаются и металлическая связь сохраняется, хотя и ослаблена. [165] Металлы имеют тенденцию быть реактивными по отношению к неметаллам. [18] Из этих обобщений можно найти некоторые исключения: например, бериллий, хром, [85] марганец, [166] сурьма, [167] висмут, [168] и уран хрупкие (перечень не исчерпывающий); [85] хром чрезвычайно тверд; [169] галлий, рубидий, цезий и ртуть являются жидкими при комнатной температуре или близкой к ней; [p] и благородные металлы , такие как золото, химически очень инертны. [170] [171]
Неметаллы проявляют разные свойства. Те, что образуют гигантские ковалентные кристаллы, имеют высокие температуры плавления и кипения, поскольку для преодоления прочных ковалентных связей требуется значительная энергия. Те, что образуют дискретные молекулы, удерживаются вместе главным образом за счет дисперсионных сил, которые легче преодолеть; таким образом, они, как правило, имеют более низкие температуры плавления и кипения, [172] и многие из них представляют собой жидкости или газы при комнатной температуре. [18] Неметаллы часто выглядят тусклыми. Они имеют тенденцию быть реактивными по отношению к металлам, за исключением благородных газов, которые инертны по отношению к большинству веществ. [18] В твердом состоянии они хрупкие, поскольку их атомы прочно удерживаются на месте. Они менее плотны и плохо проводят электричество [18] , поскольку в них нет подвижных электронов. [173] Вблизи границы запрещенная зона мала, и поэтому многие элементы в этой области являются полупроводниками, такими как кремний, германий [173] и теллур. [151] Селен имеет как полупроводниковый серый аллотроп, так и изолирующий красный аллотроп; мышьяк имеет металлический серый аллотроп, полупроводниковый черный аллотроп и изолирующий желтый аллотроп (хотя последний нестабилен в условиях окружающей среды). [152] Опять же, есть исключения; например, алмаз имеет самую высокую теплопроводность из всех известных материалов, больше, чем любой металл. [174]
Принято обозначать класс металлоидов, лежащий на границе между металлами и неметаллами, поскольку элементы в этой области являются промежуточными как по физическим, так и по химическим свойствам. [18] Однако в литературе не существует единого мнения относительно того, какие именно элементы следует так обозначать. Когда используется такая категория, почти всегда включаются кремний, германий, мышьяк и теллур, а также обычно бор и сурьма; но большинство источников включают также и другие элементы без согласия относительно того, какие дополнительные элементы следует добавить, а некоторые вместо этого вычитают из этого списка. [q] Например, в отличие от всех других элементов, которые обычно считаются металлоидами или неметаллами, единственная стабильная форма сурьмы имеет металлическую проводимость. Более того, по своему физическому и химическому поведению этот элемент напоминает висмут и, в более общем плане, другие металлы p-блока. На этом основании некоторые авторы утверждают, что его лучше классифицировать как металл, чем как металлоид. [85] [179] [152] С другой стороны, селен обладает некоторыми полупроводниковыми свойствами в своей наиболее стабильной форме (хотя у него также есть изолирующие аллотропы), и утверждалось, что его следует считать металлоидом [179] – хотя это ситуация справедлива и для фосфора [152] , который является гораздо более редким включением среди металлоидов. [д]
В периодической таблице Менделеева существуют и другие отношения между элементами, не входящими в одну и ту же группу, например, диагональные отношения между элементами, соседними по диагонали (например, литием и магнием). [122] Некоторые сходства также можно обнаружить между основными группами и группами переходных металлов или между ранними актинидами и ранними переходными металлами, когда элементы имеют одинаковое количество валентных электронов. Таким образом, уран чем-то напоминает хром и вольфрам из шестой группы [122] , поскольку все три имеют шесть валентных электронов. [180] Отношения между элементами с одинаковым количеством валентных электронов, но разными типами валентных орбиталей называются вторичными или изодонорными отношениями: они обычно имеют одинаковые максимальные степени окисления, но не одинаковые минимальные степени окисления. Например, и хлор, и марганец имеют максимальную степень окисления +7 (например, Cl 2 O 7 и Mn 2 O 7 ), но их соответствующие минимальные степени окисления составляют -1 (например, HCl ) и -3 (K 2 [Mn( СО) 4 ]). Элементы с одинаковым количеством валентных вакансий, но разным количеством валентных электронов связаны третичными или изоакцепторными отношениями: они обычно имеют схожие минимальные, но не максимальные степени окисления. Например, водород и хлор имеют минимальную степень окисления -1 (в гидридах и хлоридах ), но максимальная степень окисления водорода равна +1 (например, H 2 O ), а у хлора - +7. [59]
Многие другие физические свойства элементов демонстрируют периодические изменения в соответствии с периодическим законом, например, температуры плавления , температуры кипения , теплоты плавления , теплоты испарения , энергия атомизации и так далее. Подобные периодические изменения возникают и у соединений элементов, которые можно наблюдать, сравнивая гидриды, оксиды, сульфиды, галогениды и т. д. [144] Химические свойства труднее описать количественно, но они также имеют свою периодичность. Примеры включают изменение кислотных и основных свойств элементов и их соединений, стабильность соединений и методы выделения элементов. [114] Периодичность использовалась и использовалась очень широко для предсказания свойств неизвестных новых элементов и новых соединений, и она занимает центральное место в современной химии. [181]
В литературе использовалось множество терминов для описания наборов элементов, которые ведут себя одинаково. Названия групп щелочной металл , щелочноземельный металл , триэль , тетрел , пниктоген , халькоген , галоген и благородный газ признаны ИЮПАК; другие группы могут обозначаться по их номеру или по их первому элементу (например, группа 6 представляет собой группу хрома). [8] [182] Некоторые разделяют элементы p-блока из групп с 13 по 16 по металличности, [177] [175] , хотя не существует ни определения IUPAC, ни точного консенсуса относительно того, какие именно элементы следует считать металлами, неметаллами или полуметаллы (иногда называемые металлоидами). [177] [175] [8] Также нет единого мнения о том, как следует называть металлы, пришедшие на смену переходным металлам, при этом среди использованных возможностей были постпереходные металлы и плохие металлы . [r] Некоторые передовые монографии исключают элементы группы 12 из числа переходных металлов на основании их иногда совершенно разных химических свойств, но это не универсальная практика [183] , и ИЮПАК в настоящее время не упоминает ее как допустимую в своих Принципах Химическая номенклатура . [184]
Лантаноидами считаются элементы La-Lu, которые очень похожи друг на друга: исторически они включали только Ce-Lu, но лантан стал широко использоваться . [8] Редкоземельные элементы (или редкоземельные металлы) добавляют к лантанидам скандий и иттрий. [8] Аналогично, актиниды считаются элементами Ac–Lr (исторически Th–Lr), [8] хотя вариация свойств в этом наборе гораздо больше, чем внутри лантаноидов. [53] ИЮПАК рекомендует называть лантаноиды и актиноиды во избежание двусмысленности, поскольку суффикс -ide обычно обозначает отрицательный ион; однако лантаноиды и актиниды остаются обычным явлением. [8] С ростом признания лютеция и лоуренсия элементами d-блока некоторые авторы начали определять лантаноиды как La-Yb, а актиниды как Ac-No, что соответствует f-блоку. [58] [11] [185] [ 186] [187] [188] Трансактиниды или сверхтяжелые элементы — это короткоживущие элементы, не считая актинидов, начиная с лоуренция или резерфордия (в зависимости от того, где заканчиваются актиниды). [188] [189] [190] [191] [192]
Существует гораздо больше категорий, которые используются в соответствии с определенными дисциплинами. В астрофизике металл определяется как любой элемент с атомным номером больше 2, то есть все, кроме водорода и гелия. [193] Термин «полуметалл» имеет другое определение в физике, чем в химии: висмут является полуметаллом по физическим определениям, но химики обычно считают его металлом. [194] Некоторые термины широко используются, но без какого-либо формального определения, например, « хэви-метал », которому был дан такой широкий спектр определений, что его критиковали как «фактически бессмысленный». [195]
Объем терминов значительно различается у разных авторов. Например, согласно ИЮПАК, к благородным газам можно отнести всю группу, включая очень радиоактивный сверхтяжелый элемент оганессон. [196] Однако среди специалистов по сверхтяжелым элементам это делается нечасто: в этом случае под «благородным газом» обычно подразумевают нереактивное поведение более легких элементов группы. Поскольку расчеты обычно предсказывают, что оганессон не должен быть особенно инертен из-за релятивистских эффектов и даже не может быть газом при комнатной температуре, если его можно будет производить в больших количествах, его статус как благородного газа часто подвергается сомнению в этом контексте. [197] Кроме того, иногда встречаются национальные различия: в Японии щелочноземельные металлы часто не включают бериллий и магний, поскольку их поведение отличается от более тяжелых металлов 2 группы. [198]

В 1817 году немецкий физик Иоганн Вольфганг Дёберейнер начал формулировать одну из первых попыток классификации элементов. [199] В 1829 году он обнаружил, что может объединять некоторые элементы в группы по три, причем члены каждой группы имеют родственные свойства. Он назвал эти группы триадами . [200] [201] Хлор, бром и йод образовали триаду; как и кальций, стронций и барий; литий, натрий и калий; и сера, селен и теллур. Сегодня все эти триады составляют часть современных групп. [202] Различные химики продолжали его работу и смогли выявить все больше связей между небольшими группами элементов. Однако они не смогли построить одну схему, охватывающую их всех. [203]

Джон Ньюлендс опубликовал в журнале Chemical News в феврале 1863 года письмо о периодичности химических элементов. [204] В 1864 году Ньюлендс опубликовал в «Chemical News» статью, показывающую, что если элементы расположены в порядке их атомного веса, то элементы, имеющие последовательные номера, часто либо принадлежат к одной и той же группе, либо занимают сходные положения в разных группах, и он указал Выяснилось, что каждый восьмой элемент, начиная с данного, является в этой аранжировке своего рода повторением первого, подобно восьмой ноте октавы в музыке (Закон Октав). [204] Однако формулировка Ньюлендса хорошо работала только для элементов основной группы и столкнулась с серьезными проблемами с остальными. [59]
Немецкий химик Лотар Мейер заметил последовательности схожих химических и физических свойств, повторяющиеся через определенные промежутки времени. По его мнению, если бы атомные веса были отложены по ординатам (т.е. по вертикали), а атомные объемы по абсциссам (т.е. по горизонтали) (кривая получила серию максимумов и минимумов), то наиболее электроположительные элементы появились бы на вершинах кривой в порядок их атомных весов. В 1864 году вышла его книга; он содержал раннюю версию таблицы Менделеева, содержащую 28 элементов, и классифицировал элементы на шесть семейств по их валентности - впервые элементы были сгруппированы по их валентности. Работы по организации элементов по атомному весу до сих пор блокировались из-за неточных измерений атомных весов. [205] В 1868 году он переработал свою таблицу, но эта редакция была опубликована как черновик только после его смерти. [206]

Окончательный прорыв совершил русский химик Дмитрий Менделеев . Хотя другие химики (включая Мейера) примерно в то же время открыли некоторые другие версии периодической системы, Менделеев был самым преданным делу разработки и защиты своей системы, и именно его система больше всего повлияла на научное сообщество. [207] 17 февраля 1869 года (1 марта 1869 года по григорианскому календарю) Менделеев начал упорядочивать элементы и сравнивать их по атомному весу. Он начал с нескольких элементов, и в течение дня его система росла, пока не охватила большинство известных элементов. После того как он нашел непротиворечивое расположение, его печатная таблица появилась в мае 1869 г. в журнале Русского химического общества. [208] Когда элементы, казалось, не вписывались в систему, он смело предсказывал, что либо валентности, либо атомные массы были измерены неправильно, или что недостающий элемент еще предстоит обнаружить. [59] В 1871 году Менделеев опубликовал длинную статью, включающую обновленную форму своей таблицы, в которой были явны его предсказания для неизвестных элементов. Менделеев подробно предсказал свойства трех из этих неизвестных элементов: поскольку в них отсутствовали более тяжелые гомологи бора, алюминия и кремния, он назвал их эка-бор, эка-алюминий и эка-кремний («эка» на санскрите означает «эка-бор», «эка-алюминий» и «эка-кремний»). "один"). [208] [209] : 45

В 1875 году французский химик Поль-Эмиль Лекок де Буабодран , работая, не зная о предсказании Менделеева, обнаружил новый элемент в образце минерала сфалерита и назвал его галлием. Он выделил элемент и начал определять его свойства. Менделеев, прочитав публикацию де Буабодрана, отправил письмо, в котором утверждал, что галлий — это предсказанный им эка-алюминий. Хотя Лекок де Буабодран поначалу был настроен скептически и подозревал, что Менделеев пытается присвоить себе свое открытие, позже он признал, что Менделеев был прав. [210] В 1879 году шведский химик Ларс Фредрик Нильсон открыл новый элемент, который назвал скандием: им оказался экабор. Эка-кремний был открыт в 1886 году немецким химиком Клеменсом Винклером , который назвал его германием. Свойства галлия, скандия и германия соответствовали предсказаниям Менделеева. [211] В 1889 году Менделеев отметил на лекции Фарадея в Королевском институте в Лондоне, что он не рассчитывал прожить достаточно долго, «чтобы упомянуть об их открытии Химическому обществу Великобритании как подтверждение точности и общности периодической теории». закон". [212] Даже открытие благородных газов в конце XIX века, которое Менделеев не предсказал, аккуратно вписалось в его схему в качестве восьмой основной группы. [213]
Тем не менее у Менделеева возникли некоторые проблемы с вписыванием известных лантаноидов в свою схему, поскольку они не демонстрировали периодического изменения валентности, как другие элементы. После долгих исследований чешский химик Богуслав Браунер в 1902 году предположил, что все лантаноиды можно объединить в одну группу в таблице Менделеева. Он назвал это «гипотезой астероидов» в качестве астрономической аналогии: точно так же, как между Марсом и Юпитером вместо одной планеты существует пояс астероидов , так и место под иттрием считалось занятым всеми лантанидами, а не только одним элементом. [20]

После того, как внутренняя структура атома была исследована, голландский физик-любитель Антониус ван ден Брук в 1913 году предположил, что заряд ядра определяет расположение элементов в таблице Менделеева. [214] [215] Новозеландский физик Эрнест Резерфорд придумал слово «атомный номер» для обозначения этого ядерного заряда. [216] В опубликованной статье Ван дер Брока он проиллюстрировал первую электронную периодическую таблицу, показывающую элементы, расположенные в соответствии с числом их электронов. [217] Резерфорд подтвердил в своей статье 1914 года, что Бор принял точку зрения ван дер Брока. [218]
.jpg/440px-Henry_Moseley_(1887-1915).jpg)
В том же году английский физик Генри Мозли с помощью рентгеновской спектроскопии экспериментально подтвердил предложение ван ден Брока. Мозли определил величину ядерного заряда каждого элемента от алюминия до золота и показал, что порядок Менделеева фактически размещает элементы в последовательном порядке по ядерному заряду. [219] Заряд ядра идентичен количеству протонов и определяет значение атомного номера ( Z ) каждого элемента. Использование атомного номера дает точную целочисленную последовательность элементов. Исследования Мозли сразу же разрешили несоответствия между атомным весом и химическими свойствами; это были такие случаи, как теллур и йод, где атомный номер увеличивается, но атомный вес уменьшается. [214] Хотя Мозли вскоре был убит в Первой мировой войне, шведский физик Манне Зигбан продолжил свои исследования до урана и установил, что это элемент с самым высоким из известных на тот момент атомным номером (92). [220] На основе исследований Мозли и Зигбана было также известно, какие атомные номера соответствуют недостающим элементам, которые еще предстоит найти. [214]
Датский физик Нильс Бор применил к атому идею Макса Планка о квантовании. Он пришел к выводу, что энергетические уровни электронов квантованы: разрешен только дискретный набор стабильных энергетических состояний. Затем Бор попытался понять периодичность через электронные конфигурации, предположив в 1913 году, что внутренние электроны должны отвечать за химические свойства элемента. [221] [222] В 1913 году он создал первую электронную таблицу Менделеева, основанную на квантовом атоме. [223]
Бор назвал свои электронные оболочки «кольцами» в 1913 году: во времена его планетарной модели атомные орбитали внутри оболочек не существовали. Бор объясняет в части 3 своей знаменитой статьи 1913 года, что максимальное количество электронов в оболочке равно восьми, написав: «Мы видим далее, что кольцо из n электронов не может вращаться в одном кольце вокруг ядра с зарядом ne, если только n < 8 ." Для меньших атомов электронные оболочки заполнялись бы следующим образом: «кольца электронов соединятся только в том случае, если они содержат равное число электронов; и что, соответственно, число электронов на внутренних кольцах будет только 2, 4, 8». Однако в более крупных атомах самая внутренняя оболочка будет содержать восемь электронов: «с другой стороны, периодическая система элементов убедительно предполагает, что уже в неоне N = 10 возникнет внутреннее кольцо из восьми электронов». Предложенные им электронные конфигурации атомов (показаны справа) по большей части не соответствуют известным сейчас. [224] [225]
Первым, кто систематически расширил и исправил химические потенциалы атомной теории Бора, был Вальтер Коссель в 1914 и 1916 годах. Коссель объяснил, что в периодической таблице новые элементы будут создаваться по мере добавления электронов к внешней оболочке. В статье Косселя он пишет: «Это приводит к выводу, что электроны, добавляемые далее, должны располагаться в концентрических кольцах или оболочках, на каждом из которых... только известное число электронов, а именно восемь в нашем случай — следует устроить.Как только одно кольцо или оболочка завершена, нужно начинать новое для следующего элемента; число электронов, которые наиболее легко доступны и лежат на самой внешней периферии, снова увеличивается от элемента к элементу и, следовательно, при образовании каждой новой оболочки химическая периодичность повторяется». [226] [227]
В статье 1919 года Ирвинг Ленгмюр постулировал существование «ячеек», которые мы теперь называем орбиталями, каждая из которых может содержать только два электрона, и они были расположены в «эквидистантных слоях», которые мы теперь называем оболочками. Он сделал исключение: первая оболочка содержала только два электрона. [228] Химик Чарльз Ругли Бери предположил в 1921 году, что восемь и восемнадцать электронов в оболочке образуют стабильные конфигурации. Бери предположил, что электронные конфигурации переходных элементов зависят от валентных электронов в их внешней оболочке. [229] Он ввел слово « переход» для описания элементов, теперь известных как переходные металлы или переходные элементы. [230]
По инициативе Бора Вольфганг Паули занялся проблемой электронных конфигураций в 1923 году. Паули расширил схему Бора, включив в нее четыре квантовых числа , и сформулировал свой принцип исключения , который гласил, что никакие два электрона не могут иметь одинаковые четыре квантовых числа. Это объяснило длину периодов в таблице Менделеева (2, 8, 18 и 32), которая соответствовала количеству электронов, которые могла занять каждая оболочка. [231] В 1925 году Фридрих Хунд пришел к конфигурациям, близким к современным. [232] В результате этих достижений периодичность стала основываться на количестве химически активных или валентных электронов, а не на валентностях элементов. [59] Принцип Ауфбау , описывающий электронные конфигурации элементов, был впервые эмпирически обнаружен Эрвином Маделунгом в 1926 году, [46] хотя первым, кто опубликовал его, был Владимир Карапетов в 1930 году . [233] [234] В 1961 году Всеволод Клечковский вывел первую часть правила Маделунга (что орбитали заполняются в порядке возрастания n + ℓ) из модели Томаса – Ферми ; [235] полное правило было получено на основе аналогичного потенциала в 1971 году Юрием Н. Демковым и Валентином Н. Островским. [236] [с]

Квантовая теория уточнила, что переходные металлы и лантаноиды образуют свои отдельные группы, переходные между основными группами, хотя некоторые химики и раньше предлагали таблицы, показывающие их таким образом: английский химик Генри Бассет сделал это в 1892 году, датский химик Юлиус Томсен в 1895 году и швейцарский химик Альфред Вернер в 1905 году. Бор использовал форму Томсена в своей Нобелевской лекции 1922 года; Форма Вернера очень похожа на современную форму из 32 столбцов. В частности, это вытеснило астероидную гипотезу Браунера. [20]
Точное положение лантаноидов и, следовательно, состав группы 3 оставалось спорным еще несколько десятилетий, поскольку их электронные конфигурации изначально были измерены неправильно. [11] [93] По химическим соображениям Бассетт, Вернер и Бери сгруппировали скандий и иттрий с лютецием, а не с лантаном (первые два оставили пустое пространство ниже иттрия, поскольку лютеций еще не был обнаружен). [20] [229] В 1927 году Хунд предположил, что все атомы лантаноидов имеют конфигурацию [Xe]4f 0−14 5d 1 6s 2 из-за их преобладающей трехвалентности. Теперь известно, что взаимосвязь между химией и электронной конфигурацией более сложна. [t] [55] Ранние спектроскопические данные, казалось, подтверждали эти конфигурации, и поэтому периодическая таблица была структурирована так, чтобы иметь группу 3, состоящую из скандия, иттрия, лантана и актиния, с четырнадцатью f-элементами, разбивающими d-блок между лантаном и актинием. гафний. [11] Но позже было обнаружено, что это верно только для четырех из пятнадцати лантаноидов (лантана, церия, гадолиния и лютеция), а остальные атомы лантаноидов не имеют d-электрона. В частности, иттербий завершает 4f-оболочку, и поэтому советские физики Лев Ландау и Евгений Лифшиц отметили в 1948 году, что лютеций правильно рассматривается как элемент d-блока, а не элемента f-блока; [12] о том, что массивный лантан является f-металлом, впервые предположил Джун Кондо в 1963 году на основании его низкотемпературной сверхпроводимости . [101] Это прояснило важность изучения низколежащих возбужденных состояний атомов, которые могут играть роль в химической среде при классификации элементов по блокам и расположении их на столе. [64] [66] [11] Многие авторы впоследствии заново открыли эту поправку, основываясь на физических, химических и электронных проблемах, и применили ее ко всем соответствующим элементам, в результате чего группа 3 содержит скандий, иттрий, лютеций и лоуренсий [64] [ 9] [93] и наличие лантана через иттербий и актиния через нобелий в качестве строк f-блока: [64] [9] эта исправленная версия обеспечивает согласованность с правилом Маделунга и подтверждает первоначальное химическое размещение Бассетта, Вернера и Бери. [20]
В 1988 году ИЮПАК выпустил отчет в поддержку такого состава группы 3, [9] это решение было подтверждено в 2021 году. [10] В учебниках до сих пор можно найти вариации состава группы 3, [22] и некоторые аргументы против этого. формат до сих пор публикуется, [13] , но химики и физики, которые рассматривали этот вопрос, в основном согласны с группой 3, содержащей скандий, иттрий, лютеций и лоуренсий, и оспаривают контраргументы как непоследовательные. [13]

К 1936 году пул недостающих элементов от водорода до урана сократился до четырех: элементы 43, 61, 85 и 87 остались отсутствующими. Элемент 43 в конечном итоге стал первым элементом, который был синтезирован искусственно посредством ядерных реакций, а не обнаружен в природе. Он был открыт в 1937 году итальянскими химиками Эмилио Сегре и Карло Перье , которые назвали свое открытие технецием , в честь греческого слова, означающего «искусственный». [237] Элементы 61 ( прометий ) и 85 ( астат ) также были получены искусственно в 1945 и 1940 годах соответственно; Элемент 87 ( франций ) стал последним элементом, открытым в природе французским химиком Маргаритой Перей в 1939 году . нептуний (путем бомбардировки урана нейтронами). [76] Гленн Т. Сиборг и его команда из Национальной лаборатории Лоуренса в Беркли (LBNL) продолжили открытие трансурановых элементов, начиная с плутония в 1941 году, и обнаружили, что вопреки прежним представлениям, элементы, начиная с актиния, были родственниками лантаноидов, а не переходные металлы. [239] Бассетт (1892), Вернер (1905) и французский инженер Шарль Жане (1928) ранее предлагали это, но их идеи тогда не получили всеобщего признания. [20] Сиборг поэтому назвал их актинидами. [239] Элементы до 101 (названные менделевием в честь Менделеева) были синтезированы до 1955 года либо посредством нейтронного или альфа-частичного облучения, либо в результате ядерных взрывов в случае 99 (эйнштейний) и 100 (фермий). [76]
Значительные разногласия возникли с элементами со 102 по 106 в 1960-х и 1970-х годах, когда возникла конкуренция между командой LBNL (ныне возглавляемой Альбертом Гиорсо ) и командой советских учёных Объединенного института ядерных исследований (ОИЯИ) под руководством Георгия Флёрова . Каждая команда заявляла об открытии, а в некоторых случаях каждая предлагала свое собственное имя для элемента, что вызвало споры об именах элементов , которые длились десятилетия. Эти элементы были получены путем бомбардировки актинидов легкими ионами. [240] ИЮПАК сначала придерживался подхода невмешательства, предпочитая подождать и посмотреть, будет ли достигнут консенсус. Но поскольку это был разгар Холодной войны , стало ясно, что этого не произойдет. Таким образом, ИЮПАК и Международный союз теоретической и прикладной физики (IUPAP) создали в 1985 году рабочую группу по трансфермию (TWG, фермий — элемент 100) для определения критериев открытия, [241] которые были опубликованы в 1991 году. [242] После некоторых дальнейших разногласий эти элементы получили свои окончательные названия в 1997 году, включая сиборгий (106) в честь Сиборга. [243]

Критерии TWG использовались для разрешения более поздних претензий об открытии элементов от LBNL и ОИЯИ, а также от исследовательских институтов в Германии ( GSI ) и Японии ( Riken ). [244] В настоящее время рассмотрение заявлений об открытии осуществляется Совместной рабочей группой IUPAC/IUPAP . После присвоения приоритета элементы были официально добавлены в таблицу Менделеева, и первооткрывателям было предложено предложить свои названия. [19] К 2016 году это произошло со всеми элементами до 118, таким образом заполнив первые семь строк периодической таблицы. [19] [245] Открытие элементов после 106 стало возможным благодаря методам, разработанным Юрием Оганесяном в ОИЯИ: холодный синтез (бомбардировка свинца и висмута тяжелыми ионами) сделал возможным открытие элементов со 107 по 112 в 1981–2004 гг. GSI и 113 в Рикене, а также руководил командой ОИЯИ (в сотрудничестве с американскими учёными) по открытию элементов со 114 по 118 с помощью горячего синтеза (бомбардировки актинидов ионами кальция) в 1998–2010 гг. [246] [247] Самый тяжелый из известных элементов, оганессон (118), назван в честь Оганесяна. Элемент 114 назван флеровием в честь своего предшественника и наставника Флёрова. [247]
В честь 150-летия таблицы Менделеева Организация Объединенных Наций объявила 2019 год Международным годом таблицы Менделеева, отмечая «одно из самых значительных достижений в науке». [248] Критерии открытия, установленные TWG, были обновлены в 2020 году в ответ на экспериментальный и теоретический прогресс, который не был предусмотрен в 1991 году. [249] Сегодня таблица Менделеева является одним из самых узнаваемых символов химии. [82] ИЮПАК сегодня участвует во многих процессах, связанных с таблицей Менделеева: распознаванием и присвоением названий новым элементам, рекомендацией номеров групп и коллективных названий, а также обновлением атомных весов. [19]

Последние названные элементы — нихоний (113), московий (115), теннессин (117) и оганессон (118) — завершили седьмую строку таблицы Менделеева. [19] Будущие элементы должны начинаться с восьмой строки . Эти элементы могут обозначаться либо по их атомным номерам (например, « элемент 119 »), либо по систематическим названиям элементов ИЮПАК, принятым в 1978 году, которые напрямую связаны с атомными номерами (например, «унунэнниум» для элемента 119, производное от латинского unus «один», греческое ennea «девять» и традиционный суффикс -ium для металлических элементов). [19] Все попытки синтезировать такие элементы до сих пор не увенчались успехом. Попытка создания 119-го элемента продолжается с 2018 года в научно-исследовательском институте Рикен в Японии. ЛБНЛ в США и ОИЯИ в России также планируют предпринять собственные попытки синтеза первых нескольких элементов 8-го периода. [252] [253] [254] [255] [256]
Если бы восьмой период следовал шаблону, заданному предыдущими периодами, то он содержал бы пятьдесят элементов, заполняющих подоболочки 8s, 5g, 6f, 7d и, наконец, 8p в этом порядке. Но к этому моменту релятивистские эффекты должны привести к значительным отклонениям от правила Маделунга. Были предложены различные модели конфигураций элементов восьмого периода, а также способов отображения результатов в таблице Менделеева. Все согласны с тем, что восьмой период должен начинаться, как и предыдущие, с двух элементов восьмерок, 119 и 120 . Однако после этого массивные энергетические перекрытия между подоболочками 5g, 6f, 7d и 8p означают, что все они начинают заполняться вместе, и неясно, как выделить конкретные серии 5g и 6f. [60] [257] [258] [259] [260] Таким образом, элементы с 121 по 156 не подходят в качестве химических аналогов любой предыдущей группы в предыдущих частях таблицы, [129] хотя иногда их помещали как 5g. , 6f и другие серии, формально отражающие их электронную конфигурацию. [129] Эрик Шерри поднял вопрос о том, должна ли расширенная таблица Менделеева учитывать несоблюдение правила Маделунга в этом регионе или такие исключения следует игнорировать. [257] На этом этапе оболочечная структура также может быть довольно формальной: уже сейчас ожидается, что распределение электронов в атоме оганессона будет довольно однородным, без различимой оболочечной структуры. [261]
Ситуация с элементами 157 по 172 должна вернуться в норму и больше напоминать предыдущие строки. [251] Тяжелые p-оболочки расщепляются в результате спин-орбитального взаимодействия : одна p-орбиталь (p 1/2 ) более стабилизирована, а две другие (p 3/2 ) дестабилизированы. (Такие сдвиги квантовых чисел происходят для всех типов оболочек, но наибольшее различие в порядке они имеют для p-оболочек.) Вполне вероятно, что к элементу 157 заполнены 8s и 8p 1/2 оболочки с четырьмя электронами. в общей сложности провалились в ядро. За пределами ядра следующие орбитали — это 7d и 9s с одинаковыми энергиями, за ними следуют 9p 1/2 и 8p 3/2 с аналогичными энергиями, а затем большой разрыв. [251] Таким образом, орбитали 9s и 9p 1/2 по существу заменяют орбитали 8s и 8p 1/2 , что делает элементы 157–172, вероятно, химически аналогичными группам 3–18: например, элемент 164 будет располагаться на две позиции ниже свинца. в группе 14 по обычной схеме, но вместо этого он очень похож на палладий в группе 10. [55] [259] [60] [250] [129] Таким образом, для достижения следующего благородного элемента после 118 требуется пятьдесят четыре элемента, а не пятьдесят. [262] Однако, хотя эти выводы об элементах с 157 по 172 химия являются в целом согласны с моделями, [129] [60] существуют разногласия относительно того, должна ли таблица Менделеева быть составлена так, чтобы отражать химические аналогии, или она должна отражать вероятные формальные электронные конфигурации, которые должны сильно отличаться от более ранних периодов и не согласованы между источники. Таким образом, дискуссия о формате восьмой строки продолжается. [60] [259] [260] [105]
За пределами элемента 172 расчет усложняется тем, что уровень энергии электрона 1s становится мнимым. Такая ситуация имеет физическую интерпретацию и сама по себе не накладывает электронных ограничений на периодическую таблицу, но правильный способ включения таких состояний в многоэлектронные расчеты все еще остается открытой проблемой. Эту проблему необходимо будет решить, чтобы продолжить расчет структуры таблицы Менделеева после этого момента. [263]
Ядерная стабильность, вероятно, окажется решающим фактором, ограничивающим количество возможных элементов. Это зависит от баланса между электрическим отталкиванием между протонами и сильной силой, связывающей протоны и нейтроны вместе. [264] Протоны и нейтроны располагаются в оболочках , так же, как электроны, и поэтому закрытая оболочка может значительно повысить стабильность: известные сверхтяжелые ядра существуют благодаря такому замыканию оболочки, вероятно, при примерно 114–126 протонах и 184 нейтронах. [263] Они, вероятно, близки к предсказанному острову стабильности , где сверхтяжелые нуклиды должны быть более долгоживущими, чем ожидалось: прогнозы для самых долгоживущих нуклидов на острове варьируются от микросекунд до миллионов лет. [105] [265] [266] Тем не менее следует отметить, что это, по сути, экстраполяции в неизвестную часть карты нуклидов, и необходимо учитывать систематические неопределенности модели. [105]
При прохождении замкнутых оболочек стабилизирующий эффект должен исчезнуть: [267] таким образом, ожидается, что сверхтяжелые нуклиды с числом нейтронов более 184 будут иметь гораздо более короткое время жизни и спонтанно делиться в течение 10–15 секунд . Если это так, то не имело бы смысла считать их химическими элементами: ИЮПАК определяет, что элемент существует только в том случае, если ядро живет дольше 10–14 секунд — времени, необходимого ему для того, чтобы собрать электронное облако. Тем не менее, теоретические оценки периодов полураспада очень зависят от модели и варьируются на многие порядки. [263] Чрезвычайное отталкивание между протонами, по прогнозам, приведет к экзотическим ядерным топологиям с ожидаемыми пузырьками, кольцами и торами: это еще больше усложняет экстраполяцию. [105] Не ясно, существуют ли какие-либо дальнейшие замыкания оболочек из-за ожидаемого размытия отдельных ядерных оболочек (как уже ожидается для электронных оболочек в Оганессоне). [267] Более того, даже если существуют более поздние оболочки, неясно, позволят ли они существовать таким тяжелым элементам. [268] [269] [270] [177] Таким образом, возможно, что периодическая таблица практически заканчивается вокруг элемента 120, поскольку элементы становятся слишком недолговечными, чтобы их можно было наблюдать, а затем слишком недолговечными, чтобы иметь химию; Таким образом, эра открытия новых элементов подошла бы к концу. [177] [271] Если еще одно закрытие протонной оболочки после 126 действительно существует, то это, вероятно, происходит около 164; [268] таким образом, область, где периодичность нарушается, более или менее соответствует области нестабильности между замыканиями оболочек. [129]
Альтернативно, кварковая материя может стать стабильной при больших массовых числах, когда ядро состоит из свободно текущих вверх и вниз кварков , а не связывает их в протоны и нейтроны; это создало бы континент стабильности вместо острова. [272] [273] Могут иметь место и другие эффекты: например, в очень тяжелых элементах 1s-электроны, вероятно, будут проводить значительное количество времени так близко к ядру, что фактически находятся внутри него, что делает их уязвимыми для захват электрона . [274]
Даже если элементы восьмого ряда могут существовать, их производство, вероятно, будет трудным, и оно должно стать еще более трудным по мере увеличения атомного номера. [275] Хотя ожидается, что 8s-элементы 119 и 120 будут достижимы с помощью существующих средств, ожидается, что элементы, выходящие за рамки этого, потребуют новой технологии, [276] если они вообще могут быть произведены. [277] Экспериментальная характеристика этих элементов по химическому составу также представляет собой большую проблему. [252]
Периодический закон может быть представлен несколькими способами, из которых стандартная таблица Менделеева является лишь одним из них. [278] В течение 100 лет после появления таблицы Менделеева в 1869 году Эдвард Г. Мазурс собрал около 700 различных опубликованных версий периодической таблицы. [180] [279] Многие формы сохраняют прямоугольную структуру, в том числе левоступенчатую периодическую таблицу Шарля Жане (на фото ниже) и модернизированную форму оригинального восьмиколоночного макета Менделеева, который до сих пор распространен в России. Другие форматы периодической таблицы имеют гораздо более экзотическую форму, например спирали ( изображение Отто Теодора Бенфея справа), круги и треугольники. [280]
Альтернативные таблицы Менделеева часто разрабатываются, чтобы выделить или подчеркнуть химические или физические свойства элементов, которые не так очевидны в традиционных таблицах Менделеева, причем разные таблицы больше ориентированы на химию или физику с обеих сторон. [281] Стандартная форма, которая остается наиболее распространенной, находится где-то посередине. [281]
Множество различных форм таблицы Менделеева вызвали вопросы о том, существует ли оптимальная или окончательная форма таблицы Менделеева, и если да, то какой она может быть. На оба вопроса в настоящее время нет единого ответа. [282] [281] Таблица левого шага Джанет все чаще обсуждается как кандидат на роль оптимальной или наиболее фундаментальной формы; Скерри написал в поддержку этого, поскольку он проясняет природу гелия как элемента s-блока, увеличивает регулярность за счет повторения всех длин периодов, точно следует правилу Маделунга, заставляя каждый период соответствовать одному значению n + ℓ , и упорядочивает атомный номер. триады и аномальный тренд первого ряда. Хотя он отмечает, что размещение гелия поверх щелочноземельных металлов можно рассматривать как недостаток с химической точки зрения, он парирует это, апеллируя к аномалии первого ряда, указывая, что таблица Менделеева «фундаментально сводится к квантовой механике» и что речь идет об «абстрактных элементах» и, следовательно, об атомных свойствах, а не о макроскопических свойствах. [283]
В 15-й группе таблицы Менделеева, как и в обеих соседних группах, металлический характер усиливается при движении вниз. Точнее, происходит переход от чисто неметаллического элемента (N) через элементы с неметаллическими и металлическими модификациями к чисто металлическим элементам (Sb, Bi). В этой главе рассматриваются два элемента, помимо азота, которые при стандартных условиях явно неметаллические: фосфор и мышьяк. Однако химия мышьяка описана лишь кратко, поскольку многие соединения мышьяка напоминают соответствующие виды фосфора.
Сверхтяжелые элементы (
Z
> 102) балансируют на пределе массы и заряда.
「12.アルカリ土類金属」の範囲についても,△を含めれば,すべての教科書で提案が考慮されている。歴史的には第4 周期のカルシウム以下を指していた用語だったが,「周期表の2 族に対応する用語とする」というIUPAC の勧告1)に従うのは現在では自然な流れだろう。
Первое использование термина «переход» в его современном электронном смысле, по-видимому, связано с британским химиком Ч. Р. Бери, который впервые использовал этот термин в своей статье 1921 года об электронной структуре атомов и периодической таблице.