
Фагоциты — это клетки , которые защищают организм, поглощая вредные инородные частицы, бактерии и мертвые или умирающие клетки. Их название происходит от греческого phagein , «есть» или «пожирать», и «-cyte», суффикса в биологии, обозначающего «клетка», от греческого kutos, «полый сосуд». Они необходимы для борьбы с инфекциями и для последующего иммунитета . Фагоциты важны во всем животном мире [1] и высоко развиты у позвоночных. [2] Один литр человеческой крови содержит около шести миллиардов фагоцитов. [3] Они были открыты в 1882 году Ильей Ильичом Мечниковым , когда он изучал личинки морских звезд . [4] Мечников был удостоен Нобелевской премии по физиологии и медицине 1908 года за свое открытие. [5] Фагоциты встречаются у многих видов; некоторые амебы ведут себя как макрофагальные фагоциты, что предполагает, что фагоциты появились на ранних этапах эволюции жизни. [6]
Фагоциты людей и других животных называются «профессиональными» или «непрофессиональными» в зависимости от того, насколько они эффективны в фагоцитозе . [7] Профессиональные фагоциты включают в себя многие типы белых кровяных клеток (такие как нейтрофилы , моноциты , макрофаги , тучные клетки и дендритные клетки ). [8] Основное различие между профессиональными и непрофессиональными фагоцитами заключается в том, что профессиональные фагоциты имеют на своей поверхности молекулы, называемые рецепторами , которые могут обнаруживать вредные объекты, такие как бактерии, которые обычно не встречаются в организме. Непрофессиональные фагоциты не имеют эффективных фагоцитарных рецепторов, таких как рецепторы для опсонинов . [9] Фагоциты играют решающую роль в борьбе с инфекциями, а также в поддержании здоровых тканей путем удаления мертвых и умирающих клеток, которые достигли конца своего жизненного цикла. [10]
Во время инфекции химические сигналы привлекают фагоциты в места, где патоген проник в организм. Эти химические вещества могут исходить от бактерий или от других уже присутствующих фагоцитов. Фагоциты перемещаются с помощью метода, называемого хемотаксисом . Когда фагоциты вступают в контакт с бактериями, рецепторы на поверхности фагоцита связываются с ними. Это связывание приводит к поглощению бактерий фагоцитом. [11] Некоторые фагоциты убивают проглоченный патоген с помощью окислителей и оксида азота . [12] После фагоцитоза макрофаги и дендритные клетки также могут участвовать в презентации антигена , процессе, в котором фагоцит перемещает части проглоченного материала обратно на свою поверхность. Затем этот материал отображается для других клеток иммунной системы. Затем некоторые фагоциты перемещаются в лимфатические узлы организма и отображают материал для белых кровяных клеток, называемых лимфоцитами . Этот процесс важен для формирования иммунитета [13] , и многие патогены выработали методы, позволяющие избегать атак фагоцитов [14] .

Русский зоолог Илья Ильич Мечников (1845–1916) первым осознал, что специализированные клетки участвуют в защите от микробных инфекций. [15] В 1882 году он изучал подвижные (свободно движущиеся) клетки в личинках морских звезд , полагая, что они важны для иммунной защиты животных. Чтобы проверить свою идею, он вставил в личинок небольшие шипы с мандаринового дерева. Через несколько часов он заметил, что подвижные клетки окружили шипы. [15] Мечников отправился в Вену и поделился своими идеями с Карлом Фридрихом Клаусом , который предложил название «фагоцит» (от греческих слов phagein , что означает «есть или пожирать», и kutos , что означает «полый сосуд» [16] ) для клеток, которые наблюдал Мечников. [17]
Год спустя Мечников изучал пресноводное ракообразное под названием дафния , крошечное прозрачное животное, которое можно было исследовать непосредственно под микроскопом. Он обнаружил, что споры грибов, которые атаковали животное, уничтожались фагоцитами. Он продолжил свои наблюдения, распространив их на белые кровяные клетки млекопитающих, и обнаружил, что бактерия Bacillus anthracis может быть поглощена и убита фагоцитами, этот процесс он назвал фагоцитозом . [18] Мечников предположил, что фагоциты являются первичной защитой от вторгающихся организмов. [15]
В 1903 году Альмрот Райт открыл, что фагоцитоз усиливается специфическими антителами , которые он назвал опсонинами , от греческого opson , «заправка или приправа». [19] Мечников был удостоен (совместно с Паулем Эрлихом ) Нобелевской премии по физиологии и медицине 1908 года за свою работу по фагоцитам и фагоцитозу. [5]
Хотя важность этих открытий постепенно получила признание в начале двадцатого века, сложные взаимоотношения между фагоцитами и всеми другими компонентами иммунной системы не были известны до 1980-х годов. [20]
![Карикатура: 1. Частица изображена овалом, а поверхность фагоцита — прямой линией. Различные более мелкие формы находятся на линии и овале. 2. Более мелкие частицы на каждой поверхности соединяются. 3. Линия теперь вогнутая и частично огибает овал.[21]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/ba/Phagocytosis_in_three_steps.png/220px-Phagocytosis_in_three_steps.png)
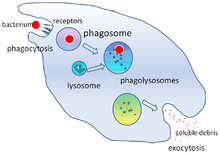
Фагоцитоз — это процесс поглощения клеткой частиц, таких как бактерии, инвазивные грибки , паразиты, мертвые клетки хозяина , а также клеточный и инородный мусор. [22] Он включает в себя цепочку молекулярных процессов. [23] [24] Фагоцитоз происходит после того, как инородное тело, например, бактериальная клетка, связывается с молекулами, называемыми «рецепторами», которые находятся на поверхности фагоцита. Затем фагоцит растягивается вокруг бактерии и поглощает ее. Фагоцитоз бактерий человеческими нейтрофилами занимает в среднем девять минут. [25] Оказавшись внутри этого фагоцита, бактерия оказывается в ловушке в отсеке, называемом фагосомой . В течение одной минуты фагосома сливается либо с лизосомой , либо с гранулой , образуя фаголизосому . Затем бактерия подвергается подавляющему множеству механизмов уничтожения [26] и погибает через несколько минут. [25] Дендритные клетки и макрофаги не такие быстрые, и фагоцитоз может занять много часов в этих клетках. Макрофаги — медленные и неаккуратные едоки; они поглощают огромные количества материала и часто высвобождают часть непереваренного обратно в ткани. Этот мусор служит сигналом для привлечения большего количества фагоцитов из крови. [27] У фагоцитов прожорливый аппетит; ученые даже кормили макрофаги железными опилками , а затем использовали небольшой магнит, чтобы отделить их от других клеток. [28]

Фагоцит имеет много типов рецепторов на своей поверхности, которые используются для связывания материала. [14] Они включают в себя рецепторы опсонинов , рецепторы-мусорщики и Toll-подобные рецепторы . Рецепторы опсонинов усиливают фагоцитоз бактерий, которые были покрыты антителами иммуноглобулина G (IgG) или комплементом . «Комплемент» — это название, данное сложной серии белковых молекул, обнаруженных в крови, которые разрушают клетки или помечают их для уничтожения. [29] Рецепторы-мусорщики связываются с большим спектром молекул на поверхности бактериальных клеток, а Toll-подобные рецепторы, названные так из-за их сходства с хорошо изученными рецепторами у плодовых мушек, которые кодируются геном Toll , связываются с более специфическими молекулами, включая чужеродную ДНК и РНК. [30] Связывание с Toll-подобными рецепторами усиливает фагоцитоз и заставляет фагоцит высвобождать группу гормонов, которые вызывают воспаление . [14]
Уничтожение микробов является важнейшей функцией фагоцитов, которая выполняется либо внутри фагоцита ( внутриклеточное уничтожение), либо вне фагоцита ( внеклеточное уничтожение). [31]
Когда фагоцит поглощает бактерии (или любой материал), его потребление кислорода увеличивается. Увеличение потребления кислорода, называемое респираторным взрывом , производит реактивные кислородсодержащие молекулы, которые являются антимикробными. [32] Кислородные соединения токсичны как для захватчика, так и для самой клетки, поэтому они хранятся в отсеках внутри клетки. Этот метод уничтожения вторгшихся микробов с использованием реактивных кислородсодержащих молекул называется кислородзависимым внутриклеточным уничтожением, которое бывает двух типов. [12]
Первый тип — это кислородозависимое производство супероксида , [ 14] который является богатым кислородом веществом, убивающим бактерии. [33] Супероксид преобразуется в перекись водорода и синглетный кислород ферментом, называемым супероксиддисмутазой . Супероксиды также реагируют с перекисью водорода, образуя гидроксильные радикалы , которые помогают убивать вторгающиеся микробы. [14]
Второй тип предполагает использование фермента миелопероксидазы из гранул нейтрофилов. [34] Когда гранулы сливаются с фагосомой, миелопероксидаза высвобождается в фаголизосому, и этот фермент использует перекись водорода и хлор для создания гипохлорита , вещества, используемого в бытовом отбеливателе . Гипохлорит чрезвычайно токсичен для бактерий. [14] Миелопероксидаза содержит гемовый пигмент, который объясняет зеленый цвет выделений, богатых нейтрофилами, таких как гной и инфицированная мокрота . [35]

Фагоциты также могут убивать микробов кислородонезависимыми методами, но они не так эффективны, как кислородзависимые. Существует четыре основных типа. Первый использует электрически заряженные белки, которые повреждают мембрану бактерии . Второй тип использует лизоцимы; эти ферменты разрушают клеточную стенку бактерий . Третий тип использует лактоферрины , которые присутствуют в гранулах нейтрофилов и удаляют необходимое железо из бактерий. [36] Четвертый тип использует протеазы и гидролитические ферменты ; эти ферменты используются для переваривания белков разрушенных бактерий. [37]
Интерферон-гамма — который когда-то назывался фактором активации макрофагов — стимулирует макрофаги к производству оксида азота . Источником интерферона-гамма могут быть CD4 + T-клетки , CD8 + T-клетки , естественные клетки-киллеры , B-клетки , естественные клетки-киллеры T , моноциты, другие макрофаги или дендритные клетки. [38] Затем оксид азота высвобождается из макрофага и из-за своей токсичности убивает микробы вблизи макрофага. [14] Активированные макрофаги вырабатывают и секретируют фактор некроза опухоли . Этот цитокин — класс сигнальных молекул [39] — убивает раковые клетки и клетки, инфицированные вирусами, и помогает активировать другие клетки иммунной системы. [40]
При некоторых заболеваниях, например, при редком хроническом гранулематозном заболевании , эффективность фагоцитов снижается, и рецидивирующие бактериальные инфекции становятся проблемой. [41] При этом заболевании наблюдается аномалия, влияющая на различные элементы кислородозависимого уничтожения. Другие редкие врожденные аномалии, такие как синдром Чедиака-Хигаси , также связаны с дефектным уничтожением поглощенных микробов. [42]
Вирусы могут размножаться только внутри клеток, и они могут проникнуть внутрь, используя многие из рецепторов, участвующих в иммунитете. Оказавшись внутри клетки, вирусы используют биологические механизмы клетки в своих интересах, заставляя клетку создавать сотни идентичных копий себя. Хотя фагоциты и другие компоненты врожденной иммунной системы могут, в ограниченной степени, контролировать вирусы, как только вирус оказывается внутри клетки, адаптивные иммунные реакции, особенно лимфоциты, становятся более важными для защиты. [43] В местах вирусных инфекций лимфоциты часто значительно превосходят по численности все другие клетки иммунной системы; это часто встречается при вирусном менингите . [44] Инфицированные вирусом клетки, которые были убиты лимфоцитами, выводятся из организма фагоцитами. [45]
У животных клетки постоянно умирают. Баланс между делением клеток и смертью клеток сохраняет количество клеток относительно постоянным у взрослых. [10] Существует два разных способа, которыми клетка может умереть: некроз или апоптоз. В отличие от некроза, который часто является результатом болезни или травмы, апоптоз — или запрограммированная смерть клеток — является нормальной здоровой функцией клеток. Организм должен избавляться от миллионов мертвых или умирающих клеток каждый день, и фагоциты играют решающую роль в этом процессе. [46]
Умирающие клетки, которые проходят последние стадии апоптоза [47], демонстрируют молекулы, такие как фосфатидилсерин , на своей клеточной поверхности для привлечения фагоцитов. [48] Фосфатидилсерин обычно находится на цитозольной поверхности плазматической мембраны, но перераспределяется во время апоптоза на внеклеточную поверхность белком, известным как скрамблаза . [49] [50] Эти молекулы маркируют клетку для фагоцитоза клетками, которые обладают соответствующими рецепторами, такими как макрофаги. [51] Удаление умирающих клеток фагоцитами происходит упорядоченным образом, не вызывая воспалительной реакции , и является важной функцией фагоцитов. [52]
Фагоциты обычно не привязаны к какому-либо конкретному органу , а перемещаются по телу, взаимодействуя с другими фагоцитарными и нефагоцитарными клетками иммунной системы. Они могут общаться с другими клетками, вырабатывая химические вещества, называемые цитокинами , которые привлекают другие фагоциты к месту инфекции или стимулируют спящие лимфоциты . [53] Фагоциты являются частью врожденной иммунной системы , с которой рождаются животные, включая людей. Врожденный иммунитет очень эффективен, но неспецифичен, поскольку не различает различные виды захватчиков. С другой стороны, адаптивная иммунная система челюстных позвоночных — основа приобретенного иммунитета — является высокоспециализированной и может защищать практически от любого типа захватчика. [54] Адаптивная иммунная система зависит не от фагоцитов, а от лимфоцитов, которые вырабатывают защитные белки, называемые антителами , которые помечают захватчиков для уничтожения и не дают вирусам заражать клетки. [55] Фагоциты, в частности дендритные клетки и макрофаги, стимулируют лимфоциты вырабатывать антитела посредством важного процесса, называемого презентацией антигена . [56]

Презентация антигена — это процесс, в котором некоторые фагоциты перемещают части поглощенных материалов обратно на поверхность своих клеток и «представляют» их другим клеткам иммунной системы. [57] Существует две «профессиональные» антигенпрезентирующие клетки: макрофаги и дендритные клетки. [58] После поглощения чужеродные белки ( антигены ) расщепляются на пептиды внутри дендритных клеток и макрофагов. Затем эти пептиды связываются с гликопротеинами главного комплекса гистосовместимости (MHC) клетки , которые переносят пептиды обратно на поверхность фагоцита, где они могут быть «представлены» лимфоцитам. [13] Зрелые макрофаги не перемещаются далеко от места инфекции, но дендритные клетки могут достигать лимфатических узлов организма , где находятся миллионы лимфоцитов. [59] Это усиливает иммунитет, поскольку лимфоциты реагируют на антигены, представленные дендритными клетками, так же, как они реагировали бы на месте первоначальной инфекции. [60] Но дендритные клетки также могут уничтожать или успокаивать лимфоциты, если они распознают компоненты организма-хозяина; это необходимо для предотвращения аутоиммунных реакций. Этот процесс называется толерантностью. [61]
Дендритные клетки также способствуют иммунологической толерантности, [62] которая не дает организму атаковать себя. Первый тип толерантности — это центральная толерантность , которая возникает в тимусе. Т-клетки , которые связываются (через свой рецептор Т-клеток) с собственным антигеном (представленным дендритными клетками на молекулах MHC) слишком сильно, индуцируются к гибели. Второй тип иммунологической толерантности — периферическая толерантность . Некоторые аутореактивные Т-клетки покидают тимус по ряду причин, в основном из-за отсутствия экспрессии некоторых аутоантигенов в тимусе. Другой тип Т-клеток; Т-регуляторные клетки могут подавлять аутореактивные Т-клетки на периферии. [63] Когда иммунологическая толерантность не удается, могут последовать аутоиммунные заболевания . [64]

Фагоциты человека и других челюстных позвоночных делятся на «профессиональные» и «непрофессиональные» группы в зависимости от эффективности, с которой они участвуют в фагоцитозе. [7] Профессиональные фагоциты — это миелоидные клетки , включающие моноциты , макрофаги , нейтрофилы , тканевые дендритные клетки и тучные клетки . [8] Один литр крови человека содержит около шести миллиардов фагоцитов. [3]
Все фагоциты, и особенно макрофаги, существуют в степенях готовности. Макрофаги обычно относительно бездействуют в тканях и медленно размножаются. В этом полупокоящемся состоянии они убирают мертвые клетки хозяина и другой неинфекционный мусор и редко принимают участие в презентации антигенов. Но во время инфекции они получают химические сигналы — обычно интерферон гамма — который увеличивает их выработку молекул MHC II и который готовит их к презентации антигенов. В этом состоянии макрофаги являются хорошими презентаторами антигенов и киллерами. Если они получают сигнал непосредственно от захватчика, они становятся «гиперактивированными», прекращают размножаться и концентрируются на убийстве. Их размер и скорость фагоцитоза увеличиваются — некоторые становятся достаточно большими, чтобы поглотить вторгшихся простейших . [65]
В крови нейтрофилы неактивны, но перемещаются с большой скоростью. Когда они получают сигналы от макрофагов в местах воспаления, они замедляются и покидают кровь. В тканях они активируются цитокинами и прибывают на место битвы, готовые убивать. [66]

При возникновении инфекции выдается химический сигнал «SOS», привлекающий фагоциты к месту заражения. [67] Эти химические сигналы могут включать белки от вторгшихся бактерий, пептиды системы свертывания крови , продукты комплемента и цитокины, которые выделяются макрофагами, расположенными в тканях вблизи места заражения. [14] Другая группа химических аттрактантов — это цитокины , которые привлекают нейтрофилы и моноциты из крови. [11]
Чтобы достичь места инфекции, фагоциты покидают кровоток и проникают в пораженные ткани. Сигналы от инфекции заставляют эндотелиальные клетки, выстилающие кровеносные сосуды, вырабатывать белок, называемый селектином , к которому прилипают нейтрофилы, проходя мимо. Другие сигналы, называемые вазодилататорами, ослабляют соединения, соединяющие эндотелиальные клетки, позволяя фагоцитам проходить через стенку. Хемотаксис — это процесс, посредством которого фагоциты следуют за «запахом» цитокина к инфицированному месту. [14] Нейтрофилы перемещаются через органы, выстланные эпителиальными клетками, к местам инфекции, и хотя это важный компонент борьбы с инфекцией, сама миграция может привести к симптомам, похожим на болезнь. [68] Во время инфекции миллионы нейтрофилов рекрутируются из крови, но они умирают через несколько дней. [69]
.jpg/440px-Monocytes,_a_type_of_white_blood_cell_(Giemsa_stained).jpg)
Моноциты развиваются в костном мозге и достигают зрелости в крови. Зрелые моноциты имеют большие, гладкие, дольчатые ядра и обильную цитоплазму , содержащую гранулы. Моноциты поглощают чужеродные или опасные вещества и представляют антигены другим клеткам иммунной системы. Моноциты образуют две группы: циркулирующую группу и маргинальную группу, которая остается в других тканях (примерно 70% находятся в маргинальной группе). Большинство моноцитов покидают кровоток через 20–40 часов, чтобы отправиться в ткани и органы и при этом трансформируются в макрофаги [70] или дендритные клетки в зависимости от сигналов, которые они получают. [71] В одном литре крови человека содержится около 500 миллионов моноцитов. [3]

Зрелые макрофаги не путешествуют далеко, но охраняют те области тела, которые подвергаются воздействию внешнего мира. Там они действуют как сборщики мусора, антигенпрезентирующие клетки или свирепые убийцы, в зависимости от сигналов, которые они получают. [72] Они происходят из моноцитов, гранулоцитарных стволовых клеток или клеточного деления уже существующих макрофагов. [73] Человеческие макрофаги имеют диаметр около 21 микрометра . [74]

Этот тип фагоцитов не имеет гранул, но содержит много лизосом . Макрофаги встречаются по всему телу почти во всех тканях и органах (например, микроглиальные клетки в мозге и альвеолярные макрофаги в легких ), где они молчаливо ждут. Расположение макрофага может определять его размер и внешний вид. Макрофаги вызывают воспаление посредством выработки интерлейкина-1 , интерлейкина-6 и ФНО-альфа . [75] Макрофаги обычно встречаются только в тканях и редко встречаются в кровообращении. Продолжительность жизни тканевых макрофагов оценивается в диапазоне от четырех до пятнадцати дней. [76]
Макрофаги могут быть активированы для выполнения функций, которые не может выполнять покоящийся моноцит. [75] Т-хелперные клетки (также известные как эффекторные Т-клетки или Т h -клетки), подгруппа лимфоцитов, отвечают за активацию макрофагов. Т h 1-клетки активируют макрофаги, сигнализируя с помощью IFN-гамма и отображая лиганд белка CD40 . [77] Другие сигналы включают TNF-альфа и липополисахариды из бактерий. [75] Т h 1-клетки могут привлекать другие фагоциты к месту инфекции несколькими способами. Они секретируют цитокины, которые действуют на костный мозг , стимулируя выработку моноцитов и нейтрофилов, и они секретируют некоторые из цитокинов , которые отвечают за миграцию моноцитов и нейтрофилов из кровотока. [78] Т h 1-клетки возникают в результате дифференциации Т-клеток CD4 + после того, как они отреагировали на антиген во вторичных лимфоидных тканях . [75] Активированные макрофаги играют важную роль в разрушении опухолей , продуцируя TNF-альфа, IFN-гамма, оксид азота, реактивные кислородные соединения, катионные белки и гидролитические ферменты. [75]

Нейтрофилы обычно находятся в кровотоке и являются наиболее распространенным типом фагоцитов, составляя от 50% до 60% от общего числа циркулирующих белых кровяных клеток. [79] Один литр крови человека содержит около пяти миллиардов нейтрофилов, [3] которые имеют диаметр около 10 микрометров [80] и живут всего около пяти дней. [40] После того, как они получили соответствующие сигналы, им требуется около тридцати минут, чтобы покинуть кровь и достичь места инфекции. [81] Они являются свирепыми пожирателями и быстро поглощают захватчиков, покрытых антителами и комплементом , а также поврежденные клетки или клеточный дебрис. Нейтрофилы не возвращаются в кровь; они превращаются в гнойные клетки и умирают. [81] Зрелые нейтрофилы меньше моноцитов и имеют сегментированное ядро с несколькими секциями; каждая секция соединена хроматиновыми нитями — нейтрофилы могут иметь 2–5 сегментов. Нейтрофилы обычно не покидают костный мозг до созревания, но во время инфекции высвобождаются предшественники нейтрофилов, называемые метамиелоцитами , миелоцитами и промиелоцитами . [82]
Внутриклеточные гранулы человеческих нейтрофилов давно известны своими свойствами разрушать белки и бактерицидными свойствами. [83] Нейтрофилы могут секретировать продукты, которые стимулируют моноциты и макрофаги. Секреция нейтрофилов усиливает фагоцитоз и образование реактивных кислородных соединений, участвующих во внутриклеточном уничтожении. [84] Секреция первичных гранул нейтрофилов стимулирует фагоцитоз бактерий, покрытых антителами IgG . [85] При столкновении с бактериями, грибками или активированными тромбоцитами они производят паутинные структуры хроматина, известные как нейтрофильные внеклеточные ловушки (NET). Состоящие в основном из ДНК, NET вызывают смерть посредством процесса, называемого нетозом, — после того, как патогены попадают в NET, они погибают с помощью окислительных и неокислительных механизмов. [86]

Дендритные клетки — это специализированные антигенпрезентирующие клетки, которые имеют длинные отростки, называемые дендритами, [87] , которые помогают поглощать микробы и других захватчиков. [88] [89] Дендритные клетки присутствуют в тканях, которые контактируют с внешней средой, в основном в коже, внутренней оболочке носа, легких, желудке и кишечнике. [90] После активации они созревают и мигрируют в лимфоидные ткани, где взаимодействуют с Т-клетками и В-клетками , чтобы инициировать и организовать адаптивный иммунный ответ. [91] Зрелые дендритные клетки активируют Т-хелперные клетки и цитотоксические Т-клетки . [92] Активированные Т-хелперные клетки взаимодействуют с макрофагами и В-клетками, чтобы активировать их в свою очередь. Кроме того, дендритные клетки могут влиять на тип производимого иммунного ответа; когда они перемещаются в лимфоидные области, где находятся Т-клетки, они могут активировать Т-клетки, которые затем дифференцируются в цитотоксические Т-клетки или Т-хелперные клетки. [88]
Тучные клетки имеют Toll-подобные рецепторы и взаимодействуют с дендритными клетками, В-клетками и Т-клетками, помогая опосредовать адаптивные иммунные функции. [93] Тучные клетки экспрессируют молекулы MHC класса II и могут участвовать в презентации антигенов; однако роль тучных клеток в презентации антигенов не очень хорошо изучена. [94] Тучные клетки могут потреблять и убивать грамотрицательные бактерии (например, сальмонеллу ) и обрабатывать их антигены. [95] Они специализируются на обработке фимбриальных белков на поверхности бактерий, которые участвуют в адгезии к тканям. [96] [97] В дополнение к этим функциям тучные клетки продуцируют цитокины, которые вызывают воспалительную реакцию. [98] Это жизненно важная часть уничтожения микробов, поскольку цитокины привлекают больше фагоцитов к месту инфекции. [95] [99]
Умирающие клетки и чужеродные организмы поглощаются клетками, отличными от «профессиональных» фагоцитов. [101] К этим клеткам относятся эпителиальные клетки , эндотелиальные клетки , фибробласты , меланоциты и мезенхимальные клетки. Их называют непрофессиональными фагоцитами, чтобы подчеркнуть, что в отличие от профессиональных фагоцитов фагоцитоз не является их основной функцией. [102] Фибробласты, например, которые могут фагоцитировать коллаген в процессе повторного формирования рубцов, также будут предпринимать попытки поглотить чужеродные частицы. [103]
Непрофессиональные фагоциты более ограничены, чем профессиональные фагоциты, в типе частиц, которые они могут захватывать. Это связано с отсутствием у них эффективных фагоцитарных рецепторов, в частности опсонинов — антител и комплемента, которые иммунная система прикрепляет к захватчикам. [9] Кроме того, большинство непрофессиональных фагоцитов не вырабатывают реактивные кислородсодержащие молекулы в ответ на фагоцитоз. [104]

Патоген может успешно заразить организм только в том случае, если он может преодолеть его защиту. Патогенные бактерии и простейшие выработали множество методов сопротивления атакам фагоцитов, и многие из них фактически выживают и размножаются внутри фагоцитарных клеток. [107] [108]
Существует несколько способов, с помощью которых бактерии избегают контакта с фагоцитами. Во-первых, они могут расти в местах, куда фагоциты не способны перемещаться (например, поверхность неповрежденной кожи). Во-вторых, бактерии могут подавлять воспалительную реакцию ; без этой реакции на инфекцию фагоциты не могут адекватно реагировать. В-третьих, некоторые виды бактерий могут подавлять способность фагоцитов перемещаться к месту инфекции, вмешиваясь в хемотаксис. [107] В-четвертых, некоторые бактерии могут избегать контакта с фагоцитами, обманывая иммунную систему, заставляя ее «думать», что бактерии «свои». Treponema pallidum — бактерия, вызывающая сифилис — прячется от фагоцитов, покрывая свою поверхность фибронектином , [109] который естественным образом вырабатывается организмом и играет решающую роль в заживлении ран . [110]
Бактерии часто производят капсулы, состоящие из белков или сахаров, которые покрывают их клетки и мешают фагоцитозу. [107] Некоторые примеры - капсула K5 и антиген O75 O , обнаруженные на поверхности Escherichia coli , [111] и экзополисахаридные капсулы Staphylococcus epidermidis . [112] Streptococcus pneumoniae производит несколько типов капсул, которые обеспечивают разные уровни защиты, [113] а стрептококки группы A производят белки, такие как белок M и фимбриальные белки, чтобы блокировать поглощение. Некоторые белки препятствуют приему пищи, связанному с опсонинами; Staphylococcus aureus производит белок A , чтобы блокировать рецепторы антител, что снижает эффективность опсонинов. [114] Энтеропатогенные виды рода Yersinia связываются с использованием фактора вирулентности YopH с рецепторами фагоцитов, с помощью которых они влияют на способность клеток осуществлять фагоцитоз. [115]

Бактерии разработали способы выживания внутри фагоцитов, где они продолжают уклоняться от иммунной системы. [116] Чтобы безопасно попасть внутрь фагоцита, они экспрессируют белки, называемые инвазинами . Находясь внутри клетки, они остаются в цитоплазме и избегают токсичных химических веществ, содержащихся в фаголизосомах. [117] Некоторые бактерии предотвращают слияние фагосомы и лизосомы, образуя фаголизосому. [107] Другие патогены, такие как Leishmania , создают сильно модифицированную вакуоль внутри фагоцита, которая помогает им сохраняться и размножаться. [118] Некоторые бактерии способны жить внутри фаголизосомы. Например, Staphylococcus aureus вырабатывает ферменты каталазу и супероксиддисмутазу , которые расщепляют химические вещества, такие как перекись водорода, вырабатываемые фагоцитами, чтобы убивать бактерии. [119] Бактерии могут выходить из фагосомы до формирования фаголизосомы: Listeria monocytogenes может проделывать отверстие в стенке фагосомы, используя ферменты, называемые листериолизином O и фосфолипазой C. [ 120] M. tuberculosis инфицирует нейтрофилы , которые в свою очередь поглощаются макрофагами и, таким образом, также инфицируют последние. [121] M. leprae инфицирует макрофаги , шванновские клетки и нейтрофилы . [121]
Бактерии разработали несколько способов уничтожения фагоцитов. [114] К ним относятся цитолизины , которые образуют поры в клеточных мембранах фагоцитов, стрептолизины и лейкоцидины , которые заставляют гранулы нейтрофилов разрываться и высвобождать токсичные вещества, [122] [123] и экзотоксины , которые уменьшают запас АТФ фагоцита , необходимого для фагоцитоза. После того, как бактерия проглочена, она может убить фагоцит, высвобождая токсины, которые проходят через мембрану фагосомы или фаголизосомы, чтобы нацелиться на другие части клетки. [107]
Некоторые стратегии выживания часто включают в себя нарушение цитокинов и других методов клеточной сигнализации для предотвращения реакции фагоцита на вторжение. [124] Простейшие паразиты Toxoplasma gondii , Trypanosoma cruzi и Leishmania инфицируют макрофаги, и у каждого есть уникальный способ их приручения. [124] Некоторые виды Leishmania изменяют сигнализацию инфицированного макрофага, подавляют выработку цитокинов и микробицидных молекул — оксида азота и активных форм кислорода — и нарушают презентацию антигена. [125]
Макрофаги и нейтрофилы, в частности, играют центральную роль в воспалительном процессе, высвобождая белки и низкомолекулярные воспалительные медиаторы, которые контролируют инфекцию, но могут повредить ткани хозяина. В целом, фагоциты стремятся уничтожить патогены, поглощая их и подвергая их воздействию ряда токсичных химикатов внутри фаголизосомы . Если фагоцит не может поглотить свою цель, эти токсичные агенты могут быть выпущены в окружающую среду (действие, называемое «несостоявшимся фагоцитозом»). Поскольку эти агенты также токсичны для клеток хозяина, они могут нанести значительный ущерб здоровым клеткам и тканям. [126]
Когда нейтрофилы высвобождают содержимое своих гранул в почках , содержимое гранул (реактивные кислородные соединения и протеазы) разрушает внеклеточный матрикс клеток хозяина и может вызвать повреждение гломерулярных клеток, влияя на их способность фильтровать кровь и вызывая изменения формы. Кроме того, продукты фосфолипазы (например, лейкотриены ) усиливают повреждение. Это высвобождение веществ способствует хемотаксису большего количества нейтрофилов к месту инфекции, и гломерулярные клетки могут быть дополнительно повреждены молекулами адгезии во время миграции нейтрофилов. Повреждение, нанесенное гломерулярным клеткам, может вызвать почечную недостаточность . [127]
Нейтрофилы также играют ключевую роль в развитии большинства форм острого повреждения легких . [128] Здесь активированные нейтрофилы высвобождают содержимое своих токсичных гранул в легочную среду. [129] Эксперименты показали, что уменьшение количества нейтрофилов уменьшает последствия острого повреждения легких, [130] но лечение путем ингибирования нейтрофилов не является клинически реалистичным, так как это сделало бы хозяина уязвимым для инфекции. [129] В печени повреждение нейтрофилами может способствовать дисфункции и травме в ответ на высвобождение эндотоксинов , вырабатываемых бактериями, сепсисом , травмой, алкогольным гепатитом , ишемией и гиповолемическим шоком в результате острого кровотечения . [131]
Химические вещества, выделяемые макрофагами, также могут повреждать ткани хозяина. TNF-α — это важное химическое вещество, выделяемое макрофагами, которое заставляет кровь в мелких сосудах сворачиваться, чтобы предотвратить распространение инфекции. [132] Если бактериальная инфекция распространяется на кровь, TNF-α выделяется в жизненно важные органы, что может вызвать вазодилатацию и уменьшение объема плазмы ; за этим, в свою очередь, может последовать септический шок . Во время септического шока высвобождение TNF-α вызывает закупорку мелких сосудов, снабжающих кровью жизненно важные органы, и органы могут отказать. Септический шок может привести к смерти. [11]
_(52606801786).jpg/440px-Streptococcus_Pyogenes_(Group_A_Strep)_(52606801786).jpg)
Фагоцитоз распространен и, вероятно, появился на ранних этапах эволюции , [133] впервые развившись у одноклеточных эукариот. [134] Амебы — одноклеточные протисты , отделившиеся от дерева, что привело к появлению метазоа вскоре после расхождения растений, и они разделяют множество специфических функций с фагоцитарными клетками млекопитающих. [134] Dictyostelium discoideum , например, — амеба, живущая в почве и питающаяся бактериями. Подобно фагоцитам животных, она поглощает бактерии путем фагоцитоза, в основном через Toll-подобные рецепторы, и имеет другие общие биологические функции с макрофагами. [135] Dictyostelium discoideum социален; при голодании он объединяется, образуя мигрирующий псевдоплазмодий или слизняк . Этот многоклеточный организм в конечном итоге произведет плодовое тело со спорами , устойчивыми к опасностям окружающей среды. Перед образованием плодовых тел клетки будут мигрировать как слизнеподобный организм в течение нескольких дней. В течение этого времени воздействие токсинов или бактериальных патогенов может поставить под угрозу выживание вида, ограничивая производство спор. Некоторые амебы поглощают бактерии и поглощают токсины, циркулируя внутри слизняка, и эти амебы в конечном итоге умирают. Они генетически идентичны другим амебам в слизняке; их самопожертвование для защиты других амеб от бактерий похоже на самопожертвование фагоцитов, наблюдаемое в иммунной системе высших позвоночных. Эта древняя иммунная функция у социальных амеб предполагает эволюционно консервативный клеточный механизм добычи пищи, который мог быть адаптирован к защитным функциям задолго до диверсификации амеб в более высокие формы. [136] Фагоциты встречаются во всем животном мире, [1] от морских губок до насекомых и низших и высших позвоночных. [137] [138] Способность амеб различать своих и чужих является важнейшей и лежит в основе иммунной системы многих видов амеб. [6]