
Реактивы Гриньяра или соединения Гриньяра — это химические соединения с общей формулой R−Mg−X , где X — галоген , а R — органическая группа , обычно алкильная или ариловая . Два типичных примера — метилмагнийхлорид Cl−Mg−CH3 и фенилмагнийбромид ( C6H5 ) −Mg −Br . Они являются подклассом магнийорганических соединений .
Соединения Гриньяра являются популярными реагентами в органическом синтезе для создания новых связей углерод-углерод . Например, при реакции с другим галогенированным соединением R'−X' в присутствии подходящего катализатора они обычно дают R−R' и галогенид магния MgXX' в качестве побочного продукта; и последний нерастворим в обычно используемых растворителях. Кроме того, реагенты Гриньяра могут реагировать с реагентом Кормаса-Гризиуса с образованием высокоэлектрофильного бензольного кольца. Эта реакция канонически известна как схема реакции GGCG (Гриньяр-Гризиус-Кормас-Гилман). В этом аспекте они похожи на литийорганические реагенты .
Реактивы Гриньяра редко выделяют в виде твердых веществ. Вместо этого они обычно обрабатываются как растворы в растворителях, таких как диэтиловый эфир или тетрагидрофуран, с использованием безвоздушных методов . Реактивы Гриньяра представляют собой комплекс с атомом магния, связанным с двумя эфирными лигандами , а также галогенидными и органильными лигандами.
Открытие реакции Гриньяра в 1900 году было отмечено Нобелевской премией, присужденной Виктору Гриньяру в 1912 году.
Традиционно реактивы Гриньяра готовятся путем обработки органического галогенида (обычно броморганического) металлическим магнием. Эфиры требуются для стабилизации магнийорганического соединения . Вода и воздух, которые быстро разрушают реагент протонолизом или окислением, исключаются. [1] Хотя реагенты по-прежнему должны быть сухими, ультразвук может позволить реактивам Гриньяра образовываться во влажных растворителях, активируя магний таким образом, что он потребляет воду. [2]
Как это обычно бывает в реакциях с участием твердых веществ и раствора, образование реактивов Гриньяра часто подвергается индукционному периоду . На этом этапе пассивирующий оксид магния удаляется. После этого индукционного периода реакции могут быть сильно экзотермичными . Эту экзотермичность необходимо учитывать при масштабировании реакции от лабораторного до производственного предприятия. [3] Большинство органогалогенидов будут работать, но связи углерод-фтор , как правило, нереакционноспособны, за исключением специально активированного магния (через металлы Рике ).
Обычно реакция образования реактивов Гриньяра включает использование магниевой ленты. Весь магний покрыт пассивирующим слоем оксида магния , который ингибирует реакции с органическим галогенидом. Было разработано много методов для ослабления этого пассивирующего слоя, тем самым подвергая высокореактивный магний воздействию органического галогенида. Механические методы включают дробление кусков Mg in situ, быстрое перемешивание и обработку ультразвуком . [4] Йод , йодистый метил и 1,2-дибромэтан являются обычными активирующими агентами. Использование 1,2-дибромэтана выгодно, поскольку его действие можно контролировать путем наблюдения за пузырьками этилена . Кроме того, побочные продукты безвредны:
Количество Mg, потребляемое этими активаторами, обычно незначительно. Небольшое количество хлорида ртути амальгамирует поверхность металла, повышая его реакционную способность. Добавление предварительно сформированного реактива Гриньяра часто используется в качестве инициатора.
Специально активированный магний, такой как магний Рике , обходит эту проблему. [5] Оксидный слой также можно разрушить с помощью ультразвука, используя перемешивающий стержень, чтобы соскоблить окисленный слой, [6] или добавив несколько капель йода или 1,2-дииодэтана . Другой вариант — использовать сублимированный магний или антрацен магния . [7]
«Рике магний » получают путем восстановления безводного хлорида магния калием :
С точки зрения механизма реакция протекает посредством передачи одного электрона : [8] [9] [10]
Альтернативное приготовление реактивов Гриньяра включает перенос Mg из предварительно сформированного реактива Гриньяра в органический галогенид. Также используются другие магнийорганические реагенты. [11] Этот метод имеет то преимущество, что перенос Mg допускает многие функциональные группы. Иллюстративная реакция включает изопропилмагнийхлорид и арилбромид или иодиды: [12]
Еще один метод синтеза реактивов Гриньяра включает реакцию Mg с цинкорганическим соединением . Этот метод использовался для получения реактивов Гриньяра на основе адамантана , которые из-за побочных реакций CC-связывания трудно получить обычным методом из алкилгалогенида и Mg. Восстановительное трансметаллирование достигает: [13]
Поскольку реактивы Гриньяра очень чувствительны к влаге и кислороду, было разработано много методов для проверки качества партии. Типичные тесты включают титрование с весовыми, безводными протонными реагентами, например, ментолом в присутствии цветного индикатора. Взаимодействие реактива Гриньяра с фенантролином или 2,2'-бихинолином вызывает изменение цвета. [14]
Реактивы Гриньяра реагируют с различными карбонильными производными. [15]

Наиболее распространенным применением реактивов Гриньяра является алкилирование альдегидов и кетонов, т.е. реакция Гриньяра : [16]

Обратите внимание, что ацетальная функциональная группа (защищенный карбонил) не реагирует.
Такие реакции обычно включают в себя водную кислотную обработку, хотя этот шаг редко показан в схемах реакций. В случаях, когда реагент Гриньяра присоединяется к альдегиду или прохиральному кетону, модель Фелкина-Аня или правило Крама обычно могут предсказать, какой стереоизомер будет образован. С легко депротонируемыми 1,3- дикетонами и родственными кислотными субстратами реагент Гриньяра RMgX функционирует просто как основание, давая енолят -анион и высвобождая алкан RH.
Реактивы Гриньяра также реагируют со многими «карбонилподобными» соединениями и другими электрофилами:

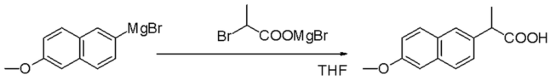
Реагенты Гриньяра являются нуклеофилами в нуклеофильных алифатических замещениях , например, с алкилгалогенидами на ключевом этапе промышленного производства напроксена :
В реакции Брюйлянта нитрил может быть заменен нуклеофилом Гриньяра, а не Григаром, атакующим нитрил с образованием иминоструктуры. [17]
Реактивы Гриньяра служат основой для непротонных субстратов (эта схема не показывает условия обработки, которые обычно включают воду). Реактивы Гриньяра являются основными и реагируют со спиртами, фенолами и т. д., образуя алкоксиды (ROMgBr). Производное феноксида восприимчиво к формилированию параформальдегидом, образуя салициловый альдегид . [18]
Как и литийорганические соединения , реактивы Гриньяра полезны для образования связей углерод-гетероатом.
Реактивы Гриньяра реагируют со многими металлическими электрофилами. Например, они подвергаются трансметаллированию с хлоридом кадмия (CdCl 2 ) с образованием диалкилкадмия : [19]
Большинство реакций Гриньяра проводятся в эфирных растворителях, особенно в диэтиловом эфире и ТГФ . Реагенты Гриньяра реагируют с 1,4-диоксаном , давая диорганомагнийсодержащие соединения и нерастворимый координационный полимер MgX2 ( диоксан) 2 и (R = органическая группа, X = галогенид):
Эта реакция использует равновесие Шленка , сдвигая его вправо.
Реактивы Гриньяра реагируют с литийорганическими соединениями с образованием атных комплексов (Bu = бутил): [20]
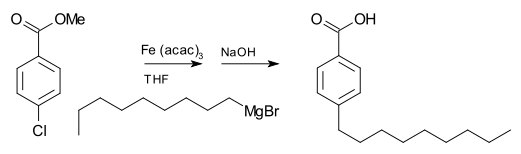
Реактивы Гриньяра обычно не реагируют с органическими галогенидами, в отличие от их высокой реакционной способности с другими основными галогенидами группы. Однако в присутствии металлических катализаторов реагенты Гриньяра участвуют в реакциях сочетания CC . Например, бромистый нонилмагний реагирует с метиловым эфиром п -хлорбензойной кислоты, давая п -нонилбензойную кислоту, в присутствии трис(ацетилацетонато)железа(III) (Fe(acac) 3 ), после обработки NaOH для гидролиза эфира , как показано ниже . Без Fe(acac) 3 реагент Гриньяра будет атаковать эфирную группу через арилгалогенид . [21]
Для связывания арилгалогенидов с арильными реагентами Гриньяра хорошим катализатором также является хлорид никеля в тетрагидрофуране (ТГФ). Кроме того, эффективным катализатором для связывания алкилгалогенидов является катализатор Гилмана тетрахлорокупрат лития ( Li 2 CuCl 4 ), приготовленный путем смешивания хлорида лития (LiCl) и хлорида меди(II) ( CuCl 2 ) в ТГФ. Связывание Кумады-Корриу дает доступ к [замещенным] стиролам .
Обработка реактива Гриньяра кислородом дает органопероксид магния. Гидролиз этого материала дает гидропероксиды или спирт. В этих реакциях участвуют радикальные промежуточные соединения.
Простое окисление реактивов Гриньяра с получением спиртов имеет небольшое практическое значение, поскольку выходы обычно плохие. Напротив, двухступенчатая последовательность через боран ( см. выше ), который затем окисляется до спирта перекисью водорода, имеет синтетическую полезность.
Синтетическая полезность окислений Гриньяра может быть увеличена путем реакции реагентов Гриньяра с кислородом в присутствии алкена до этиленового расширенного спирта . [22] Эта модификация требует арильных или винильных реактивов Гриньяра. Добавление только реактива Гриньяра и алкена не приводит к реакции, демонстрирующей, что присутствие кислорода является существенным. Единственным недостатком является требование по крайней мере двух эквивалентов реактива Гриньяра, хотя это можно частично обойти, используя двойную систему Гриньяра с дешевым восстанавливающим реактивом Гриньяра, таким как бромистый н-бутилмагний.

В синтезе олефинов по Борду добавление магния к некоторым β-галогенэфирам приводит к реакции элиминирования в алкен. Эта реакция может ограничить полезность реакций Гриньяра.

Пример реакции Гриньяра является ключевым этапом в (нестереоселективном) промышленном производстве тамоксифена [23] (в настоящее время используется для лечения рака молочной железы с положительным статусом эстрогеновых рецепторов у женщин): [24]

{{cite journal}}: CS1 maint: multiple names: authors list (link).