
Химический элемент — это химическое вещество , которое не может быть разбито на другие вещества химическими реакциями . Основная частица, составляющая химический элемент, — это атом . Элементы идентифицируются по числу протонов в их ядре, [1] известному как атомный номер элемента . [2] Например, кислород имеет атомный номер 8, что означает, что каждый атом кислорода имеет 8 протонов в своем ядре. Атомы одного и того же элемента могут иметь разное количество нейтронов в своих ядрах, известных как изотопы элемента. Два или более атомов могут объединяться, образуя молекулы . Химические соединения — это молекулы, состоящие из атомов разных элементов, в то время как смеси содержат атомы разных элементов, не обязательно объединенные в молекулы. Атомы могут преобразовываться в разные элементы в ядерных реакциях , которые изменяют атомный номер атома.
Почти вся барионная материя во Вселенной состоит из элементов (среди редких исключений — нейтронные звезды ). Когда различные элементы подвергаются химическим реакциям, атомы перестраиваются в новые соединения, удерживаемые вместе химическими связями . Только несколько элементов, таких как серебро и золото , встречаются в несвязанном виде в виде относительно чистых природных минералов элементов . Почти все другие встречающиеся в природе элементы встречаются на Земле в виде соединений или смесей. Воздух в основном представляет собой смесь молекулярного азота и кислорода , хотя он содержит соединения, включая углекислый газ и воду , а также атомарный аргон , благородный газ , который химически инертен и, следовательно, не вступает в химические реакции.
История открытия и использования элементов началась с ранних человеческих обществ , которые открыли такие природные минералы, как углерод , сера , медь и золото (хотя современная концепция элемента еще не была понята). Попытки классифицировать материалы, подобные этим, привели к появлению концепций классических элементов , алхимии и подобных теорий на протяжении всей истории. Большая часть современного понимания элементов развилась из работы Дмитрия Менделеева , русского химика, который опубликовал первую узнаваемую периодическую таблицу в 1869 году. Эта таблица организует элементы по возрастанию атомного номера в строки (« периоды »), в которых столбцы (« группы ») разделяют повторяющиеся («периодические») физические и химические свойства . Периодическая таблица суммирует различные свойства элементов, позволяя химикам выводить связи между ними и делать прогнозы относительно еще не открытых элементов и потенциальных новых соединений.
К ноябрю 2016 года Международный союз теоретической и прикладной химии (ИЮПАК) признал в общей сложности 118 элементов. Первые 94 встречаются в природе на Земле , а остальные 24 являются синтетическими элементами, полученными в ядерных реакциях. За исключением нестабильных радиоактивных элементов (радиоэлементов), которые быстро распадаются , почти все элементы доступны в промышленности в различных количествах. Открытие и синтез новых элементов является продолжающейся областью научных исследований.
Самые легкие элементы — водород и гелий , оба созданы в результате нуклеосинтеза Большого взрыва в первые 20 минут существования Вселенной [3] в соотношении около 3:1 по массе (или 12:1 по числу атомов), [4] [5] вместе с крошечными следами следующих двух элементов, лития и бериллия . Почти все другие элементы, обнаруженные в природе, были созданы различными естественными методами нуклеосинтеза . [6] На Земле небольшие количества новых атомов естественным образом производятся в нуклеогенных реакциях или в космогенных процессах, таких как расщепление космических лучей . Новые атомы также естественным образом производятся на Земле как радиогенные дочерние изотопы продолжающихся процессов радиоактивного распада , таких как альфа-распад , бета-распад , спонтанное деление , кластерный распад и другие более редкие режимы распада.
Из 94 встречающихся в природе элементов, те, у которых атомные номера от 1 до 82, имеют по крайней мере один стабильный изотоп (за исключением технеция , элемента 43, и прометия , элемента 61, у которых нет стабильных изотопов). Стабильными считаются те изотопы, для которых еще не наблюдалось радиоактивного распада. Элементы с атомными номерами от 83 до 94 нестабильны до такой степени, что радиоактивный распад всех изотопов может быть обнаружен. Некоторые из этих элементов, в частности висмут (атомный номер 83), торий (атомный номер 90) и уран (атомный номер 92), имеют один или несколько изотопов с периодами полураспада, достаточно длинными, чтобы выжить в качестве остатков взрывного звездного нуклеосинтеза , который произвел тяжелые металлы до образования нашей Солнечной системы . При более чем 1,9 × 1019 лет, что в миллиард раз больше предполагаемого возраста Вселенной, висмут-209 имеет самый длинный известный период полураспада альфа-распада среди всех изотопов и почти всегда рассматривается наравне с 80 стабильными элементами. [7] [8] Самые тяжелые элементы (после плутония, элемента 94) подвергаются радиоактивному распаду с периодами полураспада настолько короткими, что они не встречаются в природе и должны быть синтезированы .
В настоящее время известно 118 элементов. В этом контексте «известный» означает наблюдаемый достаточно хорошо, даже по нескольким продуктам распада, чтобы быть дифференцированным от других элементов. [9] [10] Совсем недавно, в октябре 2006 года, было сообщено о синтезе элемента 118 (с тех пор названного оганесоном ), а в апреле 2010 года было сообщено о синтезе элемента 117 ( теннессина ). [11] [12] Из этих 118 элементов 94 встречаются в природе на Земле. Шесть из них встречаются в экстремальных следовых количествах: технеций , атомный номер 43; прометий , номер 61; астат , номер 85; франций , номер 87; нептуний , номер 93; и плутоний , номер 94. Эти 94 элемента были обнаружены во всей Вселенной, в спектрах звезд, а также сверхновых, где вновь образуются короткоживущие радиоактивные элементы. Первые 94 элемента были обнаружены непосредственно на Земле в виде первичных нуклидов, присутствовавших при формировании Солнечной системы , или в виде естественных продуктов деления или трансмутации урана и тория.
Оставшиеся 24 более тяжелых элемента, не обнаруженных сегодня ни на Земле, ни в астрономических спектрах, были созданы искусственно: все они радиоактивны, с коротким периодом полураспада; если какой-либо из этих элементов присутствовал при формировании Земли, он наверняка полностью распался, а если и присутствует в новых, то в количествах, слишком малых, чтобы быть замеченным. Технеций был первым предположительно не встречающимся в природе элементом, синтезированным в 1937 году, хотя следовые количества технеция с тех пор были обнаружены в природе (а также элемент, возможно, был открыт естественным путем в 1925 году). [13] Эта модель искусственного производства и последующего естественного открытия была повторена с несколькими другими радиоактивными природными редкими элементами. [14]
Список элементов доступен по названию, атомному номеру, плотности, температуре плавления, температуре кипения и химическому символу , а также энергии ионизации . Нуклиды стабильных и радиоактивных элементов также доступны в виде списка нуклидов , отсортированных по продолжительности периода полураспада для тех, которые нестабильны. Одним из наиболее удобных и, безусловно, наиболее традиционных представлений элементов является представление в форме периодической таблицы, которая группирует элементы со схожими химическими свойствами (и обычно также схожими электронными структурами).
Атомный номер элемента равен числу протонов в каждом атоме и определяет элемент. [15] Например, все атомы углерода содержат 6 протонов в своем атомном ядре ; поэтому атомный номер углерода равен 6. [16] Атомы углерода могут иметь разное число нейтронов; атомы одного и того же элемента, имеющие разное число нейтронов, известны как изотопы элемента. [17]
Число протонов в ядре также определяет его электрический заряд , который, в свою очередь, определяет число электронов атома в неионизированном состоянии. Электроны размещаются на атомных орбиталях , которые определяют химические свойства атома . Число нейтронов в ядре обычно оказывает очень малое влияние на химические свойства элемента; за исключением водорода (для которого кинетический изотопный эффект является значительным). Таким образом, все изотопы углерода имеют почти идентичные химические свойства, поскольку все они имеют шесть электронов, хотя они могут иметь от 6 до 8 нейтронов. Вот почему атомный номер, а не массовое число или атомный вес , считается идентификационной характеристикой элемента.
Символ атомного номера — Z.
Изотопы — это атомы одного и того же элемента (то есть с одинаковым числом протонов в ядре), но имеющие разное число нейтронов . Так, например, существует три основных изотопа углерода. Все атомы углерода имеют 6 протонов, но они могут иметь либо 6, 7, либо 8 нейтронов. Поскольку их массовые числа равны 12, 13 и 14 соответственно, указанные три изотопа известны как углерод-12 , углерод-13 и углерод-14 ( 12C , 13C и 14C ). Природный углерод представляет собой смесь 12C ( около 98,9%), 13C (около 1,1%) и около 1 атома на триллион 14C .
Большинство (66 из 94) встречающихся в природе элементов имеют более одного стабильного изотопа. За исключением изотопов водорода (которые сильно отличаются друг от друга по относительной массе — достаточно, чтобы вызывать химические эффекты), изотопы данного элемента химически почти неразличимы.
Все элементы имеют радиоактивные изотопы (радиоизотопы); большинство из этих радиоизотопов не встречаются в природе. Радиоизотопы обычно распадаются на другие элементы посредством альфа-распада , бета-распада или обратного бета-распада ; некоторые изотопы самых тяжелых элементов также подвергаются спонтанному делению . Изотопы, которые не являются радиоактивными, называются «стабильными» изотопами. Все известные стабильные изотопы встречаются в природе (см. первичный нуклид ). Многие радиоизотопы, которые не встречаются в природе, были охарактеризованы после того, как были искусственно получены. Некоторые элементы не имеют стабильных изотопов и состоят только из радиоизотопов: в частности, элементами без каких-либо стабильных изотопов являются технеций (атомный номер 43), прометий (атомный номер 61) и все наблюдаемые элементы с атомным номером больше 82.
Из 80 элементов, имеющих хотя бы один стабильный изотоп, 26 имеют только один стабильный изотоп. Среднее число стабильных изотопов для 80 стабильных элементов составляет 3,1 стабильных изотопа на элемент. Наибольшее число стабильных изотопов для одного элемента составляет 10 (для олова , элемента 50).
Массовое число элемента, A , — это число нуклонов (протонов и нейтронов) в атомном ядре. Различные изотопы данного элемента различаются по их массовому числу, которое записывается как верхний индекс с левой стороны химического символа (например, 238 U). Массовое число всегда является целым числом и имеет единицу измерения «нуклоны». Таким образом, магний-24 (24 — массовое число) — это атом с 24 нуклонами (12 протонов и 12 нейтронов).
В то время как массовое число просто подсчитывает общее число нейтронов и протонов и, таким образом, является целым числом, атомная масса конкретного изотопа (или «нуклида») элемента является массой одного атома этого изотопа и обычно выражается в дальтонах (символ: Да) или универсальных атомных единицах массы (символ: u). Его относительная атомная масса является безразмерным числом, равным атомной массе, деленной на атомную массовую постоянную , которая равна 1 Да. В общем случае массовое число данного нуклида немного отличается по значению от его относительной атомной массы, поскольку масса каждого протона и нейтрона не равна точно 1 Да; поскольку электроны вносят меньшую долю в атомную массу, поскольку число нейтронов превышает число протонов; и из-за ядерной энергии связи и энергии связи электронов. Например, атомная масса хлора-35 с точностью до пяти значащих цифр составляет 34,969 Да, а хлора-37 — 36,966 Да. Однако относительная атомная масса каждого изотопа довольно близка к его массовому числу (всегда в пределах 1%). Единственный изотоп, атомная масса которого является точным натуральным числом, — это 12С , масса которого составляет 12 Да; поскольку дальтон определяется как 1/12 массы свободного нейтрального атома углерода-12 в основном состоянии.
Стандартный атомный вес (обычно называемый «атомным весом») элемента — это среднее значение атомных масс всех изотопов химического элемента, обнаруженных в конкретной среде, взвешенное по изотопному содержанию относительно атомной единицы массы. Это число может быть дробью, которая не близка к целому числу. Например, относительная атомная масса хлора составляет 35,453 а.е.м., что сильно отличается от целого числа, поскольку это среднее значение около 76% хлора-35 и 24% хлора-37. Всякий раз, когда относительное значение атомной массы отличается более чем на ~1% от целого числа, это происходит из-за этого эффекта усреднения, поскольку в образце этого элемента естественным образом присутствуют значительные количества более чем одного изотопа.
Химики и ядерщики имеют разные определения чистого элемента . В химии чистый элемент означает вещество, все атомы которого (или на практике почти все) имеют одинаковое атомное число или число протонов . Однако ядерщики определяют чистый элемент как элемент, состоящий только из одного изотопа. [18]
Например, медная проволока химически чиста на 99,99%, если 99,99% ее атомов — медь, по 29 протонов каждый. Однако она не является изотопно чистой, поскольку обычная медь состоит из двух стабильных изотопа, 69% 63 Cu и 31% 65 Cu, с разным числом нейтронов. Однако чистое золото было бы и химически, и изотопно чистым, поскольку обычное золото состоит только из одного изотопа, 197 Au.
Атомы химически чистых элементов могут связываться друг с другом химически более чем одним способом, что позволяет чистому элементу существовать в нескольких химических структурах ( пространственных расположениях атомов ), известных как аллотропы , которые различаются по своим свойствам. Например, углерод может быть найден в виде алмаза , который имеет тетраэдрическую структуру вокруг каждого атома углерода; графита , который имеет слои атомов углерода с гексагональной структурой, уложенные друг на друга; графена , который представляет собой один слой графита, который очень прочен; фуллеренов , которые имеют почти сферическую форму; и углеродных нанотрубок , которые представляют собой трубки с гексагональной структурой (даже они могут отличаться друг от друга по электрическим свойствам). Способность элемента существовать в одной из многих структурных форм известна как «аллотропия».
Исходное состояние элемента определяется по соглашению, обычно как термодинамически наиболее устойчивый аллотроп и физическое состояние при давлении 1 бар и заданной температуре (обычно при 298,15 К). Однако для фосфора исходным состоянием является белый фосфор, хотя он и не является самым устойчивым аллотропом, а исходным состоянием для углерода является графит, поскольку структура графита более стабильна, чем у других аллотропов. В термохимии элемент определяется как имеющий энтальпию образования, равную нулю, в своем исходном состоянии.
К элементам можно в целом применить несколько видов описательной категоризации, включая рассмотрение их общих физических и химических свойств, их состояний вещества в обычных условиях, их температур плавления и кипения, их плотности, их кристаллической структуры в твердых телах и их происхождения.
Для характеристики общих физических и химических свойств химических элементов обычно используются несколько терминов. Первое различие — между металлами , которые легко проводят электричество , неметаллами , которые этого не делают, и небольшой группой ( металлоидами ), имеющими промежуточные свойства и часто ведущими себя как полупроводники .
Более точная классификация часто представлена в цветных презентациях периодической таблицы. Эта система ограничивает термины «металл» и «неметалл» только некоторыми из более широко определенных металлов и неметаллов, добавляя дополнительные термины для определенных наборов более широко рассматриваемых металлов и неметаллов. Версия этой классификации, используемая в представленных здесь периодических таблицах, включает: актиниды , щелочные металлы , щелочноземельные металлы , галогены , лантаноиды , переходные металлы , постпереходные металлы , металлоиды , реактивные неметаллы и благородные газы . В этой системе щелочные металлы, щелочноземельные металлы и переходные металлы, а также лантаноиды и актиниды являются особыми группами металлов, рассматриваемых в более широком смысле. Аналогично реактивные неметаллы и благородные газы являются неметаллами, рассматриваемыми в более широком смысле. В некоторых презентациях галогены не различаются, при этом астат идентифицируется как металлоид, а другие идентифицируются как неметаллы.
Другим часто используемым основным различием между элементами является их состояние вещества (фаза), будь то твердое , жидкое или газообразное , при стандартной температуре и давлении (СТП). Большинство элементов являются твердыми веществами при СТП, в то время как некоторые являются газами. Только бром и ртуть являются жидкими при 0 градусов Цельсия (32 градуса Фаренгейта) и давлении 1 атмосфера; цезий и галлий являются твердыми при этой температуре, но плавятся при 28,4°C (83,2°F) и 29,8°C (85,6°F) соответственно.
Точки плавления и кипения , обычно выражаемые в градусах Цельсия при давлении в одну атмосферу, обычно используются для характеристики различных элементов. Хотя они известны для большинства элементов, одно или оба этих измерения все еще не определены для некоторых радиоактивных элементов, доступных только в малых количествах. Поскольку гелий остается жидким даже при абсолютном нуле при атмосферном давлении, в обычных представлениях он имеет только точку кипения, а не точку плавления.
Плотность при выбранной стандартной температуре и давлении (СТП) часто используется для характеристики элементов. Плотность часто выражается в граммах на кубический сантиметр (г/см 3 ) . Поскольку несколько элементов являются газами при обычно встречающихся температурах, их плотности обычно указываются для их газообразных форм; при сжижении или затвердевании газообразные элементы имеют плотности, аналогичные плотности других элементов.
Когда элемент имеет аллотропы с различной плотностью, один представительный аллотроп обычно выбирается в сводных презентациях, в то время как плотности для каждого аллотропа могут быть указаны там, где приводится более подробная информация. Например, три известных аллотропа углерода ( аморфный углерод , графит и алмаз ) имеют плотность 1,8–2,1, 2,267 и 3,515 г/см 3 соответственно.
Элементы, изученные на сегодняшний день в виде твердых образцов, имеют восемь типов кристаллических структур : кубическую , объемно-центрированную кубическую , гранецентрированную кубическую, гексагональную , моноклинную , орторомбическую , ромбоэдрическую и тетрагональную . Для некоторых из синтетически полученных трансурановых элементов имеющиеся образцы были слишком малы для определения кристаллических структур.
Химические элементы также можно классифицировать по их происхождению на Земле: первые 94 считаются естественными, тогда как элементы с атомными номерами свыше 94 были получены только искусственным путем посредством ядерных реакций, осуществляемых человеком.
Из 94 встречающихся в природе элементов 83 считаются первичными и либо стабильными , либо слабо радиоактивными. Самые долгоживущие изотопы оставшихся 11 элементов имеют периоды полураспада, слишком короткие для того, чтобы они присутствовали в начале Солнечной системы, и поэтому считаются переходными элементами. Из этих 11 переходных элементов пять ( полоний , радон , радий , актиний и протактиний ) являются относительно распространенными продуктами распада тория и урана . Остальные шесть переходных элементов (технеций, прометий, астат, франций , нептуний и плутоний ) встречаются лишь изредка, как продукты редких режимов распада или процессов ядерных реакций с участием урана или других тяжелых элементов.
Элементы с атомными номерами от 1 до 82, за исключением 43 (технеция) и 61 (прометия), имеют по крайней мере один изотоп, для которого не наблюдалось радиоактивного распада. Однако, как предсказывают, наблюдаемо стабильные изотопы некоторых элементов (таких как вольфрам и свинец ) будут слабо радиоактивными с очень длительными периодами полураспада: [19] например, периоды полураспада, предсказанные для наблюдательно стабильных изотопов свинца, находятся в диапазоне от 10 35 до 10 189 лет. Элементы с атомными номерами 43, 61 и 83 по 94 достаточно нестабильны, чтобы можно было обнаружить их радиоактивный распад. Три из этих элементов, висмут (элемент 83), торий (90) и уран (92), имеют один или несколько изотопов с периодами полураспада, достаточно длинными, чтобы выжить в качестве остатков взрывного звездного нуклеосинтеза , который произвел тяжелые элементы до образования Солнечной системы. Например, при более чем 1,9 × 1019 лет, что в миллиард раз больше предполагаемого возраста Вселенной, висмут-209 имеет самый длинный известный периодполураспада альфа-распада среди всех изотопов. [7] [8] Последние 24 элемента (после плутония, элемента 94) подвергаются радиоактивному распаду с короткими периодами полураспада и не могут быть получены как дочерние элементы более долгоживущих элементов, и поэтому, как известно, вообще не встречаются в природе.
Свойства элементов часто суммируются с помощью периодической таблицы, которая мощно и элегантно организует элементы путем увеличения атомного номера в строки ( «периоды» ), в которых столбцы ( «группы» ) разделяют повторяющиеся («периодические») физические и химические свойства. Таблица содержит 118 подтвержденных элементов по состоянию на 2021 год.
Хотя существуют и более ранние предшественники этой презентации, ее изобретение обычно приписывают русскому химику Дмитрию Менделееву в 1869 году, который намеревался с помощью таблицы проиллюстрировать повторяющиеся тенденции в свойствах элементов. Макет таблицы со временем совершенствовался и расширялся по мере открытия новых элементов и разработки новых теоретических моделей для объяснения химического поведения.
Использование периодической таблицы в настоящее время повсеместно в химии, обеспечивая чрезвычайно полезную основу для классификации, систематизации и сравнения всех многочисленных форм химического поведения. Таблица также нашла широкое применение в физике , геологии , биологии , материаловедении , машиностроении , сельском хозяйстве , медицине , питании , гигиене окружающей среды и астрономии . Ее принципы особенно важны в химической инженерии .
Различные химические элементы официально идентифицируются по их уникальным атомным номерам, принятым названиям и химическим символам .
Известные элементы имеют атомные номера от 1 до 118, традиционно представленные в виде арабских цифр . Поскольку элементы могут быть однозначно упорядочены по атомному номеру, традиционно от низшего к высшему (как в периодической таблице), наборы элементов иногда указываются такими обозначениями, как «через», «за пределами» или «от ... через», как в «через железо», «за пределами урана» или «от лантана до лютеция». Термины «легкий» и «тяжелый» иногда также используются неформально для обозначения относительных атомных номеров (не плотностей), как в «легче углерода» или «тяжелее свинца», хотя атомные массы элементов (их атомные веса или атомные массы) не всегда монотонно увеличиваются с их атомными номерами.
Наименование различных веществ, которые сейчас известны как элементы, предшествовало атомной теории материи, поскольку названия давались локально различными культурами различным минералам, металлам, соединениям, сплавам, смесям и другим материалам, хотя в то время не было известно, какие химические вещества являются элементами, а какие соединениями. Поскольку они были идентифицированы как элементы, существующие названия известных в древности элементов (например, золото, ртуть, железо) были сохранены в большинстве стран. Национальные различия возникли из-за названий элементов либо из соображений удобства, либо из-за языковых тонкостей, либо из-за национализма. Например, немецкие носители используют "Wasserstoff" (водное вещество) для "водорода", "Sauerstoff" (кислотное вещество) для "кислорода" и "Stickstoff" (удушающее вещество) для "азота"; английский и некоторые другие языки используют "sodium" для "natrium" и "potassium" для "kalium"; а французы, итальянцы, греки, португальцы и поляки предпочитают «azote/azot/azoto» (от корней, означающих «нет жизни») вместо «азот».
Для целей международной коммуникации и торговли официальные названия химических элементов, как древних, так и недавно признанных, определяются Международным союзом теоретической и прикладной химии (IUPAC), который принял решение о своего рода международном английском языке, опираясь на традиционные английские названия, даже если химический символ элемента основан на латинском или другом традиционном слове, например, приняв «gold» вместо «aurum» в качестве названия 79-го элемента (Au). IUPAC предпочитает британские написания « alluminium » и «caesium» американским «aluminum» и «cesium», а американское «sulfur» британскому «sulphur». Однако элементы, которые практично продавать оптом во многих странах, часто по-прежнему имеют местные национальные названия, и страны, национальные языки которых не используют латинский алфавит , скорее всего, будут использовать названия элементов IUPAC.
Согласно ИЮПАК, названия элементов не являются именами собственными; поэтому полное название элемента в английском языке не пишется с заглавной буквы, даже если оно образовано от имени собственного , как в californium и einsteinium . Названия изотопов также пишутся без заглавной буквы, например, carbon-12 или Iranian-235 . Символы химических элементов (например, Cf для californium и Es для einsteinium) всегда пишутся с заглавной буквы (см. ниже).
Во второй половине 20-го века физические лаборатории получили возможность производить элементы с периодами полураспада, слишком короткими для того, чтобы их могло существовать заметное количество в любое время. Они также названы ИЮПАК, который обычно принимает название, выбранное первооткрывателем. Такая практика может привести к спорному вопросу о том, какая исследовательская группа фактически открыла элемент, вопросу, который задержал присвоение названий элементам с атомным номером 104 и выше на значительное время. (См. споры о наименовании элементов ).
Предшественниками таких споров были националистические наименования элементов в конце 19 века. Например, лютеций был назван в честь Парижа, Франция. Немцы не хотели уступать права на наименование французам, часто называя его кассиопеем . Аналогично, британский открыватель ниобия первоначально назвал его колумбием , в честь Нового Света . Он широко использовался в этом качестве в американских публикациях до международной стандартизации (в 1950 году).
До того, как химия стала наукой , алхимики разработали тайные символы для металлов и обычных соединений. Однако они использовались в качестве сокращений в диаграммах или процедурах; не было концепции объединения атомов в молекулы . Благодаря своим достижениям в атомной теории материи Джон Дальтон разработал собственные более простые символы, основанные на кругах, для изображения молекул.
Современная система химических обозначений была изобретена Йенсом Якобом Берцелиусом в 1814 году. В этой системе химические символы — это не просто аббревиатуры, хотя каждая состоит из букв латинского алфавита . Они предназначены в качестве универсальных символов для людей всех языков и алфавитов.
Поскольку латынь была общепринятым языком науки во времена Берцелиуса, его символы были сокращениями, основанными на латинских названиях элементов (это могут быть классические латинские названия элементов, известные с античности, или неолатинские монеты для более поздних элементов). После символов не ставится точка, как в случае с сокращениями. В большинстве случаев латинские названия элементов, используемые Берцелиусом, имеют те же корни, что и современное английское название. Например, водород имеет символ «H» от неолатинского hydrogenium , который имеет те же греческие корни, что и английское hydrogen . Однако в одиннадцати случаях латинские (используемые Берцелиусом) и английские названия элементов имеют разные корни. Восемь из них — это семь металлов древности и металлоид, также известный с древности: «Fe» (лат. ferrum ) для железа , «Hg» (лат. hydrargyrum ) для ртути , «Sn» (лат. stannum ) для олова , «Au» (лат. aurum ) для золота, «Ag» (лат. argentum ) для серебра , «Pb» (лат. plumbum ) для свинца , «Cu» (лат. cuprum ) для меди и «Sb» (лат. stibium ) для сурьмы . Три других несоответствия между неолатинскими (как использовал Берцелиус) и английскими названиями — «Na» (неолатинский natrium ) для натрия , «K» (неолатинский kalium ) для калия и «W» (неолатинский wolframium ) для вольфрама . Эти несоответствия возникли из-за разных предложений по наименованию элементов в современную эпоху . Первоначально Берцелиус предложил «So» и «Po» для натрия и калия, но позже в том же году он изменил символы на «Na» и «K».
Элементам, открытым после 1814 года, также были присвоены уникальные химические символы, основанные на названии элемента. Использование латыни в качестве универсального языка науки постепенно исчезало, но химические названия вновь открытых элементов стали заимствоваться из языка в язык с небольшими изменениями или вообще без них. Символы элементов, открытых после 1814 года, соответствуют их названиям на английском, французском (игнорируя острый ударение на ⟨é⟩ ) и немецком языке (хотя немецкий язык часто допускает альтернативное написание с ⟨k⟩ или ⟨z⟩ вместо ⟨c⟩ : например, название кальция может быть написано Calcium или Kalzium на немецком языке, но его символ всегда «Ca»). Другие языки иногда изменяют написание названий элементов: испанский iterbio (иттербий), итальянский afnio (гафний), шведский moskovium (московий); но эти изменения не влияют на химические символы: Yb, Hf, Mc.
Химические символы понимаются на международном уровне, когда названия элементов могут потребовать перевода. В прошлом были некоторые различия. Например, немцы в прошлом использовали "J" (для названия Jod ) для йода, но теперь используют "I" и Iod .
Первая буква химического символа всегда заглавная, как в предыдущих примерах, а последующие буквы, если таковые имеются, всегда строчные. Таким образом, символы для калифорния и эйнштейния — Cf и Es.
В химических уравнениях также есть символы для групп элементов, например, в сравнительных формулах. Часто это одна заглавная буква, и буквы зарезервированы и не используются для названий конкретных элементов. Например, « X » обозначает переменную группу (обычно галоген) в классе соединений, в то время как « R » — это радикал , означающий структуру соединения, такую как углеводородная цепь. Буква « Q » зарезервирована для «тепла» в химической реакции. « Y » также часто используется как общий химический символ, хотя это также символ иттрия . « Z » также часто используется как общая переменная группа. « E » используется в органической химии для обозначения электроноакцепторной группы или электрофила ; аналогично « Nu » обозначает нуклеофил . « L » используется для обозначения общего лиганда в неорганической и металлоорганической химии . « M » также часто используется вместо общего металла.
Также неформально используются как минимум два других двухбуквенных общих химических символа: « Ln » для любого лантаноида и « An » для любого актиноида . « Rg » раньше использовалось для любого инертного газового элемента, но теперь группа инертных газов переименована в благородные газы , а « Rg » теперь относится к рентгению .
Изотопы элемента различаются по массовому числу (общее количество протонов и нейтронов), причем это число сочетается с символом элемента. ИЮПАК предпочитает, чтобы символы изотопов записывались в виде надстрочных обозначений, когда это практично, например, 12 C и 235 U. Однако используются и другие обозначения, такие как углерод-12 и уран-235 или C-12 и U-235.
В качестве особого случая три природных изотопа водорода часто обозначаются как H для 1 H ( протий ), D для 2 H ( дейтерий ) и T для 3 H ( тритий ). Такое соглашение проще использовать в химических уравнениях, поскольку оно устраняет необходимость каждый раз записывать массовое число. Таким образом, формула для тяжелой воды может быть записана как D 2 O вместо 2 H 2 O.

Только около 4% от общей массы Вселенной состоит из атомов или ионов , и, таким образом, представлена элементами. Эта фракция составляет около 15% от общей массы материи, а остальная часть материи (85%) является темной материей . Природа темной материи неизвестна, но она не состоит из атомов элементов, поскольку не содержит протонов, нейтронов или электронов. (Оставшаяся нематериальная часть массы Вселенной состоит из еще менее изученной темной энергии ).
94 встречающихся в природе элемента были получены по крайней мере четырьмя классами астрофизических процессов. Большая часть водорода, гелия и очень небольшое количество лития были получены в первые несколько минут Большого взрыва . Этот нуклеосинтез Большого взрыва произошел только один раз; другие процессы продолжаются. Ядерный синтез внутри звезд производит элементы посредством звездного нуклеосинтеза, включая все элементы от углерода до железа по атомному номеру. Элементы с более высоким атомным номером, чем железо, включая тяжелые элементы, такие как уран и плутоний, производятся различными формами взрывного нуклеосинтеза в сверхновых и слияниях нейтронных звезд . Легкие элементы литий , бериллий и бор производятся в основном посредством расщепления космических лучей (фрагментации, вызванной космическими лучами ) углерода, азота и кислорода.
На ранних этапах Большого взрыва нуклеосинтез водорода привел к образованию водорода-1 (протия, 1 H) и гелия-4 ( 4 He), а также меньшего количества дейтерия ( 2 H) и крошечных количеств (порядка 10 −10 ) лития и бериллия. Еще меньшие количества бора могли быть получены в Большом взрыве, поскольку он наблюдался в некоторых очень старых звездах, в то время как углерод не наблюдался. [22] Никакие элементы тяжелее бора не были произведены в Большом взрыве. В результате изначальное обилие атомов (или ионов) состояло из ~75% 1 H, 25% 4 He и 0,01% дейтерия, с лишь крошечными следами лития, бериллия и, возможно, бора. [23] Последующее обогащение галактических гало произошло из-за звездного нуклеосинтеза и нуклеосинтеза сверхновых . [24] Однако распространенность элементов в межгалактическом пространстве все еще может напоминать первичные условия, если только она не была обогащена каким-либо образом.

На Земле (и в других местах) следовые количества различных элементов продолжают производиться из других элементов как продукты процессов ядерной трансмутации . К ним относятся некоторые, произведенные космическими лучами или другими ядерными реакциями (см. космогенные и нуклеогенные нуклиды), и другие, произведенные как продукты распада долгоживущих первичных нуклидов. [25] Например, следовые (но обнаруживаемые) количества углерода-14 ( 14 C) постоянно производятся в воздухе космическими лучами, воздействующими на атомы азота, а аргон-40 ( 40 Ar) постоянно производится распадом изначально возникшего, но нестабильного калия-40 ( 40 K). Кроме того, три изначально возникших, но радиоактивных актинида, торий, уран и плутоний, распадаются через ряд повторно производимых, но нестабильных элементов, таких как радий и радон , которые временно присутствуют в любом образце, содержащем эти металлы. Три других радиоактивных элемента — технеций, прометий и нептуний — встречаются в природных материалах лишь случайно, образуясь в виде отдельных атомов в результате ядерного деления ядер различных тяжелых элементов или в других редких ядерных процессах.
Помимо 94 природных элементов, несколько искусственных элементов были получены с помощью ядерной физики . К 2016 году в ходе этих экспериментов были получены все элементы вплоть до атомного номера 118.
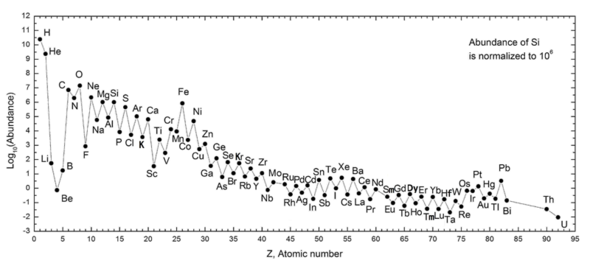
Следующий график (обратите внимание на логарифмическую шкалу) показывает распространенность элементов в нашей Солнечной системе. Таблица показывает 12 наиболее распространенных элементов в нашей галактике (оценено спектроскопически), измеренных в частях на миллион по массе . [26] Близлежащие галактики, которые развивались по схожим линиям, имеют соответствующее обогащение элементами тяжелее водорода и гелия. Более далекие галактики рассматриваются такими, какими они были в прошлом, поэтому их распространенность элементов кажется ближе к изначальной смеси. Однако, поскольку физические законы и процессы кажутся общими для всей видимой Вселенной , ученые ожидают, что эти галактики эволюционировали в схожем распространении элементов.
Распространенность элементов в Солнечной системе соответствует их происхождению из нуклеосинтеза во время Большого взрыва и ряда предшественников сверхновых звезд. Очень распространенные водород и гелий являются продуктами Большого взрыва, но следующие три элемента редки, поскольку у них было мало времени для образования во время Большого взрыва, и они не производятся в звездах (однако они производятся в небольших количествах путем распада более тяжелых элементов в межзвездной пыли в результате воздействия космических лучей). Начиная с углерода, элементы производятся в звездах путем накопления из альфа-частиц (ядер гелия), что приводит к попеременно большему распространению элементов с четными атомными номерами (они также более стабильны). В целом, такие элементы вплоть до железа производятся в больших звездах в процессе становления сверхновыми . Железо-56 особенно распространено, поскольку это самый стабильный нуклид, который можно легко получить из альфа-частиц (будучи продуктом распада радиоактивного никеля-56, в конечном итоге образованного из 14 ядер гелия). Элементы тяжелее железа образуются в ходе процессов поглощения энергии в крупных звездах, и их распространенность во Вселенной (и на Земле) обычно уменьшается с увеличением их атомного номера.
Распространенность химических элементов на Земле варьируется от воздуха до коры и океана, а также в различных типах жизни. Распространенность элементов в земной коре отличается от таковой в Солнечной системе (как видно на Солнце и массивных планетах, таких как Юпитер) в основном выборочной потерей самых легких элементов (водорода и гелия), а также летучих неона, углерода (в виде углеводородов), азота и серы в результате солнечного нагрева на раннем этапе формирования Солнечной системы. Кислород, самый распространенный элемент Земли по массе, удерживается на Земле в сочетании с кремнием. Алюминий в количестве 8% по массе более распространен в земной коре, чем во Вселенной и Солнечной системе, но состав гораздо более объемной мантии, в которой вместо алюминия (который встречается там только в количестве 2% массы) есть магний и железо, более точно отражает элементный состав Солнечной системы, за исключением отмеченной потери летучих элементов в космос и потери железа, которое мигрировало в ядро Земли.
Состав человеческого тела , напротив, более точно соответствует составу морской воды — за исключением того, что в человеческом теле имеются дополнительные запасы углерода и азота, необходимые для образования белков и нуклеиновых кислот , а также фосфора в нуклеиновых кислотах и молекулы переноса энергии аденозинтрифосфата (АТФ), которая встречается в клетках всех живых организмов. Определенным видам организмов требуются особые дополнительные элементы , например, магний в хлорофилле зеленых растений, кальций в раковинах моллюсков или железо в гемоглобине в эритроцитах позвоночных .
Понятие «элемент» как неделимое вещество развивалось в течение трех основных исторических этапов: классические определения (например, определения древних греков), химические определения и атомные определения.
Древняя философия постулировала набор классических элементов для объяснения наблюдаемых закономерностей в природе . Первоначально эти элементы относились к земле , воде , воздуху и огню, а не к химическим элементам современной науки.
Термин «элементы» ( stoicheia ) впервые был использован греческим философом Платоном около 360 г. до н. э. в его диалоге «Тимей» , который включает обсуждение состава неорганических и органических тел и является спекулятивным трактатом по химии. Платон считал, что элементы, введенные столетием ранее Эмпедоклом, состоят из небольших многогранных форм : тетраэдр (огонь), октаэдр (воздух), икосаэдр (вода) и куб (земля). [33] [34]
Аристотель , около 350 г. до н.э. , также использовал термин stoicheia и добавил пятый элемент, эфир , который образовал небеса. Аристотель определил элемент как:
Элемент – одно из тех тел, на которые могут разлагаться другие тела, и которое само не способно делиться на другие. [35]
.jpg/440px-Portret_van_Robert_Boyle,_RP-P-OB-4578_(cropped).jpg)
.jpg/440px-Sceptical_chymist_1661_Boyle_Title_page_AQ18_(3).jpg)
В 1661 году в «Скептическом химике» Роберт Бойль предложил свою теорию корпускуляризма, которая отдавала предпочтение анализу материи как состоящей из неприводимых единиц материи (атомов); и, не приняв ни взгляда Аристотеля на четыре элемента, ни взгляда Парацельса на три основных элемента, оставил открытым вопрос о количестве элементов. Бойль выступал против предопределенного числа элементов — прямо против трех принципов Парацельса (сера, ртуть и соль), косвенно против «аристотелевских» элементов (земля, вода, воздух и огонь), поскольку Бойль считал, что аргументы против первого были по крайней мере столь же обоснованы против второго.
Многое из того, что я собираюсь донести... может быть безразлично применено к четырем перипатетическим элементам и трем химическим принципам... поскольку химическая гипотеза, по-видимому, гораздо более подкреплена опытом, чем другая, будет целесообразно настаивать главным образом на ее опровержении; тем более, что большинство аргументов, которые используются против нее, могут, с небольшими изменениями, быть сделаны... по крайней мере столь же убедительными против менее правдоподобной, аристотелевской доктрины. [36]
Затем Бойль изложил свою точку зрения в четырех предложениях. В первом и втором он предполагает, что материя состоит из частиц, но что эти частицы может быть трудно разделить. Бойль использовал концепцию «корпускул» — или «атомов», [37] , как он их еще называл, — чтобы объяснить, как ограниченное число элементов может объединяться в огромное число соединений.
Предложение I. ... При первом Производстве смешанных Тел, Универсальная Материя, из которой они ... состояли, была фактически разделена на малые Частицы. [38] ... Генерация ... и истощение Тел ... и ... Химические Разложения смешанных Тел, и ... Операции ... Огня над ними ... обнаруживают, что они состоят из частей очень малых ... Эпикур ... как вы хорошо знаете, предполагает ... все ... Тела ... производятся ... Атомами, движущимися взад и вперед ... в ... Бесконечном Вакууме . [39] ... Предложение II. ... Эти мельчайшие Частицы ... были ... связаны в мельчайшие ... Кластеры ..., которые нелегко рассеять на такие Частицы, которые их составляли. [40] ... Если мы припишем Корпускулам, из которых состоит каждый Элемент, особый размер и форму... такие... Корпускулы могут быть смешаны в столь различных пропорциях и... связаны столь многими... способами, что из них может быть составлено почти невероятное количество... Конкретных веществ. [41]
Бойль объяснил, что золото реагирует с царской водкой , а ртуть — с азотной кислотой, серной кислотой и серой, образуя различные «соединения», и что их можно извлечь из этих соединений, как и следовало ожидать от элементов. Однако Бойль не рассматривал золото, [42] ртуть, [43] или свинец [42] как элементы, а скорее — вместе с вином [44] — «совершенно смешанные тела».
Ртуть... с Aqua fortis превратится в... белый порошок... с Sulfur он образует кроваво-красный... Cinaber. И все же из всех этих экзотических соединений мы можем получить тот же самый текущий Mercury. [45] ... Предложение III. ... Из большинства таких смешанных тел... с помощью огня можно фактически получить определенное число (будь то три, четыре или пять, или меньше или больше) субстанций... Химики имеют обыкновение называть ингредиенты смешанных тел принципами , как аристотелианцы называют их элементами . ... Принципы ... как не состоящие из каких-либо более первичных тел: и элементы , поскольку все смешанные тела составлены из них. [46]
Хотя Бойль в первую очередь считается первым современным химиком, «Скептический химик» все еще содержит старые идеи об элементах, чуждые современной точке зрения. Сера, например, не только знакомый желтый неметалл, но и горючий «дух». [44]

В 1724 году в своей книге «Логика » английский министр и логик Исаак Уоттс перечислил элементы, которые тогда признавали химики. Список элементов Уоттса включал два принципа Парацельса (серу и соль) и два классических элемента (землю и воду), а также «дух». Однако Уоттс отметил отсутствие консенсуса среди химиков. [47]
Элементы — это такие субстанции, которые не могут быть разделены или сведены к двум или более субстанциям различных видов. ... Последователи Аристотеля считали Огонь, Воздух, Землю и Воду четырьмя Элементами, из которых состоят все земные вещи; и они предполагали, что Небеса — это Квинтэссенция или пятый вид Тела, отличный от всех этих: Но с тех пор, как экспериментальная Философия... стала лучше понята, эта Доктрина была полностью опровергнута. Химики считают Дух, Соль, Серу, Воду и Землю своими пятью Элементами, потому что они могут свести все земные вещи к этим пяти: .. хотя они не все согласны.

Первый современный список элементов был дан в работе Антуана Лавуазье «Элементы химии» 1789 года , которая содержала 33 элемента, включая легкие и теплородные . [48] К 1818 году Йенс Якоб Берцелиус определил атомные веса для 45 из 49 принятых тогда элементов. У Дмитрия Менделеева в периодической таблице 1869 года было 63 элемента.

От Бойля до начала 20 века элемент определялся как чистое вещество, которое не может быть разложено на более простое вещество и не может быть преобразовано в другие элементы химическими процессами. Элементы в то время обычно различались по их атомным весам, свойству, которое можно было измерить с достаточной точностью с помощью имеющихся аналитических методов.

Открытие английским физиком Генри Мозли в 1913 году того, что заряд ядра является физической основой атомного числа, еще более уточненное, когда стала понятна природа протонов и нейтронов , в конечном итоге привело к современному определению элемента на основе атомного числа (числа протонов). Использование атомных чисел, а не атомных весов, для различения элементов имеет большую прогностическую ценность (поскольку эти числа являются целыми числами), а также разрешает некоторые двусмысленности в химическом представлении из-за различных свойств изотопов и аллотропов в пределах одного и того же элемента. В настоящее время ИЮПАК определяет элемент как существующий, если у него есть изотопы со временем жизни более 10−14 секунд , необходимых ядру для образования электронного облака. [49]
К 1914 году было известно восемьдесят семь элементов, все они встречались в природе (см. Открытие химических элементов ). Остальные встречающиеся в природе элементы были открыты или выделены в последующие десятилетия, а различные дополнительные элементы также были получены синтетически, причем большую часть этой работы пионером был Гленн Т. Сиборг . В 1955 году был открыт элемент 101, названный менделевием в честь Д. И. Менделеева, первого, кто расположил элементы в периодическом порядке.
Десять материалов, известных различным доисторическим культурам, теперь известны как элементы: углерод, медь, золото , железо, свинец, ртуть, серебро, сера, олово и цинк . Три дополнительных материала, которые теперь считаются элементами, мышьяк , сурьма и висмут , были признаны отдельными веществами до 1500 года нашей эры. Фосфор , кобальт и платина были выделены до 1750 года.
К 1900 году были идентифицированы и охарактеризованы большинство оставшихся природных элементов, в том числе:
Элементы, выделенные или полученные с 1900 года, включают:
Первым трансурановым элементом (элементом с атомным номером больше 92), открытым в 1940 году, был нептуний . С 1999 года совместная рабочая группа ИЮПАК/ИЮПАП рассматривала заявки на открытие новых элементов. По состоянию на январь 2016 года все 118 элементов были подтверждены ИЮПАК как открытые. Открытие элемента 112 было признано в 2009 году, и для него были предложены название коперниций и химический символ Cn . [50] Название и символ были официально одобрены ИЮПАК 19 февраля 2010 года. [51] Самым тяжелым элементом, который, как полагают, был синтезирован на сегодняшний день, является элемент 118, оганесон , 9 октября 2006 года в Лаборатории ядерных реакций имени Г. Н. Флерова в Дубне , Россия. [10] [52] Теннессин , элемент 117, был последним элементом, открытие которого было объявлено в 2009 году. [53] 28 ноября 2016 года ученые ИЮПАК официально признали названия четырех новейших элементов с атомными номерами 113, 115, 117 и 118. [54] [55]
В следующей сортируемой таблице показаны 118 известных элементов.