Бериллий — химический элемент ; он имеет символ Be и атомный номер 4. Это стально-серый, твердый, прочный, легкий и хрупкий щелочноземельный металл . Это двухвалентный элемент, который встречается в природе только в сочетании с другими элементами, образуя минералы. Драгоценные камни с высоким содержанием бериллия включают берилл ( аквамарин , изумруд , красный берилл ) и хризоберилл . Это относительно редкий элемент во Вселенной , обычно встречающийся как продукт расщепления более крупных атомных ядер, которые столкнулись с космическими лучами . В ядрах звезд бериллий истощается, поскольку он сплавляется в более тяжелые элементы. Бериллий составляет около 0,0004 процента по массе земной коры. Ежегодное производство бериллия в мире в размере 220 тонн обычно производится путем извлечения из минерала берилла , сложный процесс, поскольку берилл прочно связан с кислородом .
В структурных применениях сочетание высокой жесткости на изгиб , термической стабильности , теплопроводности и низкой плотности (в 1,85 раза больше, чем у воды) делает бериллий желанным аэрокосмическим материалом для компонентов самолетов, ракет , космических аппаратов и спутников . [9] Из-за своей низкой плотности и атомной массы бериллий относительно прозрачен для рентгеновских лучей и других форм ионизирующего излучения ; поэтому он является наиболее распространенным оконным материалом для рентгеновского оборудования и компонентов детекторов частиц . [9] При добавлении в качестве легирующего элемента к алюминию , меди (особенно сплаву бериллия с медью ), железу или никелю бериллий улучшает многие физические свойства. [9] Например, инструменты и компоненты, изготовленные из сплавов бериллия и меди , прочны и тверды и не создают искр при ударе о стальную поверхность. На воздухе поверхность бериллия легко окисляется при комнатной температуре, образуя пассивирующий слой толщиной 1–10 нм, который защищает его от дальнейшего окисления и коррозии. [10] Металл окисляется в массе (за пределами пассивирующего слоя) при нагревании выше 500 °C (932 °F), [11] и ярко горит при нагревании примерно до 2500 °C (4530 °F). [12]
Коммерческое использование бериллия требует постоянного использования соответствующего оборудования для контроля за пылью и промышленного контроля из-за токсичности вдыхаемой пыли, содержащей бериллий, которая может вызвать у некоторых людей хроническое опасное для жизни аллергическое заболевание — бериллиоз . [13] Берилиоз обычно проявляется хроническим легочным фиброзом , а в тяжелых случаях — правосторонней сердечной недостаточностью и смертью. [14]
Бериллий — это стальной серый и твердый металл , который является хрупким при комнатной температуре и имеет плотноупакованную гексагональную кристаллическую структуру . [9] Он обладает исключительной жесткостью ( модуль Юнга 287 ГПа) и температурой плавления 1287 °C. Модуль упругости бериллия примерно на 35% больше, чем у стали. Сочетание этого модуля и относительно низкой плотности приводит к необычно высокой скорости звукопроводимости в бериллии — около 12,9 км/с при условиях окружающей среды . Другие важные свойства — высокая удельная теплоемкость (1925 Дж·кг −1 ·К −1 ) и теплопроводность (216 Вт·м −1 ·К −1 ), что делает бериллий металлом с наилучшими характеристиками рассеивания тепла на единицу веса. В сочетании с относительно низким коэффициентом линейного теплового расширения (11,4 × 10−6 К − 1 ) эти характеристики приводят к уникальной стабильности в условиях термической нагрузки. [15]
Природный бериллий, за исключением небольшого загрязнения космогенными радиоизотопами, представляет собой изотопно чистый бериллий-9, ядерный спин которого равен 3/2 . Бериллий имеет большое сечение рассеяния для нейтронов высокой энергии, около 6 барн для энергий выше примерно 10 кэВ. Поэтому он работает как отражатель и замедлитель нейтронов , эффективно замедляя нейтроны до диапазона тепловой энергии ниже 0,03 эВ, где полное сечение по крайней мере на порядок ниже; точное значение сильно зависит от чистоты и размера кристаллитов в материале.
Единственный первичный изотоп бериллия 9 Be также подвергается реакции нейтронов (n,2n) с энергией нейтронов более 1,9 МэВ, чтобы произвести 8 Be , который почти немедленно распадается на две альфа-частицы. Таким образом, для нейтронов высокой энергии бериллий является нейтронным множителем, выделяя больше нейтронов, чем поглощает. Эта ядерная реакция выглядит так: [16]
Нейтроны высвобождаются, когда ядра бериллия сталкиваются с энергичными альфа-частицами [15], вызывая ядерную реакцию
где4
2Он
является альфа-частицей и12
6С
является ядром углерода-12 . [16]
Бериллий также испускает нейтроны при бомбардировке гамма-лучами. Таким образом, природный бериллий, бомбардируемый либо альфа-, либо гамма-лучами из подходящего радиоизотопа, является ключевым компонентом большинства радиоизотопных источников нейтронов для ядерной реакции для лабораторного производства свободных нейтронов.
Небольшие количества трития высвобождаются при9
4Быть
Ядра поглощают нейтроны низкой энергии в трехступенчатой ядерной реакции
6
2Он
имеет период полураспада всего 0,8 секунды, β − — это электрон, и6
3Ли
имеет высокое сечение поглощения нейтронов. Тритий является радиоизотопом, вызывающим беспокойство в потоках отходов ядерных реакторов. [17]
Как металл, бериллий прозрачен или полупрозрачен для большинства длин волн рентгеновских и гамма-лучей , что делает его полезным для выходных окон рентгеновских трубок и других подобных аппаратов. [18]
Как стабильные, так и нестабильные изотопы бериллия создаются в звездах, но радиоизотопы не сохраняются долго. Считается, что большая часть стабильного бериллия во Вселенной изначально была создана в межзвездной среде, когда космические лучи вызывали деление более тяжелых элементов, обнаруженных в межзвездном газе и пыли. [19] Первичный бериллий содержит только один стабильный изотоп, 9Be , и поэтому бериллий, в отличие от всех стабильных элементов с четным атомным числом, является моноизотопным и мононуклидным элементом .

Радиоактивный космогенный 10Be образуется в атмосфере Земли в результате расщепления кислорода космическими лучами . [20] 10Be накапливается на поверхности почвы , где его относительно длительный период полураспада (1,36 миллиона лет) обеспечивает длительное время пребывания до распада до бора -10. Таким образом, 10Be и его дочерние продукты используются для изучения естественной эрозии почвы , формирования почвы и развития латеритных почв , а также в качестве показателя для измерения изменений солнечной активности и возраста ледяных кернов . [21] Производство 10Be обратно пропорционально солнечной активности, поскольку усиление солнечного ветра в периоды высокой солнечной активности уменьшает поток галактических космических лучей, достигающих Земли. [20] Ядерные взрывы также образуют 10Be в результате реакции быстрых нейтронов с 13C в углекислом газе в воздухе. Это один из показателей прошлой активности на полигонах испытаний ядерного оружия . [22] Изотоп 7Be (период полураспада 53 дня) также является космогенным и обнаруживает обилие в атмосфере, связанное с солнечными пятнами, подобно 10Be .
8Be имеет очень короткий период полураспада, около 8 × 10−17 с, что способствует его значительной космологической роли, поскольку элементы тяжелее бериллия не могли быть получены путем ядерного синтеза в Большом взрыве . [23] Это связано с отсутствием достаточного времени во время фазы нуклеосинтеза Большого взрыва для производства углерода путем слияния ядер 4 He и очень низкой концентрацией доступного бериллия-8. Британский астроном сэр Фред Хойл впервые показал, что энергетические уровни 8 Be и 12 C позволяют производить углерод с помощью так называемого тройного альфа-процесса в звездах, работающих на гелии, где доступно больше времени нуклеосинтеза. Этот процесс позволяет углероду производиться в звездах, но не в Большом взрыве. Углерод, созданный звездами (основа углеродной жизни ), таким образом, является компонентом элементов в газе и пыли, выброшенных звездами AGB и сверхновыми (см. также нуклеосинтез Большого взрыва ), а также создание всех других элементов с атомными номерами, большими, чем у углерода. [24]
Электроны 2s бериллия могут способствовать образованию химических связей. Поэтому, когда 7 Be распадается посредством захвата L-электронов , он делает это, забирая электроны из своих атомных орбиталей , которые могут участвовать в образовании связей. Это делает скорость его распада в измеримой степени зависящей от его химического окружения – редкое явление при ядерном распаде. [25]
Самый короткоживущий известный изотоп бериллия — 16Be , который распадается посредством испускания нейтронов с периодом полураспада6,5 × 10−22 с . [26] Известно, что экзотические изотопы 11Be и 14Be обладают ядерным гало . [27] Это явление можно объяснить тем, что ядра 11Be и 14Be имеют соответственно 1 и 4 нейтрона, вращающихся по орбитам, существенно выходящим за пределы классической модели ядра Ферми «капля воды».


Концентрация бериллия на Солнце составляет 0,1 части на миллиард (ppb). [28] Концентрация бериллия в земной коре составляет от 2 до 6 частей на миллион (ppm), и он является 47-м по распространенности элементом. [29] [30] Наибольшая концентрация бериллия наблюдается в почвах — 6 ppm. [30] Следовые количества 9 Be обнаружены в атмосфере Земли. [30] Концентрация бериллия в морской воде составляет 0,2–0,6 частей на триллион . [30] [31] Однако в речной воде бериллия больше — его концентрация составляет 0,1 ppb. [32]
Бериллий содержится в более чем 100 минералах, [33] но большинство из них редки или не распространены. Наиболее распространенные минералы, содержащие берилл, включают: бертрандит (Be 4 Si 2 O 7 (OH) 2 ), берилл (Al 2 Be 3 Si 6 O 18 ), хризоберилл (Al 2 BeO 4 ) и фенакит (Be 2 SiO 4 ). Драгоценные формы берилла — аквамарин , красный берилл и изумруд . [15] [34] [35] Зеленый цвет в формах берилла ювелирного качества обусловлен различным количеством хрома (около 2% для изумруда). [36]
Две основные руды бериллия, берилл и бертрандит, находятся в Аргентине, Бразилии, Индии, Мадагаскаре, России и Соединенных Штатах. [36] Общие мировые запасы бериллиевой руды превышают 400 000 тонн. [36]
Извлечение бериллия из его соединений является сложным процессом из-за его высокого сродства к кислороду при повышенных температурах и его способности восстанавливать воду при удалении его оксидной пленки. В настоящее время США, Китай и Казахстан являются единственными тремя странами, участвующими в промышленной добыче бериллия. [37] Казахстан производит бериллий из концентрата, запасенного до распада Советского Союза около 1991 года. Этот ресурс был почти исчерпан к середине 2010-х годов. [38]
Производство бериллия в России было остановлено в 1997 году и планируется возобновить в 2020-х годах. [39] [40]
Бериллий чаще всего извлекается из минерала берилла , который либо спекается с использованием экстракционного агента, либо расплавляется в растворимую смесь. Процесс спекания включает смешивание берилла с фторосиликатом натрия и содой при 770 °C (1420 °F) для образования фторобериллата натрия , оксида алюминия и диоксида кремния . [9] Гидроксид бериллия осаждается из раствора фторобериллата натрия и гидроксида натрия в воде. Извлечение бериллия методом расплава включает измельчение берилла в порошок и нагревание его до 1650 °C (3000 °F). [9] Расплав быстро охлаждается водой, а затем повторно нагревается до 250–300 °C (482–572 °F) в концентрированной серной кислоте , в основном получая сульфат бериллия и сульфат алюминия . [9] Затем водный раствор аммиака используется для удаления алюминия и серы, оставляя гидроксид бериллия.
Гидроксид бериллия, полученный методом спекания или плавления, затем преобразуется во фторид бериллия или хлорид бериллия . Для образования фторида водный раствор фтористого аммония добавляется к гидроксиду бериллия, в результате чего образуется осадок тетрафторобериллата аммония , который нагревается до 1000 °C (1830 °F) для образования фторида бериллия. [9] Нагревание фторида до 900 °C (1650 °F) с магнием образует мелкодисперсный бериллий, а дополнительный нагрев до 1300 °C (2370 °F) создает компактный металл. [9] Нагревание гидроксида бериллия образует оксид бериллия , который становится хлоридом бериллия при соединении с углеродом и хлором. Электролиз расплавленного хлорида бериллия затем используется для получения металла. [9]
Бериллий имеет высокую электроотрицательность по сравнению с другими элементами группы 2; таким образом, связи C-Be менее поляризованы, чем другие связи CM II , [41], хотя присоединенный углерод все еще несет отрицательный дипольный момент .
Атом бериллия имеет электронную конфигурацию [He] 2s 2 . Преобладающая степень окисления бериллия - +2; атом бериллия потерял оба своих валентных электрона. Комплексы бериллия с более низкими степенями окисления встречаются чрезвычайно редко. Например, сообщалось о бис(карбеновых) соединениях, предположительно содержащих бериллий в степени окисления 0 и +1, хотя эти утверждения оказались спорными. [42] [43] Был описан стабильный комплекс со связью Be-Be, который формально представляет бериллий в степени окисления +1. [44] Химическое поведение бериллия в значительной степени является результатом его малых атомных и ионных радиусов. Таким образом, он имеет очень высокие потенциалы ионизации и сильную поляризацию при связывании с другими атомами, поэтому все его соединения являются ковалентными . Его химия имеет сходство с химией алюминия, пример диагональной связи .
При комнатной температуре поверхность бериллия образует слой оксидной пассивации толщиной 1-10 нм , который предотвращает дальнейшие реакции с воздухом, за исключением постепенного утолщения оксида примерно до 25 нм. При нагревании выше примерно 500 °C окисление в основной объем металла прогрессирует вдоль границ зерен. [11] После того, как металл воспламеняется на воздухе путем нагревания выше точки плавления оксида около 2500 °C, бериллий ярко горит, [12] образуя смесь оксида бериллия и нитрида бериллия . Бериллий легко растворяется в неокисляющих кислотах , таких как HCl и разбавленная H 2 SO 4 , но не в азотной кислоте или воде, поскольку это образует оксид. Это поведение похоже на поведение алюминия. Бериллий также растворяется в щелочных растворах. [9] [45]
Бинарные соединения бериллия(II) являются полимерными в твердом состоянии. BeF 2 имеет структуру, похожую на кремний , с тетраэдрами BeF 4 , общими по углам. BeCl 2 и BeBr 2 имеют цепочечные структуры с тетраэдрами, общими по ребрам. Оксид бериллия , BeO, представляет собой белое тугоплавкое твердое вещество, имеющее кристаллическую структуру вюрцита и теплопроводность, такую же высокую, как у некоторых металлов. BeO является амфотерным . Известны сульфид , селенид и теллурид бериллия, все имеющие структуру цинковой обманки . [46] Нитрид бериллия , Be 3 N 2 , является соединением с высокой температурой плавления, которое легко гидролизуется. Известен азид бериллия , BeN 6 , а фосфид бериллия, Be 3 P 2 имеет структуру, похожую на Be 3 N 2 . Известен ряд боридов бериллия, таких как Be5B , Be4B , Be2B , BeB2 , BeB6 и BeB12 . Карбид бериллия , Be2C , представляет собой тугоплавкое соединение кирпично-красного цвета, которое реагирует с водой с образованием метана . [46] Силицид бериллия не обнаружен. [45]
Галогениды BeX 2 (X = F, Cl, Br и I) имеют линейную мономерную молекулярную структуру в газовой фазе. [45] Комплексы галогенидов образуются с одним или несколькими лигандами, отдающими в общей сложности две пары электронов. Такие соединения подчиняются правилу октета . Другие 4-координационные комплексы, такие как акваион [Be(H 2 O) 4 ] 2+ , также подчиняются правилу октета.
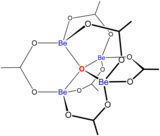
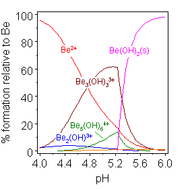
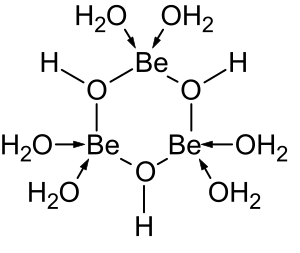
Растворы солей бериллия, такие как сульфат бериллия и нитрат бериллия , являются кислыми из-за гидролиза иона [Be(H 2 O) 4 ] 2+ . Концентрация первого продукта гидролиза, [Be(H 2 O) 3 (OH)] + , составляет менее 1% от концентрации бериллия. Наиболее стабильным продуктом гидролиза является тримерный ион [Be 3 (OH) 3 (H 2 O) 6 ] 3+ . Гидроксид бериллия , Be(OH) 2 , нерастворим в воде при pH 5 или более. Следовательно, соединения бериллия, как правило, нерастворимы при биологическом pH. Из-за этого вдыхание пыли металлического бериллия приводит к развитию фатального состояния бериллиоза . Be(OH) 2 растворяется в сильнощелочных растворах . [47]
Бериллий(II) образует мало комплексов с монодентатными лигандами, поскольку молекулы воды в акваионе [Be(H 2 O) 4 ] 2+ очень прочно связаны с ионом бериллия. Заметными исключениями являются ряд водорастворимых комплексов с фторид- ионом: [48]
Бериллий(II) образует множество комплексов с бидентатными лигандами, содержащими атомы-доноры кислорода. [47] Вид [Be 3 O(H 2 PO 4 ) 6 ] 2- примечателен тем, что в его центре находится 3-координированный оксидный ион. Основной ацетат бериллия , Be 4 O(OAc) 6 , имеет оксидный ион, окруженный тетраэдром атомов бериллия.
С органическими лигандами, такими как ион малоната , кислота депротонирует при образовании комплекса. Донорными атомами являются два кислорода. Образование комплекса конкурирует с реакцией гидролиза ионов металла, и также образуются смешанные комплексы как с анионом, так и с гидроксид-ионом. Например, известны производные циклического тримера, в котором бидентатный лиганд заменяет одну или несколько пар молекул воды. [49]
Алифатические гидроксикарбоновые кислоты, такие как гликолевая кислота, образуют довольно слабые монодентатные комплексы в растворе, в которых гидроксильная группа остается нетронутой. В твердом состоянии гидроксильная группа может депротонироваться: гексамер, был выделен давно. [49] [50] Ароматические гидроксилиганды (т.е. фенолы ) образуют относительно прочные комплексы. Например, для комплексов с тироном сообщалось о значениях log K 1 и log K 2 12,2 и 9,3 . [49] [51]
Бериллий, как правило, имеет довольно слабое сродство к аммиачным лигандам. [49] [52] Такие лиганды, как ЭДТА, ведут себя как дикарбоновые кислоты. [ требуется ссылка ] Существует много ранних сообщений о комплексах с аминокислотами, но, к сожалению, они не надежны, поскольку сопутствующие реакции гидролиза не были поняты на момент публикации. Сообщалось о значениях log β приблизительно от 6 до 7. Степень образования мала из-за конкуренции с реакциями гидролиза. [49] [52]
Химия органобериллия ограничена академическими исследованиями из-за стоимости и токсичности бериллия, производных бериллия и реагентов, необходимых для введения бериллия, таких как хлорид бериллия . Известно, что металлоорганические соединения бериллия обладают высокой реакционной способностью. [53] Примерами известных органобериллийсодержащих соединений являются динеопентилбериллий, [54] бериллоцен (Cp 2 Be), [55] [56] [57] [58] диаллилбериллий (по реакции обмена диэтилбериллия с триаллилбором), [59] бис(1,3-триметилсилилаллил)бериллий, [60] Be( mes ) 2 , [53] и (комплекс бериллия(I)) дибериллоцен. [44] Лигандами также могут быть арилы [61] и алкинилы. [62]
Минерал берилл , содержащий бериллий, использовался по крайней мере со времен династии Птолемеев в Египте. [63] В первом веке нашей эры римский натуралист Плиний Старший в своей энциклопедии «Естественная история» упомянул , что берилл и изумруд («smaragdus») похожи. [64] Papyrus Graecus Holmiensis , написанный в третьем или четвертом веке нашей эры, содержит заметки о том, как приготовить искусственный изумруд и берилл. [64]

Ранние анализы изумрудов и бериллов, проведенные Мартином Генрихом Клапротом , Торберном Улофом Бергманом , Францем Карлом Ахардом и Иоганном Якобом Биндхаймом всегда давали схожие элементы, что привело к ошибочному выводу о том, что оба вещества являются алюмосиликатами . [65] Минералог Рене Жюст Гаюи обнаружил, что оба кристалла геометрически идентичны, и попросил химика Луи-Николя Воклена провести химический анализ. [63]
В докладе 1798 года, прочитанном перед Институтом Франции , Воклен сообщил, что он нашел новую «землю», растворив гидроксид алюминия из изумруда и берилла в дополнительной щелочи . [66] Редакторы журнала Annales de chimie et de physique назвали новую землю «глюцином» из-за сладкого вкуса некоторых ее соединений. [67] Клапрот предпочел название «бериллий» из-за того, что иттрий также образовывал сладкие соли. [68] [69] Название бериллий впервые использовал Фридрих Вёлер в 1828 году. [70]

Фридрих Вёлер [71] и Антуан Бюсси [72] независимо друг от друга выделили бериллий в 1828 году с помощью химической реакции металлического калия с хлоридом бериллия следующим образом:
Используя спиртовую лампу, Вёлер нагревал чередующиеся слои хлорида бериллия и калия в платиновом тигле, закрытом проволокой. Вышеуказанная реакция немедленно произошла и заставила тигель раскалиться добела. После охлаждения и промывки полученного серо-черного порошка он увидел, что он состоит из мелких частиц с темным металлическим блеском. [73] Высокореактивный калий был получен электролизом его соединений, процессом, открытым 21 годом ранее. Химический метод с использованием калия дал только мелкие зерна бериллия, из которых нельзя было отлить или выковать слиток металла.
Прямой электролиз расплавленной смеси фторида бериллия и фторида натрия Полем Лебо в 1898 году привел к получению первых чистых (от 99,5 до 99,8%) образцов бериллия. [73] Однако промышленное производство началось только после Первой мировой войны. Первоначальное промышленное участие включало дочерние компании и ученых, связанных с Union Carbide and Carbon Corporation в Кливленде, штат Огайо, и Siemens & Halske AG в Берлине. В США процессом руководил Хью С. Купер, директор The Kemet Laboratories Company. В Германии первый коммерчески успешный процесс производства бериллия был разработан в 1921 году Альфредом Стоком и Гансом Гольдшмидтом . [74]
Образец бериллия был подвергнут бомбардировке альфа-лучами от распада радия в эксперименте 1932 года Джеймса Чедвика , который раскрыл существование нейтрона . [ 36] Этот же метод используется в одном классе лабораторных источников нейтронов на основе радиоизотопов , которые производят 30 нейтронов на каждый миллион α-частиц. [29]
Производство бериллия резко возросло во время Второй мировой войны из-за растущего спроса на твердые сплавы бериллия и меди и люминофоры для люминесцентных ламп . Большинство ранних люминесцентных ламп использовали ортосиликат цинка с различным содержанием бериллия для излучения зеленоватого света. Небольшие добавки вольфрамата магния улучшили синюю часть спектра, получив приемлемый белый свет. Люминофоры на основе галофосфата заменили люминофоры на основе бериллия после того, как было обнаружено, что бериллий токсичен. [75]
Электролиз смеси фторида бериллия и фторида натрия использовался для выделения бериллия в 19 веке. Высокая температура плавления металла делает этот процесс более энергозатратным, чем соответствующие процессы, используемые для щелочных металлов . В начале 20 века производство бериллия путем термического разложения иодида бериллия было исследовано после успеха аналогичного процесса для производства циркония , но этот процесс оказался неэкономичным для массового производства. [76]
Чистый металлический бериллий не был доступен до 1957 года, хотя он использовался в качестве легирующего металла для упрочнения и повышения жесткости меди гораздо раньше. [36] Бериллий можно было получить путем восстановления соединений бериллия, таких как хлорид бериллия, металлическим калием или натрием. В настоящее время большую часть бериллия производят путем восстановления фторида бериллия магнием . [ 77] Цена на американском рынке слитков бериллия, отлитых в вакууме, составляла около 338 долларов за фунт (745 долларов за килограмм) в 2001 году. [78]
В период с 1998 по 2008 год мировое производство бериллия сократилось с 343 до примерно 200 тонн . Затем к 2018 году оно возросло до 230 тонн, из которых 170 тонн поступило из Соединенных Штатов. [79] [80]
Бериллий был назван в честь полудрагоценного минерала берилла , из которого он был впервые выделен. [81] [82] [83] Название бериллий было введено Вёлером в 1828 году.
Хотя Хэмфри Дэви не удалось выделить его, он предложил название глюций для нового металла, полученное от названия земли, в которой он был найден, — глюцина ; измененные формы этого названия, глюциний или глюцинум (символ Gl) продолжали использоваться в 20 веке. [84] Бериллий и глюцин использовались одновременно до 1949 года, когда ИЮПАК принял бериллий в качестве стандартного названия элемента. [85]


Из-за своего низкого атомного числа и очень низкого поглощения рентгеновских лучей, старейшим и по-прежнему одним из самых важных применений бериллия является изготовление окон для излучения рентгеновских трубок . [36] Чрезвычайные требования предъявляются к чистоте и чистоте бериллия, чтобы избежать артефактов на рентгеновских снимках. Тонкие бериллиевые фольги используются в качестве окон для излучения рентгеновских детекторов, и их чрезвычайно низкое поглощение минимизирует эффекты нагрева, вызванные высокоинтенсивными, низкоэнергетическими рентгеновскими лучами, типичными для синхротронного излучения. Вакуумно-плотные окна и пучковые трубки для радиационных экспериментов на синхротронах изготавливаются исключительно из бериллия. В научных установках для различных исследований рентгеновского излучения (например, энергодисперсионной рентгеновской спектроскопии ) держатель образца обычно изготавливается из бериллия, поскольку его испускаемые рентгеновские лучи имеют гораздо более низкие энергии (≈100 эВ), чем рентгеновские лучи от большинства изученных материалов. [15]
Низкий атомный номер также делает бериллий относительно прозрачным для энергичных частиц . Поэтому он используется для создания пучковой трубы вокруг области столкновения в установках физики элементарных частиц , таких как все четыре основных эксперимента детекторов на Большом адронном коллайдере ( ALICE , ATLAS , CMS , LHCb ), [86] Теватроне и в SLAC . Низкая плотность бериллия позволяет продуктам столкновения достигать окружающих детекторов без значительного взаимодействия, его жесткость позволяет создавать мощный вакуум внутри трубы для минимизации взаимодействия с газами, его термическая стабильность позволяет ему правильно функционировать при температурах всего на несколько градусов выше абсолютного нуля , а его диамагнитная природа не позволяет ему мешать сложным многополюсным магнитным системам, используемым для управления и фокусировки пучков частиц . [ 87]
Из-за своей жесткости, легкого веса и размерной стабильности в широком диапазоне температур металлический бериллий используется для легких структурных компонентов в оборонной и аэрокосмической промышленности в высокоскоростных самолетах , управляемых ракетах , космических кораблях и спутниках , включая космический телескоп Джеймса Уэбба . Несколько жидкотопливных ракет использовали ракетные сопла, изготовленные из чистого бериллия. [88] [89] Сам порошок бериллия изучался в качестве ракетного топлива , но это использование так и не было реализовано. [36] Небольшое количество экстремально высококлассных велосипедных рам было изготовлено с использованием бериллия. [90] С 1998 по 2000 год команда McLaren Formula One использовала двигатели Mercedes-Benz с поршнями из сплава бериллия и алюминия . [91] Использование бериллиевых компонентов двигателей было запрещено после протеста Scuderia Ferrari . [92]
Смешивание около 2,0% бериллия с медью образует сплав, называемый бериллиевой медью , который в шесть раз прочнее, чем медь в чистом виде. [93] Бериллиевые сплавы используются во многих областях благодаря сочетанию эластичности, высокой электропроводности и теплопроводности , высокой прочности и твердости , немагнитных свойств, а также хорошей коррозионной и усталостной стойкости . [36] [9] Эти области применения включают в себя неискрящие инструменты, которые используются вблизи горючих газов (бериллиевый никель), пружины , мембраны (бериллиевый никель и бериллиевое железо), используемые в хирургических инструментах, и высокотемпературные устройства. [36] [9] Всего лишь 50 частей на миллион бериллия, легированного жидким магнием, приводит к значительному повышению стойкости к окислению и снижению воспламеняемости. [9]

Высокая упругая жесткость бериллия привела к его широкому использованию в точных приборах, например, в инерциальных системах наведения и в опорных механизмах оптических систем. [15] Сплавы бериллия и меди также применялись в качестве упрочняющего агента в « пистолетах Джейсона », которые использовались для снятия краски с корпусов кораблей. [94]
В системах звукоусиления скорость, с которой распространяется звук, напрямую влияет на резонансную частоту усилителя , тем самым влияя на диапазон слышимых высокочастотных звуков. Бериллий выделяется своей исключительно высокой скоростью распространения звука по сравнению с другими металлами. [95] Это уникальное свойство позволяет бериллию достигать более высоких резонансных частот, что делает его идеальным материалом для использования в качестве диафрагмы в высококачественных громкоговорителях. [96]
Бериллий использовался для изготовления иглодержателей в высокопроизводительных иглах звукоснимателей фонографов , где его чрезвычайная жесткость и низкая плотность позволяли уменьшить вес отслеживающего груза до 1 грамма, при этом отслеживая высокочастотные пассажи с минимальными искажениями. [97]
Ранее основным применением бериллия были тормоза для военных самолетов из-за его твердости, высокой температуры плавления и исключительной способности рассеивать тепло . Экологические соображения привели к замене другими материалами. [15]
Для снижения затрат бериллий можно сплавлять со значительным количеством алюминия , получая сплав AlBeMet (торговое название). Эта смесь дешевле чистого бериллия, при этом сохраняя многие желаемые свойства.
Бериллиевые зеркала представляют особый интерес. Зеркала большой площади, часто с сотовой структурой поддержки , используются, например, в метеорологических спутниках, где малый вес и долговременная размерная стабильность имеют решающее значение. Меньшие бериллиевые зеркала используются в оптических системах наведения и в системах управления огнем , например, в немецких основных боевых танках Leopard 1 и Leopard 2. В этих системах требуется очень быстрое перемещение зеркала, что снова диктует малую массу и высокую жесткость. Обычно бериллиевое зеркало покрыто твердым химическим никелевым покрытием , которое легче полируется до более тонкой оптической отделки, чем бериллиевое. В некоторых приложениях бериллиевая заготовка полируется без какого-либо покрытия. Это особенно применимо к криогенным операциям, где несоответствие теплового расширения может привести к короблению покрытия. [15]
Космический телескоп Джеймса Уэбба имеет 18 шестиугольных бериллиевых секций для своих зеркал, каждое из которых покрыто тонким слоем золота. [98] Поскольку JWST будет сталкиваться с температурой 33 К, зеркало изготовлено из позолоченного бериллия, который способен выдерживать экстремальные холода лучше, чем стекло. Бериллий сжимается и деформируется меньше, чем стекло, и остается более однородным при таких температурах. [99] По той же причине оптика космического телескопа Spitzer полностью изготовлена из металлического бериллия. [100]

Бериллий немагнитен. Поэтому инструменты, изготовленные из материалов на основе бериллия, используются военно-морскими или военными группами по обезвреживанию взрывоопасных предметов для работы на морских минах или вблизи них , поскольку эти мины обычно имеют магнитные взрыватели . [102] Они также встречаются в материалах для технического обслуживания и строительства вблизи аппаратов магнитно-резонансной томографии (МРТ) из-за генерируемых сильных магнитных полей. [103] В области радиосвязи и мощных (обычно военных) радаров ручные инструменты, изготовленные из бериллия, используются для настройки сильномагнитных клистронов , магнетронов , ламп бегущей волны и т. д., которые используются для генерации высоких уровней микроволновой мощности в передатчиках . [ требуется ссылка ]
Тонкие пластины или фольги из бериллия иногда используются в конструкциях ядерного оружия в качестве самого внешнего слоя плутониевых ям на первичных стадиях термоядерных бомб , размещаемых для окружения делящегося материала. Эти слои бериллия являются хорошими «толкателями» для имплозии плутония -239 , и они являются хорошими отражателями нейтронов , как и в ядерных реакторах с замедлителем на бериллии . [104]
Бериллий обычно используется в некоторых источниках нейтронов в лабораторных устройствах, в которых требуется относительно немного нейтронов (вместо того, чтобы использовать ядерный реактор или генератор нейтронов , работающий на ускорителе частиц ). Для этой цели мишень из бериллия-9 бомбардируется энергичными альфа-частицами из радиоизотопа, такого как полоний -210, радий -226, плутоний -238 или америций -241. В происходящей ядерной реакции ядро бериллия трансмутируется в углерод-12, и испускается один свободный нейтрон, движущийся примерно в том же направлении, в котором направлялась альфа-частица. Такие источники нейтронов из бериллия, управляемые альфа-распадом , называемые нейтронными инициаторами "urchin" , использовались в некоторых ранних атомных бомбах . [104] Источники нейтронов, в которых бериллий бомбардируется гамма-лучами из радиоизотопа гамма-распада , также используются для получения лабораторных нейтронов. [105]
Бериллий используется в изготовлении топлива для реакторов CANDU . Топливные элементы имеют небольшие придатки, которые припаяны к оболочке твэла с помощью индукционной пайки с Be в качестве припоя. Подшипниковые площадки припаиваются на месте, чтобы предотвратить контакт между топливным пучком и напорной трубой, содержащей его, а межэлементные прокладки припаиваются, чтобы предотвратить контакт элементов друг с другом.
Бериллий используется в Объединенной европейской исследовательской лаборатории ядерного синтеза «Торус» , и он будет использоваться в более продвинутом ИТЭР для кондиционирования компонентов, которые обращены к плазме. [106] Бериллий был предложен в качестве материала оболочки для ядерных топливных стержней из-за его хорошего сочетания механических, химических и ядерных свойств. [15] Фторид бериллия является одной из солей, входящих в состав эвтектической солевой смеси FLiBe , которая используется в качестве растворителя, замедлителя и охладителя во многих гипотетических конструкциях реакторов на расплавленных солях , включая реактор на жидком фториде тория (LFTR). [107]
Малый вес и высокая жесткость бериллия делают его полезным в качестве материала для высокочастотных динамиков . Поскольку бериллий дорог (во много раз дороже титана ), его трудно формировать из-за его хрупкости, и он токсичен при неправильном обращении, бериллиевые твитеры ограничены использованием в домашнем [108] [109] [110] высококачественном аудио и в системах оповещения . [111] [112] Некоторые высококачественные продукты были обманным путем заявлены как изготовленные из этого материала. [113]
В некоторых высококачественных картриджах для фонографов использовались бериллиевые кантилеверы для улучшения отслеживания за счет уменьшения массы. [114]
Бериллий является легирующей примесью p-типа в соединениях полупроводников III-V . Он широко используется в таких материалах, как GaAs , AlGaAs , InGaAs и InAlAs, выращенных методом молекулярно-лучевой эпитаксии (МЛЭ). [115] Лист бериллиевой крестообразной прокатки является превосходной структурной опорой для печатных плат в технологии поверхностного монтажа . В критических электронных приложениях бериллий является как структурной опорой, так и теплоотводом . Приложение также требует коэффициента теплового расширения , который хорошо соответствует подложкам из оксида алюминия и полиимидного стекла . Композитные материалы из оксида бериллия и оксида бериллия « E-Materials » были специально разработаны для этих электронных приложений и имеют дополнительное преимущество, заключающееся в том, что коэффициент теплового расширения может быть адаптирован для соответствия различным материалам подложки. [15]
Оксид бериллия полезен для многих применений, где требуются комбинированные свойства электроизолятора и превосходного проводника тепла, с высокой прочностью и твердостью и очень высокой температурой плавления. Оксид бериллия часто используется в качестве базовой пластины изолятора в мощных транзисторах в радиочастотных передатчиках для телекоммуникаций. Оксид бериллия изучается для использования в повышении теплопроводности ядерных топливных таблеток из диоксида урана . [116] Соединения бериллия использовались в люминесцентных осветительных трубках, но это использование было прекращено из-за болезни бериллиоз , которая развилась у рабочих, которые производили трубки. [117]
Бериллий является компонентом нескольких стоматологических сплавов . [118] [119] Бериллий используется в рентгеновских окнах, поскольку он прозрачен для рентгеновских лучей, что позволяет получать более четкие и эффективные изображения. [120] В медицинском диагностическом оборудовании, таком как компьютерные томографы и маммографы, прочность и легкий вес бериллия повышают долговечность и производительность. [121] Бериллий используется в аналитическом оборудовании для крови, ВИЧ и других заболеваний. [122] Бериллиевые сплавы используются в хирургических инструментах, оптических зеркалах и лазерных системах для лечения. [123] [124]
В среднем в организме человека содержится около 35 микрограммов бериллия, что не считается вредным. [126] Бериллий химически похож на магний и поэтому может вытеснять его из ферментов , что приводит к их сбоям. [126] Поскольку Be 2+ является сильно заряженным и небольшим ионом, он может легко проникать во многие ткани и клетки, где он специально нацелен на ядра клеток, ингибируя многие ферменты, включая те, которые используются для синтеза ДНК. Его токсичность усугубляется тем фактом, что организм не имеет возможности контролировать уровень бериллия, и, попав внутрь организма, бериллий не может быть удален. [127]
Хроническая бериллиевая болезнь (ХББ), или бериллиоз , является легочным и системным гранулематозным заболеванием, вызванным вдыханием пыли или паров, загрязненных бериллием; к этому недугу могут привести как большие количества в течение короткого времени, так и малые количества в течение длительного времени. Симптомы болезни могут развиваться в течение пяти лет; около трети пациентов с ней умирают, а выжившие остаются инвалидами. [126] Международное агентство по изучению рака (МАИР) относит бериллий и его соединения к канцерогенам категории 1. [128]
В США Управление по охране труда и промышленной гигиене (OSHA) установило допустимый предел воздействия (PEL) для бериллия и его соединений в размере 0,2 мкг/м 3 как средневзвешенное значение за 8 часов (TWA) и 2,0 мкг/м 3 как предел кратковременного воздействия за период выборки в 15 минут. Национальный институт охраны труда и промышленной гигиене (NIOSH) установил рекомендуемый верхний предел предела воздействия (REL) в размере 0,5 мкг/м 3 . Значение IDLH (непосредственно опасно для жизни и здоровья) составляет 4 мг/м 3 . [129] Токсичность бериллия сопоставима с другими токсичными металлоидами/металлами, такими как мышьяк и ртуть . [130] [131]
Воздействие бериллия на рабочем месте может привести к сенсибилизированному иммунному ответу и со временем к развитию бериллиоза . [132] NIOSH в США исследует эти эффекты в сотрудничестве с крупным производителем бериллиевой продукции. NIOSH также проводит генетические исследования сенсибилизации и КБД независимо от этого сотрудничества. [132]
Острая бериллиевая болезнь в форме химического пневмонита была впервые зарегистрирована в Европе в 1933 году, а в Соединенных Штатах — в 1943 году. Исследование показало, что около 5% рабочих на заводах по производству люминесцентных ламп в 1949 году в Соединенных Штатах имели заболевания легких, связанные с бериллием. [133] Хронический бериллиоз во многих отношениях напоминает саркоидоз , и дифференциальная диагностика часто затруднена. Он убил некоторых ранних работников, занимавшихся разработкой ядерного оружия, таких как Герберт Л. Андерсон . [134]
Бериллий может быть обнаружен в угольном шлаке. Когда шлак превращается в абразивный агент для очистки твердых поверхностей от краски и ржавчины, бериллий может попасть в воздух и стать источником воздействия. [135]
Хотя использование соединений бериллия в люминесцентных лампах было прекращено в 1949 году, потенциальная опасность воздействия бериллия существует в ядерной и аэрокосмической промышленности, при очистке металлического бериллия и плавке сплавов, содержащих бериллий, при производстве электронных устройств и при работе с другими материалами, содержащими бериллий. [136]
Ранние исследователи предприняли крайне опасную практику идентификации бериллия и его различных соединений по его сладкому вкусу. Современный тест на бериллий в воздухе и на поверхностях был разработан и опубликован в качестве международного добровольного консенсусного стандарта ASTM D7202. Процедура использует разбавленный бифторид аммония для растворения и флуоресцентного обнаружения с бериллием, связанным с сульфированным гидроксибензохинолином, что позволяет обнаруживать до 100 раз более чувствительное, чем рекомендуемый предел концентрации бериллия на рабочем месте. Флуоресценция увеличивается с увеличением концентрации бериллия. Новая процедура была успешно испытана на различных поверхностях и эффективна для растворения и обнаружения тугоплавкого оксида бериллия и кремнистого бериллия в малых концентрациях (ASTM D7458). [137] [138] Руководство по аналитическим методам NIOSH содержит методы измерения профессионального воздействия бериллия. [139]