
Синтетическая биология ( SynBio ) — это междисциплинарная область науки, которая фокусируется на живых системах и организмах и применяет инженерные принципы для разработки новых биологических частей, устройств и систем или для перепроектирования существующих систем, встречающихся в природе. [1]
Это отрасль науки, которая охватывает широкий спектр методологий из различных дисциплин, таких как биотехнология , биоматериалы , материаловедение/инженерия , генная инженерия , молекулярная биология , молекулярная инженерия , системная биология , мембранная наука , биофизика , химическая и биологическая инженерия . электротехника и вычислительная техника , техника управления и эволюционная биология .
Это включает в себя проектирование и конструирование биологических модулей , биологических систем и биологических машин или перепроектирование существующих биологических систем для полезных целей. [2]
Кроме того, это отрасль науки, которая фокусируется на новых способностях инженерии существующих организмов с целью перепроектирования их для полезных целей. [3]
Чтобы создать предсказуемые и надежные системы с новыми функциями, которые еще не существуют в природе, необходимо также применить инженерную парадигму проектирования систем к биологическим системам. По мнению Европейской комиссии, возможно, речь идет о молекулярном ассемблере, основанном на биомолекулярных системах, таких как рибосома. [4]
1910: Первое заметное использование термина « синтетическая биология» в публикации Стефана Ледюка «Теория физико-химической теории жизни и спонтанных поколений» . [5] Он также отметил этот термин в другой публикации, La Biologie Synthétique, в 1912 году. [6]
1944 : Канадско-американский учёный Освальд Эйвери показывает, что ДНК — это материал, из которого состоят гены и хромосомы . Это становится основой, на которой строятся все последующие генетические исследования. [7]
1953 : Фрэнсис Крик и Джеймс Уотсон публикуют структуру ДНК в природе .
1961: Джейкоб и Моно постулируют клеточную регуляцию с помощью молекулярных сетей на основе исследования lac -оперона в E. coli и предвидят возможность собирать новые системы из молекулярных компонентов. [8]
1973: Первое молекулярное клонирование и амплификация ДНК в плазмиде опубликовано в PNAS Коэном, Бойером и др. представляет собой рассвет синтетической биологии. [9]
1978: Арбер , Натанс и Смит получают Нобелевскую премию по физиологии и медицине за открытие ферментов рестрикции , что побудило Шибальского сделать редакционный комментарий в журнале Gene :
Работа над нуклеазами рестрикции не только позволяет нам легко конструировать молекулы рекомбинантной ДНК и анализировать отдельные гены, но также привела нас в новую эру синтетической биологии, где не только описываются и анализируются существующие гены, но также могут быть созданы новые структуры генов. и оценено. [10]
1988: Первая амплификация ДНК с помощью полимеразной цепной реакции (ПЦР) с использованием термостабильной ДНК-полимеразы опубликована в журнале Science Mullis et al. [11] Это позволило избежать добавления новой ДНК-полимеразы после каждого цикла ПЦР, что значительно упростило мутагенез и сборку ДНК.
2000: В двух статьях в журнале Nature сообщается о синтетических биологических схемах , генетическом переключателе и биологических часах, возникающих путем объединения генов в клетках E. coli . [12] [13]
2003: Том Найт изобрел наиболее широко используемые стандартизированные части ДНК, плазмиды BioBrick . [14] Эти детали станут центральными в Международном конкурсе генно-инженерных машин (iGEM), основанном в Массачусетском технологическом институте в следующем году.
2003: Исследователи разрабатывают путь предшественника артемизинина в E. coli . [15]
2004: В Массачусетском технологическом институте проводится первая международная конференция по синтетической биологии Synthetic Biology 1.0 (SB1.0).
2005: Исследователи разрабатывают светочувствительную схему в E. coli . [16] Другая группа разрабатывает схемы, способные формировать многоклеточные структуры. [17]
2006: Исследователи разрабатывают синтетическую схему, которая способствует бактериальной инвазии в опухолевые клетки. [18]
2010: Исследователи публикуют в журнале Science первый синтетический бактериальный геном под названием M. mycoides JCVI-syn1.0. [19] [20] Геном состоит из химически синтезированной ДНК с использованием дрожжевой рекомбинации.
2011: В дрожжах созданы функциональные синтетические плечи хромосом. [21]
2012: Лаборатории Шарпантье и Дудна публикуют в журнале Science информацию о программировании бактериального иммунитета CRISPR-Cas9 для направленного расщепления ДНК. [22] Эта технология значительно упростила и расширила редактирование генов эукариот.
2019: Ученые из ETH Zurich сообщают о создании первого бактериального генома под названием Caulobacter ethensis-2.0 , полностью созданного с помощью компьютера, хотя родственная жизнеспособная форма C. ethensis-2.0 еще не существует. [23] [24]
2019: Исследователи сообщают о создании новой синтетической (возможно, искусственной ) формы жизнеспособной жизни , варианта бактерий Escherichia coli , путем сокращения естественного числа 64 кодонов в бактериальном геноме до 59 кодонов вместо этого, чтобы кодировать 20 аминокислот. кислоты . [25] [26]
2020: Ученые создали первого ксенобота — программируемый синтетический организм, полученный из клеток лягушки и созданный искусственным интеллектом. [27]
2021: Ученые сообщили, что ксеноботы способны самовоспроизводиться, собирая рыхлые клетки в окружающей среде и затем формируя новых ксеноботов. [28]
Это область, масштабы которой расширяются с точки зрения системной интеграции, создания организмов и практических открытий. [1]
Инженеры рассматривают биологию как технологию (иными словами, данная система включает в себя биотехнологию или ее биологическую инженерию ). [29] Синтетическая биология включает в себя широкое переопределение и расширение биотехнологии с конечной целью создания возможности проектировать и создавать инженерные живые биологические системы, которые обрабатывают информацию, манипулируют химическими веществами, изготавливают материалы и структуры, производят энергию, обеспечивают пищу, а также поддерживают и поддерживают улучшить здоровье человека, а также расширить фундаментальные знания о биологических системах и нашей окружающей среде. [30]
Исследователи и компании, работающие в области синтетической биологии, используют силу природы для решения проблем в сельском хозяйстве, производстве и медицине. [3]
Благодаря более мощным возможностям генной инженерии и снижению затрат на синтез и секвенирование ДНК область синтетической биологии быстро растет. В 2016 году более 350 компаний в 40 странах активно занимались приложениями синтетической биологии; чистая стоимость всех этих компаний на мировом рынке оценивалась в 3,9 миллиарда долларов. [31] Синтетическая биология в настоящее время не имеет общепринятого определения. Вот несколько примеров:
Это наука о новой генетической и физической инженерии для создания новых (и, следовательно, синтетических) форм жизни. Для разработки организмов с новыми или улучшенными характеристиками эта новая область исследований объединяет знания и методы биологии, инженерии и смежных дисциплин для создания химически синтезированной ДНК. [32] [33]
Биомолекулярная инженерия включает подходы, направленные на создание набора функциональных единиц, которые можно внедрить для реализации новых технологических функций в живых клетках. Генная инженерия включает подходы к созданию синтетических хромосом или минимальных организмов, таких как Mycoplasma Laboratorium .
Биомолекулярный дизайн относится к общей идее дизайна de novo и аддитивной комбинации биомолекулярных компонентов. Каждый из этих подходов преследует схожую задачу: разработать более синтетический объект на более высоком уровне сложности, изобретательно манипулируя более простой частью на предыдущем уровне. [34] [35] Оптимизация этих экзогенных путей в неестественных системах требует итеративной тонкой настройки отдельных биомолекулярных компонентов для выбора самых высоких концентраций желаемого продукта. [36]
С другой стороны, «переписчики» — это синтетические биологи, заинтересованные в проверке нередуцируемости биологических систем. Из-за сложности естественных биологических систем было бы проще восстановить представляющие интерес природные системы с нуля; предоставить инженерные суррогаты, которые легче понять, контролировать и манипулировать. [37] Рерайтеры черпают вдохновение в рефакторинге — процессе, который иногда используется для улучшения компьютерного программного обеспечения.
Биоинженерия, синтетическая геномика, синтетическая биология протоклеток, нетрадиционная молекулярная биология и методы in silico — это пять категорий синтетической биологии. [38]
Необходимо рассмотреть различия и аналогии между категориями синтетической биологии для ее социальной и этической оценки, разграничить проблемы, затрагивающие всю область, и частные, относящиеся к конкретной. [38]
Подобласть биоинженерии концентрируется на создании новых метаболических и регуляторных путей и в настоящее время, вероятно, привлекает внимание большинства исследователей и финансирование. В первую очередь это мотивировано желанием сделать биотехнологию законной инженерной дисциплиной. Говоря об этой области синтетической биологии, слово «биоинженерия» не следует путать с «традиционной генной инженерией», которая предполагает введение единственного трансгена в предполагаемый организм. Биоинженеры адаптировали синтетическую биологию, чтобы обеспечить существенно более комплексный взгляд на то, как изменять организмы или метаболические системы. [38]
Типичным примером одногенной генной инженерии является вставка человеческого гена инсулина в бактерии для создания трансгенных белков. Создание совершенно новых сигнальных путей, содержащих многочисленные гены и регуляторные компоненты (таких как колебательный контур, инициирующий периодическое производство зеленого флуоресцентного белка (GFP) в клетках млекопитающих), известно как биоинженерия как часть синтетической биологии. [38]
Используя упрощенные и абстрактные метаболические и регуляторные модули, а также другие стандартизированные части, которые можно свободно комбинировать для создания новых путей или существ, биоинженерия стремится создать инновационные биологические системы. Ожидается, что эта стратегия не только создаст безграничные возможности для новых приложений, но и сделает биоинженерию более предсказуемой и контролируемой, чем традиционная биотехнология. [38]
Формирование животных с химически изготовленным (минимальным) геномом — еще один аспект синтетической биологии, который подчеркивается синтетической геномикой. Эта область синтетической биологии стала возможной благодаря постоянному развитию технологии синтеза ДНК, которая теперь позволяет производить молекулы ДНК с тысячами пар оснований по разумной цене. Цель состоит в том, чтобы объединить эти молекулы в полные геномы и трансплантировать их в живые клетки, заменив геном клетки-хозяина и перепрограммировав ее метаболизм для выполнения различных функций. [38]
Ученые ранее продемонстрировали потенциал этого подхода, создавая инфекционные вирусы путем синтеза геномов нескольких вирусов. Эти значительные достижения в области науки и техники вызвали первоначальную обеспокоенность общественности относительно рисков, связанных с этой технологией. [38]
Простой геном может также работать как «геном шасси», который можно быстро увеличить за счет включения генов, созданных для определенных задач. Такие «существа-шасси» больше подходят для внедрения новых функций, чем дикие организмы, поскольку у них будет меньше биологических путей, которые потенциально могут конфликтовать с новыми функциями, в дополнение к наличию определенных мест вставки. Синтетическая геномика стремится создать существ с новой «архитектурой», очень похожей на метод биоинженерии. Он принимает интегративный или целостный взгляд на организм. В этом случае целью является создание геномов шасси на основе необходимых генов и других необходимых последовательностей ДНК, а не разработка метаболических или регуляторных путей на основе абстрактных критериев. [38]
Генерация синтетических клеток in vitro является протоклеточной отраслью синтетической биологии. Липидные везикулы, которые имеют все необходимые компоненты для функционирования как целостной системы, могут быть использованы для создания таких искусственных клеток. В конце концов, эти синтетические клетки должны отвечать требованиям, позволяющим считаться живыми, а именно способности к самовоспроизведению, самоподдержанию и эволюции. Это конечная цель метода протоклеток, однако существуют и другие промежуточные шаги, которые не соответствуют всем критериям живой клетки. Для выполнения определенной функции эти липидные везикулы содержат клеточные экстракты или более специфические наборы биологических макромолекул и сложных структур, таких как ферменты, нуклеиновые кислоты или рибосомы. Например, липосомы могут осуществлять определенные полимеразные цепные реакции или синтезировать определенный белок. [38]
Синтетическая биология протоклеток приближает искусственную жизнь на шаг ближе к реальности, в конечном итоге синтезируя не только геном, но и каждый компонент клетки in vitro, в отличие от подхода синтетической геномики, который опирается на принуждение естественной клетки выполнять инструкции, закодированные введенный синтетический геном. Синтетические биологи в этой области рассматривают свою работу как фундаментальное исследование условий, необходимых для существования жизни и ее происхождения, больше, чем любые другие методы. Однако метод протоклеток также хорошо пригоден для применения; Подобно другим побочным продуктам синтетической биологии, протоклетки можно использовать для производства биополимеров и лекарств. [38]
Целью стратегии «неестественной молекулярной биологии» является создание новых разновидностей жизни, основанных на другом типе молекулярной биологии, например, на новых типах нуклеиновых кислот или новом генетическом коде. Создание новых типов нуклеотидов, которые могут быть встроены в уникальные нуклеиновые кислоты, может быть достигнуто путем изменения определенных компонентов ДНК или РНК, таких как основания или сахара основной цепи. [38]
Нормальный генетический код изменяется путем вставки четверных кодонов или изменения некоторых кодонов для кодирования новых аминокислот, что впоследствии позволит использовать неприродные аминокислоты с уникальными характеристиками в производстве белка. Настройка ферментативного аппарата клетки для обоих подходов является научной и технологической проблемой. [38]
Новый вид жизни будет сформирован организмами, геном которых будет построен на синтетических нуклеиновых кислотах или на совершенно новой системе кодирования синтетических аминокислот. Этот новый образ жизни будет иметь некоторые преимущества, но также и некоторые новые опасности. При выпуске в окружающую среду не будет горизонтального переноса генов или ауткроссинга генов с природными видами. Более того, подобные синтетические организмы могут быть созданы так, чтобы для синтеза белков или нуклеиновых кислот требовались неприродные материалы, что сделало бы их неспособными процветать в дикой природе, если бы они случайно сбежали. [38]
С другой стороны, если бы эти организмы в конечном итоге смогли выжить за пределами контролируемого космоса, они могли бы иметь особое преимущество перед природными организмами, поскольку были бы устойчивы к хищным живым организмам или природным вирусам, что могло бы привести к неконтролируемому распространению синтетических организмов. организмы. [38]
Синтетическая биология in silico и различные стратегии взаимосвязаны. Разработка сложных конструкций, будь то метаболические пути, фундаментальные клеточные процессы или геномы шасси, является одной из основных трудностей, с которыми сталкиваются четыре метода синтетической биологии, изложенные выше. По этой причине синтетическая биология имеет развитую ветвь in silico, аналогичную системной биологии, целью которой является создание вычислительных моделей для проектирования общих биологических компонентов или синтетических схем, которые по сути являются симуляциями синтетических организмов. [38]
Практическое применение симуляций и моделей в биоинженерии или других областях синтетической биологии является долгосрочной целью синтетической биологии in silico. Многие из компьютерных моделей синтетических организмов, созданных до сих пор, практически не имеют прямой аналогии с живыми существами. В связи с этим синтетическая биология in silico выделена в данной статье в отдельную группу. [38]
Целесообразно объединить пять областей под эгидой синтетической биологии как единую область исследований. Несмотря на то, что они сосредоточены на различных аспектах жизни, таких как регуляция обмена веществ, основные элементы или биохимический состав, все эти пять стратегий работают на одну и ту же цель: создание новых типов живых организмов. Кроме того, разнообразные методологии начинаются с многочисленных методологических подходов, что приводит к разнообразию подходов синтетической биологии. [38]
Синтетическая биология — это междисциплинарная область, основанная на множестве различных научных дисциплин, а не на какой-то одной области или методе. Все синтетические биологи преследуют одну и ту же основную цель — проектирование и создание новых форм жизни, несмотря на то, что они могут использовать различные методологии, методы и исследовательские инструменты. Любая оценка синтетической биологии, независимо от того, рассматривает ли она этические, юридические соображения или соображения безопасности, должна учитывать тот факт, что, хотя некоторые вопросы, риски и проблемы уникальны для каждого метода, в других обстоятельствах необходимо рассматривать синтетическую биологию в целом. во внимание. [38]
Синтетическая биология традиционно делится на четыре различных инженерных подхода: сверху вниз, параллельно, ортогонально и снизу вверх. [39]
Чтобы воспроизвести возникающее поведение из естественной биологии и создать искусственную жизнь, используются неестественные химические вещества. Другой ищет взаимозаменяемые компоненты биологических систем, чтобы соединить их и создать системы, которые не работают естественным образом. В любом случае синтетическая цель вынуждает исследователей выходить в новую область, чтобы заняться и решить проблемы, которые не могут быть легко решены путем анализа. В связи с этим возникают новые парадигмы, которые не могут быть легко реализованы при анализе. Помимо оборудования, которое колеблется, ползет и играет в крестики-нолики, синтетическая биология создала диагностические инструменты, которые улучшают лечение пациентов с инфекционными заболеваниями. [40]
Он предполагает использование методов метаболической и генной инженерии для придания новых функций живым клеткам. [41] Сравнивая универсальные гены и исключая несущественные для создания базового генома, этот метод стремится уменьшить сложность существующих клеток. Эти инициативы основаны на гипотезе единого происхождения клеточной жизни, так называемого « Последнего универсального общего предка» , которая подтверждает наличие универсального минимального генома, давшего начало всем живым существам. Однако недавние исследования открывают возможность того, что эукариотические и прокариотические клетки, составляющие древо жизни, могли возникнуть из группы первичных клеток, а не из одной клетки. В результате, даже несмотря на то, что стремление к «минимальному геному», подобно Святому Граалю, стало неуловимым, исключение ряда несущественных функций ухудшает приспособленность организма и приводит к «хрупким» геномам. [39]
Этот подход предполагает создание новых биологических систем in vitro путем объединения «неживых» биомолекулярных компонентов [42] , часто с целью создания искусственной клетки .
Воспроизведение, репликация и сборка — три важнейших принципа самоорганизации, которые принимаются во внимание для достижения этой цели. Клетки, состоящие из контейнера и метаболизма, считаются «аппаратным обеспечением» в определении воспроизводства, тогда как репликация происходит, когда система дублирует точную копию самой себя, как в случае с ДНК, которая считается «программным обеспечением». " Когда везикулы или контейнеры (такие как коацерваты Опарина) образуются из крошечных капель органических молекул, таких как липиды или липосомы, происходит агрегирование и сборка мембраноподобных структур, содержащих фосфолипиды. [39]
Изучение протоклеток существует наряду с другими инициативами в области синтетической биологии in vitro, которые направлены на производство минимальных клеток, метаболических путей или «нерожденных белков», а также на имитацию физиологических функций, включая деление и рост клеток. Улучшение синтетических путей in vitro действительно может оказать влияние на некоторые другие отрасли синтетической биологии, включая метаболическую инженерию, несмотря на то, что оно больше не классифицируется как исследования синтетической биологии. Это исследование, имеющее прежде всего важное значение, заслуживает должного признания как исследование синтетической биологии. [39]
Параллельная инженерия также известна как биоинженерия. Базовый генетический код является основой для параллельных инженерных исследований, в которых обычные биомолекулы, такие как нуклеиновые кислоты и 20 аминокислот, используются для построения биологических систем. Для различных приложений в области биокомпьютеров, биоэнергетики, биотоплива, биоремедиации, оптогенетики и медицины он включает стандартизацию компонентов ДНК, разработку переключателей, биосенсоров, генетических схем, логических вентилей и операторов сотовой связи. Для управления экспрессией двух или более генов и/или белков большинство этих приложений часто основано на использовании одного или нескольких векторов (или плазмид). Небольшие кольцевые двухцепочечные единицы ДНК, известные как плазмиды, которые в основном обнаруживаются в прокариотических клетках, но иногда могут обнаруживаться и в эукариотических клетках, могут реплицироваться автономно хромосомной ДНК. [39]
Это также известно как перпендикулярная инженерия. Эта стратегия, также называемая «химической синтетической биологией», главным образом направлена на изменение или расширение генетических кодов живых систем с использованием искусственных оснований ДНК и/или аминокислот. Это подразделение также связано с ксенобиологией , недавно разработанной областью, которая сочетает в себе системную химию, синтетическую биологию, экзобиологию и исследования происхождения жизни. В последние десятилетия исследователи создали соединения, структурно подобные каноническим основам ДНК, чтобы проверить, могут ли эти «чужеродные» или ксеномолекулы (XNA) использоваться в качестве носителей генетической информации. Аналогично этому, неканонические фрагменты заняли место сахара ДНК ( дезоксирибозы ). [39] Чтобы выразить информацию, отличную от 20 обычных аминокислот белков, генетический код может быть изменен или расширен. Один метод включает в себя включение определенной неприродной, неканонической или ксеноаминокислоты (ХАА) в один или несколько белков в одном или нескольких определенных местах с использованием ортогональных ферментов и адаптера транспортной РНК из другого организма. Используя «направленную эволюцию», которая влечет за собой повторяющиеся циклы мутагенеза генов (производство генотипического разнообразия), скрининга или отбора (специфического фенотипического признака) и амплификации лучшего варианта для следующего итерационного раунда, образуются ортогональные ферменты. был эффективно включен в белки более сложных существ, таких как черви и мухи, а также в бактерии, дрожжи и клеточные линии человека. В результате изменений канонических последовательностей ДНК направленная эволюция также позволяет развивать ортогональные рибосомы, которые облегчают включение XAA в белки или создают «зеркальную жизнь» или биологические системы, содержащие биомолекулы, состоящие из энантиомеров с различной хиральной ориентацией. [39]
Несколько новых технологий сыграли решающую роль в успехе синтетической биологии. Концепции включают стандартизацию биологических частей и иерархическую абстракцию, позволяющую использовать эти части в синтетических системах. [43] ДНК служит руководством к тому, как должны функционировать биологические процессы, подобно партитуре сложной симфонии жизни. Наша способность понимать и проектировать биологические системы претерпела значительные изменения в результате достижений последних нескольких десятилетий как в чтении (секвенировании), так и в записи (синтезе) последовательностей ДНК. Эти разработки позволили создать новаторские методы проектирования, сборки и модификации генов, материалов, цепей и метаболических путей, кодируемых ДНК, что позволяет постоянно увеличивать степень контроля над биологическими системами и даже целыми организмами. [44]
Базовые технологии включают чтение и запись ДНК (секвенирование и изготовление). Измерения в различных условиях необходимы для точного моделирования и автоматизированного проектирования (САПР).
Благодаря резкому снижению затрат на синтез олигонуклеотидов («олиго») и появлению ПЦР, размеры конструкций ДНК из олигонуклеотидов увеличились до геномного уровня. [45] В 2000 году исследователи сообщили о синтезе генома вируса гепатита С размером 9,6 кб (кило пар оснований) из химически синтезированных 60-80-меров. [46] В 2002 году исследователям из Университета Стоуни-Брук удалось синтезировать геном полиовируса длиной 7741 п.н. из его опубликованной последовательности, создав второй синтетический геном, продолжавшийся два года. [47] В 2003 году геном бактериофага Phi X 174 длиной 5386 п.о. был собран примерно за две недели. [48] В 2006 году та же команда из Института Дж. Крейга Вентера сконструировала и запатентовала синтетический геном новой минимальной бактерии Mycoplasma Laboratorium и работала над тем, чтобы заставить ее функционировать в живой клетке. [49] [50] [51]
В 2007 году сообщалось, что несколько компаний предлагали синтез генетических последовательностей длиной до 2000 пар оснований (п.н.) по цене около 1 доллара за п.н. и со сроком выполнения менее двух недель. [52] Олигонуклеотиды , собранные с фотолитографического или струйного ДНК-чипа в сочетании с ПЦР и коррекцией ошибок несоответствия ДНК, позволяют недорогим крупномасштабным изменениям кодонов в генетических системах улучшить экспрессию генов или включить новые аминокислоты ( см. Проекты синтетических клеток Чёрча и Энтони Форстера. [53] [54] ) . Это благоприятствует подходу синтеза с нуля.
Кроме того, система CRISPR/Cas стала многообещающим методом редактирования генов. Его охарактеризовали как «самую важную инновацию в области синтетической биологии почти за 30 лет». [55] В то время как другие методы требуют месяцев или лет для редактирования последовательностей генов, CRISPR ускоряет это время до недель. [55] Однако из-за простоты использования и доступности он вызвал этические проблемы, особенно в связи с его использованием в биохакинге . [56] [57] [58]
Секвенирование ДНК определяет порядок нуклеотидных оснований в молекуле ДНК. Синтетические биологи используют секвенирование ДНК в своей работе несколькими способами. Во-первых, крупномасштабные усилия по секвенированию генома продолжают предоставлять информацию о природных организмах. Эта информация обеспечивает богатую основу, из которой синтетические биологи могут конструировать детали и устройства. Во-вторых, секвенирование может подтвердить, что изготовленная система соответствует своему замыслу. В-третьих, быстрое, дешевое и надежное секвенирование может способствовать быстрому обнаружению и идентификации синтетических систем и организмов. [59]
Это способность системы или компонента работать без привязки к своему контексту. [60]
Наиболее часто используемые [61] : 22–23 стандартизированных части ДНК — это плазмиды BioBrick , изобретенные Томом Найтом в 2003 году . [14] Биокирпичики хранятся в Реестре стандартных биологических частей в Кембридже, штат Массачусетс. Стандарт BioBrick использовался десятками тысяч студентов по всему миру в международном конкурсе генно-инженерных машин (iGEM). Стандарт сборки BioBrick 10 способствует модульности, позволяя сращивать и заменять кодирующие последовательности BioBrick с помощью ферментов рестрикции EcoRI или XbaI (префикс BioBrick), а также SpeI и PstI (суффикс BioBrick). [61] : 22–23
Перекрытие последовательностей между двумя генетическими элементами ( генами или кодирующими последовательностями ), называемое перекрывающимися генами , может предотвратить их индивидуальное манипулирование. [62] Чтобы повысить модульность генома, практика рефакторинга генома или улучшения «внутренней структуры существующей системы для будущего использования при одновременном сохранении внешней функции системы» [63] была принята во всех дисциплинах синтетической биологии. [62] Некоторые примечательные примеры рефакторинга, включая кластер фиксации азота [64] и систему секреции типа III [65], а также бактериофаги T7 [63] и ΦX174. [66]
Хотя ДНК наиболее важна для хранения информации, большая часть клеточной деятельности осуществляется белками. Инструменты могут отправлять белки в определенные области клетки и связывать разные белки вместе. Сила взаимодействия между белками-партнерами должна регулироваться в диапазоне от нескольких секунд (желательно для динамических сигнальных событий) до необратимого взаимодействия (желательно для стабильности устройства или устойчивости к суровым условиям). Такой контроль обеспечивают такие взаимодействия, как спиральные спирали , [67] связывание домена SH3 с пептидом [68] или SpyTag/SpyCatcher [69] . Кроме того, необходимо регулировать белок-белковые взаимодействия в клетках, например, со светом (с использованием доменов, чувствительных к свету, кислороду и напряжению ) или проницаемыми для клеток небольшими молекулами путем химически индуцированной димеризации . [70]
В живой клетке молекулярные мотивы встроены в более крупную сеть с вышестоящими и нижестоящими компонентами. Эти компоненты могут изменить возможности сигнализации модуля моделирования. В случае сверхчувствительных модулей вклад чувствительности модуля может отличаться от чувствительности, которую модуль поддерживает изолированно. [71] [72]
Модели служат основой для проектирования инженерных биологических систем, лучше предсказывая поведение системы до ее изготовления. Синтетическая биология извлекает выгоду из лучших моделей того, как биологические молекулы связывают субстраты и катализируют реакции, как ДНК кодирует информацию, необходимую для определения клетки, и как ведут себя многокомпонентные интегрированные системы. Многомасштабные модели сетей генной регуляции ориентированы на приложения синтетической биологии. Моделирование может моделировать все биомолекулярные взаимодействия в транскрипции , трансляции , регуляции и индукции генных регуляторных сетей. [73] [74] [75] [76]
Только обширное моделирование может позволить изучить динамическую экспрессию генов в форме, подходящей для исследований и проектирования, из-за большого количества задействованных видов и сложности их взаимоотношений. Динамическое моделирование всех биомолекулярных взаимосвязей, участвующих в регуляции, транспорте, транскрипции, индукции и трансляции, позволяет детализировать конструкции на молекулярном уровне. В отличие от моделирования искусственных сетей апостериорно, это контрастирует. [77]
Микрофлюидика , в частности капельная микрофлюидика, — это новый инструмент, используемый для создания новых компонентов, а также для их анализа и характеристики. [78] [79] Он широко используется в скрининговых анализах. [80]
Исследования рассмотрели компоненты механизма транскрипции ДНК . Одним из желаний ученых, создающих синтетические биологические схемы , является возможность контролировать транскрипцию синтетической ДНК в одноклеточных организмах ( прокариотах ) и в многоклеточных организмах ( эукариотах ). В одном исследовании проверялась регулируемость синтетических транскрипционных факторов (sTF) в областях транскрипционной продукции и кооперативной способности среди множества комплексов транскрипционных факторов. [81] Исследователи смогли мутировать функциональные области, называемые цинковыми пальцами , ДНК-специфический компонент sTF, чтобы уменьшить их сродство к конкретным сайтам последовательности операторной ДНК и, таким образом, уменьшить связанную с этим сайт-специфическую активность sTF (обычно регуляцию транскрипции). Далее они использовали цинковые пальцы в качестве компонентов комплексообразующих sTF, которые являются механизмами трансляции эукариот . [81]
Инициативы в области синтетической биологии часто направлены на перепроектирование организмов, чтобы они могли создавать материалы, такие как лекарства или топливо, или приобретать новые функции, такие как способность чувствовать что-то в окружающей среде. Примеры того, что исследователи создают с помощью синтетической биологии, включают:
Под биосенсором понимается сконструированный организм, обычно бактерия, который способен сообщать о некоторых явлениях окружающей среды, таких как присутствие тяжелых металлов или токсинов. Одной из таких систем является оперон Lux Aliivibrio fischeri [83] , который кодирует фермент, который является источником бактериальной биолюминесценции , и может быть помещен после соответствующего промотора для экспрессии генов люминесценции в ответ на определенный стимул окружающей среды. [84] Один из таких созданных датчиков представлял собой биолюминесцентное бактериальное покрытие на светочувствительном компьютерном чипе для обнаружения определенных загрязнителей нефти . Когда бактерии чувствуют загрязняющее вещество, они люминесцируют. [85] Другим примером подобного механизма является обнаружение мин с помощью сконструированного репортерного штамма E.coli , способного обнаруживать TNT и его основной продукт деградации DNT и, следовательно, производить зеленый флуоресцентный белок ( GFP ). [86]
Модифицированные организмы могут воспринимать сигналы окружающей среды и посылать выходные сигналы, которые можно обнаружить и использовать в диагностических целях. Использовались когорты микробов. [87]
Биосенсоры также могут использоваться для обнаружения патогенных сигнатур, таких как SARS-CoV-2 , и могут быть носимыми . [88] [89]
С целью обнаружения и реагирования на различные временные факторы окружающей среды клетки разработали широкий спектр регуляторных цепей, от транскрипционных до посттрансляционных. Эти схемы состоят из модулей преобразователей, которые фильтруют сигналы и активируют биологический ответ, а также тщательно спроектированных чувствительных секций, которые присоединяют аналиты и регулируют пороги обнаружения сигналов. Модульность и селективность запрограммированы в биосенсорных цепях на транскрипционном, трансляционном и посттрансляционном уровнях для достижения тонкого баланса двух основных сенсорных модулей. [90]
Однако не все синтетические продукты питания являются продуктами питания для животных – например, по состоянию на 2021 год существуют также продукты из синтетического кофе , которые, как сообщается, близки к коммерциализации. [98] [99] [100] Аналогичными областями исследований и производства на основе синтетической биологии, которые можно использовать для производства продуктов питания и напитков, являются:
Фотосинтезирующие микробные клетки использовались как шаг к синтетическому производству паучьего шелка . [105] [106]
Биологический компьютер относится к инженерной биологической системе, которая может выполнять операции, подобные компьютеру, что является доминирующей парадигмой в синтетической биологии. Исследователи построили и охарактеризовали различные логические элементы в ряде организмов [107] и продемонстрировали как аналоговые, так и цифровые вычисления в живых клетках. Они продемонстрировали, что бактерии можно спроектировать для выполнения как аналоговых, так и/или цифровых вычислений. [108] [109] В 2007 году исследование человеческих клеток продемонстрировало универсальный логический вычислитель, который работает в клетках млекопитающих. [110] Впоследствии в 2011 году исследователи использовали эту парадигму для демонстрации экспериментальной терапии, в которой используются биологические цифровые вычисления для обнаружения и уничтожения раковых клеток человека. [111] В 2016 году другая группа исследователей продемонстрировала, что принципы компьютерной инженерии могут использоваться для автоматизации проектирования цифровых схем в бактериальных клетках. [112] В 2017 году исследователи продемонстрировали систему «булева логика и арифметика посредством вырезания ДНК» (BLADE) для создания цифровых вычислений в клетках человека. [113] В 2019 году исследователи внедрили перцептрон в биологические системы, открыв путь машинному обучению в этих системах. [114]
Клетки используют взаимодействующие гены и белки, которые называются генными цепями, для реализации разнообразных функций, таких как реагирование на сигналы окружающей среды, принятие решений и общение. Задействованы три ключевых компонента: ДНК, РНК и синтетические биологи, разработанные генными цепями, которые могут контролировать экспрессию генов на нескольких уровнях, включая транскрипционный, посттранскрипционный и трансляционный уровни.
Традиционная метаболическая инженерия получила развитие благодаря внедрению комбинаций чужеродных генов и оптимизации путем направленной эволюции. Это включает в себя разработку E. coli и дрожжей для коммерческого производства предшественника противомалярийного препарата Артемизинин . [115]
Целые организмы еще предстоит создать с нуля, хотя живые клетки можно трансформировать с помощью новой ДНК. Несколько способов позволяют создавать синтетические компоненты ДНК и даже целые синтетические геномы , но как только желаемый генетический код получен, он интегрируется в живую клетку, которая, как ожидается, будет проявлять желаемые новые способности или фенотипы во время роста и процветания. [116] Трансформация клеток используется для создания биологических цепей , которыми можно манипулировать для получения желаемых результатов. [12] [13]
Объединив синтетическую биологию с материаловедением , можно было бы использовать клетки в качестве микроскопических молекулярных фабрик для производства материалов, свойства которых были бы генетически закодированы. Реинжиниринг позволил создать волокна Керли, амилоидный компонент внеклеточного материала биопленок , в качестве платформы для программируемого наноматериала . Эти нановолокна были генетически сконструированы для выполнения определенных функций, включая адгезию к подложкам, создание шаблонов наночастиц и иммобилизацию белков. [117]
Природные белки могут быть сконструированы, например, путем направленной эволюции , могут быть созданы новые белковые структуры, которые соответствуют или улучшают функциональность существующих белков. Одна группа создала пучок спирали , который был способен связывать кислород со свойствами, подобными гемоглобину , но не связывал окись углерода . [119] Подобная белковая структура была создана для поддержки различных активностей оксидоредуктазы [120] , в то время как другая образовала структурно и последовательно новую АТФазу . [121] Другая группа создала семейство рецепторов, связанных с G-белком, которые могут быть активированы инертной небольшой молекулой N-оксида клозапина, но нечувствительны к нативному лиганду , ацетилхолину ; эти рецепторы известны как DREADD . [122] Новые функциональные возможности или специфичность белка также могут быть созданы с использованием вычислительных подходов. В одном исследовании удалось использовать два разных вычислительных метода: метод биоинформатики и молекулярного моделирования для анализа баз данных последовательностей и метод вычислительного проектирования ферментов для перепрограммирования специфичности фермента. Оба метода привели к созданию ферментов с более чем 100-кратной специфичностью для производства спиртов с более длинной цепью из сахара. [123]
Другое распространенное исследование — расширение природного набора из 20 аминокислот . Без учета стоп-кодонов идентифицирован 61 кодон , но в целом у всех организмов кодируется только 20 аминокислот. Определенные кодоны созданы для кодирования альтернативных аминокислот, включая: нестандартные аминокислоты, такие как O- метилтирозин ; или экзогенные аминокислоты, такие как 4-фторфенилаланин. Обычно в этих проектах используются перекодированные пары нонсенс-супрессор тРНК — аминоацил-тРНК-синтетаза из других организмов, хотя в большинстве случаев требуются серьезные инженерные разработки. [124]
Другие исследователи исследовали структуру и функцию белка, сокращая нормальный набор из 20 аминокислот. Ограниченные библиотеки последовательностей белков создаются путем создания белков, в которых группы аминокислот могут быть заменены одной аминокислотой. [125] Например, несколько неполярных аминокислот в белке можно заменить одной неполярной аминокислотой. [126] Один проект продемонстрировал, что инженерная версия хоризматмутазы по-прежнему обладала каталитической активностью даже при использовании только девяти аминокислот. [127]
Исследователи и компании практикуют синтетическую биологию для синтеза промышленных ферментов с высокой активностью, оптимальным выходом и эффективностью. Эти синтезированные ферменты призваны улучшить такие продукты, как моющие средства и безлактозные молочные продукты, а также сделать их более экономически эффективными. [128] Улучшения метаболической инженерии с помощью синтетической биологии являются примером биотехнологического метода, используемого в промышленности для открытия фармацевтических препаратов и ферментирующих химикатов. Синтетическая биология может исследовать системы модульных путей в биохимическом производстве и повысить выход метаболического производства. Искусственная ферментативная активность и последующее влияние на скорость и выход метаболических реакций могут разработать «новые эффективные стратегии улучшения клеточных свойств… для промышленно важного биохимического производства». [129]
Ученые могут закодировать цифровую информацию в одной нити синтетической ДНК . В 2012 году Джордж М. Чёрч закодировал в ДНК одну из своих книг по синтетической биологии. Объем данных в 5,3 МБ был более чем в 1000 раз больше, чем предыдущий самый большой объем информации, хранившийся в синтезированной ДНК. [130] Аналогичный проект закодировал в ДНК полные сонеты Уильяма Шекспира . [131] В более общем смысле, такие алгоритмы, как NUPACK, [132] ViennaRNA, [133] Калькулятор сайта связывания рибосомы, [134] Cello, [135] и Калькулятор неповторяющихся частей [136] позволяют создавать новые генетические системы.
Было разработано множество технологий включения неприродных нуклеотидов и аминокислот в нуклеиновые кислоты и белки как in vitro, так и in vivo. Например, в мае 2014 года исследователи объявили, что успешно внедрили в бактериальную ДНК два новых искусственных нуклеотида . Включив отдельные искусственные нуклеотиды в культуральную среду, они смогли заменить бактерии 24 раза; они не создали мРНК или белки, способные использовать искусственные нуклеотиды. [137] [138] [139]
Синтетическая биология вызвала интерес НАСА , поскольку она может помочь производить ресурсы для астронавтов из ограниченного набора соединений, присылаемых с Земли. [140] [141] [142] На Марсе, в частности, синтетическая биология может привести к производственным процессам, основанным на местных ресурсах, что сделает ее мощным инструментом в развитии оккупированных аванпостов с меньшей зависимостью от Земли. [140] Велись работы по разработке штаммов растений, способных справиться с суровой марсианской средой, с использованием методов, аналогичных тем, которые используются для повышения устойчивости сельскохозяйственных культур к определенным факторам окружающей среды. [143]
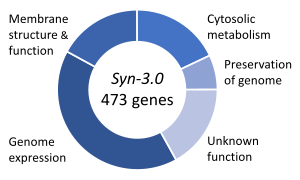
Одной из важных тем синтетической биологии является синтетическая жизнь , которая связана с гипотетическими организмами, созданными in vitro из биомолекул и/или их химических аналогов . Эксперименты с синтетической жизнью пытаются либо исследовать происхождение жизни , изучить некоторые свойства жизни, либо, что более амбициозно, воссоздать жизнь из неживых ( абиотических ) компонентов. Синтетическая биология жизни пытается создать живые организмы, способные выполнять важные функции: от производства фармацевтических препаратов до детоксикации загрязненной земли и воды. [145] В медицине это открывает перспективы использования дизайнерских биологических частей в качестве отправной точки для новых классов методов лечения и диагностических инструментов. [145]
Живая «искусственная клетка» определяется как полностью синтетическая клетка, которая может захватывать энергию , поддерживать ионные градиенты , содержать макромолекулы , а также хранить информацию и обладать способностью мутировать . [146] Никто не смог создать такую ячейку. [146]
Полностью синтетическая бактериальная хромосома была получена в 2010 году Крейгом Вентером , и его команда внедрила ее в опустошенные геномом бактериальные клетки-хозяева. [19] Клетки-хозяева были способны расти и размножаться. [147] [148] Лаборатория Микоплазмы — единственный живой организм с полностью модифицированным геномом.
Первый живой организм с «искусственным» расширенным кодом ДНК был представлен в 2014 году; команда использовала кишечную палочку , геном которой был извлечен и заменен хромосомой с расширенным генетическим кодом. Добавленные нуклеозиды представляют собой d5SICS и dNaM . [139]
В мае 2019 года исследователи сообщили о создании новой синтетической (возможно, искусственной ) формы жизнеспособной жизни , варианта бактерий Escherichia coli , путем сокращения естественного числа 64 кодонов в бактериальном геноме до 59 кодонов. , чтобы кодировать 20 аминокислот . [25] [26]
В 2017 году было начато международное крупномасштабное исследовательское сотрудничество с открытым исходным кодом Build-a-Cell по созданию синтетических живых клеток [149] , за которым последовали национальные организации по производству синтетических клеток в нескольких странах, включая FabriCell, [150] MaxSynBio [151] ] и BaSyC. [152] Европейские усилия по созданию синтетических клеток были объединены в 2019 году в инициативу SynCellEU. [153]
В 2023 году исследователям удалось создать первые искусственно созданные человеческие эмбрионы, полученные из стволовых клеток. [154]
В терапии синтетическая биология достигла значительных успехов в изменении и упрощении области терапии за относительно короткий период времени. Фактически, новые терапевтические платформы, от открытия механизмов заболеваний и мишеней лекарств до производства и транспортировки малых молекул, стали возможными благодаря логическому и модельно-ориентированному проектированию биологических компонентов. [60]
Устройства синтетической биологии были разработаны в качестве методов терапевтического лечения. Можно контролировать полностью созданные вирусы и организмы, воздействуя на определенные патогены и пути развития заболеваний. Таким образом, в двух независимых исследованиях 91,92 исследователи использовали генетически модифицированные бактериофаги для борьбы с бактериями, устойчивыми к антибиотикам, придавая им генетические особенности, которые специально нацелены и препятствуют защите бактерий от активности антибиотиков. [155]
В терапии рака , поскольку традиционные лекарства часто без разбора воздействуют на опухоли и нормальные ткани, могут быть полезны искусственно созданные вирусы и организмы, которые могут идентифицировать и связывать свое терапевтическое действие с патологическими сигналами. Например, активность пути р53 в клетках человека была введена в аденовирусы, чтобы контролировать их репликацию. [155]
Бактерии уже давно используются в лечении рака. Бифидобактерии и клостридии избирательно колонизируют опухоли и уменьшают их размеры. [156] Недавно синтетические биологи перепрограммировали бактерии, чтобы они чувствовали определенное раковое состояние и реагировали на него. Чаще всего бактерии используются для доставки терапевтической молекулы непосредственно к опухоли, чтобы минимизировать нецелевые эффекты. Чтобы нацелиться на опухолевые клетки, на поверхности бактерий были экспрессированы пептиды , которые могут специфически распознавать опухоль. Используемые пептиды включают молекулу аффитела , которая специфически нацелена на рецептор 2 эпидермального фактора роста человека [157] и синтетический адгезин . [158] Другой способ — позволить бактериям чувствовать микроокружение опухоли , например, гипоксию, путем встраивания логического элемента И в бактерии. [159] Тогда бактерии высвобождают целевые терапевтические молекулы в опухоль только посредством лизиса [160] или системы бактериальной секреции . [161] Преимущество лизиса состоит в том, что он может стимулировать иммунную систему и контролировать рост. Можно использовать несколько типов систем секреции, а также другие стратегии. Система индуцируется внешними сигналами. Индукторы включают химические вещества, электромагнитные или световые волны.
В этих методах лечения применяются несколько видов и штаммов. Наиболее часто используемыми бактериями являются Salmonella typhimurium , Escherichia coli , Bifidobacteria , Streptococcus , Lactobacillus , Listeria и Bacillus subtilis . Каждый из этих видов обладает своими свойствами и уникален для терапии рака с точки зрения колонизации тканей, взаимодействия с иммунной системой и простоты применения.
Разработанная платформа на основе дрожжей
Синтетические биологи разрабатывают генетически модифицированные живые дрожжи, которые могут доставлять терапевтические биологические лекарства. При пероральном приеме эти живые дрожжи действуют как микрофабрики и производят терапевтические молекулы непосредственно в желудочно-кишечном тракте. Поскольку дрожжи являются эукариотическими, их ключевым преимуществом является то, что их можно применять вместе с антибиотиками. Пробиотические дрожжи, экспрессирующие пуринергический рецептор P2Y2 человека, подавляли воспаление кишечника на мышиных моделях воспалительного заболевания кишечника. [162] Были разработаны живые дрожжи S. boulardii , доставляющие тетраспецифичный антитоксин, который эффективно нейтрализует токсин A и токсин B Clostridioides difficile. Этот терапевтический антитоксин представляет собой смесь четырех однодоменных антител ( нанотел ), которые мощно и широко нейтрализуют два основных фактора вирулентности C. difficile в месте инфекции в доклинических моделях. [163] Первое клиническое испытание на людях искусственных живых дрожжей для лечения инфекции Clostridium difficile ожидается в 2024 году и будет спонсироваться разработчиком Fzata, Inc.
Иммунная система играет важную роль в развитии рака и может быть использована для атаки раковых клеток. Клеточная терапия фокусируется на иммунотерапии , в основном с помощью Т-клеток .
Рецепторы Т-клеток были сконструированы и «обучены» обнаруживать эпитопы рака . Химерные антигенные рецепторы (CAR) состоят из фрагмента антитела, слитого с внутриклеточными сигнальными доменами Т-клеток, которые могут активировать и запускать пролиферацию клетки. FDA одобрило множество методов лечения второго поколения на основе CAR. [164]
Генные переключатели были разработаны для повышения безопасности лечения. Выключатели были разработаны для прекращения терапии в случае проявления у пациента серьезных побочных эффектов. [165] Механизмы могут более точно контролировать систему, останавливать и повторно активировать ее. [166] [167] Поскольку количество Т-клеток важно для устойчивости и тяжести терапии, рост Т-клеток также контролируется для определения эффективности и безопасности терапии. [168]
Хотя несколько механизмов могут улучшить безопасность и контроль, ограничения включают в себя сложность индукции больших цепей ДНК в клетки и риски, связанные с введением в клетки чужеродных компонентов, особенно белков.
Самым популярным биотопливом является этанол, получаемый из кукурузы или сахарного тростника, но этот метод производства биотоплива затруднителен и ограничен из-за высоких затрат на сельское хозяйство и неадекватных топливных характеристик этанола. Заменителем и потенциальным источником возобновляемой энергии являются микробы, метаболические пути которых были изменены, чтобы они могли более эффективно преобразовывать биомассу в биотопливо. Можно ожидать, что эти методы будут успешными только в том случае, если их производственные затраты будут соответствовать или даже превысить затраты на нынешнее производство топлива. В связи с этим существует несколько лекарств, дорогостоящие процедуры производства которых не позволяют им иметь более широкий терапевтический диапазон. Создание новых материалов и микробиологическое производство биоматериалов существенно выиграют от новых инструментов искусственной биологии. [155]
Система кластеризованных часто расположенных коротких палиндромных повторов (CRISPR)/CRISPR-ассоциированных (Cas) является мощным методом геномной инженерии целого ряда организмов благодаря своей простоте, модульности и масштабируемости. В этом методе направляющая РНК (гРНК) привлекает нуклеазу CRISPR Cas9 к определенному месту в геноме, вызывая двухцепочечный разрыв. Для достижения желаемого изменения генома (т.е. удаления или вставки гена) можно использовать несколько процессов репарации ДНК, включая рекомбинацию, направленную на гомологию, и соединение негомологических концов. Кроме того, dCas9 (мертвый Cas9 или Cas9 с дефицитом нуклеазы), двойной мутант Cas9 (H840A, D10A), использовался для контроля экспрессии генов в бактериях или когда он связан со стимуляцией сайта супрессии у дрожжей. [169]
Для построения и развития биологических систем решающее значение имеют регулирующие компоненты, включая регуляторы, сайты связывания рибосом (RBS) и терминаторы. Несмотря на годы исследований, существует множество различных разновидностей и количества промоторов и терминаторов для Escherichia coli, но и для хорошо изученного модельного организма Saccharomyces cerevisiae, а также для других представляющих интерес организмов, эти инструменты довольно скудны. Чтобы преодолеть это ограничение, были изобретены многочисленные методы поиска и идентификации промоторов и терминаторов, включая интеллектуальный анализ генома, случайный мутагенез, гибридную инженерию, биофизическое моделирование, комбинаторный дизайн и рациональный дизайн. [169]
Синтетическая биология использовалась для создания органоидов , которые представляют собой выращенные в лаборатории органы для применения в медицинских исследованиях и трансплантации. [170]
3D-биопечать можно использовать для реконструкции тканей из различных областей тела. Предшественником внедрения 3D-печати в здравоохранении стала серия испытаний, проведенных исследователями Бостонской детской больницы. Команда вручную изготовила запасные мочевые пузыри для семи пациентов, построив каркасы, а затем наложив на них слои клеток пациентов и позволив им расти. Испытания прошли успешно, поскольку пациенты оставались в добром здравии в течение 7 лет после имплантации, что побудило научного сотрудника по имени Энтони Атала, доктора медицинских наук, искать способы автоматизации процесса. [171] Пациентов с терминальной стадией заболевания мочевого пузыря теперь можно лечить с помощью биоинженерных тканей мочевого пузыря для восстановления поврежденного органа. [172] Эту технологию также потенциально можно применять к костям, коже, хрящам и мышечной ткани. [173] Однако одной из долгосрочных целей технологии 3D-биопечати является реконструкция целого органа, а также минимизация проблемы нехватки органов для трансплантации. [174] Биопечать полностью функциональных органов, например, печени, кожи, мениска или поджелудочной железы, не имела большого успеха. [175] [176] [177] В отличие от имплантируемых стентов, органы имеют сложную форму, и их значительно сложнее биопринтировать. Например, биопечатное сердце должно отвечать не только структурным требованиям, но также требованиям к васкуляризации, механической нагрузке и распространению электрического сигнала. [178] В 2022 году было сообщено о первом успехе клинического испытания 3D-биопечатного трансплантата, изготовленного из собственных клеток пациента, наружного уха для лечения микротии [179] . [180]
3D-биопечать способствует значительному прогрессу в медицинской области тканевой инженерии , позволяя проводить исследования инновационных материалов, называемых биоматериалами . Некоторые из наиболее известных биоинженерных веществ обычно прочнее обычных материалов тела, включая мягкие ткани и кости. Эти компоненты могут в будущем заменить или даже улучшить исходные материалы корпуса. Кроме того, Агентство по уменьшению угроз Министерства обороны стремится печатать мини-органы, такие как сердце, печень и легкие, что позволит более точно тестировать новые лекарства и, возможно, устранить необходимость испытаний на животных. [181]
Продолжаются исследования и разработки методов, основанных на синтетической биологии, для стимулирования регенерации у людей [ актуально? ] , а также создание трансплантируемых искусственных органов .
Синтетическая биология может быть использована для создания наночастиц, которые можно использовать для доставки лекарств, а также для других целей. [182] В рамках дополнительных исследований и разработок были созданы синтетические клетки , имитирующие функции биологических клеток. Приложения включают в себя медицину, например, дизайнерские наночастицы , которые заставляют клетки крови разъедать изнутри наружу части атеросклеротических бляшек , которые вызывают сердечные приступы. [183] [184] [185] Синтетические микрокапли для клеток водорослей или синергетические водорослево-бактериальные многоклеточные сфероидные микробные реакторы , например, могут быть использованы для производства водорода в качестве биотехнологии экономии водорода . [186] [187]
Дизайнерские клетки млекопитающих создаются людьми для определенного поведения, например, иммунные клетки, экспрессирующие синтетический рецептор, предназначенный для борьбы с конкретным заболеванием. [188] [189] Электрогенетика — это применение синтетической биологии, которое предполагает использование электрических полей для стимуляции реакции в сконструированных клетках. [190] Управлять дизайнерскими ячейками можно относительно легко с помощью обычных электронных устройств, таких как смартфоны. Кроме того, электрогенетика позволяет создавать устройства, которые намного меньше и компактнее, чем устройства, использующие другие стимулы за счет использования микроскопических электродов. [190] Одним из примеров того, как электрогенетика используется на благо общественного здравоохранения, является стимуляция дизайнерских клеток, которые способны производить/доставлять терапевтические средства. [191] Это было реализовано в ячейках Electro HEK, клетках, которые содержат потенциал-управляемые кальциевые каналы, которые являются электрочувствительными, а это означает, что ионный канал можно контролировать с помощью электропроводности между электродами и ячейками Electro HEK. [190] Было показано , что уровни экспрессии искусственного гена, который содержали эти клетки Electro HEK, можно контролировать путем изменения напряжения или длины электрического импульса. Дальнейшие исследования расширили эту надежную систему, одно из которых представляет собой систему линии бета-клеток, предназначенную для контроля высвобождения инсулина на основе электрических сигналов. [192]
Создание новой жизни и изменение существующей жизни вызвали этические проблемы в области синтетической биологии и активно обсуждаются. [193] [194]
Общие этические вопросы включают в себя:
Этические аспекты синтетической биологии имеют три основные особенности: биобезопасность , биобезопасность и создание новых форм жизни. [196] Другие упомянутые этические вопросы включают регулирование новых творений, управление патентами на новые творения, распределение выгод и честность исследований. [197] [193]
Возникли этические проблемы в отношении технологий рекомбинантной ДНК и генетически модифицированных организмов (ГМО), а во многих юрисдикциях действовали обширные правила генной инженерии и исследований патогенов. Эми Гутманн , бывший глава президентской комиссии по биоэтике, утверждала, что нам следует избегать искушения чрезмерно регулировать синтетическую биологию в целом и генную инженерию в частности. По словам Гутмана, «экономия в регулировании особенно важна в новых технологиях… где особенно велик соблазн задушить инновации на основе неопределенности и страха перед неизвестным. Грубые инструменты законодательных и нормативных ограничений могут не только препятствовать распространению новых преимуществ, но может оказаться контрпродуктивным для безопасности и безопасности, не позволяя исследователям разработать эффективные меры защиты». [198]
Один этический вопрос заключается в том, приемлемо ли создание новых форм жизни, иногда называемых «игрой в Бога». В настоящее время создание новых форм жизни, отсутствующих в природе, происходит в небольших масштабах, потенциальные выгоды и опасности остаются неизвестными, а для большинства исследований обеспечивается тщательное рассмотрение и надзор. [193] Многие сторонники заявляют о огромной потенциальной ценности — для сельского хозяйства, медицины и академических знаний, среди других областей — создания искусственных форм жизни. Создание новых объектов могло бы расширить научные знания далеко за пределы того, что известно в настоящее время при изучении природных явлений. Тем не менее, существует опасение, что искусственные формы жизни могут снизить «чистоту» природы (т.е. природа может быть каким-то образом испорчена вмешательством и манипуляциями человека) и потенциально повлиять на принятие принципов, более похожих на инженерные, вместо идеалов, ориентированных на биоразнообразие и природу. Некоторые также обеспокоены тем, что если искусственная форма жизни будет выпущена в природу, она может затруднить биоразнообразие, вытесняя естественные виды в плане ресурсов (подобно тому, как цветение водорослей убивает морские виды). Еще одна проблема связана с этическим обращением с вновь созданными существами, если они ощущают боль , разум и самовосприятие. Продолжаются споры о том, следует ли предоставить таким формам жизни моральные или юридические права, хотя не существует единого мнения относительно того, как эти права будут осуществляться или обеспечиваться.
Этические и моральные обоснования, которые поддерживают определенные применения синтетической биологии, включают их потенциальное смягчение существенных глобальных проблем пагубного воздействия традиционного сельского хозяйства на окружающую среду (включая производство мяса ), благополучия животных , продовольственной безопасности и здоровья человека , [199] [200] [201 ] ] [202] , а также потенциальное сокращение человеческих потребностей в рабочей силе и, посредством терапии заболеваний, уменьшение человеческих страданий и продление жизни.
Что является наиболее этически приемлемым при рассмотрении мер биобезопасности? Как можно избежать случайного внедрения синтетической жизни в природную среду? Этим вопросам было уделено много этического рассмотрения и критической мысли. Биобезопасность относится не только к биологическому сдерживанию; это также относится к шагам, предпринятым для защиты населения от потенциально опасных биологических агентов. Несмотря на то, что такие опасения важны и остаются без ответа, не все продукты синтетической биологии вызывают обеспокоенность по поводу биологической безопасности или негативных последствий для окружающей среды. Утверждается, что большинство синтетических технологий безвредны и неспособны процветать во внешнем мире из-за своих «неестественных» характеристик, поскольку еще не существует примера трансгенного микроба, обладающего преимуществом в приспособленности в дикой природе.
В целом существующие меры контроля опасности , методологии оценки рисков и правила, разработанные для традиционных генетически модифицированных организмов (ГМО), считаются достаточными для синтетических организмов. «Внешние» методы биозащиты в лабораторных условиях включают физическое сдерживание с помощью боксов биологической безопасности и перчаточных боксов , а также средств индивидуальной защиты . В контексте сельского хозяйства они включают дистанцию изоляции и барьеры для пыльцы , аналогичные методам биологического сдерживания ГМО . Синтетические организмы могут обеспечить повышенный контроль опасности, поскольку они могут быть созданы с использованием «внутренних» методов биосдерживания, которые ограничивают их рост в неизолированной среде или предотвращают горизонтальную передачу генов природным организмам. Примеры внутреннего биосдерживания включают ауксотрофию , биологические переключатели уничтожения , неспособность организма реплицировать или передавать модифицированные или синтетические гены потомству, а также использование ксенобиологических организмов с использованием альтернативной биохимии, например, с использованием искусственных ксенонуклеиновых кислот (XNA) вместо ДНК. . [203] [204] Что касается ауксотрофии, бактерии и дрожжи можно сконструировать так, чтобы они не могли производить гистидин , важную аминокислоту для всей жизни. Таким образом, такие организмы можно выращивать только на богатой гистидином среде в лабораторных условиях, что сводит на нет опасения, что они могут распространиться в нежелательные области.
Некоторые этические проблемы связаны с биобезопасностью, когда биосинтетические технологии могут намеренно использоваться для нанесения вреда обществу и/или окружающей среде. Поскольку синтетическая биология поднимает этические проблемы и вопросы биобезопасности, человечество должно подумать и спланировать, как бороться с потенциально вредными созданиями и какие этические меры можно использовать для сдерживания гнусных биосинтетических технологий. За исключением регулирования компаний, занимающихся синтетической биологией и биотехнологиями, [205] [206] однако, эти вопросы не считаются новыми, поскольку они были подняты во время более ранних дебатов о рекомбинантной ДНК и генетически модифицированных организмах (ГМО), а также обширных правил генной инженерии. и исследования патогенов уже проводятся во многих юрисдикциях. [207]
Кроме того, разработка инструментов синтетической биологии облегчила людям с меньшим образованием, подготовкой и доступом к оборудованию модификацию и использование патогенных организмов в качестве биологического оружия. Это увеличивает угрозу биотерроризма , особенно когда террористические группы осознают значительные социальные, экономические и политические потрясения, вызванные такими пандемиями, как COVID-19 . По мере разработки новых методов в области синтетической биологии риск биотерроризма, вероятно, будет продолжать расти. [208] Хуан Сарате, который занимал должность заместителя советника национальной безопасности по борьбе с терроризмом с 2005 по 2009 год, отметил, что «тяжесть и крайние разрушительные последствия нового коронавируса, вероятно, подтолкнут воображение самых творческих и опасных групп и отдельных лиц к пересмотру биотеррористического подхода». атаки». [209]
Проект SYNBIOSAFE, финансируемый Европейским Союзом [210], опубликовал отчеты о том, как управлять синтетической биологией. В документе 2007 года были определены ключевые проблемы безопасности, этики и взаимодействия науки и общества, которые в проекте определены как общественное образование и постоянный диалог между учеными, бизнесом, правительством и специалистами по этике. [211] [212] Ключевые проблемы безопасности, выявленные SYNBIOSAFE, связаны с привлечением компаний, продающих синтетическую ДНК, и биохакерского сообщества биологов-любителей. Ключевые этические вопросы касались создания новых форм жизни.
Последующий доклад был посвящен биобезопасности, особенно проблеме так называемого двойного назначения . Например, хотя синтетическая биология может привести к более эффективному производству медицинских препаратов, она также может привести к синтезу или модификации вредных патогенов (например, оспы ). [213] Сообщество биохакеров по-прежнему вызывает особую озабоченность, поскольку распределенный и рассредоточенный характер биотехнологий с открытым исходным кодом затрудняет отслеживание, регулирование или смягчение потенциальных опасений по поводу биобезопасности и биозащищенности. [214]
COSY, еще одна европейская инициатива, фокусируется на общественном восприятии и коммуникации. [215] [216] [217] Чтобы лучше донести синтетическую биологию и ее социальные последствия до широкой публики, COSY и SYNBIOSAFE в октябре 2009 года опубликовали SYNBIOSAFE , 38-минутный документальный фильм. [210]
Международная ассоциация синтетической биологии предложила саморегулирование. [218] В нем предлагаются конкретные меры, которые должна реализовать индустрия синтетической биологии, особенно компании, занимающиеся синтезом ДНК. В 2007 году группа ученых из ведущих компаний, занимающихся синтезом ДНК, опубликовала «практический план по разработке эффективной системы надзора за отраслью синтеза ДНК». [205]
В январе 2009 года Фонд Альфреда П. Слоана профинансировал Центр Вудро Вильсона , Центр Гастингса и Институт Дж. Крейга Вентера для изучения общественного восприятия, этики и политических последствий синтетической биологии. [219]
9–10 июля 2009 г. Комитет национальных академий науки, технологий и права созвал симпозиум на тему «Возможности и проблемы в новой области синтетической биологии». [220]
После публикации первого синтетического генома и сопутствующего освещения в СМИ создаваемой «жизни» президент Барак Обама учредил Президентскую комиссию по изучению биоэтических проблем для изучения синтетической биологии. [221] Комиссия провела серию заседаний и в декабре 2010 г. опубликовала доклад под названием «Новые направления: этика синтетической биологии и новых технологий». Комиссия заявила, что «хотя достижение Вентера ознаменовало собой значительный технический прогресс в демонстрации того, что относительно большой геном может быть точно синтезирован и заменен другим, оно не равнозначно «созданию жизни». [222] Комиссия отметила, что синтетическая биология Комиссия не рекомендовала изменения в политике или надзоре и призвала к продолжению финансирования исследований и новому финансированию мониторинга, изучения возникающих этических проблем и просвещения общественности. [207]
Синтетическая биология, как главный инструмент биологических достижений, приводит к «потенциалу разработки биологического оружия, возможным непредвиденным негативным последствиям для здоровья человека... и любому потенциальному воздействию на окружающую среду». [223] Распространение таких технологий может также сделать производство биологического и химического оружия доступным для более широкого круга государственных и негосударственных субъектов . [224] Этих проблем безопасности можно избежать, регулируя использование биотехнологий в промышленности посредством политического законодательства. Федеральные руководящие принципы по генетическим манипуляциям предлагает «Президентская комиссия по биоэтике... в ответ на объявленное создание самовоспроизводящейся клетки из химически синтезированного генома выдвинула 18 рекомендаций не только для регулирования науки... для образования публика". [223]
13 марта 2012 года более 100 экологических групп и групп гражданского общества, включая « Друзей Земли» , Международный центр оценки технологий и Группу ETC , выпустили манифест «Принципы надзора за синтетической биологией ». Этот манифест призывает к введению во всем мире моратория на выпуск и коммерческое использование синтетических организмов до тех пор, пока не будут установлены более строгие правила и строгие меры биобезопасности. Группы конкретно призывают к полному запрету на использование синтетической биологии в отношении человеческого генома или человеческого микробиома . [225] [226] Ричард Левонтин писал, что некоторые принципы безопасности надзора, обсуждаемые в « Принципах надзора за синтетической биологией», разумны, но основная проблема с рекомендациями манифеста заключается в том, что «общественности в целом не хватает способность обеспечить любую осмысленную реализацию этих рекомендаций». [227]
Опасности синтетической биологии включают угрозы биобезопасности для работников и населения, опасности биобезопасности , возникающие в результате преднамеренной разработки организмов с целью причинения вреда, а также опасности для окружающей среды. Опасности для биобезопасности аналогичны опасностям, возникающим в существующих областях биотехнологии, в основном это воздействие патогенов и токсичных химикатов, хотя новые синтетические организмы могут нести новые риски. [203] Что касается биобезопасности, существуют опасения, что синтетические или модифицированные организмы теоретически могут быть использованы для биотерроризма . Потенциальные риски включают воссоздание известных патогенов с нуля, создание более опасных существующих патогенов и создание микробов для производства вредных биохимических веществ. [228] Наконец, экологические опасности включают неблагоприятное воздействие на биоразнообразие и экосистемные услуги , включая потенциальные изменения в землепользовании в результате использования синтетических организмов в сельском хозяйстве. [229] [230] Синтетическая биология является примером технологии двойного назначения , которая может быть использована способами, которые могут намеренно или непреднамеренно причинить вред людям и/или окружающей среде. Часто «ученые, принимающие их учреждения и финансирующие организации» рассматривают вопрос о том, может ли запланированное исследование быть использовано не по назначению, и иногда принимают меры для снижения вероятности неправомерного использования. [231]
Существующие системы анализа рисков для ГМО обычно считаются достаточными для синтетических организмов, хотя могут возникнуть трудности для организма, построенного «снизу вверх» из отдельных генетических последовательностей. [204] [232] Синтетическая биология обычно подпадает под действие существующих правил в отношении ГМО и биотехнологии в целом, а также любых правил, которые существуют для последующих коммерческих продуктов, хотя, как правило, ни в одной юрисдикции нет правил, специфичных для синтетической биологии. [233] [234]
cooperбыла вызвана, но так и не определена (см. страницу справки ).{{cite web}}: Отсутствует или пусто |title=( помощь ){{cite book}}: |website=игнорируется ( помощь ){{cite book}}: |website=игнорируется ( помощь )