Вакцина – биологический препарат , обеспечивающий активный приобретенный иммунитет к определенному инфекционному или злокачественному заболеванию. [1] [2] Безопасность и эффективность вакцин широко изучались и проверялись. [3] [4] Вакцина обычно содержит агент, напоминающий болезнетворный микроорганизм, и часто изготавливается из ослабленных или убитых форм микроба, его токсинов или одного из его поверхностных белков. Агент стимулирует иммунную систему организма распознать агент как угрозу, уничтожить его, а также распознать и уничтожить любые микроорганизмы, связанные с этим агентом, с которыми он может столкнуться в будущем.
Вакцины могут быть профилактическими (для предотвращения или облегчения последствий будущего заражения естественным или «диким» возбудителем ) или терапевтическими (для борьбы с уже возникшим заболеванием, например раком ). [5] [6] [7] [8] Некоторые вакцины обеспечивают полный стерилизующий иммунитет , при котором инфекция полностью предотвращается. [9]
Введение вакцин называется вакцинацией . Вакцинация – наиболее эффективный метод профилактики инфекционных заболеваний; [10] Широкое распространение иммунитета благодаря вакцинации в значительной степени ответственно за ликвидацию оспы во всем мире и ограничение таких заболеваний, как полиомиелит , корь и столбняк в большей части мира. Всемирная организация здравоохранения (ВОЗ) сообщает, что в настоящее время доступны лицензированные вакцины от двадцати пяти различных предотвратимых инфекций . [11]
Первое зарегистрированное использование прививки для предотвращения оспы произошло в 16 веке в Китае, а самые ранние намеки на эту практику в Китае появились в 10 веке. [12] Это также была первая болезнь, против которой была произведена вакцина. [13] [14] Народная практика прививки от оспы была привезена из Турции в Великобританию в 1721 году леди Мэри Уортли Монтегю . [15] Термины «вакцина» и «вакцинация» произошли от Variolae vaccinae (коровья оспа), термина, придуманного Эдвардом Дженнером (который разработал концепцию вакцин и создал первую вакцину) для обозначения коровьей оспы . В 1798 году он использовал эту фразу в длинном названии своего «Исследования о натуральной оспе, известной как коровья оспа» , в котором он описал защитное действие коровьей оспы против оспы. [16] В 1881 году, в честь Дженнера, Луи Пастер предложил расширить условия, чтобы охватить новые защитные прививки, которые тогда разрабатывались. [17] Наука о разработке и производстве вакцин называется вакцинологией .


Подавляющее большинство ученых пришли к единому мнению, что вакцины являются очень безопасным и эффективным способом борьбы и искоренения инфекционных заболеваний. [19] [20] [21] [22] Иммунная система распознает вакцинные агенты как чужеродные, уничтожает их и «запоминает» их. Когда встречается вирулентная версия агента, организм распознает белковую оболочку агента и, таким образом, готов отреагировать, сначала нейтрализуя целевой агент до того, как он сможет проникнуть в клетки, а во-вторых, распознавая и уничтожая инфицированные клетки до этого агента. может умножаться до огромных чисел. [23] [24]
Тем не менее, существуют ограничения их эффективности. [25] Иногда защита не удается по причинам, связанным с вакцинами, например, из-за неэффективного ослабления вакцины, схем вакцинации или ее введения. [26]
Сбой также может произойти по причинам, связанным с хозяином, если иммунная система хозяина не реагирует адекватно или вообще не реагирует. Отсутствие реакции со стороны хозяина происходит примерно у 2–10% людей из-за таких факторов, как генетика, иммунный статус, возраст, состояние здоровья и состояние питания. [26] Одним из типов первичного иммунодефицита , приводящего к генетической недостаточности, является Х-сцепленная агаммаглобулинемия , при которой отсутствие фермента, необходимого для развития В-клеток , не позволяет иммунной системе хозяина вырабатывать антитела к патогену . [27] [28]
Взаимодействия хозяин-патоген и реакция на инфекцию представляют собой динамические процессы, включающие множество путей иммунной системы. [29] [30] У хозяина антитела не вырабатываются мгновенно: хотя врожденный иммунитет организма может активироваться всего за двенадцать часов, для полного развития адаптивного иммунитета может потребоваться 1–2 недели. В течение этого времени хозяин все еще может заразиться. [31]
Как только антитела вырабатываются, они могут способствовать укреплению иммунитета любым из нескольких способов, в зависимости от класса задействованных антител. Их успех в уничтожении или инактивации патогена будет зависеть от количества вырабатываемых антител и от степени эффективности этих антител в борьбе со штаммом возбудителя, поскольку разные штаммы могут быть по-разному восприимчивы к определенной иммунной реакции. [30] В некоторых случаях вакцины могут привести к частичной иммунной защите (при которой иммунитет эффективен менее чем на 100%, но все же снижает риск заражения) или к временной иммунной защите (при которой иммунитет ослабевает с течением времени), а не к полному или постоянному иммунитету. Они все еще могут повысить порог повторного заражения для населения в целом и оказать существенное влияние. [32] Они также могут смягчить тяжесть инфекции, что приводит к снижению уровня смертности , снижению заболеваемости , более быстрому выздоровлению после болезни и широкому спектру других эффектов. [33] [34]
Те, кто старше, часто демонстрируют меньшую реакцию, чем те, кто моложе, - закономерность, известная как иммуностарение . [35] Адъюванты обычно используются для усиления иммунного ответа, особенно у пожилых людей, у которых иммунный ответ на простую вакцину мог быть ослаблен. [36]
Эффективность или действие вакцины зависит от нескольких факторов :
Если у вакцинированного человека действительно разовьется заболевание, против которого была привита ( прорывная инфекция ), болезнь, вероятно, будет менее вирулентной, чем в невакцинированных случаях. [38]
Важные соображения относительно эффективной программы вакцинации: [39]
В 1958 г. в США было зарегистрировано 763 094 случая кори; В результате погибло 552 человека. [40] [41] После внедрения новых вакцин число случаев заболевания упало до менее 150 в год (в среднем 56). [41] В начале 2008 года было зарегистрировано 64 случая подозрения на корь. Пятьдесят четыре из этих инфекций были связаны с ввозом из другой страны, хотя на самом деле только тринадцать процентов были приобретены за пределами Соединенных Штатов; 63 из 64 человек либо никогда не были вакцинированы против кори, либо не были уверены, были ли они вакцинированы. [41]
Вакцины привели к искоренению оспы , одной из самых заразных и смертоносных болезней человека. [42] Другие заболевания, такие как краснуха, полиомиелит , корь, эпидемический паротит, ветряная оспа и брюшной тиф , уже далеко не так распространены, как сто лет назад, благодаря широкомасштабным программам вакцинации. Пока подавляющее большинство людей вакцинировано, гораздо труднее возникнуть вспышке заболевания, не говоря уже о его распространении. Этот эффект называется коллективным иммунитетом . Полиомиелит, который передается только среди людей, является целью обширной кампании по ликвидации , в результате которой эндемичный полиомиелит распространился только на части трех стран (Афганистан, Нигерия и Пакистан). [43] Однако трудности с охватом всех детей, культурные недопонимания и дезинформация привели к тому, что ожидаемая дата искоренения несколько раз была пропущена. [44] [45] [46] [47]
Вакцины также помогают предотвратить развитие устойчивости к антибиотикам. Например, благодаря значительному снижению заболеваемости пневмонией, вызванной Streptococcus pneumoniae , программы вакцинации значительно снизили распространенность инфекций, устойчивых к пенициллину или другим антибиотикам первого ряда. [48]
По оценкам, вакцина против кори ежегодно предотвращает миллион смертей. [49]
Прививки детям, подросткам и взрослым, как правило, безопасны. [50] [51] Побочные эффекты, если таковые имеются, обычно легкие. [52] Частота побочных эффектов зависит от рассматриваемой вакцины. [52] Некоторые распространенные побочные эффекты включают лихорадку, боль вокруг места инъекции и мышечные боли. [52] Кроме того, у некоторых людей может быть аллергия на ингредиенты вакцины. [53] Вакцина MMR редко вызывает фебрильные судороги . [51]
Детерминанты, связанные с хозяином («вакцинантом»), которые делают человека восприимчивым к инфекции, такие как генетика , состояние здоровья (основное заболевание, питание, беременность, чувствительность или аллергия ), иммунная компетентность , возраст, экономические последствия или культурная среда . первичные или вторичные факторы, влияющие на тяжесть инфекции и реакцию на вакцину. [26] Пожилые люди (старше 60 лет), люди с гиперчувствительностью к аллергенам и люди, страдающие ожирением , склонны к нарушению иммуногенности , что предотвращает или подавляет эффективность вакцин, что, возможно, требует отдельных технологий вакцинации для этих конкретных групп населения или повторных повторных прививок для ограничения передачи вируса . [26]
Тяжелые побочные эффекты наблюдаются крайне редко. [51] Вакцина против ветряной оспы редко вызывает осложнения у лиц с иммунодефицитом , а ротавирусные вакцины умеренно связаны с инвагинацией кишечника . [51]
По крайней мере, в 19 странах существуют программы компенсации без вины, обеспечивающие компенсацию тем, кто столкнулся с серьезными побочными эффектами вакцинации. [54] Программа Соединенных Штатов известна как Национальный закон о вреде от прививок детям , а в Соединенном Королевстве применяется выплата за ущерб от вакцинации .

Вакцины обычно содержат аттенуированные, инактивированные или мертвые микроорганизмы или очищенные продукты, полученные из них. Используются несколько типов вакцин. [55] Они представляют собой различные стратегии, используемые в попытке снизить риск заболевания, сохраняя при этом способность вызывать полезный иммунный ответ.
Некоторые вакцины содержат живые ослабленные микроорганизмы. Многие из них представляют собой активные вирусы , которые были выращены в условиях, лишающих их вирулентных свойств, или которые используют близкородственные, но менее опасные организмы для создания широкого иммунного ответа. Хотя большинство аттенуированных вакцин являются вирусными, некоторые из них имеют бактериальную природу. Примеры включают вирусные заболевания , желтую лихорадку , корь , эпидемический паротит и краснуху , а также бактериальное заболевание брюшной тиф . Живая вакцина против микобактерий туберкулеза , разработанная Кальметтом и Гереном, не изготовлена из заразного штамма, а содержит вирулентно модифицированный штамм под названием « БЦЖ », используемый для индукции иммунного ответа на вакцину. Для иммунизации против чумы применяют живую аттенуированную вакцину, содержащую штамм Yersinia pestis EV. Аттенуированные вакцины имеют ряд преимуществ и недостатков. Аттенуированные, или живые, ослабленные вакцины обычно вызывают более стойкие иммунологические реакции. Но они могут быть небезопасны для использования у людей с ослабленным иммунитетом, а в редких случаях мутируют в вирулентную форму и вызывают заболевание. [56]
Некоторые вакцины содержат инактивированные, но ранее вирулентные микроорганизмы, уничтоженные химическими веществами, нагреванием или радиацией [57] – «призраки» с неповрежденными, но пустыми оболочками бактериальных клеток. Их считают промежуточной фазой между инактивированными и аттенуированными вакцинами. [58] Примеры включают ИПВ ( вакцину против полиомиелита ), вакцину против гепатита А , вакцину против бешенства и большинство вакцин против гриппа . [59]

Токсоидные вакцины изготавливаются из инактивированных токсичных соединений, которые вызывают заболевание, а не микроорганизмы. [60] Примеры вакцин на основе анатоксинов включают столбняк и дифтерию . [59] Не все токсоиды предназначены для микроорганизмов; например, анатоксин Crotalus atrox используется для вакцинации собак от укусов гремучей змеи . [61]
Вместо введения инактивированного или ослабленного микроорганизма в иммунную систему (что представляет собой «цельнодействующую» вакцину), субъединичная вакцина использует его фрагмент для создания иммунного ответа. Одним из примеров является субъединичная вакцина против гепатита В , которая состоит только из поверхностных белков вируса (ранее выделенных из сыворотки крови хронически инфицированных пациентов, но теперь производимых путем рекомбинации вирусных генов в дрожжах ). [62] Другим примером являются вакцины из съедобных водорослей , такие как вакцина на основе вирусоподобных частиц (VLP) против вируса папилломы человека (ВПЧ), которая состоит из основного капсидного белка вируса. [63] Другим примером являются субъединицы гемагглютинина и нейраминидазы вируса гриппа . [59] Для иммунизации против чумы используется субъединичная вакцина. [64]
Некоторые бактерии имеют полисахаридную внешнюю оболочку , которая плохо иммуногенна . Связывая эти внешние оболочки с белками (например, токсинами), иммунную систему можно заставить распознавать полисахарид , как если бы это был белковый антиген. Этот подход используется в вакцине против Haemophilus influenzae типа B. [65]
Везикулы наружной мембраны (OMV) по своей природе иммуногенны, и с их помощью можно производить эффективные вакцины. Наиболее известными вакцинами OMV являются вакцины, разработанные против менингококковой инфекции серотипа B. [66] [67]
Гетерологичные вакцины, также известные как «дженнеровские вакцины», представляют собой вакцины, которые являются патогенами других животных и либо не вызывают заболевания, либо вызывают легкое заболевание в организме, подвергаемом лечению. Классическим примером является использование Дженнером коровьей оспы для защиты от оспы. Текущим примером является использование вакцины БЦЖ , изготовленной из Mycobacterium bovis , для защиты от туберкулеза . [68]
Генетические вакцины основаны на принципе поглощения нуклеиновой кислоты клетками, после чего в соответствии с матрицей нуклеиновой кислоты образуется белок. Этот белок обычно представляет собой иммунодоминантный антиген возбудителя или поверхностный белок, обеспечивающий образование нейтрализующих антител. Подгруппа генетических вакцин включает вирусные векторные вакцины, РНК-вакцины и ДНК-вакцины. [ нужна цитата ]
Вирусные векторные вакцины используют безопасный вирус для внедрения генов патогена в организм с целью производства специфических антигенов , таких как поверхностные белки , для стимуляции иммунного ответа . [69] [70]
мРНК-вакцина (или РНК-вакцина ) представляет собой новый тип вакцины, которая состоит из нуклеиновой кислоты РНК, упакованной в вектор, такой как липидные наночастицы . [71] Среди вакцин против COVID-19 есть ряд РНК-вакцин для борьбы с пандемией COVID-19 , некоторые из которых были одобрены или получили разрешение на экстренное использование в некоторых странах. Например, вакцина Pfizer-BioNTech и мРНК-вакцина Moderna одобрены для использования у взрослых и детей в США. [72] [73] [74]
В ДНК-вакцине используется ДНК- плазмида (пДНК), которая кодирует антигенный белок, происходящий от патогена, на который будет нацелена вакцина. пДНК недорога, стабильна и относительно безопасна, что делает ее отличным вариантом для доставки вакцин. [75]
Этот подход предлагает ряд потенциальных преимуществ по сравнению с традиционными подходами, включая стимуляцию ответов как В-, так и Т-клеток, улучшенную стабильность вакцины, отсутствие какого-либо инфекционного агента и относительную простоту крупномасштабного производства. [76]
Многие инновационные вакцины также находятся в разработке и использовании.
Хотя большинство вакцин создаются с использованием инактивированных или ослабленных соединений микроорганизмов, синтетические вакцины состоят в основном или полностью из синтетических пептидов, углеводов или антигенов.
Вакцины могут быть моновалентными (также называемыми унивалентными ) или поливалентными (также называемыми поливалентными ). Моновалентная вакцина предназначена для иммунизации против одного антигена или одного микроорганизма. [82] Мультивалентная или поливалентная вакцина предназначена для иммунизации против двух или более штаммов одного и того же микроорганизма или против двух или более микроорганизмов. [83] Валентность мультивалентной вакцины может обозначаться греческим или латинским префиксом (например, двухвалентная , трехвалентная или четырехвалентная/четырехвалентная ). В некоторых случаях моновалентная вакцина может быть предпочтительнее для быстрого развития сильного иммунного ответа. [84]
Когда две или более вакцины смешиваются в одной и той же рецептуре, они могут взаимодействовать друг с другом. Чаще всего это происходит с живыми аттенуированными вакцинами, где один из компонентов вакцины более устойчив, чем другие, и подавляет рост и иммунный ответ на другие компоненты. [85]
Это явление впервые [ когда? ] отмечено в трехвалентной полиомиелитной вакцине Сэбина , где количество вируса серотипа 2 в вакцине пришлось уменьшить, чтобы он не мешал «поглощению» вирусов серотипа 1 и 3 в вакцине. [86] В исследовании 2001 года также была отмечена проблема с вакцинами против денге , где было обнаружено, что серотип DEN-3 преобладает и подавляет реакцию на серотипы DEN-1, -2 и -4. [87]

Вакцины обычно содержат один или несколько адъювантов , используемых для усиления иммунного ответа. Например, столбнячный анатоксин обычно адсорбируется на квасцах . При этом антиген представлен таким образом, что оказывает большее действие, чем простой водный столбнячный анатоксин. Людям, у которых наблюдается побочная реакция на адсорбированный столбнячный анатоксин, можно получить простую вакцину, когда придет время ревакцинации. [88]
При подготовке к кампании в Персидском заливе в 1990 году цельноклеточная коклюшная вакцина использовалась в качестве адъюванта к вакцине против сибирской язвы . Это вызывает более быстрый иммунный ответ, чем введение только вакцины против сибирской язвы, что приносит некоторую пользу, если заражение может быть неизбежным. [89]
Вакцины также могут содержать консерванты для предотвращения заражения бактериями или грибками . До недавних лет консервант тиомерсал ( он же тимеросал в США и Японии) использовался во многих вакцинах, не содержащих живых вирусов. По состоянию на 2005 год единственной детской вакциной в США, которая содержит тиомерсал в более чем следовых количествах, является вакцина против гриппа [90] , которая в настоящее время рекомендуется только детям с определенными факторами риска. [91] В состав однократных вакцин против гриппа, поставляемых в Великобританию, не входит тиомерсал. Консерванты могут использоваться на различных этапах производства вакцин, а самые сложные методы измерения могут обнаружить их следы в готовом продукте, а также в окружающей среде и населении в целом. [92]
Многие вакцины нуждаются в консервантах для предотвращения серьезных побочных эффектов, таких как инфекция стафилококка , которая в одном случае в 1928 году убила 12 из 21 ребенка, привитого дифтерийной вакциной, в которой не было консерванта. [93] Доступно несколько консервантов, в том числе тиомерсал, феноксиэтанол и формальдегид . Тиомерсал более эффективен против бактерий, имеет лучший срок хранения и улучшает стабильность, эффективность и безопасность вакцины; но в США, Европейском Союзе и некоторых других богатых странах он больше не используется в качестве консерванта в детских вакцинах в качестве меры предосторожности из-за содержания в нем ртути . [94] Хотя были сделаны противоречивые заявления о том, что тиомерсал способствует развитию аутизма , нет убедительных научных доказательств, подтверждающих эти утверждения. [95] Более того, 10–11-летнее исследование 657 461 ребенка показало, что вакцина MMR не вызывает аутизма и фактически снижает риск аутизма на семь процентов. [96] [97]
Помимо самой активной вакцины, в препаратах вакцин присутствуют или могут присутствовать следующие вспомогательные вещества и остаточные соединения производства: [98]
Были разработаны различные довольно стандартизированные сокращения названий вакцин, хотя стандартизация ни в коем случае не является централизованной или глобальной. Например, названия вакцин, используемые в Соединенных Штатах, имеют устоявшиеся сокращения, которые также широко известны и используются в других странах. Обширный их список, представленный в сортируемой таблице и доступный в свободном доступе, доступен на веб-странице Центров по контролю и профилактике заболеваний США . [100] На странице поясняется, что «Сокращения в этой таблице (столбец 3) были стандартизированы совместно сотрудниками Центров по контролю и профилактике заболеваний, рабочих групп ACIP , редактором Еженедельного отчета о заболеваемости и смертности (MMWR), редактор журнала « Эпидемиология и профилактика болезней, предупреждаемых с помощью вакцин» («Розовая книга»), члены ACIP и организации, обеспечивающие связь с ACIP». [100]
Некоторыми примерами являются « DTaP » для анатоксинов дифтерии и столбняка и бесклеточной коклюшной вакцины, «DT» для анатоксинов дифтерии и столбняка и «Td» для анатоксинов столбняка и дифтерии. На странице, посвященной вакцинации против столбняка, [101] Центр по контролю и профилактике заболеваний далее поясняет, что «Заглавные буквы в этих аббревиатурах обозначают полноценные дозы дифтерийного (D) и столбнячного (T) анатоксинов и коклюшной (P) вакцины. Строчные буквы» d" и "p" обозначают уменьшенные дозы дифтерийного и коклюшного препарата, используемые в составах для подростков и взрослых. Буква "a" в DTaP и Tdap означает "бесклеточный", что означает, что коклюшный компонент содержит только часть коклюшного организма. " [101]
Другой список установленных сокращений вакцин находится на странице Центра по контролю и профилактике заболеваний (CDC) под названием «Акронимы и сокращения вакцин», где сокращения используются в записях о прививках в США. [102] В системе названий, принятой в США, существуют некоторые условные обозначения порядка слов в названиях вакцин: сначала располагаются существительные , а прилагательные - в постпозитивном порядке . Вот почему в США для « ОПВ » используется термин «живая оральная полиовакцина», а не «оральная полиомиелитная вакцина».
Лицензирование вакцины происходит после успешного завершения цикла разработки и дальнейших клинических испытаний и других программ, участвующих в фазах I–III, демонстрирующих безопасность, иммуноактивность, иммуногенетическую безопасность при заданной конкретной дозе, доказанную эффективность в предотвращении заражения целевых групп населения и устойчивость вакцины. профилактический эффект (необходимо оценить временную выдержку или необходимость ревакцинации). [103] Поскольку профилактические вакцины преимущественно оцениваются среди здоровых групп населения и распространяются среди населения в целом, требуется высокий уровень безопасности. [104] В рамках международного лицензирования вакцины Комитет экспертов Всемирной организации здравоохранения по биологической стандартизации разработал руководящие принципы международных стандартов производства и контроля качества вакцин. процесс лицензирования. [103] Производители вакцин не получают лицензии до тех пор, пока полный клинический цикл разработки и испытаний не докажет, что вакцина безопасна и имеет долгосрочную эффективность, после научной проверки, проводимой транснациональной или национальной регулирующей организацией, такой как Европейское агентство по лекарственным средствам (EMA). или Управление по контролю за продуктами и лекарствами США (FDA). [105] [106]
После того как развивающиеся страны примут руководящие принципы ВОЗ по разработке и лицензированию вакцин, каждая страна несет свою собственную ответственность за выдачу национальной лицензии, а также за управление, внедрение и мониторинг вакцины на протяжении всего ее использования в каждой стране. [103] Укрепление доверия и признание лицензированной вакцины среди населения — это задача взаимодействия правительств и медицинских работников, чтобы гарантировать, что кампания вакцинации проходит гладко, спасает жизни и способствует восстановлению экономики. [107] [108] Когда вакцина лицензируется, ее первоначальное количество будет ограничено из-за переменных факторов производства, распределения и логистики, что требует плана распределения ограниченного количества и того, какие сегменты населения должны быть приоритетными для получения вакцины первыми. . [107]
Вакцины, разработанные для международного распространения через Детский фонд Организации Объединенных Наций (ЮНИСЕФ), требуют предварительной квалификации ВОЗ для обеспечения международных стандартов качества, безопасности, иммуногенности и эффективности для принятия во многих странах. [103]
Этот процесс требует согласованности производства в лабораториях, работающих по контракту с ВОЗ, в соответствии с надлежащей производственной практикой (GMP). [103] Когда агентства ООН участвуют в лицензировании вакцин, отдельные страны сотрудничают путем 1) выдачи регистрационного удостоверения и национальной лицензии на вакцину, ее производителей и партнеров по распространению; и 2) проведение постмаркетингового наблюдения , включая регистрацию нежелательных явлений после программы вакцинации. ВОЗ работает с национальными агентствами для мониторинга проверок производственных предприятий и дистрибьюторов на предмет соответствия GMP и нормативного надзора. [103]
Некоторые страны предпочитают покупать вакцины, лицензированные авторитетными национальными организациями, такими как EMA, FDA или национальными агентствами в других богатых странах, но такие закупки обычно обходятся дороже и могут не иметь ресурсов для распространения, подходящих для местных условий в развивающихся странах. [103]
В Европейском Союзе (ЕС) вакцины против пандемических патогенов, таких как сезонный грипп , лицензируются на территории всего ЕС, при этом все государства-члены соблюдают требования («централизованно»), лицензируются только для некоторых государств-членов («децентрализованно») или лицензируется на индивидуальном национальном уровне. [105] Как правило, все государства ЕС следуют нормативным руководствам и клиническим программам, определенным Европейским комитетом по лекарственным препаратам для человеческого применения (CHMP), научной группой Европейского агентства по лекарственным средствам (EMA), ответственной за лицензирование вакцин. [105] CHMP поддерживается несколькими экспертными группами, которые оценивают и контролируют ход разработки вакцины до и после лицензирования и распространения. [105]
В соответствии с FDA процесс установления доказательств клинической безопасности и эффективности вакцин такой же, как и процесс утверждения рецептурных лекарств . [109] В случае успешного прохождения этапов клинической разработки за процессом лицензирования вакцины следует подача заявки на получение лицензии на биологический препарат , в которой должна быть представлена группа научных экспертов (представителей различных дисциплин, таких как врачи, статистики, микробиологи, химики) и исчерпывающая документация для вакцина-кандидат, обладающая эффективностью и безопасностью на протяжении всей разработки. Также на этом этапе предлагаемое производственное предприятие проверяется экспертами-рецензентами на предмет соответствия GMP, и на этикетке должно быть соответствующее описание, чтобы поставщики медицинских услуг могли определить конкретное использование вакцины, включая возможные риски, для информирования и доставки вакцины. публике. [109] После лицензирования мониторинг вакцины и ее производства, включая периодические проверки на соответствие требованиям GMP, продолжается до тех пор, пока производитель сохраняет свою лицензию, что может включать в себя дополнительные представления в FDA тестов на эффективность, безопасность и чистоту для каждой вакцины. Этап производства вакцины. [109]
Генеральный контролер по наркотикам Индии является главой департамента Центральной организации по контролю за стандартами на лекарства при правительстве Индии, ответственным за утверждение лицензий на определенные категории лекарств, таких как вакцины, И другие, такие как кровь и продукты крови, жидкости для внутривенного вливания и сыворотки в Индии. . [110]
Пока вакцина не будет использоваться населением в целом, все потенциальные побочные эффекты вакцины могут быть неизвестны, что требует от производителей проведения исследований фазы IV для постмаркетингового наблюдения за вакциной, пока она широко используется среди населения. [103] [109] ВОЗ работает с государствами-членами ООН над внедрением постлицензионного надзора. [103] FDA полагается на Систему сообщения о побочных эффектах вакцин для отслеживания проблем безопасности вакцины на протяжении всего ее использования среди американского населения. [109]
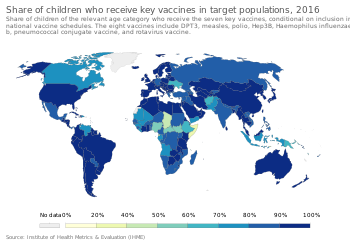
Чтобы обеспечить наилучшую защиту, детям рекомендуется делать прививки, как только их иммунная система достаточно разовьется, чтобы реагировать на определенные вакцины, при этом для достижения «полного иммунитета» часто требуются дополнительные «ревакцинации». Это привело к разработке сложных схем вакцинации. Глобальные рекомендации по графику вакцинации выпускаются Стратегической консультативной группой экспертов и в дальнейшем будут переводиться консультативным комитетом на уровне страны с учетом местных факторов, таких как эпидемиология заболевания, приемлемость вакцинации, равенство местного населения, а также программные и финансовые ограничения. [111] В США Консультативный комитет по практике иммунизации , который рекомендует внести дополнения в график для Центров по контролю и профилактике заболеваний , рекомендует плановую вакцинацию детей против [112] гепатита А , гепатита В , полиомиелита, эпидемического паротита, кори, краснухи. , дифтерия , коклюш , столбняк , HiB , ветряная оспа, ротавирус , грипп , менингококковая инфекция и пневмония . [113]
Большое количество рекомендованных вакцин и ревакцинаций (до 24 инъекций к двухлетнему возрасту) привело к проблемам с достижением полного соблюдения требований. Для борьбы со снижением уровня соблюдения требований были введены различные системы уведомления, и в настоящее время на рынке имеется множество комбинированных инъекций (например, пятивалентная вакцина и вакцина MMRV ), которые защищают от множества заболеваний.
Помимо рекомендаций по прививкам и ревакцинациям младенцев, многие специфические вакцины рекомендуются для других возрастов или для повторных инъекций на протяжении всей жизни – чаще всего от кори, столбняка, гриппа и пневмонии. Беременных женщин часто проверяют на устойчивость к краснухе. Вакцина против вируса папилломы человека рекомендована в США (по состоянию на 2011 г.) [114] и Великобритании (по состоянию на 2009 г.). [115] Рекомендации по вакцинации для пожилых людей сосредоточены на пневмонии и гриппе, которые более смертоносны для этой группы. В 2006 году была введена вакцина против опоясывающего лишая — заболевания, вызываемого вирусом ветряной оспы, которым обычно страдают пожилые люди. [116]
График и дозировка вакцинации могут быть адаптированы к уровню иммунокомпетентности человека [117] и для оптимизации распространения вакцины среди всего населения, когда ее поставки ограничены, [118] например, в условиях пандемии.
Одна из проблем в разработке вакцин носит экономический характер: многие из болезней, наиболее требующих вакцинации, включая ВИЧ , малярию и туберкулез, существуют в основном в бедных странах. У фармацевтических фирм и биотехнологических компаний мало стимулов для разработки вакцин от этих заболеваний, поскольку у них небольшой потенциал дохода. Даже в более богатых странах финансовая отдача обычно минимальна, а финансовые и другие риски велики. [119]
На сегодняшний день большая часть разработки вакцин опирается на «проталкивающее» финансирование со стороны правительства, университетов и некоммерческих организаций. [120] Многие вакцины оказались весьма экономически эффективными и полезными для общественного здравоохранения . [121] За последние десятилетия количество фактически введенных вакцин резко возросло. [122] Такое увеличение, особенно количества различных вакцин, вводимых детям перед поступлением в школу, может быть связано с постановлениями и поддержкой правительства, а не с экономическими стимулами. [123]
По данным Всемирной организации здравоохранения, самым большим препятствием для производства вакцин в менее развитых странах являются не патенты , а существенные финансовые, инфраструктурные и кадровые потребности, необходимые для выхода на рынок. Вакцины представляют собой сложные смеси биологических соединений, и, в отличие от рецептурных лекарств , не существует настоящих генерических вакцин . Вакцина, производимая на новом предприятии, должна пройти полное клиническое тестирование на безопасность и эффективность производителем. Для большинства вакцин запатентованы конкретные технологические процессы. Их можно обойти с помощью альтернативных методов производства, но для этого потребуется инфраструктура исследований и разработок и достаточно квалифицированная рабочая сила. В случае некоторых относительно новых вакцин, таких как вакцина против вируса папилломы человека , патенты могут создать дополнительный барьер. [124]
Когда во время пандемии COVID-19 в 2021 году срочно потребовалось увеличение производства вакцин , Всемирная торговая организация и правительства всего мира оценивали, стоит ли отказываться от прав интеллектуальной собственности и патентов на вакцины против COVID-19 , что «устранило бы все потенциальные барьеры для обеспечить своевременный доступ к доступным медицинским продуктам против COVID-19, включая вакцины и лекарства, а также расширить производство и поставки основных медицинских продуктов». [125]

Производство вакцин фундаментально отличается от других видов производства, включая обычное фармацевтическое производство , тем, что вакцины предназначены для введения миллионам людей, подавляющее большинство из которых совершенно здоровы. [126] Этот факт стимулирует чрезвычайно строгий производственный процесс со строгими требованиями соответствия, которые выходят далеко за рамки того, что требуется от других продуктов. [126]
В зависимости от антигена строительство предприятия по производству вакцин может стоить от 50 до 500 миллионов долларов США, для чего требуется узкоспециализированное оборудование, чистые помещения и камеры содержания. [127] Во всем мире существует нехватка персонала с правильным сочетанием навыков, опыта, знаний, компетентности и личных качеств для укомплектования линий по производству вакцин. [127] За заметным исключением Бразилии, Китая и Индии, системы образования многих развивающихся стран не в состоянии обеспечить достаточно квалифицированных кандидатов, и производители вакцин, базирующиеся в таких странах, вынуждены нанимать иностранный персонал, чтобы поддерживать производство. [127]
Производство вакцины состоит из нескольких этапов. Сначала генерируется сам антиген. Вирусы выращивают либо на первичных клетках, таких как куриные яйца (например, при гриппе), либо на непрерывных клеточных линиях, таких как культивируемые клетки человека (например, при гепатите А ). [128] Бактерии выращивают в биореакторах (например, Haemophilus influenzae типа b). Аналогично, рекомбинантный белок, полученный из вирусов или бактерий, можно получить в дрожжах, бактериях или культурах клеток. [129] [130]
После образования антигена его выделяют из клеток, использованных для его создания. Вирус может потребоваться инактивировать, возможно, без необходимости дальнейшей очистки. Рекомбинантные белки требуют множества операций, включая ультрафильтрацию и колоночную хроматографию. Наконец, в состав вакцины добавляются адъюванты, стабилизаторы и консерванты по мере необходимости. Адъювант усиливает иммунный ответ на антиген, стабилизаторы увеличивают срок хранения, а консерванты позволяют использовать многодозовые флаконы. [129] [130] Комбинированные вакцины труднее разрабатывать и производить из-за потенциальной несовместимости и взаимодействия между антигенами и другими участвующими ингредиентами. [131]
Завершающим этапом производства вакцин перед распространением является заполнение и отделка , то есть процесс наполнения флаконов вакцинами и их упаковки для распространения. Хотя это концептуально простая часть процесса производства вакцин, она часто является узким местом в процессе распространения и введения вакцин. [132] [133] [134]
Технологии производства вакцин развиваются. Ожидается, что культивируемые клетки млекопитающих будут приобретать все большее значение по сравнению с традиционными вариантами, такими как куриные яйца, из-за большей продуктивности и низкой частоты проблем с загрязнением. Ожидается, что технология рекомбинации, позволяющая производить генетически детоксицированные вакцины, будет приобретать все большую популярность для производства бактериальных вакцин, в которых используются токсоиды. Ожидается, что комбинированные вакцины уменьшат количество содержащихся в них антигенов и тем самым уменьшат нежелательные взаимодействия за счет использования молекулярных структур, связанных с патогенами . [131]
Компании с наибольшей долей рынка по производству вакцин — Merck , Sanofi , GlaxoSmithKline , Pfizer и Novartis , при этом 70% продаж вакцин сосредоточено в ЕС или США (2013 г.). [135] : 42 Заводы по производству вакцин требуют крупных капиталовложений (от 50 до 300 миллионов долларов США), и их строительство может занять от 4 до 6 лет, а полный процесс разработки вакцины занимает от 10 до 15 лет. [135] : 43 Производство в развивающихся странах играет все большую роль в поставках этих стран, особенно в отношении старых вакцин, а также в Бразилию, Индию и Китай. [135] : 47 Производители в Индии являются наиболее передовыми в развивающемся мире, в их число входит Индийский институт сывороток , один из крупнейших производителей вакцин по количеству доз и новатор в процессах, недавно повысивший эффективность производства коревой вакцины. в 10–20 раз за счет перехода на культуру клеток MRC-5 вместо куриных яиц. [135] 48 Производственные мощности Китая сосредоточены на удовлетворении собственных внутренних потребностей, при этом одна только компания Sinopharm (CNPGC) обеспечивает более 85% доз для 14 различных вакцин в Китае. [135] : 48 Бразилия приближается к моменту обеспечения своих внутренних потребностей с использованием технологий, переданных из развитого мира. [135] : 49

Одним из наиболее распространенных способов доставки вакцин в организм человека является инъекция .
Разработка новых систем доставки дает надежду на появление вакцин, которые будут более безопасными и эффективными в доставке и применении. Направления исследований включают липосомы и ISCOM (иммуностимулирующий комплекс). [136]
Заметные достижения в технологиях доставки вакцин включают пероральные вакцины. Первые попытки применения пероральных вакцин показали разную степень перспективности, начиная с начала 20-го века, когда сама возможность создания эффективной пероральной антибактериальной вакцины была спорной. [137] К 1930-м годам возрос интерес к профилактической ценности пероральной вакцины против брюшного тифа . [138]
Пероральная вакцина против полиомиелита оказалась эффективной, когда прививки проводились добровольцами без формального обучения; результаты также продемонстрировали повышенную простоту и эффективность введения вакцин. Эффективные пероральные вакцины имеют много преимуществ; например, нет риска заражения крови. Вакцины, предназначенные для перорального введения, не обязательно должны быть жидкими, а будучи твердыми, они обычно более стабильны и менее склонны к повреждению или порче в результате замораживания при транспортировке и хранении. [139] Такая стабильность снижает потребность в « холодовой цепи »: ресурсах, необходимых для хранения вакцин в ограниченном температурном диапазоне от этапа производства до момента введения, что, в свою очередь, может снизить стоимость вакцин.
Подход с использованием микроигл, который все еще находится на стадии разработки, использует «заостренные выступы, изготовленные в виде массивов, которые могут создавать пути доставки вакцины через кожу». [140]
Экспериментальная безыгольная [141] система доставки вакцин проходит испытания на животных. [142] [143] Пластырь размером со штамп, похожий на лейкопластырь, содержит около 20 000 микроскопических выступов на квадратный сантиметр. [144] Такое дермальное введение потенциально повышает эффективность вакцинации, но требует меньше вакцины, чем инъекции. [145]

Вакцинация животных используется как для предотвращения заражения ими, так и для предотвращения передачи болезней человеку. [146] Как животных, содержащихся в качестве домашних питомцев, так и животных, выращиваемых в качестве домашнего скота, регулярно вакцинируют. В некоторых случаях можно вакцинировать дикие популяции. Иногда это достигается путем распространения пищевых продуктов с вакциной в подверженных заболеваниям районах и используется для борьбы с бешенством у енотов .
В случае возникновения бешенства по закону может потребоваться вакцинация собак от бешенства. Другие вакцины для собак включают, среди прочего, чуму собак , парвовирус собак , инфекционный гепатит собак , аденовирус-2 , лептоспироз , бордетеллу , вирус парагриппа собак и болезнь Лайма .
Были зарегистрированы случаи преднамеренного или случайного применения ветеринарных вакцин у людей, в результате чего в некоторых случаях возникали заболевания, в первую очередь бруцеллез . [147] Однако сообщения о таких случаях редки, и очень мало изучено безопасность и результаты такой практики. С появлением аэрозольной вакцинации в ветеринарных клиниках в последние годы, вероятно, увеличилось воздействие на человека патогенов, которые естественным образом не переносятся человеком, таких как Bordetella bronchiseptica . [147] В некоторых случаях, особенно в случае бешенства , параллельная ветеринарная вакцина против возбудителя может быть на несколько порядков более экономичной, чем человеческая.
Вакцины DIVA (Дифференциация инфицированных от вакцинированных животных), также известные как SIVA (Отделение инфицированных от вакцинированных животных), позволяют различать инфицированных и вакцинированных животных. Вакцины DIVA несут по крайней мере на один эпитоп меньше, чем эквивалентный дикий микроорганизм. Сопутствующий диагностический тест, который выявляет антитела против этого эпитопа, помогает определить, было ли животное вакцинировано или нет. [ нужна цитата ]
Первые вакцины DIVA (ранее называвшиеся маркерными вакцинами , а с 1999 года — вакцины DIVA) и сопутствующие диагностические тесты были разработаны Дж. Т. ван Ойршотом и его коллегами в Центральном ветеринарном институте в Лелистаде, Нидерланды. [148] [149] Они обнаружили, что некоторые существующие вакцины против псевдобешенства (также называемого болезнью Ауески) имели делеции в вирусном геноме (среди которых был ген gE). Против этой делеции были получены моноклональные антитела и отобраны для разработки метода ELISA , который продемонстрировал антитела против gE. Кроме того, были созданы новые генно-инженерные gE-негативные вакцины. [150] Аналогичным образом были разработаны вакцины DIVA и сопутствующие диагностические тесты против инфекций, вызванных вирусом бычьего герпеса 1. [149] [151]
Стратегия DIVA применялась в различных странах для успешной ликвидации вируса псевдобешенства в этих странах. Поголовье свиней подвергалось интенсивной вакцинации и мониторингу с помощью сопутствующего диагностического теста, а затем инфицированных свиней удаляли из поголовья. Вакцины против бычьего герпесвируса 1 DIVA также широко используются на практике. [ нужна цитата ] Продолжаются значительные усилия по применению принципа DIVA к широкому спектру инфекционных заболеваний, таких как классическая чума свиней, [152] птичий грипп, [153] Actinobacillus pleuropneumonia [154] и сальмонеллезные инфекции у свиней. [155]

До введения вакцинации материалом от случаев коровьей оспы (гетеротипическая иммунизация) оспу можно было предотвратить путем преднамеренной вариоляции с вирусом оспы. Самые ранние намеки на практику вариоляции оспы в Китае относятся к десятому веку. [156] [ необходимо дальнейшее объяснение ] Китайцы также практиковали самое старое задокументированное использование вариаций, датируемое пятнадцатым веком. Они внедрили метод «назальной инсуффляции », вдувая в ноздри порошкообразный материал оспы, обычно струпья. Различные методы вдувания были зафиксированы на протяжении шестнадцатого и семнадцатого веков в Китае. [157] : 60 Два отчета о китайской практике прививок были получены Королевским обществом в Лондоне в 1700 году; один от Мартина Листера , который получил отчет от сотрудника Ост-Индской компании , находящегося в Китае, и другой от Клоптона Хейверса . [158] Во Франции Вольтер сообщает, что китайцы практиковали вариоляцию «эти сто лет». [159]

Мэри Уортли Монтегю , ставшая свидетельницей вариоляции в Турции, подвергла вариоляции свою четырехлетнюю дочь в присутствии врачей Королевского двора в 1721 году по возвращении в Англию. [157] Позже в том же году Чарльз Мейтленд провел экспериментальное изменение шести заключенных в тюрьме Ньюгейт в Лондоне. [160] Эксперимент увенчался успехом, и вскоре вариоляция привлекла внимание королевской семьи, которая способствовала продвижению этой процедуры. Однако в 1783 году, через несколько дней после прививки принцу Октавию Великобританскому , он умер. [161] В 1796 году врач Эдвард Дженнер взял гной из руки доярки, больной коровьей оспой , поцарапал его на руке 8-летнего мальчика Джеймса Фиппса , а шесть недель спустя заразил мальчика оспой, после чего наблюдал что он не заразился оспой. [162] [163] Дженнер расширил свои исследования и в 1798 году сообщил, что его вакцина безопасна для детей и взрослых и может передаваться из рук в руки, что уменьшило зависимость от ненадежных поставок от инфицированных коров. [161] В 1804 году испанская экспедиция по вакцинации оспы Балмис в испанские колонии Мексика и Филиппины использовала метод транспортировки из рук в руки, чтобы обойти тот факт, что вакцина сохранялась только 12 дней в пробирке . Они использовали коровью оспу. [164] Поскольку вакцинация коровьей оспой была гораздо безопаснее, чем прививка от оспы, [165] последняя, хотя и широко практиковалась в Англии, была запрещена в 1840 году. [166]

Вслед за работой Дженнера второе поколение вакцин было представлено в 1880-х годах Луи Пастером , который разработал вакцины против куриной холеры и сибирской язвы [17] , а с конца девятнадцатого века вакцины считались вопросом национального престижа. Была принята национальная политика вакцинации и приняты законы об обязательной вакцинации. [162] В 1931 году Элис Майлз Вудрафф и Эрнест Гудпасчер задокументировали, что вирус птичьей оспы можно выращивать в курином яйце с эмбрионом . Вскоре ученые начали культивировать в яйцах другие вирусы. Яйца использовались для размножения вируса при разработке вакцины против желтой лихорадки в 1935 году и вакцины против гриппа в 1945 году. В 1959 году питательная среда и клеточная культура заменили яйца в качестве стандартного метода размножения вируса для вакцин. [167]
Вакцинология процветала в двадцатом веке, когда было создано несколько успешных вакцин, в том числе против дифтерии , кори , эпидемического паротита и краснухи . Основные достижения включали разработку вакцины против полиомиелита в 1950-х годах и ликвидацию оспы в 1960-х и 1970-х годах. Морис Хиллеман был самым плодовитым из разработчиков вакцин в двадцатом веке. Поскольку вакцины стали более распространенными, многие люди начали воспринимать их как нечто само собой разумеющееся. Однако вакцины от многих важных заболеваний, включая простой герпес , малярию , гонорею и ВИЧ , остаются неуловимыми . [162] [168]

Вакцины первого поколения представляют собой цельноорганические вакцины – либо живые и ослабленные , либо убитые формы. [169] Живые ослабленные вакцины, такие как вакцины против оспы и полиомиелита, способны индуцировать ответы Т-клеток-киллеров (TC или CTL), ответы Т-хелперов ( TH ) и иммунитет антител . Однако ослабленные формы возбудителя могут перейти в опасную форму и вызвать заболевание у реципиентов вакцины с ослабленным иммунитетом (например, больных СПИДом ). Хотя убитые вакцины не несут такого риска, они не могут вызывать специфические реакции Т-клеток-киллеров и могут вообще не действовать при некоторых заболеваниях. [169]
Вакцины второго поколения были разработаны для снижения рисков, связанных с живыми вакцинами. Это субъединичные вакцины, состоящие из специфических белковых антигенов (таких как столбнячный или дифтерийный анатоксин ) или рекомбинантных белковых компонентов (таких как поверхностный антиген гепатита В ). Они могут генерировать ответы Т H и антител , но не ответы Т-клеток-киллеров. [ нужна цитата ]
РНК-вакцины и ДНК-вакцины являются примерами вакцин третьего поколения. [169] [170] [171] В 2016 году в Национальном институте здравоохранения начались испытания ДНК-вакцины против вируса Зика . Отдельно Inovio Pharmaceuticals и GeneOne Life Science начали испытания другой ДНК-вакцины против вируса Зика в Майами. По состоянию на 2016 год массовое производство вакцин не было решено. [172] Клинические испытания ДНК-вакцин для профилактики ВИЧ продолжаются. [173] Вакцины на основе мРНК , такие как BNT162b2 , были разработаны в 2020 году с помощью операции Warp Speed и массово использованы для борьбы с пандемией COVID-19 . В 2021 году Каталин Карико и Дрю Вайсман получили премию Хорвица Колумбийского университета за новаторские исследования в области технологии вакцин на основе мРНК. [174]
По крайней мере, с 2013 года ученые пытаются разработать синтетические вакцины третьего поколения, реконструируя внешнюю структуру вируса ; была надежда, что это поможет предотвратить устойчивость к вакцинам . [175]
Принципы, управляющие иммунным ответом, теперь можно использовать в индивидуальных вакцинах против многих неинфекционных заболеваний человека, таких как рак и аутоиммунные заболевания. [176] Например, экспериментальная вакцина CYT006-AngQb исследовалась как возможное средство лечения высокого кровяного давления . [177] Факторы, влияющие на тенденции разработки вакцин, включают прогресс в области трансляционной медицины, демографии , нормативной науки , политических, культурных и социальных мер. [178]
Идея производства вакцин с помощью трансгенных растений возникла еще в 2003 году. В такие растения, как табак , картофель , помидоры и бананы , могут быть встроены гены, которые заставляют их производить вакцины, пригодные для людей. [179] В 2005 году были разработаны бананы, из которых производят вакцину против гепатита B для человека . [180]
Неуверенность в вакцинации – это задержка с принятием вакцин или отказ от них, несмотря на наличие служб вакцинации. Этот термин охватывает прямой отказ от вакцинации, отсрочку вакцинации, принятие вакцин, но сохранение неуверенности в их использовании, или использование одних вакцин, но не других. [181] [182] [183] [184] Существует подавляющее большинство ученых, считающих, что вакцины в целом безопасны и эффективны. [185] [186] [187] [188] Нерешительность в отношении вакцинации часто приводит к вспышкам заболеваний и смертям от болезней, предупреждаемых с помощью вакцин . [189] [190] [191] [192] [193] [194] Таким образом, Всемирная организация здравоохранения охарактеризовала неуверенность в вакцинации как одну из десяти крупнейших глобальных угроз здоровью в 2019 году. [195] [196]
Влияние вакцин на здоровье населения поистине замечательно. Одно исследование, изучающее влияние вакцинации детей на когорту новорожденных в США в 2001 году, показало, что вакцины предотвратили 33 000 смертей и 14 миллионов случаев заболеваний (Zhou et al. 2005). Математические модели 73 стран, поддерживаемых альянсом ГАВИ, показывают, что вакцины предотвратят 23,3 миллиона смертей в 2011–2020 годах по сравнению с тем, что произошло бы, если бы вакцин не было (Lee et al. 2013). Вакцины были разработаны против широкого спектра патогенов человека.