
Газ — одно из четырех основных состояний материи . Другие — твердое , жидкое и плазма . [1] Чистый газ может состоять из отдельных атомов (например, благородный газ, такой как неон ), элементарных молекул, состоящих из одного типа атомов (например, кислород ), или сложных молекул, состоящих из различных атомов (например, углекислый газ ). Газовая смесь , такая как воздух , содержит различные чистые газы. То, что отличает газы от жидкостей и твердых тел, — это огромное разделение отдельных частиц газа . Это разделение обычно делает бесцветный газ невидимым для человеческого наблюдателя.
Газообразное состояние вещества находится между жидким и плазменным состояниями, [2] последнее из которых обеспечивает верхнюю границу температуры для газов. Ограничивая нижний конец температурной шкалы, лежат вырожденные квантовые газы [3] , которые привлекают все большее внимание. [4] Атомарные газы высокой плотности, переохлажденные до очень низких температур, классифицируются по своему статистическому поведению либо как бозе-газы , либо как ферми-газы . Полный список этих экзотических состояний вещества см. в списке состояний вещества .
Единственными химическими элементами , которые являются стабильными двухатомными гомоядерными молекулярными газами в STP, являются водород (H 2 ), азот (N 2 ), кислород (O 2 ) и два галогена : фтор (F 2 ) и хлор (Cl 2 ). При объединении с одноатомными благородными газами — гелием (He), неоном (Ne), аргоном (Ar), криптоном (Kr), ксеноном (Xe) и радоном (Rn) — эти газы называются «элементарными газами».
Слово gas впервые использовал фламандский химик начала XVII века Ян Баптист ван Гельмонт . [5] Он выделил диоксид углерода , первый известный газ, отличный от воздуха. [6] Слово Ван Гельмонта, по-видимому, было просто фонетической транскрипцией древнегреческого слова χάος « хаос » — g в голландском языке произносилось как ch в « loch » (глухой велярный фрикативный звук, / x / ) — в этом случае Ван Гельмонт просто следовал устоявшемуся алхимическому использованию, впервые засвидетельствованному в трудах Парацельса . Согласно терминологии Парацельса, хаос означал что-то вроде « ультраразреженной воды » . [7]
Альтернативная история заключается в том, что термин Ван Гельмонта произошел от « gahst (или geist ), что означает призрак или дух». [8] Эта история не получила доверия от редакторов Оксфордского словаря английского языка . [9] Напротив, франко-американский историк Жак Барзён предположил, что Ван Гельмонт заимствовал слово из немецкого Gäscht , что означает пену, образующуюся в результате брожения . [10]
Поскольку большинство газов трудно наблюдать напрямую, они описываются с помощью четырех физических свойств или макроскопических характеристик: давления , объема , числа частиц (химики группируют их по молям ) и температуры. Эти четыре характеристики неоднократно наблюдались такими учеными, как Роберт Бойль , Жак Шарль , Джон Дальтон , Жозеф Гей-Люссак и Амедео Авогадро для различных газов в различных условиях. Их подробные исследования в конечном итоге привели к математической связи между этими свойствами, выраженной законом идеального газа (см. раздел Идеальный и совершенный газ ниже).
Частицы газа находятся на большом расстоянии друг от друга и, следовательно, имеют более слабые межмолекулярные связи, чем жидкости или твердые тела. Эти межмолекулярные силы являются результатом электростатического взаимодействия между частицами газа. Одноименно заряженные области различных частиц газа отталкиваются, в то время как противоположно заряженные области различных частиц газа притягиваются друг к другу; газы, содержащие постоянно заряженные ионы , известны как плазма . Газообразные соединения с полярными ковалентными связями содержат постоянный дисбаланс зарядов и поэтому испытывают относительно сильные межмолекулярные силы, хотя чистый заряд соединения остается нейтральным. Кратковременные, случайно индуцированные заряды существуют через неполярные ковалентные связи молекул, и электростатические взаимодействия, вызванные ими, называются силами Ван-дер-Ваальса . Взаимодействие этих межмолекулярных сил варьируется в пределах вещества, что определяет многие физические свойства, уникальные для каждого газа. [11] [12] Сравнение температур кипения для соединений, образованных ионными и ковалентными связями, приводит нас к такому выводу. [13]
По сравнению с другими состояниями вещества газы имеют низкую плотность и вязкость . Давление и температура влияют на частицы в пределах определенного объема. Это изменение в разделении частиц и скорости называется сжимаемостью . Это разделение частиц и размер влияют на оптические свойства газов, как можно найти в следующем списке показателей преломления . Наконец, частицы газа расходятся или диффундируют , чтобы равномерно распределиться по любому контейнеру.
При наблюдении за газом обычно указывают систему отсчета или масштаб длины . Больший масштаб длины соответствует макроскопической или глобальной точке зрения на газ. Эта область (называемая объемом) должна быть достаточно большой по размеру, чтобы содержать большую выборку частиц газа. Результирующий статистический анализ этого размера выборки дает «среднее» поведение (т. е. скорость, температуру или давление) всех частиц газа в пределах области. Напротив, меньший масштаб длины соответствует микроскопической или частицевой точке зрения.
Макроскопически характеристики газа измеряются либо в терминах самих частиц газа (скорость, давление или температура), либо их окружения (объем). Например, Роберт Бойль изучал пневматическую химию в течение небольшой части своей карьеры. Один из его экспериментов был связан с макроскопическими свойствами давления и объема газа. В его эксперименте использовался манометр с J-образной трубкой , который выглядит как пробирка в форме буквы J. Бойль удерживал инертный газ в закрытом конце пробирки со столбиком ртути , тем самым делая количество частиц и температуру постоянными. Он заметил, что при увеличении давления в газе путем добавления большего количества ртути в столбик объем удерживаемого газа уменьшался (это известно как обратная зависимость). Более того, когда Бойль умножал давление и объем каждого наблюдения, произведение было постоянным. Это соотношение сохранялось для каждого газа, который наблюдал Бойль, что привело к закону (PV=k), названному в честь его работы в этой области.

Существует множество математических инструментов для анализа свойств газа. Лабораторное оборудование Бойля позволяло использовать всего лишь простые вычисления для получения аналитических результатов. Его результаты стали возможны, потому что он изучал газы в условиях относительно низкого давления, где они вели себя «идеальным» образом. Эти идеальные соотношения применяются к расчетам безопасности для различных условий полета используемых материалов. Однако высокотехнологичное оборудование, используемое сегодня, было разработано, чтобы помочь нам безопасно исследовать более экзотические рабочие среды, где газы больше не ведут себя «идеальным» образом. Поскольку газы подвергаются экстремальным условиям, инструменты для их интерпретации становятся более сложными, от уравнений Эйлера для невязкого потока до уравнений Навье–Стокса [14] , которые полностью учитывают вязкие эффекты. Эта передовая математика, включая статистику и многомерное исчисление , адаптированная к условиям рассматриваемой газовой системы, позволяет решать такие сложные динамические ситуации, как возвращение космического корабля в атмосферу. Примером является анализ возвращения космического челнока, изображенный на рисунке, чтобы убедиться, что свойства материала в этом состоянии нагрузки являются подходящими. В этой ситуации полета газ уже не ведет себя идеально.
Символ, используемый для представления давления в уравнениях, — «p» или «P» с единицей СИ — паскалем .

При описании контейнера с газом термин «давление» (или абсолютное давление) относится к средней силе на единицу площади, которую газ оказывает на поверхность контейнера. В этом объеме иногда проще визуализировать частицы газа, движущиеся по прямым линиям, пока они не столкнутся с контейнером (см. диаграмму вверху). Сила, сообщаемая частицей газа контейнеру во время этого столкновения, представляет собой изменение импульса частицы . [15] Во время столкновения изменяется только нормальная составляющая скорости. Частица, движущаяся параллельно стенке, не изменяет своего импульса. Следовательно, средняя сила на поверхности должна быть средним изменением линейного импульса от всех этих столкновений частиц газа.
Давление представляет собой сумму всех нормальных составляющих силы, оказываемой частицами, ударяющимися о стенки контейнера, деленную на площадь поверхности стенки.
Символ, используемый для обозначения температуры в уравнениях, — T , единица измерения СИ — кельвин .
Скорость частицы газа пропорциональна ее абсолютной температуре . Объем воздушного шара на видео уменьшается, когда захваченные частицы газа замедляются при добавлении чрезвычайно холодного азота. Температура любой физической системы связана с движениями частиц (молекул и атомов), которые составляют [газовую] систему. [16] В статистической механике температура является мерой средней кинетической энергии, хранящейся в молекуле (также известной как тепловая энергия). Методы хранения этой энергии диктуются степенями свободы самой молекулы ( энергетическими модами ). Тепловая (кинетическая) энергия, добавленная к газу или жидкости ( эндотермический процесс), производит поступательное, вращательное и колебательное движение. Напротив, твердое тело может увеличивать свою внутреннюю энергию только за счет возбуждения дополнительных колебательных мод, поскольку структура кристаллической решетки предотвращает как поступательное, так и вращательное движение. Эти нагретые молекулы газа имеют больший диапазон скоростей (более широкое распределение скоростей) с более высокой средней или средней скоростью. Дисперсия этого распределения обусловлена постоянным изменением скоростей отдельных частиц из-за повторяющихся столкновений с другими частицами. Диапазон скоростей можно описать распределением Максвелла–Больцмана . Использование этого распределения подразумевает идеальные газы вблизи термодинамического равновесия для рассматриваемой системы частиц.
Символ, используемый для обозначения удельного объема в уравнениях, — «v» с единицами СИ кубические метры на килограмм.
Символ, используемый для обозначения объема в уравнениях, — «V» с единицей измерения СИ — кубическими метрами.
При выполнении термодинамического анализа обычно говорят об интенсивных и экстенсивных свойствах . Свойства, которые зависят от количества газа (либо по массе, либо по объему), называются экстенсивными свойствами, в то время как свойства, которые не зависят от количества газа, называются интенсивными свойствами. Удельный объем является примером интенсивного свойства, поскольку он представляет собой отношение объема, занимаемого единицей массы газа, которая одинакова во всей системе в состоянии равновесия. [17] 1000 атомов газа занимают то же пространство, что и любые другие 1000 атомов при любой заданной температуре и давлении. Эту концепцию легче визуализировать для твердых тел, таких как железо, которые являются несжимаемыми по сравнению с газами. Однако сам объем --- не удельный --- является экстенсивным свойством.
Символ, используемый для представления плотности в уравнениях, — ρ (rho) с единицами СИ килограмм на кубический метр. Этот термин является обратной величиной удельного объема.
Поскольку молекулы газа могут свободно перемещаться внутри контейнера, их масса обычно характеризуется плотностью. Плотность — это количество массы на единицу объема вещества или величина, обратная удельному объему. Для газов плотность может изменяться в широких пределах, поскольку частицы могут свободно перемещаться ближе друг к другу, когда их ограничивает давление или объем. Это изменение плотности называется сжимаемостью . Подобно давлению и температуре, плотность является переменной состояния газа, и изменение плотности в ходе любого процесса регулируется законами термодинамики. Для статического газа плотность одинакова во всем контейнере. Таким образом, плотность является скалярной величиной . С помощью кинетической теории можно показать, что плотность обратно пропорциональна размеру контейнера, в котором заключена фиксированная масса газа. В этом случае фиксированной массы плотность уменьшается по мере увеличения объема.
Если бы можно было наблюдать газ под мощным микроскопом, то можно было бы увидеть совокупность частиц без определенной формы или объема, которые находятся в более или менее хаотичном движении. Эти частицы газа меняют направление только при столкновении с другой частицей или со стенками контейнера. Этот микроскопический вид газа хорошо описывается статистической механикой , но его можно описать многими различными теориями. Кинетическая теория газов , которая предполагает, что эти столкновения являются абсолютно упругими , не учитывает межмолекулярные силы притяжения и отталкивания.
Кинетическая теория дает представление о макроскопических свойствах газов, рассматривая их молекулярный состав и движение. Начиная с определений импульса и кинетической энергии , [18] можно использовать сохранение импульса и геометрические соотношения куба, чтобы связать макроскопические системные свойства температуры и давления с микроскопическим свойством кинетической энергии на молекулу. Теория дает усредненные значения для этих двух свойств.
Кинетическая теория газов может помочь объяснить, как система (рассматриваемая совокупность частиц газа) реагирует на изменения температуры, вызывая соответствующее изменение кинетической энергии .
Например: представьте, что у вас есть герметичный контейнер фиксированного размера ( постоянного объема), содержащий фиксированное количество частиц газа; начиная с абсолютного нуля (теоретическая температура, при которой атомы или молекулы не имеют тепловой энергии, т. е. не движутся и не вибрируют), вы начинаете добавлять энергию в систему, нагревая контейнер, так что энергия передается частицам внутри. Как только их внутренняя энергия превысит энергию нулевой точки , то есть их кинетическая энергия (также известная как тепловая энергия ) станет ненулевой, частицы газа начнут двигаться вокруг контейнера. По мере дальнейшего нагревания коробки (по мере добавления большего количества энергии) отдельные частицы увеличивают свою среднюю скорость по мере увеличения общей внутренней энергии системы. Более высокая средняя скорость всех частиц приводит к большей скорости, с которой происходят столкновения (т. е. большему количеству столкновений в единицу времени) между частицами и контейнером, а также между самими частицами.
Макроскопическая , измеримая величина давления является прямым результатом столкновений этих микроскопических частиц с поверхностью, на которой отдельные молекулы оказывают небольшую силу, каждая из которых вносит свой вклад в общую силу, приложенную в определенной области. ( Читайте § Давление. )
Аналогично, макроскопически измеримая величина температуры является количественной оценкой общего количества движения или кинетической энергии, которую проявляют частицы. ( Читайте § Температура. )
В кинетической теории газов предполагается, что кинетическая энергия состоит исключительно из линейных перемещений в соответствии с распределением скоростей частиц в системе. Однако в реальных газах и других реальных веществах движения, которые определяют кинетическую энергию системы (которые в совокупности определяют температуру), намного сложнее, чем простое линейное перемещение из-за более сложной структуры молекул по сравнению с отдельными атомами, которые действуют аналогично точечным массам . В реальных термодинамических системах квантовые явления играют большую роль в определении тепловых движений. Случайные тепловые движения (кинетическая энергия) в молекулах представляют собой комбинацию конечного набора возможных движений, включая перемещение, вращение и вибрацию . Этот конечный диапазон возможных движений, наряду с конечным набором молекул в системе, приводит к конечному числу микросостояний внутри системы; мы называем набор всех микросостояний ансамблем . Конкретно для атомных или молекулярных систем мы могли бы потенциально иметь три различных вида ансамбля, в зависимости от ситуации: микроканонический ансамбль , канонический ансамбль или большой канонический ансамбль . Конкретные комбинации микросостояний в ансамбле — это то, как мы действительно определяем макросостояние системы (температура, давление, энергия и т. д.). Чтобы сделать это, мы должны сначала подсчитать все микросостояния с помощью функции распределения . Использование статистической механики и функции распределения является важным инструментом во всей физической химии, поскольку это ключ к связи между микроскопическими состояниями системы и макроскопическими переменными, которые мы можем измерить, такими как температура, давление, теплоемкость, внутренняя энергия, энтальпия и энтропия, и это лишь некоторые из них. ( Читайте : Функция распределения Значение и значимость )
Использование функции распределения для нахождения энергии молекулы или системы молекул иногда может быть приближено теоремой о равнораспределении , что значительно упрощает расчет. Однако этот метод предполагает, что все молекулярные степени свободы одинаково заполнены и, следовательно, одинаково используются для хранения энергии внутри молекулы. Это означало бы, что внутренняя энергия изменяется линейно с температурой, что не соответствует действительности. Это игнорирует тот факт, что теплоемкость изменяется с температурой из-за того, что определенные степени свободы недостижимы (т. е. «заморожены») при более низких температурах. По мере увеличения внутренней энергии молекул увеличивается и способность хранить энергию в дополнительных степенях свободы. По мере того, как больше степеней свободы становятся доступными для удержания энергии, это приводит к увеличению молярной теплоемкости вещества. [19]

Броуновское движение — это математическая модель, используемая для описания случайного движения частиц, взвешенных в жидкости. Анимация частиц газа, использующая розовые и зеленые частицы, иллюстрирует, как это поведение приводит к распространению газов ( энтропии ). Эти события также описываются теорией частиц .
Поскольку наблюдение отдельных частиц газа (атомов или молекул) находится на пределе (или за пределами) современных технологий, только теоретические расчеты дают предположения о том, как они движутся, но их движение отличается от броуновского движения, поскольку броуновское движение включает в себя плавное сопротивление из-за силы трения многих молекул газа, прерываемое сильными столкновениями отдельной (или нескольких) молекул газа с частицей. Таким образом, частица (обычно состоящая из миллионов или миллиардов атомов) движется по неровной траектории, но не такой неровной, как можно было бы ожидать, если бы исследовалась отдельная молекула газа.
Силы между двумя или более молекулами или атомами, как притягивающие, так и отталкивающие, называются межмолекулярными силами . Межмолекулярные силы испытываются молекулами, когда они находятся в физической близости друг от друга. [20] [21] Эти силы очень важны для правильного моделирования молекулярных систем, поскольку они позволяют точно предсказать микроскопическое поведение молекул в любой системе, и, следовательно, необходимы для точного предсказания физических свойств газов (и жидкостей) в широких пределах физических условий.
Возникнув из изучения физической химии , одной из самых известных межмолекулярных сил во всей физике являются силы Ван-дер-Ваальса . Силы Ван-дер-Ваальса играют ключевую роль в определении почти всех физических свойств жидкостей, таких как вязкость , скорость потока и газовая динамика (см. раздел физических характеристик). Взаимодействия Ван-дер-Ваальса между молекулами газа являются причиной того, что моделирование «реального газа» математически сложнее, чем « идеального газа». Игнорирование этих зависящих от близости сил позволяет рассматривать реальный газ как идеальный , что значительно упрощает вычисления.
Межмолекулярное притяжение и отталкивание между двумя молекулами газа зависят от расстояния между ними. Объединенные притяжения и отталкивания хорошо моделируются потенциалом Леннарда-Джонса , [22] [23] , который является одним из наиболее изученных из всех межатомных потенциалов, описывающих потенциальную энергию молекулярных систем. Из-за общей применимости и важности модельную систему Леннарда-Джонса часто называют «Леннард-Джонсиум». [24] [25] Потенциал Леннарда-Джонса между молекулами можно разбить на два отдельных компонента: дальнодействующее притяжение из-за силы дисперсии Лондона и ближнедействующее отталкивание из-за электрон-электронного обменного взаимодействия (которое связано с принципом исключения Паули ).
Когда две молекулы находятся на относительно большом расстоянии (то есть имеют высокую потенциальную энергию), они испытывают слабую силу притяжения, заставляющую их двигаться друг к другу, что снижает их потенциальную энергию. Однако, если молекулы находятся слишком далеко , то они не будут испытывать никакой значимой силы притяжения. Кроме того, если молекулы окажутся слишком близко , то они столкнутся и испытают очень высокую силу отталкивания (моделируемую твердыми сферами ), которая намного сильнее силы притяжения, так что любое притяжение из-за близости игнорируется.
Когда две молекулы приближаются друг к другу с расстояния, которое не слишком далеко и не слишком близко, их притяжение увеличивается по мере увеличения величины их потенциальной энергии (становясь более отрицательным) и снижает их общую внутреннюю энергию. [26] Притяжение, заставляющее молекулы сближаться, может произойти только в том случае, если молекулы остаются в непосредственной близости в течение времени, необходимого для физического сближения . Следовательно, силы притяжения наиболее сильны, когда молекулы движутся с низкой скоростью . Это означает, что притяжение между молекулами существенно, когда температура газа низкая . Однако, если бы вы изотермически сжали этот холодный газ в небольшой объем, заставив молекулы приблизиться друг к другу и повысив давление, отталкивание начало бы преобладать над притяжением, поскольку скорость, с которой происходят столкновения, значительно возросла бы. Следовательно, при низких температурах и низких давлениях притяжение является доминирующим межмолекулярным взаимодействием.
Если две молекулы движутся с высокой скоростью в произвольных направлениях по непересекающимся траекториям, то они не проведут достаточно времени в непосредственной близости, чтобы на них подействовала сила притяжения Лондона-дисперсии. Если две молекулы сталкиваются, они движутся слишком быстро, и их кинетическая энергия будет намного больше любой потенциальной энергии притяжения, поэтому они будут испытывать только отталкивание при столкновении. Таким образом, притяжением между молекулами можно пренебречь при высоких температурах из-за высоких скоростей. При высоких температурах и высоких давлениях отталкивание является доминирующим межмолекулярным взаимодействием.
Принимая во внимание вышеизложенные эффекты, которые вызывают эти притяжения и отталкивания, реальные газы отличаются от модели идеального газа следующим обобщением: [27]
Уравнение состояния (для газов) — это математическая модель, используемая для приблизительного описания или прогнозирования свойств состояния газа. В настоящее время не существует единого уравнения состояния, которое точно предсказывает свойства всех газов при всех условиях. Поэтому был разработан ряд гораздо более точных уравнений состояния для газов в определенных диапазонах температур и давлений. Наиболее широко обсуждаемыми «газовыми моделями» являются «совершенный газ», «идеальный газ» и «реальный газ». Каждая из этих моделей имеет свой собственный набор предположений для облегчения анализа данной термодинамической системы. [28] Каждая последующая модель расширяет температурный диапазон покрытия, к которому она применяется.
Уравнение состояния идеального или совершенного газа — это закон идеального газа, который выглядит следующим образом:
где P — давление, V — объем, n — количество газа (в мольных единицах), R — универсальная газовая постоянная , 8,314 Дж/(моль К), а T — температура. Записанная таким образом, она иногда называется «химической версией», поскольку подчеркивает число молекул n . Ее также можно записать как
где — удельная газовая постоянная для конкретного газа, в единицах Дж/(кг К), а ρ = m/V — плотность. Эта запись является версией «газодинамика», которая более практична при моделировании газовых потоков с ускорением без химических реакций.
Закон идеального газа не делает предположений о теплоемкости газа . В самом общем случае удельная теплоемкость является функцией как температуры, так и давления. Если зависимость от давления (и, возможно, также зависимость от температуры) пренебрегается в конкретном приложении, иногда говорят, что газ является идеальным газом , хотя точные предположения могут различаться в зависимости от автора и/или области науки.
Для идеального газа закон идеального газа применяется без ограничений на удельную теплоемкость. Идеальный газ — это упрощенный «реальный газ» с предположением, что коэффициент сжимаемости Z установлен равным 1, что означает, что это пневматическое отношение остается постоянным. Коэффициент сжимаемости, равный единице, также требует, чтобы четыре переменные состояния следовали закону идеального газа .
Это приближение больше подходит для приложений в инженерии, хотя более простые модели могут использоваться для получения диапазона "приблизительных значений" того, где должно находиться реальное решение. Примером, где "приближение идеального газа" было бы подходящим, может быть внутренняя часть камеры сгорания реактивного двигателя . [29] Также может быть полезно сохранить элементарные реакции и химические диссоциации для расчета выбросов .

Каждое из перечисленных ниже предположений усложняет решение проблемы. Поскольку плотность газа увеличивается с ростом давления, межмолекулярные силы играют более существенную роль в поведении газа, что приводит к тому, что закон идеального газа больше не обеспечивает «разумных» результатов. На верхнем пределе температурных диапазонов двигателя (например, секции камеры сгорания – 1300 К) сложные частицы топлива поглощают внутреннюю энергию посредством вращений и вибраций, которые заставляют их удельные теплоемкости отличаться от теплоемкостей двухатомных молекул и благородных газов. При температуре, превышающей эту более чем вдвое, начинается электронное возбуждение и диссоциация частиц газа, в результате чего давление подстраивается под большее количество частиц (переход от газа к плазме ). [30] Наконец, предполагалось, что все термодинамические процессы описывают однородные газы, скорости которых изменяются в соответствии с фиксированным распределением. Использование неравновесной ситуации подразумевает, что поле потока должно быть охарактеризовано каким-то образом, чтобы обеспечить решение. Одной из первых попыток расширить границы закона идеального газа было включение в него различных термодинамических процессов путем корректировки уравнения таким образом, чтобы pV n = константа , а затем варьирования n с помощью различных значений, таких как удельное теплоемкость , γ .
Реальные эффекты газа включают в себя корректировки, сделанные для учета более широкого диапазона поведения газа:
Для большинства приложений такой подробный анализ является излишним. Примерами, где реальные газовые эффекты могли бы оказать существенное влияние, были бы возвращение космического челнока , где присутствовали чрезвычайно высокие температуры и давления, или газы, образующиеся во время геологических событий, как на изображении извержения горы Редаут в 1990 году .
Постоянный газ — это термин, используемый для газа, который имеет критическую температуру ниже диапазона нормальных температур, пригодных для обитания человека, и поэтому не может быть сжижен давлением в этом диапазоне. Исторически считалось, что такие газы невозможно сжижать, и поэтому они будут постоянно оставаться в газообразном состоянии. Термин относится к хранению при температуре окружающей среды и транспортировке газов под высоким давлением. [31]

Закон Бойля был, возможно, первым выражением уравнения состояния. В 1662 году Роберт Бойль провел серию экспериментов, используя стеклянную трубку в форме буквы J, которая была запаяна с одного конца. В трубку добавлялась ртуть, удерживая фиксированное количество воздуха в коротком, запаянном конце трубки. Затем объем газа тщательно измерялся по мере добавления в трубку дополнительной ртути. Давление газа можно было определить по разнице между уровнем ртути в коротком конце трубки и в длинном, открытом конце. Изображение оборудования Бойля показывает некоторые экзотические инструменты, которые Бойль использовал во время своего изучения газов.
В ходе этих экспериментов Бойль заметил, что давление, оказываемое газом, находящимся при постоянной температуре, обратно пропорционально объему газа. [32] Например, если объем уменьшается вдвое, давление удваивается; а если объем удваивается, давление уменьшается вдвое. Учитывая обратную зависимость между давлением и объемом, произведение давления ( P ) и объема ( V ) является константой ( k ) для данной массы ограниченного газа, пока температура постоянна. Формула выглядит следующим образом:
Поскольку объемы и давления фиксированного количества газа до и после, при одинаковых температурах до и после, равны константе k , их можно связать уравнением:
В 1787 году французский физик и пионер воздухоплавания Жак Шарль обнаружил, что кислород, азот, водород, углекислый газ и воздух расширяются в одинаковой степени в одном и том же интервале в 80 кельвинов. Он отметил, что для идеального газа при постоянном давлении объем прямо пропорционален его температуре:
В 1802 году Жозеф Луи Гей-Люссак опубликовал результаты похожих, хотя и более обширных экспериментов. [33] Гей-Люссак отдал должное более ранней работе Шарля, назвав закон в его честь. Сам Гей-Люссак считается автором закона, описывающего давление, который он открыл в 1809 году. Он гласит, что давление, оказываемое идеальным газом на стенки сосуда, пропорционально его температуре.
В 1811 году Амедео Авогадро подтвердил, что равные объемы чистых газов содержат одинаковое количество частиц. Его теория не была общепринятой до 1858 года, когда другой итальянский химик Станислао Канниццаро смог объяснить неидеальные исключения. Для его работы с газами столетием ранее физическая константа, носящая его имя ( постоянная Авогадро ), представляет собой число атомов на моль элементарного углерода-12 (6,022 × 1023 моль −1 ) . Это определенное число частиц газа при стандартной температуре и давлении (закон идеального газа) занимает 22,40 литра, что называется молярным объемом .
Закон Авогадро гласит, что объем, занимаемый идеальным газом, пропорционален количеству вещества в этом объеме. Это приводит к молярному объему газа, который при нормальных условиях равен 22,4 дм 3 /моль (литров на моль). Соотношение определяется как где n — количество вещества в газе (число молекул, деленное на постоянную Авогадро ).

В 1801 году Джон Дальтон опубликовал закон парциальных давлений из своей работы с законом идеального газа: Давление смеси нереактивных газов равно сумме давлений всех составляющих газов по отдельности. Математически это можно представить для n видов как:
Изображение журнала Дальтона отображает символику, которую он использовал в качестве стенографии для записи пути, которым он следовал. Среди его ключевых наблюдений в журнале по смешиванию нереакционноспособных «упругих жидкостей» (газов) были следующие: [34]

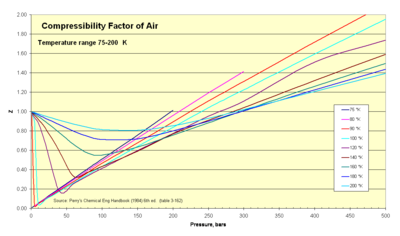
Термодинамики используют этот фактор ( Z ) для изменения уравнения идеального газа с целью учета эффектов сжимаемости реальных газов. Этот фактор представляет собой отношение фактического и идеального удельных объемов. Иногда его называют «фактором подгонки» или поправкой для расширения полезного диапазона закона идеального газа для целей проектирования. Обычно это значение Z очень близко к единице. Изображение фактора сжимаемости иллюстрирует, как Z изменяется в диапазоне очень низких температур.

Частицы, по сути, «прилипают» к поверхности объекта, движущегося через него. Этот слой частиц называется пограничным слоем. На поверхности объекта он по существу статичен из-за трения поверхности. Объект с его пограничным слоем фактически является новой формой объекта, которую остальные молекулы «видят» по мере приближения объекта. Этот пограничный слой может отделиться от поверхности, по сути, создавая новую поверхность и полностью изменяя путь потока. Классическим примером этого является срывающийся аэродинамический профиль . Изображение дельта-крыла четко показывает утолщение пограничного слоя по мере того, как газ течет справа налево вдоль передней кромки.

В динамике жидкости турбулентность или турбулентный поток — это режим потока, характеризующийся хаотическими, стохастическими изменениями свойств. Сюда входит диффузия с низким импульсом, конвекция с высоким импульсом и быстрое изменение давления и скорости в пространстве и времени. Спутниковый вид погоды вокруг островов Робинзона Крузо иллюстрирует один пример.
Вязкость, физическое свойство, является мерой того, насколько хорошо соседние молекулы прилипают друг к другу. Твердое тело может выдерживать сдвиговую силу из-за прочности этих липких межмолекулярных сил. Жидкость будет непрерывно деформироваться при воздействии аналогичной нагрузки. Хотя газ имеет более низкое значение вязкости, чем жидкость, это все равно наблюдаемое свойство. Если бы газы не имели вязкости, они бы не прилипали к поверхности крыла и не образовывали пограничный слой. Изучение дельта- крыла на изображении Шлирена показывает, что частицы газа прилипают друг к другу (см. раздел Пограничный слой).
В механике жидкости число Рейнольдса представляет собой отношение инерционных сил ( v s ρ ), которые доминируют в турбулентном потоке, к вязким силам ( μ/L ), которые пропорциональны вязкости. Это одно из важнейших безразмерных чисел в динамике жидкости и используется, как правило, вместе с другими безразмерными числами, для предоставления критерия для определения динамического подобия. Таким образом, число Рейнольдса обеспечивает связь между результатами моделирования (проектированием) и реальными условиями в натуральную величину. Его также можно использовать для характеристики потока.
Поскольку общее число степеней свободы стремится к бесконечности, система будет находиться в макросостоянии , которое соответствует наибольшей множественности . Чтобы проиллюстрировать этот принцип, наблюдайте температуру кожи замороженного металлического стержня. Используя тепловое изображение температуры кожи, отметьте распределение температуры на поверхности. Это первоначальное наблюдение температуры представляет собой « микросостояние ». В какой-то момент в будущем второе наблюдение температуры кожи создает второе микросостояние. Продолжая этот процесс наблюдения, можно создать ряд микросостояний, которые иллюстрируют тепловую историю поверхности стержня. Характеристика этого исторического ряда микросостояний возможна путем выбора макросостояния, которое успешно классифицирует их все в одну группу.
Когда передача энергии из системы прекращается, это состояние называется термодинамическим равновесием. Обычно это состояние подразумевает, что система и окружающая среда находятся при одной и той же температуре, так что тепло больше не передается между ними. Это также подразумевает, что внешние силы уравновешены (объем не меняется), и все химические реакции внутри системы завершены. Временная шкала для этих событий различается в зависимости от рассматриваемой системы. Контейнер со льдом, которому позволяют растаять при комнатной температуре, растает за часы, в то время как в полупроводниках передача тепла, которая происходит при переходе устройства из включенного в выключенное состояние, может составлять порядка нескольких наносекунд.
Вероятно, нет никаких оснований в идее (встречающейся с XVIII в. и далее, например, в J. Priestley On Air (1774) Introd. 3) о том, что Ван Гельмонт смоделировал gas по образцу голландского geest spirit или любого из его родственных слов.