Никель Ренея / ˈ r eɪ n iː ˈ n ɪ k əl / , также называемый губчатым никелем , [1] представляет собой мелкозернистое твердое вещество, состоящее в основном из никеля , полученного из никель- алюминиевого сплава. [2] [3] Известно несколько марок, большинство из которых представляют собой твердые вещества серого цвета. Некоторые из них пирофорны , но большинство из них используются в виде устойчивых на воздухе суспензий. Никель Ренея используется в качестве реагента и катализатора в органической химии . Он был разработан в 1926 году американским инженером Мюрреем Рэйни для гидрирования растительных масел. [4] [5] Raney является зарегистрированной торговой маркой WR Grace and Company . Другими крупными производителями являются Evonik и Johnson Matthey .

Сплав Ni–Al получают растворением никеля в расплавленном алюминии с последующим охлаждением («закалкой»). В зависимости от соотношения Ni:Al при закалке выделяются различные фазы. Во время процедуры гашения добавляются небольшие количества третьего металла, например цинка или хрома, для повышения активности полученного катализатора. Этот третий металл называется « промотором ». [6] Промотор превращает смесь из бинарного сплава в тройной сплав, что может привести к различным свойствам закалки и выщелачивания во время активации.
В процессе активации сплав, обычно в виде мелкодисперсного порошка, обрабатывается концентрированным раствором гидроксида натрия . [3] Упрощенная реакция выщелачивания описывается следующим химическим уравнением :
Образование алюмината натрия (Na[Al(OH) 4 ]) требует использования растворов гидроксида натрия высокой концентрации, чтобы избежать образования гидроксида алюминия , который в противном случае выпал бы в осадок в виде байерита . [6] Поэтому используются растворы гидроксида натрия с концентрацией до 5 М.
Температура, используемая для выщелачивания сплава, оказывает заметное влияние на свойства катализатора. Обычно выщелачивание проводят при температуре от 70 до 100 °C. Площадь поверхности никеля Ренея (и связанных с ним катализаторов в целом) имеет тенденцию уменьшаться с увеличением температуры выщелачивания. [7] Это происходит из-за структурных перестроек внутри сплава, которые можно рассматривать как аналог спекания , когда связки сплава начинают прилипать друг к другу при более высоких температурах, что приводит к потере пористой структуры. [ нужна цитата ]
В процессе активации Al выщелачивается из фаз NiAl 3 и Ni 2 Al 3 , присутствующих в сплаве, тогда как большая часть Ni остается в форме NiAl. Удаление Al из некоторых фаз, но не из других, известно как « селективное выщелачивание ». Показано, что фаза NiAl обеспечивает структурную и термическую стабильность катализатора. В результате катализатор весьма устойчив к разложению («разрушению», обычно известному как «старение»). [7] Такое сопротивление позволяет хранить и повторно использовать никель Ренея в течение длительного периода; однако для лабораторного использования обычно предпочтительны свежие препараты. [8] По этой причине коммерческий никель Ренея доступен как в «активной», так и в «неактивной» формах.
Перед хранением катализатор можно промыть дистиллированной водой при температуре окружающей среды для удаления остатков алюмината натрия. Для хранения предпочтительнее использовать бескислородную ( дегазированную ) воду, чтобы предотвратить окисление катализатора, которое может ускорить процесс его старения и привести к снижению каталитической активности. [6]



Макроскопически никель Ренея представляет собой мелкодисперсный серый порошок. Микроскопически каждая частица этого порошка представляет собой трехмерную сетку с порами неправильного размера и формы, подавляющее большинство из которых создается в процессе выщелачивания. Никель Ренея отличается термической и структурной стабильностью, а также большой площадью поверхности Брунауэра - Эммета - Теллера ( БЭТ ). Эти свойства являются прямым результатом процесса активации и способствуют относительно высокой каталитической активности. [ нужна цитата ]
Площадь поверхности обычно определяется методом БЭТ с использованием газа, который предпочтительно адсорбируется на металлических поверхностях, например водорода . С помощью этого типа измерений было показано, что почти вся открытая площадь частицы катализатора содержит Ni на своей поверхности. [6] Поскольку Ni является активным металлом катализатора, большая площадь поверхности Ni означает, что большая поверхность доступна для одновременного протекания реакций, что отражается в повышенной активности катализатора. Коммерчески доступный никель Ренея имеет среднюю площадь поверхности Ni 100 м 2 на грамм катализатора. [6]
Высокая каталитическая активность в сочетании с тем фактом, что водород поглощается порами катализатора во время активации, делает никель Ренея полезным катализатором для многих реакций гидрирования . Его структурная и термическая стабильность (т. е. он не разлагается при высоких температурах) позволяет использовать его в широком диапазоне условий реакции. [9] [10] Кроме того, растворимость никеля Ренея незначительна в большинстве распространенных лабораторных растворителей, за исключением минеральных кислот, таких как соляная кислота, а его относительно высокая плотность (около 6,5 г см -3 ) [1] также облегчает его отделение от жидкой фазы после завершения реакции.
Никель Ренея используется во многих промышленных процессах и в органическом синтезе из-за его стабильности и высокой каталитической активности при комнатной температуре. [6] [11] [12]
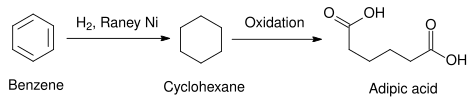
В коммерческом применении никель Ренея используется в качестве катализатора гидрирования бензола в циклогексан . В некоторых случаях используются другие гетерогенные катализаторы, например, с использованием элементов платиновой группы . Платиновые металлы, как правило, более активны и требуют более мягких температур, но они дороже, чем никель Ренея. [13] Полученный таким образом циклогексан может быть использован в синтезе адипиновой кислоты , сырья, используемого в промышленном производстве полиамидов , таких как нейлон. [14]
Другие промышленные применения никеля Ренея включают преобразование:
Никель Ренея используется в органическом синтезе для десульфурации . Например, тиоацетали будут восстановлены до углеводородов на последней стадии восстановления Мозинго : [14] [15]

Тиолы [ 16] и сульфиды [17] можно удалить из алифатических , ароматических или гетероароматических соединений. Аналогично, никель Ренея удаляет серу из тиофена , образуя насыщенный алкан . [18]

Обычно его используют при восстановлении соединений с кратными связями , таких как алкины , алкены , [19] нитрилы , [20] диены , ароматические соединения [21] и карбонилсодержащие соединения. Кроме того, никель Ренея восстанавливает связи гетероатом-гетероатом, такие как гидразины , [22] нитрогруппы и нитрозамины. [23] Он также нашел применение при восстановительном алкилировании аминов [24] и аминировании спиртов .
При восстановлении двойной связи углерод-углерод никель Ренея присоединяет водород син- образным образом. [14]
Также был описан кобальт Ренея.
В отличие от пирофорной природы некоторых форм никеля Ренея, катализаторы на основе силицида никеля представляют собой потенциально более безопасную альтернативу. [25]


Из-за большой площади поверхности и большого объема содержащегося в нем газообразного водорода сухой активированный никель Ренея является пирофорным материалом, с которым необходимо обращаться в инертной атмосфере . Никель Ренея обычно поставляется в виде 50% суспензии в воде. Даже после реакции остаточный никель Ренея содержит значительное количество газообразного водорода и может самопроизвольно воспламениться при контакте с воздухом. [26]
Кроме того, острое воздействие никеля Ренея может вызвать раздражение дыхательных путей и полости носа, а также вызвать легочный фиброз при вдыхании. Проглатывание может привести к судорогам и кишечным расстройствам. Это также может вызвать раздражение глаз и кожи. Хроническое воздействие может привести к пневмониту и другим признакам сенсибилизации к никелю, таким как кожная сыпь («никелевый зуд»). [27]
Никель также классифицируется МАИР как возможный канцероген для человека (группа 2B, категория 3 ЕС ) и тератоген , а вдыхание мелких частиц оксида алюминия связано с болезнью Шейвера .
Мюррей Рэйни окончил Университет Кентукки по специальности инженер-механик в 1909 году. В 1915 году он присоединился к компании Lookout Oil and Refining Company в Теннесси и отвечал за установку электролитических ячеек для производства водорода, который использовался при гидрировании растительных масел. . В то время в промышленности использовался никелевый катализатор, приготовленный из оксида никеля (II) . Полагая, что можно производить более качественные катализаторы, примерно в 1921 году он начал проводить независимые исследования, продолжая работать в Lookout Oil. В 1924 году был произведен сплав Ni/ Si с соотношением 1:1 , который после обработки гидроксидом натрия оказался в пять раз более активным, чем лучший катализатор, используемый при гидрировании хлопкового масла. Патент на это открытие был выдан в декабре 1925 года. [28]
Впоследствии Рени произвел сплав Ni/Al 1:1, следуя процедуре, аналогичной той, которая использовалась для никель-кремниевого катализатора. Он обнаружил, что полученный катализатор оказался еще более активным, и подал заявку на патент в 1926 году. [29] Сейчас это обычный состав сплава для современных никелевых катализаторов Ренея. [2] Другие распространенные составы сплавов включают 21:29 Ni/Al и 3:7 Ni/Al. И активность, и протоколы приготовления этих катализаторов различаются. [2] [30]
После разработки никеля Ренея были рассмотрены другие системы сплавов с алюминием, наиболее известные из которых включают медь, рутений и кобальт . [31] Дальнейшие исследования показали, что добавление небольшого количества третьего металла в бинарный сплав будет способствовать активности катализатора. Некоторыми широко используемыми промоторами являются цинк, молибден и хром . Альтернативный способ получения энантиоселективного никеля Ренея был разработан путем поверхностной адсорбции винной кислоты . [32]