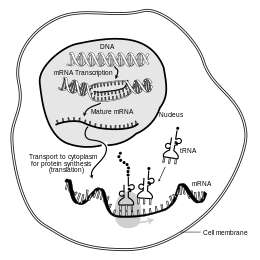
В молекулярной биологии информационная рибонуклеиновая кислота ( мРНК ) представляет собой одноцепочечную молекулу РНК , которая соответствует генетической последовательности гена и считывается рибосомой в процессе синтеза белка .
мРНК создается в процессе транскрипции , где фермент ( РНК-полимераза ) преобразует ген в первичный транскрипт мРНК (также известный как пре-мРНК ). Эта пре-мРНК обычно все еще содержит интроны , области, которые не будут кодировать конечную последовательность аминокислот . Они удаляются в процессе сплайсинга РНК , оставляя только экзоны , области, которые будут кодировать белок. Эта последовательность экзонов составляет зрелую мРНК . Зрелая мРНК затем считывается рибосомой, и рибосома создает белок, используя аминокислоты, переносимые транспортной РНК (тРНК). Этот процесс известен как трансляция . Все эти процессы являются частью центральной догмы молекулярной биологии , которая описывает поток генетической информации в биологической системе.
Как и в ДНК , генетическая информация в мРНК содержится в последовательности нуклеотидов , которые организованы в кодоны, состоящие из трех рибонуклеотидов каждый. Каждый кодон кодирует определенную аминокислоту , за исключением стоп-кодонов , которые завершают синтез белка. Для трансляции кодонов в аминокислоты требуются два других типа РНК: транспортная РНК, которая распознает кодон и предоставляет соответствующую аминокислоту, и рибосомальная РНК (рРНК), центральный компонент белкового производственного аппарата рибосомы.
Концепция мРНК была разработана Сидни Бреннером и Фрэнсисом Криком в 1960 году во время беседы с Франсуа Жакобом . В 1961 году мРНК была идентифицирована и описана независимо одной командой, состоящей из Бреннера, Жакоба и Мэтью Месельсона , и другой командой во главе с Джеймсом Уотсоном . Анализируя данные при подготовке к публикации, Жакоб и Жак Моно придумали название «информационная РНК».
Кратковременное существование молекулы мРНК начинается с транскрипции и в конечном итоге заканчивается деградацией. В течение своей жизни молекула мРНК также может быть обработана, отредактирована и транспортирована до трансляции. Эукариотические молекулы мРНК часто требуют обширной обработки и транспортировки, в то время как прокариотические молекулы мРНК не требуют этого. Молекула эукариотической мРНК и окружающие ее белки вместе называются мессенджером РНП . [ необходима цитата ]
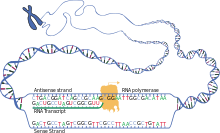
Транскрипция — это когда РНК копируется с ДНК. Во время транскрипции РНК-полимераза копирует ген с ДНК на мРНК по мере необходимости. Этот процесс немного отличается у эукариот и прокариот. Одним из заметных отличий является то, что прокариотическая РНК-полимераза связывается с ферментами, обрабатывающими ДНК, во время транскрипции, так что процессинг может продолжаться во время транскрипции. Таким образом, это приводит к тому, что новая цепь мРНК становится двухцепочечной, образуя комплементарную цепь, известную как цепь тРНК, которая при объединении неспособна образовывать структуры из спаривания оснований. Более того, шаблоном для мРНК является комплементарная цепь тРНК, которая по последовательности идентична последовательности антикодона, с которой связывается ДНК. Короткоживущий, необработанный или частично обработанный продукт называется предшественником мРНК или пре-мРНК ; после полной обработки он называется зрелой мРНК . [ необходима цитата ]
мРНК использует урацил (U) вместо тимина (T) в ДНК. Урацил (U) является комплементарным основанием аденину (A) во время транскрипции вместо тимина (T). Таким образом, при использовании шаблонной цепи ДНК для построения РНК тимин заменяется урацилом. Эта замена позволяет мРНК переносить соответствующую генетическую информацию из ДНК в рибосому для трансляции. Что касается естественной истории, урацил появился первым, а затем тимин; данные свидетельствуют о том, что РНК появилась раньше ДНК в процессе эволюции. [1] Гипотеза мира РНК предполагает, что жизнь началась с молекул РНК, до появления геномов ДНК и кодируемых белков. В ДНК эволюционная замена тимина на урацил могла повысить стабильность ДНК и улучшить эффективность репликации ДНК. [2] [3]

Процессинг мРНК сильно различается у эукариот , бактерий и архей . Неэукариотическая мРНК, по сути, созревает при транскрипции и не требует никакой обработки, за исключением редких случаев. [4] Однако эукариотическая пре-мРНК требует нескольких этапов обработки перед транспортировкой в цитоплазму и трансляцией рибосомой.
Обширная обработка эукариотической пре-мРНК, приводящая к образованию зрелой мРНК, называется сплайсингом РНК , механизмом, при котором интроны или аутроны (некодирующие области) удаляются, а экзоны (кодирующие области) соединяются. [ необходима ссылка ]
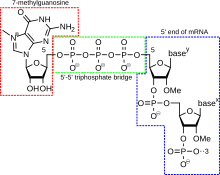
5'-кэп ( также называемый РНК-кэп, РНК- 7-метилгуанозиновый кэп или РНК-м 7 G-кэп) — это модифицированный гуаниновый нуклеотид, который был добавлен к «переднему» или 5'-концу эукариотической информационной РНК вскоре после начала транскрипции. 5'-кэп состоит из терминального остатка 7-метилгуанозина, который связан через 5'-5'-трифосфатную связь с первым транскрибированным нуклеотидом. Его присутствие имеет решающее значение для распознавания рибосомой и защиты от РНКаз . [ необходима цитата ]
Добавление кэпа сопряжено с транскрипцией и происходит ко-транскрипционно, так что каждый влияет на другой. Вскоре после начала транскрипции 5'-конец синтезируемой мРНК связывается с комплексом синтеза кэпа, связанным с РНК-полимеразой . Этот ферментативный комплекс катализирует химические реакции, необходимые для кэпирования мРНК. Синтез протекает как многоступенчатая биохимическая реакция. [ необходима цитата ]
В некоторых случаях мРНК будет отредактирована , изменив нуклеотидный состав этой мРНК. Примером у людей является мРНК аполипопротеина B , которая редактируется в некоторых тканях, но не в других. Редактирование создает ранний стоп-кодон, который при трансляции производит более короткий белок.

Полиаденилирование — это ковалентная связь полиаденилового фрагмента с молекулой информационной РНК. В эукариотических организмах большинство молекул информационной РНК (мРНК) полиаденилированы на 3'-конце, но недавние исследования показали, что короткие отрезки уридина (олигоуридилирование) также распространены. [5] Поли(А)-хвост и связанный с ним белок помогают защищать мРНК от деградации экзонуклеазами. Полиаденилирование также важно для терминации транскрипции, экспорта мРНК из ядра и трансляции. мРНК также может быть полиаденилирована в прокариотических организмах, где поли(А)-хвосты действуют, чтобы облегчить, а не препятствовать экзонуклеолитической деградации. [ необходима цитата ]
Полиаденилирование происходит во время и/или сразу после транскрипции ДНК в РНК. После завершения транскрипции цепь мРНК расщепляется под действием эндонуклеазного комплекса, связанного с РНК-полимеразой. После расщепления мРНК к свободному 3'-концу в месте расщепления добавляется около 250 остатков аденозина. Эту реакцию катализирует полиаденилатполимераза . Как и при альтернативном сплайсинге , может быть более одного варианта полиаденилирования мРНК.
Также происходят мутации сайта полиаденилирования. Первичный РНК-транскрипт гена расщепляется в месте присоединения поли-А, и к 3'-концу РНК добавляется 100–200 А. Если этот сайт изменен, будет сформирована аномально длинная и нестабильная конструкция мРНК.
Еще одно различие между эукариотами и прокариотами — это транспорт мРНК. Поскольку эукариотическая транскрипция и трансляция разделены компартментно, эукариотические мРНК должны экспортироваться из ядра в цитоплазму — процесс, который может регулироваться различными сигнальными путями. [6] Зрелые мРНК распознаются по их обработанным модификациям, а затем экспортируются через ядерную пору путем связывания с белками связывания кэпа CBP20 и CBP80, [7] , а также с комплексом транскрипции/экспорта (TREX). [8] [9] У эукариот были выявлены множественные пути экспорта мРНК. [10]
В пространственно сложных клетках некоторые мРНК транспортируются в определенные субклеточные пункты назначения. В зрелых нейронах определенные мРНК транспортируются из сомы в дендриты . Одним из мест трансляции мРНК являются полирибосомы, избирательно локализованные под синапсами. [11] мРНК для Arc/Arg3.1 индуцируется синаптической активностью и избирательно локализуется вблизи активных синапсов на основе сигналов, генерируемых рецепторами NMDA . [12] Другие мРНК также перемещаются в дендриты в ответ на внешние стимулы, такие как мРНК β-актина . [13] Для экспорта из ядра мРНК актина ассоциируется с ZBP1 [14] и позднее с субъединицей 40S . Комплекс связывается моторным белком и транспортируется в целевое место ( расширение нейрита ) вдоль цитоскелета . В конечном итоге ZBP1 фосфорилируется Src для инициирования трансляции. [15] В развивающихся нейронах мРНК также транспортируются в растущие аксоны и особенно конусы роста. Многие мРНК помечены так называемыми «почтовыми индексами», которые направляют их транспорт в определенное место. [16] [17] мРНК также могут передаваться между клетками млекопитающих через структуры, называемые туннельными нанотрубками . [18] [19]
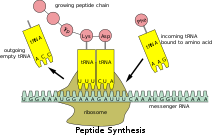
Поскольку прокариотическая мРНК не нуждается в обработке или транспортировке, трансляция рибосомой может начаться сразу после окончания транскрипции. Поэтому можно сказать, что прокариотическая трансляция сопряжена с транскрипцией и происходит ко-транскрипционно . [ необходима цитата ]
Эукариотическая мРНК, которая была обработана и перенесена в цитоплазму (т. е. зрелая мРНК), затем может быть транслирована рибосомой. Трансляция может происходить на рибосомах, свободно плавающих в цитоплазме, или направляться в эндоплазматический ретикулум частицей распознавания сигнала . Поэтому, в отличие от прокариот, эукариотическая трансляция не связана напрямую с транскрипцией. В некоторых контекстах даже возможно, что сниженные уровни мРНК сопровождаются повышенными уровнями белка, как это наблюдалось для уровней мРНК/белка EEF1A1 при раке молочной железы . [20] [ необходим непервичный источник ]

Кодирующие области состоят из кодонов , которые декодируются и транслируются в белки рибосомой; у эукариот обычно в один, а у прокариот обычно в несколько. Кодирующие области начинаются со стартового кодона и заканчиваются стоп-кодоном . В общем, стартовый кодон представляет собой триплет AUG, а стоп-кодон — UAG («янтарь»), UAA («охра») или UGA («опал»). Кодирующие области, как правило, стабилизируются внутренними парами оснований; это препятствует деградации. [21] [22] Помимо того, что они кодируют белки, части кодирующих областей могут служить регуляторными последовательностями в пре-мРНК в качестве экзонных усилителей сплайсинга или экзонных сайленсеров сплайсинга .

Нетранслируемые области (UTR) представляют собой участки мРНК перед стартовым кодоном и после стоп-кодона, которые не транслируются, называемые пяти-первичной нетранслируемой областью (5'UTR) и трех-первичной нетранслируемой областью (3'UTR) соответственно. Эти области транскрибируются с кодирующей областью и, таким образом, являются экзонными , поскольку они присутствуют в зрелой мРНК. Несколько ролей в экспрессии генов были приписаны нетранслируемым областям, включая стабильность мРНК, локализацию мРНК и эффективность трансляции . Способность UTR выполнять эти функции зависит от последовательности UTR и может различаться между мРНК. Генетические варианты в 3'UTR также были вовлечены в восприимчивость к болезням из-за изменения структуры РНК и трансляции белка. [23]
Стабильность мРНК может контролироваться 5'-UTR и/или 3'-UTR из-за различного сродства к ферментам, разрушающим РНК, называемым рибонуклеазами , и к вспомогательным белкам, которые могут способствовать или ингибировать деградацию РНК. (См. также элемент стабильности, богатый C. )
Эффективность трансляции, включая иногда полное ингибирование трансляции, может контролироваться UTR. Белки, которые связываются либо с 3', либо с 5' UTR, могут влиять на трансляцию, влияя на способность рибосомы связываться с мРНК. МикроРНК, связанные с 3' UTR, также могут влиять на эффективность трансляции или стабильность мРНК.
Считается, что цитоплазматическая локализация мРНК является функцией 3'-UTR. Белки, необходимые в определенной области клетки, также могут транслироваться там; в таком случае 3'-UTR может содержать последовательности, которые позволяют локализовать транскрипт в этой области для трансляции.
Некоторые элементы, содержащиеся в нетранслируемых областях, образуют характерную вторичную структуру при транскрипции в РНК. Эти структурные элементы мРНК участвуют в регуляции мРНК. Некоторые, такие как элемент SECIS , являются мишенями для связывания белков. Один класс элементов мРНК, рибопереключатели , напрямую связывают небольшие молекулы, изменяя их складку для изменения уровней транскрипции или трансляции. В этих случаях мРНК регулирует сама себя.
3' поли(А)-хвост представляет собой длинную последовательность адениновых нуклеотидов (часто несколько сотен), добавленных к 3'-концу пре-мРНК. Этот хвост способствует экспорту из ядра и трансляции, а также защищает мРНК от деградации.
Молекула мРНК называется моноцистронной, когда она содержит генетическую информацию для трансляции только одной белковой цепи (полипептида). Это касается большинства эукариотических мРНК. [24] [25] С другой стороны, полицистронная мРНК несет несколько открытых рамок считывания (ОРС), каждая из которых транслируется в полипептид. Эти полипептиды обычно имеют связанную функцию (они часто являются субъединицами, составляющими конечный сложный белок), а их кодирующая последовательность сгруппирована и регулируется вместе в регуляторной области, содержащей промотор и оператор . Большая часть мРНК, обнаруженная у бактерий и архей, является полицистронной, [24] как и митохондриальный геном человека. [26] Дицистронная или бицистронная мРНК кодирует только два белка .

У эукариот молекулы мРНК образуют кольцевые структуры из-за взаимодействия между eIF4E и поли(А)-связывающим белком , которые оба связываются с eIF4G , образуя мост мРНК-белок-мРНК. [27] Считается, что кольцевание способствует цикличности рибосом на мРНК, что приводит к эффективной по времени трансляции, а также может обеспечивать трансляцию только неповрежденной мРНК (частично деградировавшая мРНК обычно не имеет кэпа m7G или поли-А-хвоста). [28]
Существуют и другие механизмы кольцевания, особенно в вирусной мРНК. Полиовирусная мРНК использует клеверный листок в направлении своего 5'-конца для связывания PCBP2, который связывает поли(А)-связывающий белок , образуя знакомый круг мРНК-белок-мРНК. Вирус желтой карликовости ячменя связывается между сегментами мРНК на своем 5'-конце и 3'-конце (так называемые петли целующегося стебля), кольцевая мРНК без участия каких-либо белков.
Геномы РНК-вирусов (+ цепи которых транслируются как мРНК) также обычно закольцованы. [29] Во время репликации генома закольцовывание увеличивает скорость репликации генома, циклизируя вирусную РНК-зависимую РНК-полимеразу во многом так же, как предположительно циклизируется рибосома.
Различные мРНК в пределах одной клетки имеют разное время жизни (стабильность). В бактериальных клетках отдельные мРНК могут выживать от нескольких секунд до более часа. Однако среднее время жизни составляет от 1 до 3 минут, что делает бактериальную мРНК гораздо менее стабильной, чем эукариотическая мРНК. [30] В клетках млекопитающих время жизни мРНК варьируется от нескольких минут до дней. [31] Чем выше стабильность мРНК, тем больше белка может быть произведено из этой мРНК. Ограниченное время жизни мРНК позволяет клетке быстро изменять синтез белка в ответ на ее меняющиеся потребности. Существует множество механизмов, которые приводят к разрушению мРНК, некоторые из которых описаны ниже.

В целом, у прокариот продолжительность жизни мРНК намного короче, чем у эукариот. Прокариоты разрушают сообщения, используя комбинацию рибонуклеаз, включая эндонуклеазы , 3'- экзонуклеазы и 5'-экзонуклеазы. В некоторых случаях малые молекулы РНК (мРНК) длиной от десятков до сотен нуклеотидов могут стимулировать деградацию определенных мРНК путем спаривания оснований с комплементарными последовательностями и облегчения расщепления рибонуклеазой РНКазой III . Недавно было показано, что у бактерий также есть своего рода 5'-кэп, состоящий из трифосфата на 5'-конце . [32] Удаление двух фосфатов оставляет 5'-монофосфат, в результате чего сообщение разрушается экзонуклеазой РНКазой J, которая разрушает 5' до 3'.
Внутри эукариотических клеток существует баланс между процессами трансляции и распада мРНК. Сообщения, которые активно транслируются, связываются рибосомами , эукариотическими факторами инициации eIF-4E и eIF-4G , и поли(А)-связывающим белком . eIF-4E и eIF-4G блокируют фермент декеппинг ( DCP2 ), а поли(А)-связывающий белок блокирует экзосомный комплекс , защищая концы сообщения. Баланс между трансляцией и распадом отражается в размере и обилии цитоплазматических структур, известных как P-тела . [33] Поли (А)-хвост мРНК укорачивается специализированными экзонуклеазами, которые нацелены на определенные матричные РНК с помощью комбинации цис-регуляторных последовательностей на РНК и транс-действующих РНК-связывающих белков. Считается, что удаление поли(А)-хвоста нарушает кольцевую структуру сообщения и дестабилизирует комплекс связывания кэпа . Затем сообщение подвергается деградации либо экзосомным комплексом , либо декапирующим комплексом . Таким образом, трансляционно неактивные сообщения могут быть быстро уничтожены, в то время как активные сообщения остаются нетронутыми. Механизм, посредством которого трансляция останавливается и сообщение передается комплексам распада, детально не изучен. Считалось, что большая часть распада мРНК происходит в цитоплазме; однако недавно был описан новый путь распада мРНК, который начинается в ядре. [34]
Присутствие элементов, богатых AU, в некоторых мРНК млекопитающих имеет тенденцию дестабилизировать эти транскрипты посредством действия клеточных белков, которые связывают эти последовательности и стимулируют удаление поли(А) -хвоста. Считается, что потеря поли(А)-хвоста способствует деградации мРНК, облегчая атаку как экзосомного комплекса [35] , так и комплекса декеппинг . [36] Быстрая деградация мРНК посредством элементов, богатых AU, является критическим механизмом для предотвращения перепроизводства мощных цитокинов, таких как фактор некроза опухоли (TNF) и фактор стимуляции колоний гранулоцитов-макрофагов (GM-CSF). [37] Элементы, богатые AU, также регулируют биосинтез протоонкогенных факторов транскрипции, таких как c-Jun и c-Fos . [38]
Эукариотические сообщения подлежат наблюдению с помощью бессмысленно-опосредованного распада (NMD), который проверяет наличие преждевременных стоп-кодонов (бессмысленных кодонов) в сообщении. Они могут возникнуть из-за неполного сплайсинга, рекомбинации V(D)J в адаптивной иммунной системе , мутаций в ДНК, ошибок транскрипции, утечки сканирования рибосомой, вызывающей сдвиг рамки , и других причин. Обнаружение преждевременного стоп-кодона запускает деградацию мРНК путем 5'-декапирования, удаления 3' поли(А) -хвоста или эндонуклеолитического расщепления . [39]
У метазоа малые интерферирующие РНК (siRNA), обработанные Dicer, включаются в комплекс, известный как комплекс подавления РНК-индуцированной или RISC. Этот комплекс содержит эндонуклеазу , которая расщепляет идеально комплементарные сообщения, с которыми связывается siRNA. Полученные фрагменты мРНК затем разрушаются экзонуклеазами . siRNA обычно используется в лабораториях для блокирования функции генов в клеточной культуре. Считается, что она является частью врожденной иммунной системы как защита от вирусов с двухцепочечной РНК. [40]
МикроРНК (миРНК) — это малые РНК, которые обычно частично комплементарны последовательностям в матричных РНК метазоа. [41] [42] Связывание микроРНК с сообщением может подавлять трансляцию этого сообщения и ускорять удаление поли(А)-хвоста, тем самым ускоряя деградацию мРНК. Механизм действия микроРНК является предметом активных исследований. [43] [44]
Существуют и другие способы, с помощью которых сообщения могут быть деградированы, включая , среди прочего, непрерывное затухание и подавление с помощью Piwi-взаимодействующей РНК (piRNA).
Введение модифицированной нуклеозидами последовательности информационной РНК может заставить клетку вырабатывать белок, который, в свою очередь, может напрямую лечить болезнь или может функционировать как вакцина ; более косвенно белок может заставить эндогенную стволовую клетку дифференцироваться желаемым образом. [45] [46]
Основные проблемы РНК-терапии сосредоточены на доставке РНК в соответствующие клетки. [47] Проблемы включают тот факт, что голые последовательности РНК естественным образом деградируют после подготовки; они могут спровоцировать иммунную систему организма атаковать их как захватчиков; и они непроницаемы для клеточной мембраны . [46] Оказавшись внутри клетки, они должны покинуть транспортный механизм клетки, чтобы начать действовать в цитоплазме , где находятся необходимые рибосомы . [45]
Преодолевая эти проблемы, мРНК как терапевтическое средство была впервые предложена в 1989 году «после разработки широко применимой техники трансфекции in vitro». [48] В 1990-х годах были разработаны вакцины мРНК для персонализированного рака, основанные на ненуклеозидной модифицированной мРНК. Терапии на основе мРНК продолжают исследоваться как метод лечения или терапии как рака, так и аутоиммунных, метаболических и респираторных воспалительных заболеваний. Терапии редактирования генов, такие как CRISPR, также могут выиграть от использования мРНК для побуждения клеток к производству желаемого белка Cas . [49]
С 2010-х годов РНК-вакцины и другие РНК-терапевтические средства считаются «новым классом лекарств». [50] Первые вакцины на основе мРНК получили ограниченное разрешение и были развернуты по всему миру во время пандемии COVID-19 , например, вакциной Pfizer–BioNTech COVID-19 и Moderna . [51] Нобелевская премия по физиологии и медицине 2023 года была присуждена Каталин Карико и Дрю Вайсману за разработку эффективных мРНК-вакцин против COVID-19. [52] [53] [54]
Несколько исследований молекулярной биологии в 1950-х годах показали, что РНК играет какую-то роль в синтезе белка, но эта роль не была четко понята. Например, в одном из самых ранних отчетов Жак Моно и его команда показали, что синтез РНК необходим для синтеза белка, в частности, во время производства фермента β-галактозидазы в бактерии E. coli . [55] Артур Парди также обнаружил подобное накопление РНК в 1954 году . [56] В 1953 году Альфред Херши , Джун Диксон и Марта Чейз описали определенную ДНК, содержащую цитозин (указывая, что это была РНК), которая быстро исчезла после ее синтеза в E. coli . [57] Оглядываясь назад, это могло быть одним из первых наблюдений существования мРНК, но в то время она не была признана как таковая. [58]
Идея мРНК была впервые задумана Сидни Бреннером и Фрэнсисом Криком 15 апреля 1960 года в Королевском колледже в Кембридже , когда Франсуа Жакоб рассказывал им о недавнем эксперименте, проведенном Артуром Парди , им самим и Моно (так называемый эксперимент PaJaMo, который не доказал существование мРНК, но предположил возможность ее существования). При поддержке Крика Бреннер и Жакоб немедленно приступили к проверке этой новой гипотезы и обратились за помощью к Мэтью Месельсону из Калифорнийского технологического института . Летом 1960 года Бреннер, Якоб и Месельсон провели эксперимент в лаборатории Месельсона в Калифорнийском технологическом институте, который стал первым, доказавшим существование мРНК. Осенью того же года Жакоб и Моно придумали название «информационная РНК» и разработали первую теоретическую основу для объяснения ее функции. [58]
В феврале 1961 года Джеймс Уотсон сообщил, что его исследовательская группа из Гарварда последовала за ними с серией экспериментов, результаты которых указывали примерно в том же направлении. Бреннер и другие согласились на просьбу Уотсона отложить публикацию результатов их исследований. В результате статьи Бреннера и Уотсона были опубликованы одновременно в одном и том же выпуске Nature в мае 1961 года, а в том же месяце Жакоб и Моно опубликовали свою теоретическую основу для мРНК в Journal of Molecular Biology . [58]