В биохимии синтез жирных кислот — это создание жирных кислот из ацетил-КоА и НАДФН под действием ферментов , называемых синтазами жирных кислот . Этот процесс происходит в цитоплазме клетки . Большая часть ацетил-КоА, который превращается в жирные кислоты, получается из углеводов гликолитическим путем . Гликолитический путь также обеспечивает глицерин , с которым три жирные кислоты могут соединяться (посредством сложноэфирных связей ) с образованием триглицеридов (также известных как «триацилглицерины» – в отличие от жирных «кислот» – или просто «жиров»). Конечный продукт липогенного процесса . Когда только две жирные кислоты соединяются с глицерином , а третья спиртовая группа фосфорилируется такой группой, как фосфатидилхолин , образуется фосфолипид . Фосфолипиды образуют основную часть липидных бислоев , которые составляют клеточные мембраны и окружают органеллы внутри клеток (такие как клеточное ядро , митохондрии , эндоплазматическая сеть , аппарат Гольджи и т. д.). Помимо цитозольного синтеза жирных кислот, существует еще митохондриальный синтез жирных кислот (mtFASII), при котором из малоновой кислоты с помощью малонил-КоА-синтетазы ( ACSF3 ) образуется малонил-КоА , который затем становится конечным продуктом октаноил-АСР. (C8) посредством дальнейших промежуточных этапов. [1]
Жирные кислоты с прямой цепью встречаются двух типов: насыщенные и ненасыщенные.

Подобно β-окислению , синтез жирных кислот с прямой цепью происходит посредством шести повторяющихся реакций, показанных ниже, до тех пор, пока не будет получена 16-углеродная пальмитиновая кислота . [2] [3]
На представленных схемах показано, как синтезируются жирные кислоты у микроорганизмов, и перечислены ферменты, обнаруженные в кишечной палочке . [2] Эти реакции выполняются синтетазой жирных кислот II (FASII), которая обычно содержит несколько ферментов, действующих как один комплекс. FASII присутствует в прокариотах , растениях, грибах и паразитах, а также в митохондриях . [4]
У животных, а также у некоторых грибов, таких как дрожжи, те же реакции происходят с синтазой жирных кислот I (FASI), большим димерным белком, который обладает всей ферментативной активностью, необходимой для создания жирной кислоты. FASII менее эффективен, чем FASI; однако это позволяет образовывать больше молекул, включая жирные кислоты со «средней цепью», за счет раннего обрыва цепи. [4]
После образования жирной кислоты с соотношением углерода 16:0 она может претерпевать ряд модификаций, приводящих к десатурации и/или удлинению. Элонгация, начиная со стеарата (18:0), осуществляется преимущественно в ЭР с помощью нескольких мембраносвязанных ферментов. Ферментативные этапы, участвующие в процессе элонгации, в основном такие же, как и те, которые осуществляются с помощью FAS, но четыре основных последовательных этапа элонгации выполняются отдельными белками, которые могут быть физически связаны. [5] [6]
Обратите внимание, что во время синтеза жиров восстановителем является НАДФН , тогда как НАД является окислителем при бета-окислении (расщеплении жирных кислот до ацетил-КоА). Это различие иллюстрирует общий принцип, согласно которому НАДФН расходуется во время реакций биосинтеза, тогда как НАДН генерируется в реакциях с выделением энергии. [7] (Таким образом, НАДФН также необходим для синтеза холестерина из ацетил-КоА; тогда как НАДН образуется во время гликолиза .) Источник НАДФН двоякий. Когда малат окислительно декарбоксилируется «НАДФ + -связанным яблочным ферментом» с образованием пирувата , образуются CO 2 и НАДФН. НАДФН также образуется по пентозофосфатному пути , который превращает глюкозу в рибозу, которая может использоваться в синтезе нуклеотидов и нуклеиновых кислот , или может катаболизироваться до пирувата. [7]
У человека жирные кислоты образуются из углеводов преимущественно в печени и жировой ткани , а также в молочных железах в период лактации.
Пируват, образующийся в результате гликолиза, является важным посредником в превращении углеводов в жирные кислоты и холестерин. [7] Это происходит посредством превращения пирувата в ацетил-КоА в митохондриях. Однако этот ацетил-КоА необходимо транспортировать в цитозоль, где происходит синтез жирных кислот и холестерина. Это не может произойти напрямую. Чтобы получить цитозольный ацетил-КоА, цитрат (полученный конденсацией ацетил-КоА с оксалоацетатом) удаляется из цикла лимонной кислоты и переносится через внутреннюю митохондриальную мембрану в цитозоль. [7] Там он расщепляется АТФ-цитратлиазой на ацетил-КоА и оксалоацетат. Оксалоацетат может использоваться для глюконеогенеза (в печени) или может возвращаться в митохондрии в виде малата. [8] Цитозольный ацетил-КоА карбоксилируется ацетил-КоА-карбоксилазой в малонил-КоА , что является первой стадией синтеза жирных кислот. [8] [9]
Основным топливом, запасаемым в организме животных, является жир. Запасы жира у молодого взрослого человека в среднем составляют примерно 15–20 кг (33–44 фунта), но сильно варьируются в зависимости от возраста, пола и индивидуального предрасположения. [10] Напротив, человеческое тело хранит только около 400 г (0,9 фунта) гликогена , из которых 300 г (0,7 фунта) заперты внутри скелетных мышц и недоступны для организма в целом. Примерно 100 г (0,2 фунта) гликогена, хранящегося в печени, истощаются в течение одного дня голодания. [11] После этого глюкоза, которая выбрасывается в кровь печенью для общего использования тканями организма, должна синтезироваться из глюкогенных аминокислот и нескольких других глюконеогенных субстратов , которые не включают жирные кислоты. [12]
Жирные кислоты расщепляются до ацетил-КоА посредством бета-окисления внутри митохондрий, тогда как жирные кислоты синтезируются из ацетил-КоА вне митохондрий, в цитозоле. Эти два пути различаются не только по месту их возникновения, но и по протекающим реакциям и используемым субстратам. Эти два пути взаимно ингибируют, предотвращая попадание ацетил-КоА, полученного в результате бета-окисления, в синтетический путь через реакцию ацетил-КоА-карбоксилазы . [12] Его также невозможно превратить в пируват , поскольку реакция декарбоксилирования пирувата необратима. [11] Вместо этого он конденсируется с оксалоацетатом , вступая в цикл лимонной кислоты . Во время каждого витка цикла два атома углерода покидают цикл в виде CO 2 в реакциях декарбоксилирования, катализируемых изоцитратдегидрогеназой и альфа-кетоглутаратдегидрогеназой . Таким образом, каждый виток цикла лимонной кислоты окисляет единицу ацетил-КоА, одновременно регенерируя молекулу оксалоацетата, с которой ацетил-КоА первоначально соединился с образованием лимонной кислоты . Реакции декарбоксилирования происходят до образования малата в цикле. Малат — единственное вещество, которое можно удалить из митохондрий и ввести в глюконеогенный путь с образованием глюкозы или гликогена в печени или любой другой ткани. [12] Таким образом, не может быть чистого преобразования жирных кислот в глюкозу.
Только растения обладают ферментами, превращающими ацетил-КоА в оксалоацетат, из которого может образовываться малат, который в конечном итоге превращается в глюкозу. [12]
Ацетил-КоА превращается в малонил-КоА под действием ацетил-КоА-карбоксилазы , после чего малонил-КоА предназначен для участия в пути синтеза жирных кислот. Ацетил-КоА-карбоксилаза является точкой регуляции синтеза насыщенных жирных кислот с прямой цепью и подлежит как фосфорилированию , так и аллостерическому регулированию . Регуляция посредством фосфорилирования происходит в основном у млекопитающих, тогда как аллостерическая регуляция происходит у большинства организмов. Аллостерический контроль осуществляется посредством ингибирования по принципу обратной связи пальмитоил-КоА и активации цитратом. При высоком уровне пальмитоил-КоА, конечного продукта синтеза насыщенных жирных кислот, он аллостерически инактивирует ацетил-КоА-карбоксилазу, предотвращая накопление жирных кислот в клетках. Цитрат активирует ацетил-КоА-карбоксилазу при высоких уровнях, поскольку высокие уровни указывают на то, что ацетил-КоА достаточно для участия в цикле Кребса и сохранения энергии. [13]
Высокие уровни инсулина в плазме крови (например, после еды) вызывают дефосфорилирование ацетил-КоА-карбоксилазы, способствуя тем самым образованию малонил-КоА из ацетил-КоА и, как следствие, превращению углеводов в жирные кислоты, тогда как адреналин и глюкагон (высвобождаемые в кровь во время голодания и физических упражнений) вызывают фосфорилирование этого фермента, ингибируя липогенез в пользу окисления жирных кислот посредством бета-окисления . [7] [9]
Многие бактерии используют анаэробный путь синтеза ненасыщенных жирных кислот. Этот путь не использует кислород и зависит от ферментов, которые встраивают двойную связь перед элонгацией с использованием обычного механизма синтеза жирных кислот. У Escherichia coli этот путь хорошо изучен.

Большинство бактерий, подвергающихся анаэробной десатурации, содержат гомологи FabA и FabB. [16] Клостридии являются основным исключением; у них есть новый фермент, который еще предстоит идентифицировать, который катализирует образование двойной цис-связи. [15]
Этот путь подвергается транскрипционной регуляции с помощью FadR и FabR. FadR является наиболее изученным белком, которому приписаны бифункциональные характеристики. Он действует как активатор транскрипции fabA и fabB и как репрессор регулона β-окисления . Напротив, FabR действует как репрессор транскрипции fabA и fabB. [14]
Аэробная десатурация — наиболее распространенный путь синтеза ненасыщенных жирных кислот. Он используется у всех эукариот и некоторых прокариот. Этот путь использует десатуразы для синтеза ненасыщенных жирных кислот из полноразмерных субстратов насыщенных жирных кислот. [17] Все десатуразы требуют кислорода и в конечном итоге потребляют НАДН, хотя десатурация является окислительным процессом. Десатуразы специфичны в отношении двойной связи, которую они индуцируют в субстрате. У Bacillus subtilis десатураза Δ5 - Des специфична для индукции двойной цис-связи в положении Δ5 . [8] [17] Saccharomyces cerevisiae содержит одну десатуразу, Ole1p, которая индуцирует двойную цис-связь при Δ9 . [8]
У млекопитающих аэробная десатурация катализируется комплексом трех мембраносвязанных ферментов ( НАДН-цитохром b 5 редуктаза, цитохром b 5 и десатураза ). Эти ферменты выделяют молекулярный кислород, O
2, взаимодействовать с цепью насыщенного жирного ацил-КоА, образуя двойную связь и две молекулы воды, H
2О. _ Два электрона принадлежат НАДН + Н.+
и два из одинарной связи в цепи жирной кислоты. [7] Однако эти ферменты млекопитающих не способны создавать двойные связи у атомов углерода за пределами C-9 в цепи жирных кислот. [nb 1] .) Следовательно, млекопитающие не могут синтезировать линолеат или линоленат (которые имеют двойные связи в положениях C-12 (= Δ 12 ) или C-12 и C-15 (= Δ 12 и Δ 15 ) соответственно, а также в положении 9 ), ни полиненасыщенная 20-углеродная арахидоновая кислота , полученная из линолеата. Все они называются незаменимыми жирными кислотами , что означает, что они необходимы организму, но могут быть получены только с пищей. (Арахидоновая кислота является предшественником простагландинов , которые выполняют широкий спектр функций местных гормонов .) [7]
Жирные кислоты с нечетной цепью (OCFA) — это жирные кислоты, которые содержат нечетное количество атомов углерода. Наиболее распространенными OCFA являются насыщенные производные C15 и C17, соответственно пентадекановая кислота и гептадекановая кислота . [18] Синтез четноцепных жирных кислот осуществляется путем сборки предшественников ацетил-КоА , однако пропионил-КоА вместо ацетил-КоА используется в качестве праймера для биосинтеза длинноцепочечных жирных кислот с нечетным числом атомы углерода. [19]
У B. subtilis этот путь регулируется двухкомпонентной системой : DesK и DesR. DesK представляет собой мембраносвязанную киназу, а DesR представляет собой регулятор транскрипции гена des . [8] [17] Регулирование зависит от температуры; когда температура падает, этот ген активируется. Ненасыщенные жирные кислоты повышают текучесть мембраны и стабилизируют ее при более низких температурах. DesK – сенсорный белок, который при понижении температуры будет аутофосфорилироваться. DesK-P перенесет свою фосфорильную группу на DesR. Два белка DesR-P будут димеризоваться и связываться с промоторами ДНК гена des и рекрутировать РНК-полимеразу для начала транскрипции. [8] [17]
синегнойная палочка
Как правило, в одной и той же системе не происходит как анаэробный, так и аэробный синтез ненасыщенных жирных кислот, однако исключениями являются Pseudomonas aeruginosa и Vibrio ABE-1. [20] [21] [22] Хотя P. aeruginosa подвергается преимущественно анаэробной десатурации, она также подвергается двум аэробным путям. Один путь использует Δ9 - десатуразу (DesA), которая катализирует образование двойной связи в мембранных липидах. Другой путь использует два белка, DesC и DesB, которые вместе действуют как Δ9 - десатураза, которая вставляет двойную связь в молекулу насыщенной жирной кислоты-КоА. Этот второй путь регулируется белком-репрессором DesT. DesT также является репрессором экспрессии fabAB при анаэробной десатурации в присутствии экзогенных ненасыщенных жирных кислот. Эта функция предназначена для координации экспрессии двух путей внутри организма. [21] [23]
Жирные кислоты с разветвленной цепью обычно являются насыщенными и встречаются в двух различных семействах: изо-серии и антеизо-серии. Было обнаружено, что Actinomycetales содержат уникальные механизмы синтеза жирных кислот с разветвленной цепью, в том числе образующие туберкулостериновую кислоту.
Система синтеза жирных кислот с разветвленной цепью использует α-кетокислоты в качестве праймеров. Эта система отличается от синтетазы жирных кислот с разветвленной цепью, которая использует сложные эфиры ацил-КоА с короткой цепью в качестве праймеров. [24] Праймеры α-кетокислот получаются в результате переаминирования и декарбоксилирования валина , лейцина и изолейцина с образованием 2-метилпропанил-КоА, 3-метилбутирил- КоА и 2-метилбутирил-КоА соответственно. [25] Праймеры 2-метилпропанил-КоА, полученные из валина, удлиняются для получения четных жирных кислот изо-ряда, таких как 14-метилпентадекановая (изопальмитиновая) кислота, а праймеры 3-метилбутирил-КоА из лейцина могут использоваться для образования жирные кислоты изо-ряда с нечетными номерами, такие как 13-метилтетрадекановая кислота. Праймеры 2-метилбутирил-КоА из изолейцина удлиняются с образованием жирных кислот антеизо-ряда, содержащих нечетное число атомов углерода, таких как 12-метилтетрадекановая кислота. [26] Декарбоксилирование предшественников праймера происходит посредством фермента декарбоксилазы α-кетокислот с разветвленной цепью (BCKA). Удлинение жирной кислоты происходит по тому же пути биосинтеза в Escherichia coli, который используется для производства жирных кислот с прямой цепью, где малонил-КоА используется в качестве удлинителя цепи. [27] Основными конечными продуктами являются 12–17-углеродные жирные кислоты с разветвленной цепью, и их состав имеет тенденцию быть однородным и характерным для многих видов бактерий. [26]
Декарбоксилаза BCKA и относительная активность субстратов α-кетокислот
Фермент декарбоксилаза BCKA состоит из двух субъединиц тетрамерной структуры (A 2 B 2 ) и необходим для синтеза жирных кислот с разветвленной цепью. Он отвечает за декарбоксилирование α-кетокислот, образующихся в результате переаминирования валина, лейцина и изолейцина, и образует праймеры, используемые для синтеза жирных кислот с разветвленной цепью. Активность этого фермента намного выше с субстратами α-кетокислот с разветвленной цепью, чем с субстратами с прямой цепью, а у видов Bacillus его специфичность наиболее высока для α-кето-β-метилвалериановой кислоты, полученной из изолейцина, за которой следует α- кетоизокапроат и α-кетоизовалерат. [26] [27] Высокое сродство фермента к α-кетокислотам с разветвленной цепью позволяет ему функционировать в качестве системы донора праймера для синтетазы жирных кислот с разветвленной цепью. [27]
Факторы, влияющие на длину цепочки и распределение рисунка
Праймеры α-кетокислот используются для производства жирных кислот с разветвленной цепью, длина которых обычно составляет от 12 до 17 атомов углерода. Пропорции этих жирных кислот с разветвленной цепью, как правило, одинаковы и постоянны среди конкретных видов бактерий, но могут быть изменены из-за изменений концентрации малонил-КоА, температуры или присутствия термостабильных факторов (HSF). [26] Все эти факторы могут влиять на длину цепи, и было продемонстрировано, что HSF изменяют специфичность декарбоксилазы BCKA в отношении определенного субстрата α-кетокислоты, тем самым изменяя соотношение производимых жирных кислот с разветвленной цепью. [26] Было показано, что увеличение концентрации малонил-КоА приводит к увеличению количества вырабатываемых жирных кислот C17 до тех пор, пока не будет достигнута оптимальная концентрация (≈20 мкм) малонил-КоА. Снижение температуры также имеет тенденцию слегка смещать распределение жирных кислот в сторону жирных кислот C17 у видов Bacillus . [24] [26]
Эта система функционирует аналогично системе синтеза жирных кислот с разветвленной цепью, однако в ней в качестве праймеров используются карбоновые кислоты с короткой цепью вместо альфа-кетокислот. Как правило, этот метод используется бактериями, которые не обладают способностью создавать систему жирных кислот с разветвленной цепью с использованием альфа-кето-праймеров. Типичные праймеры с короткой цепью включают изовалерат, изобутират и 2-метилбутират. Обычно кислоты, необходимые для этих праймеров, берутся из окружающей среды; это часто наблюдается у бактерий рубца. [28]
Общая реакция такая:
Разница между синтазой жирных кислот (с прямой цепью) и синтазой жирных кислот с разветвленной цепью заключается в субстратной специфичности фермента, который катализирует реакцию ацил-КоА в ацил-АСР. [24]
Омега-алициклические жирные кислоты обычно содержат омега-концевую пропильную или бутирильную циклическую группу и являются одними из основных мембранных жирных кислот, обнаруженных у нескольких видов бактерий. Синтетаза жирных кислот, используемая для производства омега-алициклических жирных кислот, также используется для производства мембранных жирных кислот с разветвленной цепью. У бактерий с мембранами, состоящими в основном из омега-алициклических жирных кислот, запас эфиров циклической карбоновой кислоты-КоА намного выше, чем у праймеров с разветвленной цепью. [24] Синтез циклических праймеров недостаточно изучен, но было высказано предположение, что механизм включает превращение сахаров в шикимовую кислоту , которая затем превращается в сложные эфиры циклогексилкарбоновой кислоты и КоА, которые служат праймерами для синтеза омега-алициклических жирных кислот [28]. ]
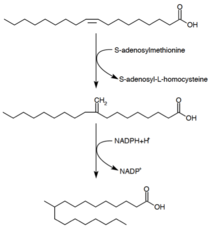
Туберкулостеариновая кислота (D-10-метилстеариновая кислота) представляет собой насыщенную жирную кислоту, которая, как известно, продуцируется Mycobacterium spp. и два вида Streptomyces . Он образуется из предшественника олеиновой кислоты (мононенасыщенной жирной кислоты). [29] После того, как олеиновая кислота этерифицируется до фосфолипида, S-аденозилметионин отдает метильную группу двойной связи олеиновой кислоты. [30] Эта реакция метилирования образует промежуточный продукт 10-метилен-октадеканоил. Последовательное восстановление остатка с НАДФН в качестве кофактора приводит к образованию 10-метилстеариновой кислоты [25]
Помимо синтеза жирных кислот в цитозоле, митохондрии также осуществляют собственный синтез жирных кислот (mtFASII). Синтез митохондриальных жирных кислот необходим для клеточного дыхания и митохондриального биогенеза . [31] Также предполагается роль медиатора во внутриклеточной передаче сигнала , поскольку уровни биоактивных липидов, таких как лизофосфолипиды и сфинголипиды , коррелируют с mtFASII. [32]
На первом этапе mtFASII малонил-КоА образуется из малоновой кислоты с помощью ACSF3 . [33] Это происходит в тандеме с митохондриальной изоформой АСС1 (mtACC1), которая все еще может производить малонил-КоА из ацетил-КоА. [34] Жирные кислоты, такие как октаноил-ACP (C8), который образует исходный субстрат биосинтеза липоевой кислоты , образуются посредством дальнейших промежуточных стадий и удлинения цепи. [32] Через липоевую кислоту в качестве кофактора и соответственно степень липоилирования mtFASII оказывает влияние на митохондриальные ферментные комплексы энергетического метаболизма, такие как комплекс пируватдегидрогеназы , комплекс α-кетоглутаратдегидрогеназы , комплекс BCKDH и систему расщепления глицина ( ГКС) и другие. [1]
Нарушения mtFASII приводят к следующим метаболическим заболеваниям:

Таким образом, положения двойных связей в цепи жирной кислоты можно указать двумя способами: с использованием обозначений Cn или ω-n. Таким образом, в 18-углеродной жирной кислоте двойная связь между C-12 (или ω-7) и C-13 (или ω-6) обозначается либо как Δ 12 , если считать от конца –COOH (указывая только « начало» двойной связи), или как ω-6 (или омега-6), если считать от -CH.
3конец. «Δ» — это греческая буква «дельта», которая в латинском алфавите переводится как «D» ( двойная связь). Омега (ω) — последняя буква греческого алфавита, поэтому она используется для обозначения «последнего» атома углерода в цепи жирных кислот. Поскольку обозначение ω-n используется почти исключительно для обозначения положений двойных связей, близких к -CH
3заканчиваются незаменимыми жирными кислотами , нет необходимости в эквивалентном обозначении типа «Δ» - использование обозначения «ω-n» всегда относится к положению двойной связи.
этот процесс графически представлен на стр. 73.