Пластида — это связанная с мембраной органелла, обнаруженная в клетках растений , водорослей и некоторых других эукариотических организмов. Пластиды считаются внутриклеточными эндосимбиотическими цианобактериями . [1]
Примерами пластид являются хлоропласты (используются для фотосинтеза ); хромопласты (используются для синтеза и хранения пигментов); лейкопласты (непигментированные пластиды, некоторые из которых могут дифференцироваться ); и апикопласты (нефотосинтетические пластиды апикомплексов , полученные в результате вторичного эндосимбиоза).
Постоянное первичное событие эндосимбиоза произошло около 1,5 миллиарда лет назад в кладе Archaeplastida — наземные растения , красные водоросли , зеленые водоросли и глаукофиты — вероятно, с цианобионтом , симбиотической цианобактерией, связанной с родом Gloeomargarita . [2] [3] Другое первичное событие эндосимбиоза произошло позже, между 140 и 90 миллионами лет назад, в фотосинтетических пластидах Paulinella amoeboids из родов цианобактерий Prochlorococcus и Synechococcus , или «кладе PS». [4] [5] Вторичные и третичные события эндосимбиоза также происходили у самых разных организмов; и некоторые организмы развили способность изолировать поглощенные пластиды — процесс, известный как клептопластия .
AFW Schimper [6] [a] был первым, кто назвал, описал и дал четкое определение пластидам, которые обладают двухцепочечной молекулой ДНК, которая долгое время считалась круглой по форме, подобной круглой хромосоме прокариотических клеток — но теперь, возможно, нет; (см. "..линейная форма" ). Пластиды являются местами для производства и хранения пигментов и других важных химических соединений, используемых клетками автотрофных эукариот . Некоторые содержат биологические пигменты, такие как используемые в фотосинтезе или определяющие цвет клетки. Пластиды в организмах, которые потеряли свои фотосинтетические свойства, очень полезны для производства молекул, таких как изопреноиды . [ 8]
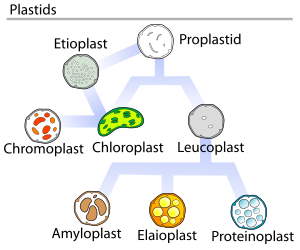

В наземных растениях пластиды, содержащие хлорофилл, могут осуществлять фотосинтез , тем самым создавая внутреннюю химическую энергию из внешней энергии солнечного света , одновременно захватывая углерод из атмосферы Земли и снабжая атмосферу живительным кислородом. Это хлорофилл-пластиды — и они называются хлоропластами ; (см. верхний рисунок).
Другие пластиды могут синтезировать жирные кислоты и терпены , которые могут использоваться для производства энергии или в качестве сырья для синтеза других молекул. Например, пластидные эпидермальные клетки производят компоненты тканевой системы, известной как растительная кутикула , включая ее эпикутикулярный воск , из пальмитиновой кислоты , которая сама синтезируется в хлоропластах ткани мезофилла . Пластиды выполняют функцию хранения различных компонентов, включая крахмалы , жиры и белки . [9]
Все пластиды происходят от пропластид, которые присутствуют в меристематических областях растения. Пропластиды и молодые хлоропласты обычно делятся бинарным делением , но более зрелые хлоропласты также обладают этой способностью.
Растительные пропластиды (недифференцированные пластиды) могут дифференцироваться в несколько форм, в зависимости от того, какую функцию они выполняют в клетке (см. верхний рисунок). Они могут развиться в любой из следующих вариантов: [10]
Лейкопласты дифференцируются в еще более специализированные пластиды, такие как:
В зависимости от своей морфологии и целевой функции пластиды обладают способностью дифференцироваться или редифференцироваться между этими и другими формами.
Каждая пластида создает несколько копий своего собственного уникального генома, или пластома (от «пластидного генома»), что для хлорофилловой пластиды (или хлоропласта) эквивалентно «хлоропластному геному» или «хлоропластной ДНК». [11] [12] Количество копий генома, производимых на пластиду, варьируется от 1000 и более в быстро делящихся новых клетках , охватывающих только несколько пластид, до 100 и менее в зрелых клетках, охватывающих многочисленные пластиды.
Пластом обычно содержит геном , который кодирует транспортные рибонуклеиновые кислоты ( тРНК ) и рибосомальные рибонуклеиновые кислоты ( рРНК ). Он также содержит белки, участвующие в фотосинтезе и транскрипции и трансляции пластидных генов . Но эти белки представляют собой лишь малую часть от общего набора белков, необходимого для построения и поддержания любого конкретного типа пластиды. Ядерные гены (в ядре клетки растения) кодируют подавляющее большинство пластидных белков; и экспрессия ядерных и пластидных генов совместно регулируется для координации развития и дифференциации пластид.
Многие пластиды, особенно те, которые отвечают за фотосинтез, обладают многочисленными внутренними мембранными слоями. Пластидная ДНК существует в виде комплексов белок-ДНК, связанных в виде локализованных областей внутри внутренней мембраны оболочки пластиды ; и эти комплексы называются «пластидными нуклеоидами ». В отличие от ядра эукариотической клетки, пластидный нуклеоид не окружен ядерной мембраной. Область каждого нуклеоида может содержать более 10 копий пластидной ДНК.
Если пропластид ( недифференцированный пластид ) содержит одну нуклеоидную область, расположенную вблизи центра пропластида, то развивающаяся (или дифференцирующаяся) пластида имеет множество нуклеоидов, локализованных на периферии пластиды и связанных с внутренней мембраной оболочки. Во время развития/дифференциации пропластид в хлоропласты — и когда пластиды дифференцируются из одного типа в другой — нуклеоиды изменяют морфологию, размер и местоположение внутри органеллы. Считается, что ремоделирование пластидных нуклеоидов происходит путем изменений в обилии и составе нуклеоидных белков.
В нормальных растительных клетках иногда образуются длинные тонкие выросты, называемые стромулами , которые простираются от пластидного тела в цитозоль клетки , соединяя при этом несколько пластид. Белки и более мелкие молекулы могут перемещаться вокруг стромул и через них. Для сравнения, в лабораторных условиях большинство культивируемых клеток, которые являются большими по сравнению с нормальными растительными клетками, производят очень длинные и обильные стромулы, которые простираются до периферии клетки.
В 2014 году были обнаружены доказательства возможной потери пластидного генома у Rafflesia lagascae , нефотосинтетического паразитического цветкового растения, и у Polytomella , рода нефотосинтетических зеленых водорослей . Обширные поиски пластидных генов в обоих таксонах не дали никаких результатов, но вывод о том, что их пластомы полностью отсутствуют, все еще остается спорным. [13] Некоторые ученые утверждают, что потеря пластидного генома маловероятна, поскольку даже эти нефотосинтетические пластиды содержат гены, необходимые для завершения различных биосинтетических путей , включая биосинтез гема. [13] [14]
Даже при любой потере пластидного генома у Rafflesiaceae пластиды все еще встречаются там в виде «оболочек» без содержания ДНК [15] , что напоминает гидрогеносомы у различных организмов.
Типы пластид у водорослей и простейших включают:
Пластида фотосинтетического вида Paulinella часто упоминается как «цианель» или хроматофор, и используется в фотосинтезе. [17] [18] У нее было гораздо более позднее эндосимбиотическое событие, в диапазоне 140–90 миллионов лет назад, что является единственным другим известным первичным эндосимбиотическим событием цианобактерий. [19] [20]
Этиопласты , амилопласты и хромопласты специфичны для растений и не встречаются в водорослях. [ необходима ссылка ] Пластиды в водорослях и роголистниках также могут отличаться от растительных пластид тем, что они содержат пиреноиды .
При размножении большинство растений наследуют свои пластиды только от одного родителя. В целом, покрытосеменные растения наследуют пластиды от женской гаметы , тогда как многие голосеменные растения наследуют пластиды от мужской пыльцы . Водоросли также наследуют пластиды только от одного родителя. Таким образом, пластидная ДНК другого родителя полностью теряется.
При нормальных внутривидовых скрещиваниях, приводящих к нормальным гибридам одного вида, наследование пластидной ДНК, по-видимому, строго однородительское, т. е. от самки. Однако при межвидовых гибридизациях наследование, по-видимому, более беспорядочное. Хотя пластиды наследуются в основном от самки при межвидовых гибридизациях, есть много сообщений о гибридах цветковых растений, производящих пластиды от самцов. Примерно 20% покрытосеменных, включая люцерну ( Medicago sativa ), обычно демонстрируют двуродительское наследование пластид. [21]
Пластидная ДНК проростков кукурузы подвергается все большему повреждению по мере развития проростков. [22] Повреждение ДНК происходит из-за окислительной среды, созданной фотоокислительными реакциями и фотосинтетическим / дыхательным переносом электронов . Некоторые молекулы ДНК восстанавливаются , но ДНК с невосстановленными повреждениями, по-видимому, деградирует до нефункциональных фрагментов.
Белки репарации ДНК кодируются ядерным геномом клетки , а затем перемещаются в пластиды, где они поддерживают стабильность/целостность генома , восстанавливая ДНК пластиды. [23] Например, в хлоропластах мха Physcomitrella patens белок, используемый для восстановления несоответствий ДНК (Msh1), взаимодействует с белками, используемыми для рекомбинационной репарации ( RecA и RecG), для поддержания стабильности генома пластиды. [24]
Считается, что пластиды произошли от эндосимбиотических цианобактерий . Предполагается, что первичное эндосимбиотическое событие Archaeplastida произошло около 1,5 миллиарда лет назад [25] и позволило эукариотам осуществлять оксигенный фотосинтез . [26] С тех пор возникло три эволюционные линии Archaeplastida, в которых пластиды называются по-разному: хлоропласты в зеленых водорослях и/или растениях, родопласты в красных водорослях и муропласты в глаукофитах. Пластиды различаются как по своей пигментации, так и по своей ультраструктуре. Например, хлоропласты в растениях и зеленых водорослях утратили все фикобилисомы , комплексы сбора света, обнаруженные в цианобактериях, красных водорослях и глаукофитах, но вместо этого содержат тилакоиды стромы и граны . Пластида глаукоцистофитов, в отличие от хлоропластов и родопластов, все еще окружена остатками клеточной стенки цианобактерий. Все эти первичные пластиды окружены двумя мембранами.
Пластида фотосинтетических видов Paulinella часто упоминается как «цианелла» или хроматофор, и имела гораздо более позднее эндосимбиотическое событие около 90–140 миллионов лет назад; это единственное известное первичное эндосимбиотическое событие цианобактерий за пределами Archaeplastida. [17] [18] Пластида принадлежит к «PS-кладе» (родов цианобактерий Prochlorococcus и Synechococcus ), которая является другой сестринской кладой по отношению к пластидам, принадлежащим Archaeplastida. [4] [5]
В отличие от первичных пластид, полученных в результате первичного эндосимбиоза прокариоктных цианобактерий, сложные пластиды возникли в результате вторичного эндосимбиоза , при котором эукариотический организм поглощает другой эукариотический организм, содержащий первичную пластиду. [27] Когда эукариот поглощает красную или зеленую водоросль и сохраняет водорослевую пластиду, эта пластида обычно окружена более чем двумя мембранами. В некоторых случаях эти пластиды могут быть снижены в своей метаболической и/или фотосинтетической способности. Водоросли со сложными пластидами, полученные в результате вторичного эндосимбиоза красной водоросли, включают гетероконты , гаптофиты , криптомонады и большинство динофлагеллят (= родопласты). Те, которые эндосимбиозировали зеленую водоросль, включают эвглениды и хлорарахниофиты (= хлоропласты). Apicomplexa , тип облигатных паразитических альвеолят , включающий возбудителей малярии ( Plasmodium spp.), токсоплазмоза ( Toxoplasma gondii ) и многих других заболеваний человека или животных, также содержит сложную пластиду (хотя эта органелла была утрачена некоторыми апикомплексанами, такими как Cryptosporidium parvum , вызывающими криптоспоридиоз ). « Апикопласт » больше не способен к фотосинтезу, но является важной органеллой и перспективной целью для разработки противопаразитарных препаратов .
Некоторые динофлагелляты и морские слизни , в частности, рода Elysia , употребляют водоросли в пищу и сохраняют пластиды переваренных водорослей, чтобы извлечь выгоду из фотосинтеза; через некоторое время пластиды также перевариваются. Этот процесс известен как клептопластия , от греческого слова kleptes ( κλέπτης ), вор.

В 1977 году Дж. М. Уотли предложил цикл развития пластид, который утверждал, что развитие пластид не всегда однонаправлено, а представляет собой сложный циклический процесс. Пропластиды являются предшественниками более дифференцированных форм пластид, как показано на диаграмме справа. [28]