Олово — химический элемент ; его символ Sn (от латинского stannum ) и атомный номер 50. Серебристый металл, олово достаточно мягкое, чтобы его можно было разрезать с небольшим усилием, [10] и брусок олова можно согнуть вручную с небольшим усилием. При сгибании можно услышать так называемый « оловной крик » как результат двойникования в кристаллах олова. [11]
Олово — постпереходный металл в 14 группе периодической таблицы элементов. Его получают в основном из минерала касситерита , который содержит оксид олова SnO
2. Олово проявляет химическое сходство с обоими своими соседями по группе 14, германием и свинцом , и имеет две основные степени окисления : +2 и немного более стабильную +4. Олово является 49-м наиболее распространенным элементом на Земле, составляя 0,00022% ее коры, и с 10 стабильными изотопами оно имеет наибольшее количество стабильных изотопов в периодической таблице из-за своего магического числа протонов.
Он имеет две основные аллотропные модификации : при комнатной температуре устойчивой аллотропной модификацией является β-олово, серебристо-белый, ковкий металл; при низких температурах это менее плотное серое α-олово, имеющее кубическую структуру алмаза. Металлическое олово нелегко окисляется на воздухе и в воде.
Первым сплавом олова, использовавшимся в больших масштабах, была бронза , состоящая из 1 ⁄ 8 олова и 7 ⁄ 8 меди (12,5% и 87,5% соответственно), начиная с 3000 г. до н. э. После 600 г. до н. э. было получено чистое металлическое олово. Олово , представляющее собой сплав 85–90% олова с остатком, обычно состоящим из меди , сурьмы , висмута, а иногда свинца и серебра, использовалось для столовых приборов со времен бронзового века . В наше время олово используется во многих сплавах, в частности, в мягких припоях оловянно-свинцового типа , которые обычно содержат 60% или более олова, и в производстве прозрачных, электропроводящих пленок оксида индия-олова в оптоэлектронных приложениях . Другое крупное применение — коррозионно -стойкое лужение стали . Из-за низкой токсичности неорганического олова луженая сталь широко используется для упаковки пищевых продуктов в виде " консервных банок ". Некоторые оловоорганические соединения могут быть чрезвычайно токсичными.

Олово — мягкий, ковкий , пластичный и высококристаллический серебристо -белый металл . Когда сгибают брусок олова, можно услышать потрескивающий звук, известный как « оловный крик », из-за двойникования кристаллов. [11] Эта черта свойственна индию , кадмию , цинку и ртути в твердом состоянии. Олово плавится при температуре около 232 °C (450 °F), самой низкой в группе 14, и кипит при температуре 2602 °C (4716 °F), второй самой низкой (перед свинцом ) в своей группе. Температура плавления дополнительно снижается до 177,3 °C (351,1 °F) для частиц размером 11 нм. [12] [13]
β-олово, также называемое белым оловом , является аллотропом (структурной формой) элементарного олова, которое стабильно при комнатной температуре и выше. Оно металлическое и ковкое, имеет объемно-центрированную тетрагональную кристаллическую структуру. α-олово, или серое олово , является неметаллической формой. Оно стабильно при температуре ниже 13,2 °C (55,8 °F) и является хрупким . α-олово имеет алмазную кубическую кристаллическую структуру, как алмаз и кремний . α-олово не обладает металлическими свойствами, поскольку его атомы образуют ковалентную структуру, в которой электроны не могут свободно перемещаться. α-олово представляет собой тускло-серый порошкообразный материал, не имеющий общих применений, кроме специализированных полупроводниковых применений. [11] γ-олово и σ-олово существуют при температурах выше 161 °C (322 °F) и давлениях выше нескольких ГПа . [14]
В холодных условиях β-олово имеет тенденцию спонтанно превращаться в α-олово, явление, известное как « оловянная чума » или «оловянная болезнь». [15] Некоторые непроверенные источники также говорят, что во время русской кампании Наполеона 1812 года температура стала настолько низкой, что оловянные пуговицы на солдатской форме со временем распались, что способствовало поражению Великой армии , [16] устойчивая легенда. [17] [18] [19]
Температура α-β-превращения составляет 13,2 °C (55,8 °F), но примеси (например, Al, Zn и т. д.) понижают ее значительно ниже 0 °C (32 °F). При добавлении сурьмы или висмута превращение может вообще не произойти, что увеличивает долговечность. [20]
Коммерческие сорта олова (содержание олова 99,8%) сопротивляются трансформации из-за ингибирующего эффекта небольших количеств висмута, сурьмы, свинца и серебра, присутствующих в качестве примесей. Легирующие элементы, такие как медь, сурьма, висмут, кадмий и серебро, повышают твердость олова. [21] Олово легко образует твердые, хрупкие интерметаллические фазы, которые обычно нежелательны. Оно не смешивается в раствор с большинством металлов и элементов, поэтому олово не обладает большой твердой растворимостью. Олово хорошо смешивается с висмутом , галлием , свинцом , таллием и цинком , образуя простые эвтектические системы. [20]
Олово становится сверхпроводником при температуре ниже 3,72 К [22] и было одним из первых изученных сверхпроводников. [23] Эффект Мейсснера , одна из характерных особенностей сверхпроводников, был впервые обнаружен в сверхпроводящих кристаллах олова. [23]
Олово устойчиво к коррозии от воды , но может быть разъедено кислотами и щелочами . Олово может быть тщательно отполировано и использовано в качестве защитного покрытия для других металлов. [11] При нагревании на воздухе оно медленно окисляется, образуя тонкий пассивирующий слой оксида олова ( SnO 2 ), который препятствует дальнейшему окислению. [24] [25]
У олова десять стабильных изотопов , наибольшее количество среди всех элементов. Их массовые числа составляют 112, 114, 115, 116, 117, 118, 119, 120, 122 и 124. Олово-120 составляет почти треть всего олова. Олово-118 и олово-116 также распространены. Олово-115 является наименее распространенным стабильным изотопом. [ необходима цитата ] Изотопы с четными массовыми числами не имеют ядерного спина , в то время как изотопы с нечетными массовыми числами имеют ядерный спин 1/2. Считается, что олово имеет такое большое множество стабильных изотопов из-за атомного номера олова , равного 50, что является « магическим числом » в ядерной физике. [ необходима цитата ]
Олово является одним из самых простых элементов для обнаружения и анализа с помощью ЯМР-спектроскопии , которая основана на молекулярной массе, а его химические сдвиги сравниваются с тетраметилоловом ( SnMe
4). [б] [26]
Из стабильных изотопов олово-115 имеет высокое сечение захвата нейтронов для быстрых нейтронов, равное 30 барн . Олово-117 имеет сечение 2,3 барн, что на порядок меньше, в то время как олово-119 имеет немного меньшее сечение 2,2 барн. [27] До того, как эти сечения стали хорошо известны, было предложено использовать оловянно-свинцовый припой в качестве охладителя для быстрых реакторов из-за его низкой температуры плавления. Текущие исследования посвящены свинцовым или свинцово-висмутовым охладителям реакторов, поскольку оба тяжелых металла почти прозрачны для быстрых нейтронов, с очень низкими сечениями захвата. [28] Чтобы использовать оловянный или оловянно-свинцовый охладитель, олово сначала должно было бы пройти изотопное разделение для удаления изотопов с нечетным массовым числом. В совокупности эти три изотопа составляют около 17% природного олова, но представляют почти все сечение захвата. Из оставшихся семи изотопов олово-112 имеет сечение захвата 1 барн. Остальные шесть изотопов, образующие 82,7% природного олова, имеют сечение захвата 0,3 барн или меньше, что делает их фактически прозрачными для нейтронов. [27]
У олова есть 31 нестабильный изотоп, массовые числа которых варьируются от 99 до 139. Нестабильные изотопы олова имеют период полураспада менее года, за исключением олова-126 , период полураспада которого составляет около 230 000 лет. Олово-100 и олово-132 — два из немногих нуклидов с « двойным магическим » ядром, которые, несмотря на свою нестабильность, поскольку имеют очень неравномерные нейтронно-протонные отношения , являются конечными точками, за пределами которых изотопы олова легче олова-100 и тяжелее олова-132 становятся гораздо менее стабильными. [29] Еще 30 метастабильных изомеров были идентифицированы для изотопов олова между 111 и 131, наиболее стабильным из которых является олово-121m с периодом полураспада 43,9 года. [30]
Относительные различия в распространенности стабильных изотопов олова можно объяснить тем, как они образуются во время звездного нуклеосинтеза . Олово-116 — олово-120, наряду с оловом-122, образуются в s -процессе (медленный захват нейтронов) в большинстве звезд , что приводит к тому, что они являются наиболее распространенными изотопами олова, в то время как олово-124 образуется только в r -процессе (быстрый захват нейтронов) при слияниях сверхновых и нейтронных звезд . Изотопы олова 115, 117 — 120 и 122 производятся как в s -процессе, так и в r -процессе, [31] Два самых легких стабильных изотопа, олово-112 и олово-114, не могут быть получены в значительных количествах в s- или r -процессах и относятся к p-ядрам , происхождение которых не совсем понятно. Некоторые теории об их образовании включают захват протонов и фотораспад . Олово-115 может быть частично получено в s -процессе, как напрямую, так и как дочерний элемент долгоживущего индия-115 , а также из распада индия-115, полученного в r -процессе. [31] [32]
Слово tin распространено в германских языках и может быть прослежено до реконструированного протогерманского * tin-om ; однокоренные слова включают немецкое Zinn , шведское tenn и голландское tin . Оно не встречается в других ветвях индоевропейских языков , за исключением заимствований из германских (например, ирландское tinne из английского). [33] [34]
Латинское название олова, stannum , изначально означало сплав серебра и свинца и стало означать «олово» в четвертом веке [35] — более раннее латинское слово для него было plumbum candidum , или «белый свинец». Stannum , по-видимому, произошло от более раннего stāgnum (означающего то же самое вещество), [33] откуда происходят романские и кельтские термины для олова , такие как французский étain , испанский estaño , итальянский stagno и ирландский stán . [33] [36] Происхождение stannum / stāgnum неизвестно; оно может быть доиндоевропейским . [ 37]
В «Meyers Konversations-Lexikon» вместо этого высказывается предположение, что олово произошло от корнуоллского слова stean , и это свидетельствует о том, что Корнуолл в первые века нашей эры был основным источником олова. [ необходима цитата ]
.jpg/440px-Sword_bronze_age_(2nd_version).jpg)
Добыча и использование олова могут быть датированы началом бронзового века около 3000 г. до н. э., когда было замечено, что медные предметы, образованные из полиметаллических руд с различным содержанием металла, имели различные физические свойства. [38] Самые ранние бронзовые предметы имели содержание олова или мышьяка менее 2% и, как полагают, являются результатом непреднамеренного легирования из-за содержания следов металла в медной руде. [39] Добавление второго металла к меди увеличивает ее твердость, снижает температуру плавления и улучшает процесс литья , производя более жидкий расплав, который охлаждается до более плотного, менее губчатого металла. [39] Это было важным нововведением, которое позволило отливать гораздо более сложные формы в закрытых формах бронзового века. Изделия из мышьяковой бронзы впервые появились на Ближнем Востоке, где мышьяк обычно встречается с медной рудой, но риски для здоровья были быстро осознаны, и поиск источников гораздо менее опасных оловянных руд начался в начале бронзового века. [40] Это создало спрос на редкий металл олово и сформировало торговую сеть, которая связала отдаленные источники олова с рынками культур бронзового века. [41]
Касситерит ( SnO
2), оксидная форма олова, скорее всего, была первоначальным источником олова. Другие оловянные руды — это менее распространенные сульфиды, такие как станнит , которые требуют более сложного процесса плавки . Касситерит часто накапливается в аллювиальных каналах в виде россыпных отложений , поскольку он тверже, тяжелее и более химически устойчив, чем сопутствующий гранит . [39] Касситерит обычно черного или темного цвета, и эти отложения можно легко увидеть на берегах рек . Аллювиальные ( россыпные ) отложения могли быть случайно собраны и отделены методами, похожими на промывку золота . [42]
В подавляющем большинстве своих соединений олово имеет степень окисления II или IV. Соединения, содержащие двухвалентное олово, называются '"`UNIQ--templatestyles-00000068-QINU`"' оловянными, а содержащие четырехвалентное олово — оловянными .
Галогенидные соединения известны для обеих степеней окисления. Для Sn(IV) хорошо известны все четыре галогенида: SnF 4 , SnCl 4 , SnBr 4 и SnI 4 . Три более тяжелых члена являются летучими молекулярными соединениями, тогда как тетрафторид является полимерным. Все четыре галогенида известны также для Sn(II): SnF 2 , SnCl
2, SnBr 2 и SnI 2 . Все они являются полимерными твердыми веществами. Из этих восьми соединений только иодиды окрашены. [43]
Хлорид олова (II) (также известный как хлорид олова) является наиболее важным коммерческим галогенидом олова. Иллюстрируя пути получения таких соединений, хлор реагирует с металлическим оловом, давая SnCl 4 , тогда как реакция соляной кислоты и олова дает SnCl
2и водородный газ. Альтернативно SnCl 4 и Sn объединяются в хлорид олова с помощью процесса, называемого конпропорционированием : [44]
Олово может образовывать множество оксидов, сульфидов и других производных халькогенидов . Диоксид SnO
2(касситерит) образуется при нагревании олова в присутствии воздуха . [43] SnO
2является амфотерным , что означает, что он растворяется как в кислых, так и в основных растворах. [45] Станнаты со структурой [ Sn(OH)
6] 2− , как К
2[ Sn(ОН)
6], также известны, хотя свободная оловянная кислота H
2[ Sn(ОН)
6] неизвестно. [ необходима цитата ]
Сульфиды олова существуют в степени окисления +2 и +4: сульфид олова(II) и сульфид олова(IV) ( мозаичное золото ).

Станнан ( SnH
4), с оловом в степени окисления +4, нестабилен. Однако хорошо известны оловоорганические гидриды, например, гидрид трибутилолова (Sn(C 4 H 9 ) 3 H). [11] Эти соединения выделяют переходные радикалы трибутилолова , которые являются редкими примерами соединений олова(III). [47]
Оловоорганические соединения, иногда называемые станнанами, представляют собой химические соединения со связями олово-углерод. [48] Из соединений олова органические производные являются наиболее полезными в коммерческом отношении. [49] Некоторые оловоорганические соединения являются высокотоксичными и использовались в качестве биоцидов . Первым оловоорганическим соединением, о котором сообщалось, был дииодид диэтилолова ((C 2 H 5 ) 2 SnI 2 ), о котором сообщил Эдвард Франкленд в 1849 году. [50]
Большинство оловоорганических соединений — бесцветные жидкости или твердые вещества, устойчивые к воздействию воздуха и воды. Они принимают тетраэдрическую геометрию. Тетраалкил- и тетраарилотиновые соединения могут быть получены с использованием реактивов Гриньяра : [49]
Смешанные галогенид-алкилы, которые более распространены и имеют большее коммерческое значение, чем тетраорганопроизводные, получают с помощью реакций перераспределения :
Двухвалентные оловоорганические соединения встречаются редко, хотя и более часто, чем родственные двухвалентные германийорганические и кремнийорганические соединения. Более высокая стабилизация, которой обладает Sn(II), объясняется «эффектом инертной пары ». Оловоорганические соединения (II) включают как станнилены (формула: R 2 Sn, как видно для синглетных карбенов ), так и дистаннилены (R 4 Sn 2 ), которые примерно эквивалентны алкенам . Оба класса демонстрируют необычные реакции. [51]

Олово образуется в результате длительного s -процесса в звездах малой и средней массы (с массой от 0,6 до 10 масс Солнца ) и, наконец, в результате бета-распада тяжелых изотопов индия . [52]
Олово является 49-м наиболее распространенным элементом в земной коре , его содержание составляет 2 ppm по сравнению с 75 ppm для цинка, 50 ppm для меди и 14 ppm для свинца. [53]
Олово не встречается в природе как самородный элемент, его необходимо извлекать из различных руд. Касситерит ( SnO
2) является единственным коммерчески важным источником олова, хотя небольшие количества олова извлекаются из сложных сульфидов, таких как станнит , цилиндрит , франкеит , канфилдит и теаллит . Минералы с оловом почти всегда связаны с гранитной породой, обычно на уровне содержания оксида олова 1%. [54]
Из-за более высокого удельного веса диоксида олова около 80% добываемого олова добывается из вторичных месторождений, расположенных ниже по течению от первичных залежей. Олово часто извлекается из гранул, вымытых вниз по течению в прошлом и отложенных в долинах или море. Наиболее экономичными способами добычи олова являются драгирование , гидроочистка или открытые карьеры . Большая часть мирового олова добывается из россыпных месторождений, которые могут содержать всего 0,015% олова. [55]
Около 253 000 тонн олова было добыто в 2011 году, в основном в Китае (110 000 тонн), Индонезии (51 000 тонн), Перу (34 600 тонн), Боливии (20 700 тонн) и Бразилии (12 000 тонн). [56] Оценки производства олова исторически менялись в зависимости от рынка и технологий добычи. Предполагается, что при нынешних темпах потребления и технологиях на Земле закончится пригодное для добычи олово через 40 лет. [57] В 2006 году Лестер Браун предположил, что олово может закончиться в течение 20 лет, основываясь на консервативных оценках 2% годового прироста. [58]
Оловянный лом является важным источником металла. Извлечение олова путем переработки быстро увеличивается с 2019 года. [59] В то время как Соединенные Штаты не добывали (с 1993 года) и не выплавляли (с 1989 года) олово, они были крупнейшим вторичным производителем, переработав почти 14 000 тонн в 2006 году. [56]
Сообщается о новых месторождениях в Монголии , [60] а в 2009 году новые месторождения олова были обнаружены в Колумбии. [61]
Олово получают путем карботермического восстановления оксидной руды углеродом или коксом. Могут использоваться как отражательные печи , так и электрические печи : [62] [63] [64]
Десять крупнейших компаний-производителей олова произвели большую часть мирового производства олова в 2007 году. [ необходима цитата ]
Большая часть мирового олова продается на Лондонской бирже металлов (LME) из 8 стран под 17 брендами. [65]
Международный совет по олову был создан в 1947 году для контроля цен на олово. Он распался в 1985 году. В 1984 году была создана Ассоциация стран-производителей олова, членами которой стали Австралия, Боливия, Индонезия, Малайзия, Нигерия, Таиланд и Заир. [68]
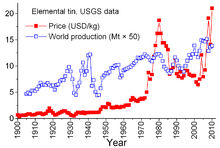
Олово является уникальным среди минеральных товаров из-за сложных соглашений между странами-производителями и странами-потребителями, датируемых 1921 годом. Более ранние соглашения, как правило, были несколько неформальными и привели к «Первому международному соглашению по олову» в 1956 году, первому из серии, которая фактически рухнула в 1985 году. Благодаря этим соглашениям Международный совет по олову (МСО) оказал значительное влияние на цены на олово. МСО поддерживал цену на олово в периоды низких цен, покупая олово для своего буферного запаса, и был в состоянии сдерживать цену в периоды высоких цен, продавая из запаса. Это был антирыночный подход, призванный обеспечить достаточный поток олова в страны-потребители и прибыль для стран-производителей. Однако буферный запас был недостаточно большим, и в течение большей части этих 29 лет цены на олово росли, иногда резко, особенно с 1973 по 1980 год, когда безудержная инфляция поразила многие мировые экономики. [69]
В конце 1970-х и начале 1980-х годов США сократили свои стратегические запасы олова, отчасти чтобы воспользоваться исторически высокими ценами на олово. Рецессия 1981–82 годов нанесла ущерб оловянной промышленности. Потребление олова резко сократилось. ITC смогла избежать действительно крутого спада за счет ускоренных закупок для своего буферного запаса; эта деятельность требовала обширных заимствований. ITC продолжала занимать до конца 1985 года, когда она достигла своего кредитного лимита. Сразу же последовал крупный «оловянный кризис» — олово было исключено из торгов на Лондонской бирже металлов примерно на три года. Вскоре после этого ITC распалась, и цена олова, теперь уже в условиях свободного рынка, упала до 4 долларов за фунт и оставалась около этого уровня в течение 1990-х годов. [69] Цена снова выросла к 2010 году с восстановлением потребления после экономического кризиса 2007–2008 годов , сопровождавшегося пополнением запасов и продолжающимся ростом потребления. [56]

Лондонская биржа металлов (LME) является основной площадкой для торговли оловом. [56] Другими рынками контрактов на олово являются рынок олова Куала-Лумпура (KLTM) и Индонезийская биржа олова (INATIN). [70]
Из-за факторов, связанных с глобальным кризисом цепочки поставок 2021 года , цены на олово почти удвоились в 2020–2021 годах и показали самый большой годовой рост за последние 30 лет. Глобальное потребление рафинированного олова упало на 1,6 процента в 2020 году, поскольку пандемия COVID-19 нарушила работу мировых производственных отраслей. [71]

В 2018 году чуть меньше половины всего произведенного олова было использовано в припое. Остальное было разделено между лужением, оловянными химикатами, латунными и бронзовыми сплавами и нишевыми применениями. [72]
Пигмент желтый 38, сульфид олова (IV) , известен как мозаичное золото . [73]
Пурпур Кассия , пигмент красный 109, водный двойной станнат золота , в основном, с точки зрения живописи, ограничивался миниатюрами из-за его высокой стоимости. Он широко использовался для изготовления клюквенного стекла . Он также использовался в искусстве для окрашивания фарфора . [74]
Свинцово-оловянный желтый (который встречается в двух желтых формах — станнат и силикат ) был пигментом , который исторически был очень важен для масляной живописи и который в своей силикатной форме некоторое время использовался во фресках . [75] Станнат свинца также известен в оранжевой форме, но не нашел широкого применения в изобразительном искусстве. Он доступен для покупки в форме пигмента у специализированных поставщиков художников. Существует еще одна второстепенная форма, с точки зрения художественного использования и доступности, свинцово-оловянного желтого, известная как свинцово-оловянный сурьмяный желтый. [ необходима цитата ]
Cerulean blue, несколько тусклый голубой, химически известный как станнат кобальта , продолжает оставаться важным пигментом художников. Его оттенок похож на оттенок марганцевого синего, Pigment Blue 33, хотя ему не хватает красочности этого пигмента и он более непрозрачен. [76] Художникам обычно приходится выбирать между станнатом кобальта и имитациями марганцевого синего, сделанными с использованием фталоцианинового сине-зеленого оттенка (Pigment Blue 15:3), поскольку промышленное производство пигмента марганцевого синего прекратилось в 1970-х годах. [77] Однако лазурный синий, сделанный с использованием станната кобальта, был популярен среди художников до производства марганцевого синего. [ необходима цитата ]
Пигмент красный 233, обычно известный как Pinkcolor или Potter's Pink, а точнее, как Chrome Tin Pink Sphene, является исторически важным пигментом в акварели . [78] Однако он снова обрел популярность благодаря интернет-сарафанному радио . Он полностью светостойкий и химически стабильный как в масляных красках, так и в акварели. Другие неорганические смешанные металлокомплексные пигменты, полученные путем прокаливания , часто содержат олово в качестве компонента. Эти пигменты известны своей светостойкостью , атмосферостойкостью, химической стабильностью, отсутствием токсичности и непрозрачностью . Многие из них довольно тусклые с точки зрения красочности. Однако некоторые обладают достаточной красочностью, чтобы быть конкурентоспособными для случаев использования, где требуется больше, чем умеренное ее количество. Некоторые ценятся за другие качества. Например, Pinkcolor выбирают многие акварелисты из-за его сильной грануляции , хотя его цветность низкая. Недавно на рынок поступил NTP Yellow ( пирохлор ) в качестве нетоксичной замены хромату свинца (II) , обладающей большей непрозрачностью, светостойкостью и устойчивостью к атмосферным воздействиям, чем предлагаемые органические пигменты-заменители хромата свинца. [79] NTP Yellow обладает самой высокой степенью насыщенности цвета среди современных неорганических смешанных металлокомплексных пигментов. Другие примеры этой группы включают Pigment Yellow 158 (олово-ванадиевый желтый касситерит ), [80] Pigment Yellow 216 (Solaplex Yellow), [81] Pigment Yellow 219 ( титаново- цинково- сурьмяный станнат), [82] Pigment Orange 82 (оксид олова титана и цинка, также известный как Sicopal Orange), [83] Pigment Red 121 (также известный как оловянно-фиолетовый и станнат хрома ), [84] Pigment Red 230 (хромово-алюминиевый розовый корунд ), [85] Pigment Red 236 (хромово-оловянная орхидея касситерит ), [86] и Pigment Black 23 (олово-сурьмяный серый касситерит). [87] Другой синий пигмент с оловом и кобальтом - Pigment Blue 81, кобальтово-оловянная синяя шпинель . [ необходима ссылка ]
Пигмент White 15, оксид олова (IV), используется для его радужности , чаще всего в качестве керамической глазури . [88] Нет зеленых пигментов, которые использовались бы художниками, имеющими в своем составе олово, а пурпурные пигменты с оловом классифицируются как красные, согласно Colour Index International . [ необходима цитата ]
Олово уже давно используется в сплавах со свинцом в качестве припоя в количестве от 5 до 70% по весу. Олово со свинцом образует эвтектическую смесь при весовой пропорции 61,9% олова и 38,1% свинца (атомная пропорция: 73,9% олова и 26,1% свинца) с температурой плавления 183 °C (361,4 °F). Такие припои в основном используются для соединения труб или электрических цепей . С тех пор как 1 июля 2006 года вступили в силу Директива Европейского союза об отходах электрического и электронного оборудования (Директива WEEE) и Директива об ограничении использования опасных веществ , содержание свинца в таких сплавах снизилось. Хотя воздействие свинца связано с серьезными проблемами со здоровьем , бессвинцовый припой не лишен своих проблем, включая более высокую температуру плавления и образование оловянных усов , которые вызывают электрические проблемы. Оловянная вредительница может появиться в бессвинцовых припоях, что приведет к потере паяного соединения. Находятся заменяющие сплавы, но проблемы с целостностью соединений остаются. [89] Обычный сплав без свинца состоит из 99% олова, 0,7% меди и 0,3% серебра, с температурой плавления 217 °C (422,6 °F). [90]

Олово легко соединяется с железом и используется для покрытия свинца , цинка и стали для предотвращения коррозии. Луженые (или луженые) стальные контейнеры широко используются для сохранения продуктов питания , и это составляет большую часть рынка металлического олова. Жестяная банка для сохранения продуктов питания была впервые изготовлена в Лондоне в 1812 году. [91] Носители британского английского языка называют такие контейнеры «tins», в то время как носители американского английского языка называют их « cans » или «tin cans». Одним из производных такого использования является сленговое выражение « tinnie » или «tinny», что означает «банка пива» в Австралии. Жестяной свисток так называется, потому что он был сначала массово произведен из луженой стали. [92] [93]
Медные сосуды для приготовления пищи, такие как кастрюли и сковороды, часто покрываются тонким слоем олова, нанесенным гальваническим способом или традиционными химическими методами, поскольку использование медной посуды с кислыми продуктами может быть токсичным. [ необходима цитата ]


Олово в сочетании с другими элементами образует широкий спектр полезных сплавов. Олово чаще всего сплавляют с медью. Пьютер на 85–99% состоит из олова, [94] а подшипниковый металл также имеет высокий процент олова. [95] [96] Бронза в основном состоит из меди с 12% олова, в то время как добавление фосфора дает фосфористую бронзу . Колокольный металл также является сплавом меди и олова, содержащим 22% олова. Олово иногда использовалось в чеканке монет; когда-то оно составляло однозначный процент (обычно пять процентов или меньше) американских пенни. [97] и канадских [98]
Соединение ниобия и олова Nb 3 Sn коммерчески используется в катушках сверхпроводящих магнитов из-за его высокой критической температуры (18 К) и критического магнитного поля (25 Тл ). Сверхпроводящий магнит весом всего два килограмма способен создавать магнитное поле обычного электромагнита весом тонны. [99]
Небольшой процент олова добавляется в циркониевые сплавы для оболочки ядерного топлива. [100]
Большинство металлических труб в органе изготовлены из сплава олова и свинца, наиболее распространенным является соотношение 50/50. Пропорция олова в трубе определяет тон трубы, поскольку олово имеет желаемый тональный резонанс. Когда сплав олова и свинца остывает, свинцовая фаза сначала затвердевает, затем, когда достигается эвтектическая температура, оставшаяся жидкость образует слоистую эвтектическую структуру олова и свинца, которая блестит; контраст со свинцовой фазой дает пятнистый или пятнистый эффект. Этот металлический сплав называют пятнистым металлом. Основные преимущества использования олова для труб включают его внешний вид, обрабатываемость и устойчивость к коррозии. [101] [102]
Соединения олова используются в производстве различных химикатов, включая стабилизаторы для ПВХ и катализаторы для промышленных процессов. Олово в форме слитков обеспечивает сырье, необходимое для этих химических реакций, гарантируя постоянное качество и производительность. [ необходима цитата ]
Оксиды индия и олова являются электропроводящими и прозрачными, и используются для изготовления прозрачных электропроводящих пленок, применяемых в оптоэлектронных устройствах, таких как жидкокристаллические дисплеи . [103]

Перфорированная луженая сталь, также называемая проколотым оловом, является ремесленной техникой, возникшей в Центральной Европе для создания функциональных и декоративных предметов домашнего обихода. Декоративные проколотые узоры существуют в большом разнообразии, основанном на местной традиции и ремесленнике. Перфорированные оловянные фонари являются наиболее распространенным применением этой ремесленной техники. Свет свечи, сияющий через проколотый узор, создает декоративный световой узор в комнате, где она находится. Фонари и другие перфорированные оловянные изделия создавались в Новом Свете с самых ранних европейских поселений. Хорошо известным примером является фонарь Ревира, названный в честь Пола Ревира . [104]
В Америке сейфы для пирогов и пищевые сейфы использовались до изобретения холодильников. Это были деревянные шкафы разных стилей и размеров — напольные или подвесные, предназначенные для защиты от вредителей и насекомых, а также для защиты от пыли скоропортящихся продуктов. В дверцах и иногда по бокам этих шкафов имелись жестяные вставки, выбитые домовладельцем, краснодеревщиком или жестянщиком в различных конструкциях, чтобы обеспечить циркуляцию воздуха и исключить попадание мух. Современные репродукции этих изделий остаются популярными в Северной Америке. [105]
Оконное стекло чаще всего изготавливается методом плавления расплавленного стекла на расплавленном олове ( флоат-стекло ), в результате чего получается ровная и безупречная поверхность. [106] Это также называется « процессом Пилкингтона ». [107]
Олово используется в качестве отрицательного электрода в современных литий-ионных аккумуляторах . Его применение несколько ограничено тем фактом, что некоторые оловянные поверхности [ которые? ] катализируют разложение электролитов на основе карбоната, используемых в литий-ионных аккумуляторах. [108]
Фторид олова (II) добавляют в некоторые средства по уходу за зубами [109] как фторид олова (SnF 2 ). Фторид олова (II) можно смешивать с абразивами на основе кальция , в то время как более распространенный фторид натрия постепенно становится биологически неактивным в присутствии соединений кальция. [110] Также было показано, что он более эффективен, чем фторид натрия, в борьбе с гингивитом . [111]
Олово используется в качестве мишени для создания лазерно-индуцированной плазмы , которая действует как источник света для литографии в экстремальном ультрафиолете . [112]
Оловоорганические соединения являются металлоорганическими соединениями, содержащими связи олово-углерод. Мировое промышленное производство оловоорганических соединений, вероятно, превышает 50 000 тонн . [113]
Основное коммерческое применение оловоорганических соединений заключается в стабилизации ПВХ- пластиков. При отсутствии таких стабилизаторов ПВХ быстро разлагается под воздействием тепла, света и атмосферного кислорода, что приводит к обесцвечиванию, образованию хрупких продуктов. Олово удаляет лабильные ионы хлорида (Cl− ) , которые в противном случае удаляли бы HCl из пластикового материала. [114] Типичные оловянные соединения — это производные карбоновой кислоты дихлорида дибутилолова, такие как дилаурат дибутилолова . [115]
Некоторые оловоорганические соединения относительно токсичны, что имеет как преимущества, так и проблемы. Они используются из-за биоцидных свойств в качестве фунгицидов , пестицидов , альгицидов , консервантов древесины и противообрастающих средств . [114] Оксид трибутилолова используется в качестве консерванта древесины . [116] Трибутилолово используется в различных промышленных целях, таких как борьба со слизью на бумажных фабриках и дезинфекция циркулирующих промышленных охлаждающих вод. [117] Трибутилолово использовалось в качестве добавки к корабельной краске для предотвращения роста обрастающих организмов на судах, и его использование сократилось после того, как оловоорганические соединения были признаны стойкими органическими загрязнителями с высокой токсичностью для некоторых морских организмов ( например, моллюска ). [118] ЕС запретил использование оловоорганических соединений в 2003 году, [119] в то время как опасения по поводу токсичности этих соединений для морской жизни и ущерба для воспроизводства и роста некоторых морских видов [114] (некоторые отчеты описывают биологические эффекты для морской жизни при концентрации 1 нанограмм на литр) привели к всемирному запрету Международной морской организации . [120] Многие страны теперь ограничивают использование оловоорганических соединений судами длиной более 25 м (82 фута). [114] Устойчивость трибутилолова в водной среде зависит от характера экосистемы. [121] Из-за этой стойкости и его использования в качестве добавки в корабельную краску высокие концентрации трибутилолова были обнаружены в морских отложениях, расположенных вблизи военно-морских доков. [122] Трибутилолово использовалось в качестве биомаркера для импозакса у неогастропод , по крайней мере, с 82 известными видами. [123] При высоком уровне ТБО в местных прибрежных районах из-за судоходной деятельности моллюски имели неблагоприятный эффект. [121] Импосексом называют навязывание мужских половых признаков особям женского пола, при котором у них вырастает пенис и семявыносящий проток . [123] [124] Высокий уровень ТБО может повредить эндокринные железы млекопитающих , репродуктивную и центральную нервную систему , костную структуру и желудочно-кишечный тракт . [124] Трибутилтин также влияет на млекопитающих, включая морских выдр, китов, дельфинов и людей. [124]
Некоторые реагенты олова полезны в органической химии . В самом большом применении хлорид олова является обычным восстановителем для преобразования нитро- и оксимных групп в амины . Реакция Стилла сочетает оловоорганические соединения с органическими галогенидами или псевдогалогенидами . [125]
Олово образует несколько интерметаллических фаз с металлическим литием, что делает его потенциально привлекательным материалом для применения в аккумуляторах. Большое объемное расширение олова при сплавлении с литием и нестабильность интерфейса олово-органический электролит при низких электрохимических потенциалах являются самыми большими проблемами для использования в коммерческих ячейках. [126] Интерметаллическое соединение олова с кобальтом и углеродом было реализовано Sony в ее ячейках Nexelion, выпущенных в конце 2000-х годов. Состав активного материала приблизительно Sn 0,3 Co 0,4 C 0,3 . Исследования показали, что только некоторые кристаллические грани тетрагонального (бета) Sn ответственны за нежелательную электрохимическую активность. [127]
Случаи отравления металлическим оловом, его оксидами и солями почти неизвестны. С другой стороны, некоторые оловоорганические соединения почти так же токсичны, как цианид . [49]
Воздействие олова на рабочем месте может происходить через дыхательные пути, контакт с кожей и глазами. Управление по охране труда и промышленной гигиене США (OSHA) установило допустимый предел воздействия олова на рабочем месте в размере 2 мг/м3 в течение 8-часового рабочего дня. Национальный институт охраны труда и промышленной гигиене (NIOSH) определил рекомендуемый предел воздействия (REL) в размере 2 мг/м3 в течение 8-часового рабочего дня. При уровнях 100 мг/м3 олово немедленно становится опасным для жизни и здоровья . [128]
Металлические пуговицы были только у офицеров, и они были сделаны из латуни.
{{cite book}}: |journal=проигнорировано ( помощь )