
Путь MAPK/ERK (также известный как путь Ras-Raf-MEK-ERK ) представляет собой цепочку белков в клетке , которая передает сигнал от рецептора на поверхности клетки к ДНК в ядре клетки.
Сигнал начинается, когда сигнальная молекула связывается с рецептором на поверхности клетки, и заканчивается, когда ДНК в ядре экспрессирует белок и вызывает некоторые изменения в клетке, такие как деление клетки . Путь включает множество белков, таких как митоген-активируемые протеинкиназы (МАРК), первоначально называемые внеклеточными сигнально-регулируемыми киназами (ERK), которые взаимодействуют путем добавления фосфатных групп к соседнему белку ( фосфорилируя его), тем самым действуя как переключатель «вкл» или «выкл».
Когда один из белков в пути мутирует, он может застрять в положении «вкл» или «выкл», что является необходимым шагом в развитии многих видов рака. Фактически, компоненты пути MAPK/ERK были впервые обнаружены в раковых клетках, и препараты, которые меняют положение «вкл» или «выкл», исследуются в качестве методов лечения рака. [1]
Сигналом, который запускает путь MAPK/ERK, является связывание внеклеточного митогена с рецептором клеточной поверхности . Это позволяет белку Ras ( малой ГТФазе ) заменить молекулу GDP на молекулу GTP , переключая «переключатель вкл/выкл» пути. Затем белок Ras может активировать MAP3K (например, Raf ), который активирует MAP2K , который активирует MAPK . Наконец, MAPK может активировать фактор транскрипции , такой как Myc . Этот процесс более подробно описан ниже.
Рецептор-связанные тирозинкиназы , такие как рецептор эпидермального фактора роста (EGFR), активируются внеклеточными лигандами , такими как эпидермальный фактор роста (EGF). Связывание EGF с EGFR активирует тирозинкиназную активность цитоплазматического домена рецептора. EGFR фосфорилируется по остаткам тирозина. Стыковочные белки, такие как GRB2, содержат домен SH2 , который связывается с остатками фосфотирозина активированного рецептора. [2] GRB2 связывается с фактором обмена гуаниновых нуклеотидов SOS посредством двух доменов SH3 GRB2. Когда комплекс GRB2-SOS стыкуется с фосфорилированным EGFR, SOS активируется. [3] Затем активированный SOS способствует удалению GDP из члена подсемейства Ras (в первую очередь H-Ras или K-Ras ). Затем белок Ras может связывать ГТФ и становиться активным.
Помимо EGFR, другие рецепторы клеточной поверхности, которые могут активировать этот путь через GRB2, включают Trk A/B , рецептор фактора роста фибробластов (FGFR) и PDGFR .
Затем активированный Ras активирует протеинкиназную активность киназы RAF . [4] Киназа RAF фосфорилирует и активирует киназу MAPK/ERK ( MEK1 или MEK2 ). MEK фосфорилирует и активирует митоген-активируемую протеинкиназу (MAPK).
RAF и MAPK/ERK являются серин/треонин-специфическими протеинкиназами . MEK является серин/тирозин/треониновой киназой.
В техническом смысле RAF, MEK и MAPK являются митоген -активируемыми киназами, как и MNK (см. ниже). MAPK изначально назывались « внеклеточными сигнально-регулируемыми киназами » (ERK) и «микротрубочково-ассоциированными протеинкиназами» (MAPK). Одним из первых белков, фосфорилируемых ERK, был микротрубочково -ассоциированный белок (MAP). Как обсуждается ниже, позднее было обнаружено множество дополнительных мишеней для фосфорилирования MAPK, и белок был переименован в «митоген-активируемую протеинкиназу» (MAPK). Серия киназ от RAF до MEK и MAPK является примером каскада протеинкиназ . Такие серии киназ предоставляют возможности для обратной связи и усиления сигнала.

Три из многих белков, фосфорилируемых MAPK, показаны на рисунке справа. Одним из эффектов активации MAPK является изменение трансляции мРНК в белки . MAPK фосфорилирует 40S рибосомальную протеинкиназу S6 (RSK) . Это активирует RSK, которая, в свою очередь, фосфорилирует рибосомальный белок S6 . [5] Первыми были выделены митоген-активируемые протеинкиназы, фосфорилирующие рибосомальный белок S6. [4]
MAPK регулирует активность нескольких факторов транскрипции . MAPK может фосфорилировать C-myc . MAPK фосфорилирует и активирует MNK, который, в свою очередь, фосфорилирует CREB . MAPK также регулирует транскрипцию гена C-Fos . Изменяя уровни и активность факторов транскрипции, MAPK приводит к изменению транскрипции генов, которые важны для клеточного цикла .
Гены 22q11, 1q42 и 19p13, влияющие на путь ERK, связаны с шизофренией , шизоаффективным расстройством , биполярным расстройством и мигренями .
Путь ERK играет важную роль в интеграции внешних сигналов от присутствия митогенов, таких как эпидермальный фактор роста (EGF), в сигнальные события, способствующие росту и пролиферации клеток во многих типах клеток млекопитающих. В упрощенной модели присутствие митогенов и факторов роста запускает активацию канонических рецепторных тирозинкиназ, таких как EGFR, что приводит к их димеризации и последующей активации малой GTPase Ras. [6] Затем это приводит к серии событий фосфорилирования ниже по течению в каскаде MAPK (Raf-MEK-ERK), в конечном итоге приводящих к фосфорилированию и активации ERK. Фосфорилирование ERK приводит к активации ее киназной активности и приводит к фосфорилированию ее многочисленных нижестоящих целей, участвующих в регуляции пролиферации клеток. В большинстве клеток некоторая форма устойчивой активности ERK необходима для того, чтобы клетки активировали гены, которые индуцируют вход в клеточный цикл и подавляют отрицательные регуляторы клеточного цикла. Две такие важные цели включают комплексы циклина D с Cdk4 и Cdk6 (Cdk4/6), которые оба фосфорилируются ERK. [7] Переход из фазы G1 в S координируется активностью циклина D-Cdk4/6, которая увеличивается в конце фазы G1, поскольку клетки готовятся войти в S-фазу в ответ на митогены. Активация Cdk4/6 способствует гиперфосфорилированию и последующей дестабилизации белка ретинобластомы (Rb). [7] Гипофосфорилированный Rb обычно связан с фактором транскрипции E2F в начале G1 и ингибирует его транскрипционную активность, предотвращая экспрессию генов входа в S-фазу, включая циклин E, циклин A2 и Emi1. [6] Активация ERK1/2 ниже по течению от митоген-индуцированной Ras-сигнализации необходима и достаточна для устранения этого блока клеточного цикла и обеспечения перехода клеток в S-фазу в большинстве клеток млекопитающих.

Точка рестрикции (точка R) отмечает критическое событие, когда клетка млекопитающего переходит к пролиферации и становится независимой от стимуляции роста. Она имеет основополагающее значение для нормальной дифференциации и гомеостаза тканей и, по-видимому, нарушается практически при всех видах рака. Хотя точка R связана с различными видами деятельности, участвующими в регуляции перехода G1–S клеточного цикла млекопитающих, лежащий в ее основе механизм остается неясным. Используя измерения отдельных клеток, Яо и др. показывают, что путь Rb–E2F функционирует как бистабильный переключатель для преобразования градуированных сывороточных входов в ответы E2F по принципу «все или ничего». [8]
Рост и сигналы митогена передаются вниз по пути ERK и включаются в несколько петель положительной обратной связи для генерации бистабильного переключателя на уровне активации E2F. [8] Это происходит из-за трех основных взаимодействий во время поздней фазы G1. Первое является результатом стимуляции митогена через ERK, что приводит к экспрессии фактора транскрипции Myc, который является прямым активатором E2F. [7] Второй путь является результатом активации ERK, что приводит к накоплению активных комплексов циклина D и Cdk4/6, которые дестабилизируют Rb посредством фосфорилирования и далее служат для активации E2F и стимулирования экспрессии его целей. Наконец, все эти взаимодействия усиливаются дополнительной петлей положительной обратной связи E2F на себя, поскольку его собственная экспрессия приводит к образованию активного комплекса циклина E и CDK2, который далее служит для фиксации решения клетки войти в S-фазу. В результате, когда концентрация сыворотки увеличивается постепенно, большинство клеток млекопитающих реагируют подобно переключателю при входе в S-фазу. Этот стимулируемый митогеном бистабильный переключатель E2F демонстрирует гистерезис, поскольку клетки не могут вернуться в G1 даже после отмены митогена после активации E2F. [8]
Путь EGFR-ERK/MAPK (рецептор эпидермального фактора роста внеклеточно-регулируемая киназа/митоген-активируемая протеинкиназа), стимулируемый EGF, имеет решающее значение для клеточной пролиферации, но временное разделение между сигналом и ответом скрывает связь сигнал-ответ в предыдущих исследованиях. В 2013 году Albeck et al. [9] предоставили ключевые экспериментальные доказательства для заполнения этого пробела в знаниях. Они измерили силу сигнала и динамику с помощью стационарной стимуляции EGF, при которой сигнализация и выход могут быть легко связаны. Они также сопоставили связь сигнал-ответ по всему динамическому диапазону пути. Используя обнаружение фосфорилированного ERK (pERK) с помощью иммунофлуоресценции высокого содержания (HCIF) и биосенсоров FRET живых клеток, они отслеживали нисходящий выход пути ERK как в живых клетках, так и в фиксированных клетках. Чтобы дополнительно связать количественные характеристики сигнализации ERK со скоростью пролиферации, они создали ряд стационарных условий с использованием диапазона концентраций EGF, применяя EGF с различными концентрациями.
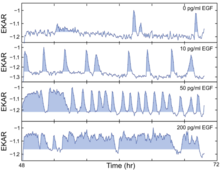
Эксперименты по визуализации отдельных клеток показали, что ERK активируется стохастическими всплесками в присутствии EGF. Кроме того, было показано, что этот путь кодирует силу входных сигналов посредством частотно-модулированных импульсов его активности. Используя биосенсоры FRET живых клеток, клетки, индуцированные различными концентрациями EGF, вызывали всплески незаконной активности разной частоты, где более высокие уровни EGF приводили к более частым всплескам активности ERK. Чтобы выяснить, как на вступление в S-фазу могут влиять спорадические импульсы активности ERK при низких концентрациях EGF, они использовали клетки MCF-10A, коэкспрессирующие EKAR-EV и RFP-geminin, и идентифицировали импульсы активности ERK с помощью оценки, а затем сопоставили эти профили активности ERK со временем индукции GFP-geminin. Они обнаружили, что более длительные периоды активности ERK стимулируют вступление в S-фазу, о чем свидетельствует увеличенная длина импульса. Чтобы понять динамику пути EGFR-ERK, в частности, как модулируется частота и амплитуда, они применили ингибитор EGFR гефитиниб или высокоселективный ингибитор киназы MAPK/ERK (MEK) PD0325901 (PD). Два ингибитора на самом деле дают немного разный результат: гефитиниб в промежуточной концентрации будет вызывать пульсирующее поведение, а также бимодальный сдвиг, который не наблюдается при PD. Они далее объединяют EGF и PD вместе и делают вывод, что частота активности ERK модулируется количественными вариациями, в то время как амплитуда модулируется изменением активности MEK. Наконец, они обратились к Fra-1, одному из нижестоящих эффекторов пути ERK, поскольку технически сложно оценить активность ERK напрямую. Чтобы понять, как интегрированный выход пути ERK (который должен быть независимым ни от частоты, ни от амплитуды) влияет на скорость пролиферации, они использовали комбинацию широкого диапазона концентраций EGF и PD и обнаружили, что на самом деле существует перевернутая «L»-образная криволинейная связь, которая предполагает, что при низких уровнях выхода пути ERK небольшие изменения интенсивности сигнала соответствуют большим изменениям скорости пролиферации, в то время как большие изменения интенсивности сигнала вблизи верхнего предела динамического диапазона оказывают небольшое влияние на пролиферацию. Флуктуация сигнализации ERK подчеркивает потенциальные проблемы с текущими терапевтическими подходами, предоставляя новую перспективу с точки зрения размышлений о нацеливании лекарств на путь ERK при раке.
Недавние эксперименты по визуализации живых клеток в клетках MCF10A и MCF7 показали, что сочетание сигналов митогена через ERK и стрессовых сигналов через активацию p53 в материнских клетках способствует вероятности того, что новообразованные дочерние клетки немедленно вернутся в клеточный цикл или войдут в состояние покоя (G0), предшествующее митозу. [10] В отличие от дочерних клеток, начинающихся без ключевых сигнальных белков после деления, митоген/ERK-индуцированная мРНК циклина D1 и индуцированный повреждением ДНК белок p53, оба долгоживущие факторы в клетках, могут стабильно наследоваться от материнских клеток после деления. Уровни этих регуляторов варьируются от клетки к клетке после митоза, и стехиометрия между ними сильно влияет на приверженность клеточному циклу через активацию Cdk2. Химические пертурбации с использованием ингибиторов ERK сигнализации или индукторов p53 сигнализации в материнских клетках предполагают, что дочерние клетки с высоким уровнем белка p53 и низким уровнем транскриптов Cyclin D1, как было показано, в первую очередь входят в G0, тогда как клетки с высоким уровнем Cyclin D1 и низким уровнем p53, скорее всего, повторно входят в клеточный цикл. Эти результаты иллюстрируют форму закодированной молекулярной памяти через историю митогенной сигнализации через ERK и стрессовой реакции через p53. [11] [12]
Неконтролируемый рост является необходимым шагом для развития всех видов рака. [13] Во многих видах рака (например, меланома ) дефект в пути MAP/ERK приводит к этому неконтролируемому росту. Многие соединения могут ингибировать шаги в пути MAP/ERK, и поэтому являются потенциальными препаратами для лечения рака, [14] [15] [16] [17] [18] например, болезни Ходжкина . [19]
Первым препаратом, лицензированным для действия на этом пути, является сорафениб — ингибитор киназы Raf . Другие ингибиторы Raf включают SB590885, PLX4720, XL281, RAF265, энкорафениб , дабрафениб и вемурафениб . [18]
Некоторые ингибиторы MEK включают кобиметиниб , CI-1040, PD0325901, биниметиниб (MEK162), селуметиниб , [18] и траметиниб (GSK1120212) [20].
Было обнаружено, что акупунктурное прижигание играет роль в облегчении вызванного алкоголем повреждения слизистой оболочки желудка в мышиной модели, что может быть тесно связано с его эффектами в регуляции активности пути передачи сигнала эпидермального фактора роста/ERK. [21]
Путь RAF-ERK также участвует в патофизиологии синдрома Нунан , полимальформирующего заболевания.
Анализ белковых микрочипов может использоваться для обнаружения тонких изменений активности белков в сигнальных путях. [22] Синдромы развития, вызванные мутациями зародышевой линии в генах, которые изменяют компоненты RAS пути передачи сигнала MAP/ERK, называются RASопатиями .
{{cite journal}}: Цитировать журнал требует |journal=( помощь )