
Стероид — это органическое соединение с четырьмя конденсированными кольцами (обозначаемыми A, B, C и D), расположенными в определенной молекулярной конфигурации .
Стероиды имеют две основные биологические функции: как важные компоненты клеточных мембран , которые изменяют текучесть мембран ; и как сигнальные молекулы . Примерами являются липидный холестерин , половые гормоны эстрадиол и тестостерон , [2] : 10–19 анаболические стероиды и противовоспалительный кортикостероидный препарат дексаметазон . [3] Сотни стероидов обнаружены в грибах , растениях и животных . Все стероиды производятся в клетках из стеролов ланостерола ( опистоконты ) или циклоартенола (растения). Ланостерол и циклоартенол получены из циклизации тритерпена сквалена . [4]
Стероиды названы в честь стероидного холестерина [5] , который впервые был описан в желчных камнях, от древнегреческого chole- « желчь » и stereos «твердый». [6] [7] [8]
Стероидное ядро ( структура ядра ) называется гонан (циклопентанопергидрофенантрен). [9] Обычно оно состоит из семнадцати атомов углерода , связанных в четыре конденсированных кольца: три шестичленных циклогексановых кольца (кольца A, B и C на первой иллюстрации) и одно пятичленное циклопентановое кольцо (кольцо D). Стероиды различаются по функциональным группам , присоединенным к этому четырехкольцевому ядру, и по степени окисления колец. Стерины представляют собой формы стероидов с гидроксигруппой в положении три и скелетом, полученным из холестана . [1] : 1785f [10] Стероиды также могут быть более радикально модифицированы, например, путем изменения структуры кольца, например, путем разрезания одного из колец. Разрезание кольца B дает секостероиды, одним из которых является витамин D 3 .


Гонан , также известный как стеран или циклопентанопергидрофенантрен, простейший стероид и ядро всех стероидов и стеролов, [11] [12] состоит из семнадцати атомов углерода в углерод-углеродных связях, образующих четыре конденсированных кольца в трехмерной форме . Три циклогексановых кольца (A, B и C на первой иллюстрации) образуют скелет пергидропроизводного фенантрена . Кольцо D имеет циклопентановую структуру. Когда присутствуют две метильные группы и восемь боковых углеродных цепей (в положении C-17, как показано для холестерина ), говорят, что стероид имеет холестановый каркас. Две общие 5α и 5β стереоизомерные формы стероидов существуют из-за различий в стороне в значительной степени плоской кольцевой системы, где присоединен атом водорода (H) в положении углерода-5, что приводит к изменению конформации стероидного A-кольца. Изомеризация боковой цепи C-21 приводит к образованию параллельного ряда соединений, называемых изостероидами. [13]
Примерами стероидных структур являются:
Помимо разрывов колец (расщеплений), расширений и сокращений (расщепления и повторного замыкания в более крупные или более мелкие кольца) — всех изменений в структуре углерод-углеродных связей — стероиды также могут различаться:
Например, стерины, такие как холестерин и ланостерол, имеют гидроксильную группу , присоединенную в положении C-3, тогда как тестостерон и прогестерон имеют карбонил (оксо-заместитель) в положении C-3. Среди этих соединений только ланостерол имеет две метильные группы в положении C-4. Холестерин, который имеет двойную связь C-5 к C-6, отличается от тестостерона и прогестерона, которые имеют двойную связь C-4 к C-5.
Почти все биологически значимые стероиды могут быть представлены как производные родительской холестериноподобной углеводородной структуры, которая служит скелетом . [ 14] [15] Эти родительские структуры имеют особые названия, такие как прегнан , андростан и т. д. Производные несут различные функциональные группы, называемые суффиксами или префиксами после соответствующих номеров, указывающих на их положение в ядре стероида. [16] Существуют широко используемые тривиальные названия стероидов природного происхождения со значительной биологической активностью, такие как прогестерон , тестостерон или кортизол . Некоторые из этих названий определены в Номенклатуре стероидов. [17] Эти тривиальные названия также могут быть использованы в качестве основы для получения новых названий, однако, путем добавления только префиксов, а не суффиксов, например, стероид 17α-гидроксипрогестерон имеет гидроксильную группу (-ОН) в положении 17 стероидного ядра по сравнению с прогестероном.
Буквы α и β [18] обозначают абсолютную стереохимию в хиральных центрах — специфическую номенклатуру, отличную от конвенции R/S [19] органической химии для обозначения абсолютной конфигурации функциональных групп, известную как правила приоритета Кана–Ингольда–Прелога . Конвенция R/S назначает приоритеты заместителям в хиральном центре на основе их атомного номера. Группа с наивысшим приоритетом назначается атому с наивысшим атомным номером, а группа с наименьшим приоритетом назначается атому с наименьшим атомным номером. Затем молекула ориентируется таким образом, чтобы группа с наименьшим приоритетом была направлена от наблюдателя, а оставшиеся три группы располагаются в порядке убывания приоритета вокруг хирального центра. Если это расположение по часовой стрелке, ему назначается конфигурация R; если против часовой стрелки, ему назначается конфигурация S. [20] Напротив, в номенклатуре стероидов используются α и β для обозначения стереохимии в хиральных центрах. Обозначения α и β основаны на ориентации заместителей относительно друг друга в определенной кольцевой системе. В общем, α относится к заместителю, который ориентирован к плоскости кольцевой системы, тогда как β относится к заместителю, который ориентирован от плоскости кольцевой системы. В стероидах, изображенных со стандартной перспективы, используемой в этой статье, α-связи изображены на рисунках как пунктирные клинья, а β-связи как сплошные клинья. [14]
Название « 11-дезоксикортизол » является примером производного названия, которое использует кортизол в качестве родительской структуры без атома кислорода (отсюда «дезокси»), присоединенного к позиции 11 (как часть гидроксильной группы). [14] [21] Нумерация позиций атомов углерода в ядре стероида установлена в шаблоне, найденном в Номенклатуре стероидов [22], который используется независимо от того, присутствует ли атом в рассматриваемом стероиде. [14]
Ненасыщенные атомы углерода (как правило, те, которые являются частью двойной связи) в стероидном ядре обозначаются путем изменения -ан на -ен. [23] Это изменение традиционно делалось в родительском названии, с добавлением префикса для обозначения положения, с или без Δ (греческая заглавная дельта), который обозначает ненасыщенность, например, 4-прегнен-11β,17α-диол-3,20-дион (также Δ 4 -прегнен-11β,17α-диол-3,20-дион) или 4-андростен-3,11,17-трион (также Δ 4 -андростен-3,11,17-трион). Однако Номенклатура стероидов рекомендует, чтобы место двойной связи всегда было рядом со слогом, обозначающим ненасыщенность, поэтому, используя его как суффикс, а не префикс, и без использования символа Δ, т. е. прегн-4-ен-11β,17α-диол-3,20-дион или андрост-4-ен-3,11,17-трион . Двойная связь обозначается атомом углерода с меньшим номером, т. е. «Δ 4 -» или «4-ен» означает двойную связь между положениями 4 и 5. Насыщение углеродами исходного стероида может быть выполнено путем добавления префикса «дигидро-», [24] т. е. насыщение углеродами 4 и 5 тестостерона двумя атомами водорода составляет 4,5α-дигидротестостерон или 4,5β-дигидротестостерон. Обычно, когда нет двусмысленности, один номер позиции водорода из стероида с насыщенной связью может быть опущен, оставляя только позицию второго атома водорода, например, 5α-дигидротестостерон или 5β-дигидротестостерон . Δ 5 -стероиды - это те, у которых двойная связь между атомами углерода 5 и 6, а Δ 4 -стероиды - это те, у которых двойная связь между атомами углерода 4 и 5. [25] [23]
Сокращения, такие как « P4 » для прогестерона и « A4 » для андростендиона , относятся к Δ4 - стероидам, тогда как « P5 » для прегненолона и « A5 » для андростендиола относятся к Δ5 - стероидам. [14]
Суффикс -ол обозначает гидроксигруппу , а суффикс -он обозначает оксогруппу. Когда к базовой структуре в разных положениях присоединены две или три идентичные группы, суффикс обозначается как -диол или -триол для гидрокси, и -дион или -трион для оксогрупп соответственно. Например, 5α-прегнан-3α,17α-диол-20-он имеет атом водорода в положении 5α (отсюда префикс "5α-"), две гидроксигруппы (-ОН) в положениях 3α и 17α (отсюда суффикс "3α,17α-диол") и оксогруппу (=O) в положении 20 (отсюда суффикс "20-он"). Однако можно обнаружить ошибочное использование суффиксов, например, «5α-прегнан-17α-диол-3,11,20-трион» [26] [ sic ] — поскольку он имеет только одну гидроксильную группу (в положении 17α), а не две, то суффикс должен быть -ол, а не -диол, так что правильное название будет «5α-прегнан-17α-ол-3,11,20-трион».
Согласно правилу, установленному в Номенклатуре стероидов, терминальная «e» в названии родительской структуры должна быть опущена перед гласной (наличие или отсутствие числа не влияет на такую элиминацию). [14] [16] Это означает, например, что если суффикс, непосредственно добавленный к названию родительской структуры, начинается с гласной, то конечная «e» удаляется из этого названия. Примером такого удаления является « 5α-pregnan-17α-ol-3,20-dione », где последняя «e» в « pregnane » опущена из-за гласной («o») в начале суффикса -ol. Некоторые авторы неправильно используют это правило, опуская терминальную «e» там, где она должна быть сохранена, или наоборот. [27]
Термин «11-оксигенированный» относится к присутствию атома кислорода в качестве оксо (=O) или гидрокси (-OH) заместителя у углерода 11. «Оксигенированный» последовательно используется в химии стероидов [28] с 1950-х годов. [29] Некоторые исследования используют термин «11-оксиандрогены» [30] [31] как сокращение для 11-оксигенированных андрогенов, чтобы подчеркнуть, что все они имеют атом кислорода, присоединенный к углероду в положении 11. [32] [33] Однако в химической номенклатуре префикс «окси» ассоциируется с эфирными функциональными группами, т. е. соединением с атомом кислорода, присоединенным к двум алкильным или арильным группам (ROR), [34] поэтому использование «окси» в названии класса стероидов может вводить в заблуждение. Можно найти четкие примеры «оксигенированных» для обозначения широкого класса органических молекул, содержащих различные кислородсодержащие функциональные группы, в других областях органической химии [35] , и уместно использовать это соглашение. [14]
Несмотря на то, что «кето» является стандартным префиксом в органической химии, рекомендации Объединенной комиссии по биохимической номенклатуре 1989 года не одобряют использование префикса «кето» для названий стероидов и отдают предпочтение префиксу «оксо» (например, 11-оксостероиды, а не 11-кетостероиды), поскольку «кето» включает углерод, который является частью стероидного ядра, и один и тот же атом углерода не должен указываться дважды. [36] [14]
Стероиды обнаружены во всех областях жизни, включая бактерии , археи и эукариоты . У эукариот стероиды обнаружены в грибах, растениях и животных. [37] [38]
Эукариотические клетки, к которым относятся животные, растения, грибы и простейшие, имеют сложную клеточную структуру с настоящим ядром и связанными с мембраной органеллами. [39]
Стероиды являются неотъемлемой частью эукариотических клеточных мембран, где они помогают поддерживать целостность и функционирование мембран. [40]
Во время эукариогенеза (появление современных эукариотических клеток) стероиды, вероятно, сыграли роль в приобретении митохондрий посредством эндоцитоза. [41]
У прокариот существуют биосинтетические пути для тетрациклического стероидного каркаса (например, у миксобактерий ) [42] – где предполагается его происхождение от эукариот [43] – и более распространенного пентациклического тритерпиноидного гопаноидного каркаса. [44]
Грибковые стероиды включают эргостеролы , которые участвуют в поддержании целостности клеточной мембраны грибка. Различные противогрибковые препараты , такие как амфотерицин B и азольные противогрибковые препараты , используют эту информацию для уничтожения патогенных грибков. [45] Грибы могут изменять содержание своего эргостерола (например, через мутации потери функции в ферментах ERG3 или ERG6 , вызывающие истощение эргостерола, или мутации, которые уменьшают содержание эргостерола) для развития устойчивости к препаратам, которые нацелены на эргостерол. [46]
Эргостерол аналогичен холестерину, обнаруженному в клеточных мембранах животных (включая людей), или фитостеролам, обнаруженным в клеточных мембранах растений. [46] Все грибы содержат большое количество эргостерола, в диапазоне от десятков до сотен миллиграммов на 100 граммов сухого веса. [46] Кислород необходим для синтеза эргостерола в грибах. [46]
Эргостерол отвечает за содержание витамина D , обнаруженного в грибах; эргостерол химически преобразуется в провитамин D2 под воздействием ультрафиолетового света . [46] Провитамин D2 спонтанно образует витамин D2. [46] Однако не все грибы используют эргостерол в своих клеточных мембранах; например, патогенный вид грибка Pneumocystis jirovecii этого не делает, что имеет важные клинические последствия (учитывая механизм действия многих противогрибковых препаратов). Используя грибок Saccharomyces cerevisiae в качестве примера, другие основные стероиды включают эргоста-5,7,22,24(28)-тетраен-3β-ол, зимостерол и ланостерол . S. cerevisiae использует 5,6-дигидроэргостерол вместо эргостерола в своей клеточной мембране. [46]
Растительные стероиды включают стероидные алкалоиды , обнаруженные в растениях семейства пасленовых [47] и мелантиевых (особенно в роде чемерицы ), [48] сердечные гликозиды , [49] фитостерины и брассиностероиды (включающие несколько растительных гормонов).
Животные стероиды включают соединения позвоночных и насекомых , последние включают экдистероиды , такие как экдистерон (контролирующий линьку у некоторых видов). Примеры позвоночных включают стероидные гормоны и холестерин; последний является структурным компонентом клеточных мембран , который помогает определять текучесть клеточных мембран и является основным компонентом бляшек (участвующих в атеросклерозе ). Стероидные гормоны включают:
Основные классы стероидных гормонов с основными представителями и примерами связанных функций: [50] [51]
Дополнительные классы стероидов включают:
А также следующий класс секостероидов (стероидов с открытым кольцом):
Стероиды можно классифицировать на основе их химического состава. [52] Один из примеров того, как MeSH выполняет эту классификацию, доступен в каталоге MeSH Википедии. Примеры этой классификации включают:

В биологии принято называть вышеуказанные классы стероидов по числу присутствующих атомов углерода, когда речь идет о гормонах: C18 - стероиды для эстранов (в основном эстрогенов), C19 - стероиды для андростанов (в основном андрогенов) и C21 - стероиды для прегнанов (в основном кортикостероидов). [53] Классификация « 17-кетостероиды » также важна в медицине.
Гонан (стероидное ядро) представляет собой исходную молекулу тетрациклического углеводорода с 17 атомами углерода без алкильных боковых цепей. [54]
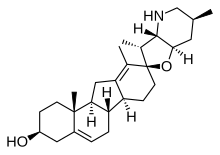
Секостероиды (лат. seco , «резать») — подкласс стероидных соединений, образующихся, биосинтетически или концептуально, в результате расщепления (расщепления) родительских стероидных колец (обычно одного из четырех). Основные подклассы секостероидов определяются атомами углерода стероидов, где произошло это расщепление. Например, прототипический секостероид холекальциферол , витамин D3 ( показан), относится к подклассу 9,10-секостероидов и происходит от расщепления атомов углерода C-9 и C-10 стероидного B-кольца; 5,6-секостероиды и 13,14-стероиды похожи. [55]
Норстероиды ( nor- , L. norma ; «нормальный» в химии, указывает на удаление углерода) [56] и гомостероиды (homo-, греч. homos ; «то же самое», указывает на добавление углерода) являются структурными подклассами стероидов, образованных в результате биосинтетических стадий. Первый включает ферментативные реакции расширения-сокращения кольца , а последний осуществляется ( биомиметически ) или (чаще) через замыкания колец ациклических предшественников с большим (или меньшим) количеством атомов кольца, чем в исходной стероидной структуре. [57]
Комбинации этих изменений колец известны в природе. Например, овцы , которые пасутся на кукурузной лилии, потребляют циклопамин (показано) и вератрамин , два из подсемейства стероидов, где C- и D-кольца сокращаются и расширяются соответственно посредством биосинтетической миграции исходного атома C-13. Потребление этих C-nor-D-гомостероидов приводит к врожденным дефектам у ягнят: циклопия от циклопамина и деформация ног от вератрамина. [58] Еще один C-nor-D-гомостероид (накитерпиозин) выделяется окинавскими цианобактериальными губками , например, Terpios hoshinota , что приводит к гибели кораллов от болезни черных кораллов. [59] Стероиды типа накитерпиозина активны против сигнального пути, включающего белки smoothened и hedgehog , путь, который является гиперактивным при ряде видов рака. [ необходима ссылка ]
Стероиды и их метаболиты часто функционируют как сигнальные молекулы (наиболее яркими примерами являются стероидные гормоны), а стероиды и фосфолипиды являются компонентами клеточных мембран . [60] Стероиды, такие как холестерин, снижают текучесть мембран . [61] Подобно липидам , стероиды являются высококонцентрированными запасами энергии. Однако они обычно не являются источниками энергии; у млекопитающих они обычно метаболизируются и выводятся.
Стероиды играют важную роль в ряде заболеваний, включая злокачественные новообразования, такие как рак предстательной железы , при котором выработка стероидов внутри и снаружи опухоли способствует агрессивности раковых клеток. [62]

Сотни стероидов, обнаруженных в животных, грибах и растениях, производятся из ланостерола (у животных и грибов; см. примеры выше) или циклоартенола (у других эукариот). И ланостерол, и циклоартенол происходят от циклизации тритерпеноида сквалена . [ 4 ] Ланостерол и циклоартенол иногда называют протостеролами , поскольку они служат исходными соединениями для всех других стероидов.
Биосинтез стероидов — это анаболический путь, который производит стероиды из простых предшественников. Уникальный биосинтетический путь наблюдается у животных (по сравнению со многими другими организмами ), что делает этот путь общей целью для антибиотиков и других противоинфекционных препаратов. Метаболизм стероидов у людей также является целью для препаратов, снижающих уровень холестерина, таких как статины . У людей и других животных биосинтез стероидов следует мевалонатному пути, который использует ацетил-КоА в качестве строительных блоков для диметилаллилдифосфата (DMAPP) и изопентенилдифосфата (IPP). [63] [ нужен лучший источник ]
На последующих этапах DMAPP и IPP конъюгируют, образуя фарнезилдифосфат (FPP), который далее конъюгирует друг с другом, образуя линейный тритерпеноид сквален. Биосинтез сквалена катализируется скваленсинтазой , которая принадлежит к семейству сквален/фитоенсинтаз . Последующее эпоксидирование и циклизация сквалена генерируют ланостерол, который является отправной точкой для дополнительных модификаций в другие стероиды (стероидогенез). [64] У других эукариот продуктом циклизации эпоксидированного сквалена (оксидосквалена) является циклоартенол.

Мевалонатный путь (также называемый путем ГМГ-КоА-редуктазы) начинается с ацетил-КоА и заканчивается диметилаллилдифосфатом (ДМАПФ) и изопентенилдифосфатом (ИПП).
DMAPP и IPP отдают изопреновые единицы, которые собираются и модифицируются для образования терпенов и изопреноидов [65] (большой класс липидов, которые включают каротиноиды и образуют самый большой класс растительных натуральных продуктов ). [66] Здесь активированные изопреновые единицы соединяются для получения сквалена и складываются в набор колец для получения ланостерола . [67] Затем ланостерол может быть преобразован в другие стероиды, такие как холестерин и эргостерол . [67] [68]
Два класса препаратов нацелены на мевалонатный путь : статины (например, розувастатин ), которые используются для снижения повышенного уровня холестерина , [69] и бисфосфонаты (например, золедронат ), которые используются для лечения ряда костно-дегенеративных заболеваний. [70]

Стероидогенез — это биологический процесс, посредством которого стероиды генерируются из холестерина и превращаются в другие стероиды. [72] Пути стероидогенеза различаются у разных видов. Основные классы стероидных гормонов, как отмечено выше (с их основными членами и функциями), — это прогестагены , кортикостероиды (кортикоиды), андрогены и эстрогены . [25] [73] У человека стероидогенез этих классов происходит в ряде мест:
У растений и бактерий немевалонатный путь (путь MEP) использует пируват и глицеральдегид-3-фосфат в качестве субстратов для производства IPP и DMAPP. [65] [78]
Во время болезней могут использоваться пути, которые в противном случае не были бы значимы у здоровых людей. Например, при одной из форм врожденной гиперплазии надпочечников дефицит ферментативного пути 21-гидроксилазы приводит к избытку 17α-гидроксипрогестерона (17-OHP) – этот патологический избыток 17-OHP в свою очередь может быть преобразован в дигидротестостерон (DHT, мощный андроген) посредством, среди прочего, 17,20-лиазы (члена семейства ферментов цитохрома P450 ), 5α-редуктазы и 3α-гидроксистероиддегидрогеназы . [79]
Стероиды в основном окисляются ферментами оксидазы цитохрома P450 , такими как CYP3A4 . Эти реакции вводят кислород в стероидное кольцо, позволяя другим ферментам расщеплять холестерин на желчные кислоты. [80] Затем эти кислоты могут быть устранены путем секреции из печени в желчь . [81] Экспрессия гена оксидазы может быть повышена сенсором стероидов PXR , когда в крови высокая концентрация стероидов. [82] Стероидные гормоны, лишенные боковой цепи холестерина и желчных кислот, обычно гидроксилируются в различных положениях кольца или окисляются в положении 17 , конъюгируются с сульфатом или глюкуроновой кислотой и выводятся с мочой. [83]
Изоляция стероидов , в зависимости от контекста, представляет собой изоляцию химического вещества, необходимого для выяснения химической структуры , дериватизации или химии деградации, биологических испытаний и других исследовательских нужд (обычно от миллиграммов до граммов, но часто больше [84] или изоляцию «аналитических количеств» интересующего вещества (где основное внимание уделяется идентификации и количественной оценке вещества (например, в биологической ткани или жидкости). Выделенное количество зависит от аналитического метода, но обычно составляет менее одного микрограмма. [85] [ нужна страница ]
Методы изоляции для достижения двух масштабов продукта различны, но включают экстракцию , осаждение, адсорбцию , хроматографию и кристаллизацию . В обоих случаях изолированное вещество очищается до химической однородности; комбинированные методы разделения и анализа, такие как ЖХ-МС , выбираются так, чтобы быть «ортогональными» — достигая их разделения на основе различных режимов взаимодействия между веществом и изолирующей матрицей — для обнаружения одного вида в чистом образце.
Определение структуры относится к методам определения химической структуры изолированного чистого стероида с использованием развивающегося набора химических и физических методов, которые включают ЯМР и кристаллографию малых молекул . [2] : 10–19 Методы анализа перекрывают обе вышеуказанные области, подчеркивая аналитические методы определения наличия стероида в смеси и определения его количества. [85]
Микробный катаболизм боковых цепей фитостеролов дает стероиды C-19, стероиды C - 22 и 17-кетостероиды (т. е. предшественники гормонов коры надпочечников и контрацептивов ) . [86] [87] [88] Добавление и модификация функциональных групп являются ключевыми при производстве широкого спектра лекарственных средств, доступных в рамках этой химической классификации. Эти модификации выполняются с использованием традиционных методов органического синтеза и/или биотрансформации . [89] [90]
Полусинтез стероидов часто начинается с предшественников, таких как холестерин , [88] фитостерины , [87] или сапогенины . [91] Усилия Syntex , компании, занимающейся торговлей мексиканским барбаско , использовали Dioscorea mexicana для производства сапогенина диосгенина на заре фармацевтической промышленности синтетических стероидов . [84]
Некоторые стероидные гормоны экономически выгодно получать только путем полного синтеза из нефтехимических продуктов (например, 13 - алкилстероиды ). [88] Например, фармацевтический норгестрел начинается с метокси - 1-тетралона , нефтехимического продукта, полученного из фенола .
За исследования стероидов был присужден ряд Нобелевских премий , в том числе:
«Je nommerai cholesterine , de χολη, желчь, et στερεος, Solide, la вещество cristallisée des Calculs biliares humanes,...» (назову холестерин – от χολη (желчь) и στερεος (твердое) – кристаллизованное вещество из желчных камней человека ... )
Основу структуры стероида составляет стерановое ядро, полициклический стерановый скелет C17, состоящий из трех конденсированных циклогексановых колец в нелинейном или фенантреновом соединении (A, B и C), и циклопентановое кольцо (D)1,2.[ постоянная мертвая ссылка ]
3S‐1.0. Определение стероидов и стеролов. Стероиды — это соединения, обладающие скелетом циклопента[a]фенантрена или скелетом, полученным из него путем одного или нескольких разрывов связей или расширений или сокращений колец. Метильные группы обычно присутствуют в положениях C-10 и C-13. Алкильная боковая цепь может также присутствовать в положении C-17. Стерины — это стероиды, содержащие гидроксильную группу в положении С-3 и большую часть скелета холестана.
3S-4. ФУНКЦИОНАЛЬНЫЕ ГРУППЫ. 3S-4.0. Общие сведения. Почти все биологически важные стероиды являются производными исходных углеводородов (см. Таблицу 1), несущих различные функциональные группы. [...] Суффиксы добавляются к названию насыщенной или ненасыщенной материнской системы (см. 33-2.5), при этом конечная e в -ane, -ene, -yne, -adiene и т. д. опускается перед гласной (наличие или отсутствие цифр не влияет на такие опущения).
3S‐4.9. Тривиальные названия важных стероидов Примеры тривиальных названий, сохраненных для важных производных стероидов, которые в основном являются природными соединениями со значительной биологической активностью, приведены в Таблице 2.
3S‐1.4. Ориентация проекционных формул. Когда кольца стероида обозначены как проекции на плоскость бумаги, формула обычно должна быть ориентирована как в 2a. Атом или группа, присоединенная к кольцу, изображенному в ориентации 2а, называется α (альфа), если он лежит ниже плоскости бумаги, или β (бета), если он лежит выше плоскости бумаги.
P‐91.2.1.1 Стереодескрипторы Кана-Ингольда-Прелога (CIP). Некоторые стереодескрипторы, описанные в системе приоритетов Кана-Ингольда-Прелога (CIP), называемые «стереодескрипторами CIP», рекомендуются для указания конфигурации органических соединений, как описано и проиллюстрировано в этой Главе и применено в Главах P‐1 по P‐8, и в номенклатуре природных продуктов в Главе P-10. Следующие стереодескрипторы используются в качестве предпочтительных стереодескрипторов (см. P‐92.1.2): (a) «R» и «S» для обозначения абсолютной конфигурации тетракоординированных (квадрилигантных) центров хиральности;
P‐13.8.1.1 Префикс «de» (не «des»), за которым следует название группы или атома (кроме водорода), обозначает удаление (или потерю) этой группы и добавление необходимых атомов водорода, т. е. обмен этой группы с атомами водорода. В качестве исключения «дезокси» при применении к гидроксисоединениям обозначает удаление атома кислорода из группы –ОН с повторным присоединением атома водорода. «Дезокси» широко используется как субтрактивный префикс в номенклатуре углеводов (см. P‐102.5.3).
3S-1.1. Нумерация и кольцевые буквы. Стероиды нумеруются, а кольца обозначаются буквами, как в формуле 1
3S-2.5 Ненасыщенность. Ненасыщенность обозначается заменой -ан на -ен, -адиен, -ин и т. д., или -ан- на -ен-, -адиен-, -ин- и т. д. Примеры: андрост-5-ен, а не 5-андростен; 5α-холест-6-ен; 5β-холеста-7,9(11)-диен; 5α-холест-6-ен-3β-ол. Примечания. 1) В настоящее время рекомендуется, чтобы место двойной связи всегда было рядом со слогом, обозначающим ненасыщенность.[...] 3) Использование символа Δ (греческая заглавная дельта) не рекомендуется для обозначения ненасыщенности в индивидуальных названиях. Однако его можно использовать в общих терминах, например, «Δ
5
-стероиды».
P-31.2.2 Общая методология. Префиксы «гидро» и «дегидро» связаны с гидрогенизацией и дегидрогенизацией, соответственно, двойной связи; таким образом, умножающие префиксы четных значений, как «ди», «тетра» и т. д., используются для указания насыщенности двойной связи(ей), например, «дигидро», «тетрагидро»; или создания двойных (или тройных) связей, как «дидегидро» и т. д. В названиях они размещаются непосредственно перед названием родительского гидрида и перед любыми неотделяемыми префиксами. Указанные атомы водорода имеют приоритет над префиксами «гидро» для низких локантов. Если указанные атомы водорода присутствуют в названии, префиксы «гидро» предшествуют им.
окси* –О– P-15.3.1.2.1.1; P-63.2.2.1.1
Префикс оксо- следует также использовать в связи с общими терминами, например, 17-оксостероиды. Термин «17-кетостероиды», часто используемый в медицинской литературе, неверен, поскольку C-17 указан дважды, так как термин кето обозначает C=O
{{cite web}}: CS1 maint: bot: original URL status unknown (link)