Тучные клетки (также известные как мастоциты или лаброциты [1] ) — это резидентные клетки соединительной ткани, содержащие множество гранул, богатых гистамином и гепарином . В частности, это тип гранулоцитов, полученных из миелоидных стволовых клеток , которые являются частью иммунной и нейроиммунной систем. Тучные клетки были открыты Полом Эрлихом в 1877 году. [2] Хотя они наиболее известны своей ролью в аллергии и анафилаксии , тучные клетки также играют важную защитную роль, будучи тесно вовлеченными в заживление ран, ангиогенез , иммунную толерантность , защиту от патогенов и проницаемость сосудов в опухолях головного мозга. [3] [4]
Тучные клетки очень похожи по внешнему виду и функциям на базофилы , другой тип белых кровяных клеток . Хотя тучные клетки когда-то считались базофилами, живущими в тканях, было показано, что эти две клетки развиваются из разных кроветворных линий и, таким образом, не могут быть одними и теми же клетками. [5]

Тучные клетки очень похожи на базофильные гранулоциты (класс белых кровяных клеток ) в крови , в том смысле, что оба являются гранулированными клетками , которые содержат гистамин и гепарин , антикоагулянт . Их ядра отличаются тем, что ядро базофила дольчатое, а ядро тучных клеток круглое. Fc-область иммуноглобулина E (IgE) связывается с тучными клетками и базофилами, и когда паратопы IgE связываются с антигеном, это заставляет клетки высвобождать гистамин и другие воспалительные медиаторы. [6] Эти сходства заставили многих предположить, что тучные клетки являются базофилами, которые «оседлали» ткани. Кроме того, у них есть общий предшественник в костном мозге, экспрессирующий молекулу CD34 . Базофилы покидают костный мозг уже зрелыми, тогда как тучные клетки циркулируют в незрелой форме, созревая только один раз в участке ткани. Место, в котором оседает незрелая тучная клетка, вероятно, определяет ее точные характеристики. [7] Первая in vitro дифференциация и рост чистой популяции тучных клеток мыши были проведены с использованием кондиционированной среды, полученной из спленоцитов, стимулированных конканавалином А. [8] Позднее было обнаружено, что интерлейкин 3 , полученный из Т-клеток, был компонентом, присутствующим в кондиционированной среде, который был необходим для дифференциации и роста тучных клеток. [9]
Тучные клетки у грызунов классически делятся на два подтипа: тучные клетки соединительнотканного типа и тучные клетки слизистой оболочки . Активность последних зависит от Т-клеток . [10]
Тучные клетки присутствуют в большинстве тканей, обычно окружающих кровеносные сосуды, нервы и лимфатические сосуды [11] , и особенно заметны вблизи границ между внешним миром и внутренней средой, например, в коже , слизистой оболочке легких и пищеварительном тракте , а также во рту , конъюнктиве и носу [7] .

Тучные клетки играют ключевую роль в воспалительном процессе. При активации тучная клетка может либо выборочно высвобождать ( постепенная дегрануляция ), либо быстро высвобождать ( анафилактическая дегрануляция ) «медиаторы» или соединения, которые вызывают воспаление, из гранул хранения в местную микросреду. [3] [12] Тучные клетки могут быть стимулированы к дегрануляции аллергенами через перекрестное связывание с рецепторами иммуноглобулина E ( например , FcεRI ) , физическим повреждением через рецепторы распознавания образов для молекулярных паттернов, ассоциированных с повреждением (DAMP), микробными патогенами через рецепторы распознавания образов для молекулярных паттернов, ассоциированных с патогеном (PAMP), и различными соединениями через связанные с ними рецепторы, сопряженные с G-белком (например, морфин через опиоидные рецепторы ) или лиганд-управляемые ионные каналы . [3] [12] Белки комплемента могут активировать мембранные рецепторы на тучных клетках, чтобы также выполнять различные функции. [7]
Тучные клетки экспрессируют высокоаффинный рецептор ( FcεRI ) для Fc-области IgE, наименее распространенного члена антител. Этот рецептор имеет настолько высокое сродство, что связывание молекул IgE по сути необратимо. В результате тучные клетки покрываются IgE, который вырабатывается плазматическими клетками (антителопродуцирующими клетками иммунной системы). Антитела IgE обычно специфичны к одному конкретному антигену .
При аллергических реакциях тучные клетки остаются неактивными до тех пор, пока аллерген не свяжется с IgE, уже покрытым на клетке. Другие события активации мембраны могут либо подготовить тучные клетки к последующей дегрануляции, либо действовать в синергии с передачей сигнала FcεRI. [13] В целом, аллергены представляют собой белки или полисахариды . Аллерген связывается с антигенсвязывающими участками, которые расположены на вариабельных участках молекул IgE, связанных с поверхностью тучных клеток. По-видимому, для активации тучных клеток требуется связывание двух или более молекул IgE (сшивание). Кластеризация внутриклеточных доменов связанных с клеткой Fc-рецепторов, которые связаны со сшитыми молекулами IgE, вызывает сложную последовательность реакций внутри тучных клеток, которые приводят к их активации. Хотя эта реакция наиболее хорошо изучена с точки зрения аллергии, по-видимому, она развилась как система защиты от паразитов и бактерий. [14]
Уникальный, специфичный для стимула набор медиаторов тучных клеток высвобождается посредством дегрануляции после активации рецепторов клеточной поверхности на тучных клетках. [12] Примеры медиаторов, которые высвобождаются во внеклеточную среду во время дегрануляции тучных клеток, включают: [7] [12] [15]
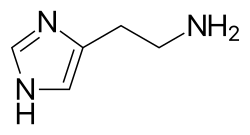
Гистамин расширяет посткапиллярные венулы, активирует эндотелий и увеличивает проницаемость кровеносных сосудов. Это приводит к локальному отеку (опуханию), теплу, покраснению и привлечению других воспалительных клеток к месту высвобождения. Он также деполяризует нервные окончания (что приводит к зуду или боли ). Кожные признаки высвобождения гистамина — это реакция «вспышка и волдырь ». Шишка и покраснение сразу после укуса комара являются хорошим примером этой реакции, которая возникает через несколько секунд после воздействия аллергена на тучную клетку. [7]
Другие физиологические активности тучных клеток изучены гораздо меньше. Несколько линий доказательств предполагают, что тучные клетки могут играть довольно фундаментальную роль во врожденном иммунитете : они способны вырабатывать широкий спектр важных цитокинов и других воспалительных медиаторов, таких как TNF-α; они экспрессируют множество «рецепторов распознавания образов», которые, как считается, участвуют в распознавании широких классов патогенов; и мыши без тучных клеток, по-видимому, гораздо более восприимчивы к различным инфекциям. [ необходима цитата ]
Гранулы тучных клеток несут в себе множество биоактивных химических веществ. Было обнаружено, что эти гранулы переносятся в соседние клетки иммунной системы и нейроны в процессе трансгрануляции через псевдоподии тучных клеток . [16]
В отличие от других кроветворных клеток иммунной системы , тучные клетки естественным образом встречаются в мозге человека , где они взаимодействуют с нейроиммунной системой . [4] В мозге тучные клетки расположены в ряде структур, которые опосредуют висцеральные сенсорные (например, боль) или нейроэндокринные функции или которые расположены вдоль барьера кровь-спинномозговая жидкость , включая стебель гипофиза , шишковидную железу , таламус и гипоталамус , area postrema , сосудистое сплетение и в дуральном слое мозговых оболочек вблизи менингеальных ноцицепторов . [4] Тучные клетки выполняют те же общие функции в организме и центральной нервной системе, такие как воздействие или регулирование аллергических реакций, врожденного и адаптивного иммунитета, аутоиммунитета и воспаления. [4] [17] Во всех системах тучные клетки служат в качестве основных эффекторных клеток , через которые патогены могут влиять на ось кишечник-мозг . [18] [19]
В желудочно-кишечном тракте тучные клетки слизистой оболочки расположены в непосредственной близости от чувствительных нервных волокон, которые взаимодействуют двунаправленно. [20] [18] [19] Когда эти тучные клетки изначально дегранулируются, они высвобождают медиаторы (например, гистамин, триптазу и серотонин), которые активируют, сенсибилизируют и повышают экспрессию мембранных ноцицепторов (например, TRPV1 ) на висцеральных афферентных нейронах через их рецепторы (соответственно, HRH1 , HRH2 , HRH3 , PAR2 , 5-HT3 ); [20] в свою очередь , возникают нейрогенное воспаление, висцеральная гиперчувствительность и нарушение моторики кишечника (например, нарушение перистальтики ). [20] Активация нейронов вызывает нейропептидную ( субстанция P и пептид, связанный с геном кальцитонина ) передачу сигналов тучным клеткам, где они связываются со своими рецепторами и запускают дегрануляцию определенного набора медиаторов ( β-гексозаминидаза , цитокины , хемокины , PGD2 , лейкотриены и эоксины ). [20] [12]

FcεR1 — это высокоаффинный IgE-рецептор, который экспрессируется на поверхности тучной клетки. FcεR1 — это тетрамер, состоящий из одной альфа-цепи (α), одной бета-цепи (β) и двух идентичных, связанных дисульфидными связями гамма-цепей (γ). Сайт связывания для IgE образован внеклеточной частью α-цепи, которая содержит два домена, похожих на Ig. Один трансмембранный домен содержит остаток аспарагиновой кислоты , а другой — короткий цитоплазматический хвост. [21] β-цепь содержит один иммунорецепторный мотив активации ITAM на основе тирозина в цитоплазматической области. Каждая γ-цепь имеет один ITAM в цитоплазматической области. Сигнальный каскад от рецептора инициируется, когда ITAM β- и γ-цепей фосфорилируются тирозинкиназой. Этот сигнал необходим для активации тучных клеток. [22] Клетки-помощники Т типа 2 ( Th2 ) и многие другие типы клеток лишены β-цепи, поэтому сигнализация опосредуется только γ-цепью. Это связано с тем, что α-цепь содержит сигналы удержания эндоплазматического ретикулума, что заставляет α-цепи оставаться деградированными в ER. Сборка α-цепи с ко-трансфицированными β- и γ-цепями маскирует удержание ER и позволяет комплексу α β γ экспортироваться в аппарат Гольджи к плазматической мембране у крыс. У людей для уравновешивания удержания α-цепи в ER необходим только γ-комплекс. [21]
Сигналы перекрестной сшивки FcεR1, опосредованные аллергеном, очень похожи на сигнальное событие, приводящее к связыванию антигена с лимфоцитами . Тирозинкиназа Lyn связана с цитоплазматическим концом β-цепи FcεR1. Антиген перекрестно связывает молекулы FcεR1, а тирозинкиназа Lyn фосфорилирует ITAM в β- и γ-цепи FcεR1 в цитоплазме. После фосфорилирования тирозинкиназа Syk присоединяется к ITAM, расположенным на γ-цепях. Это вызывает активацию тирозинкиназы Syk, заставляя ее фосфорилироваться. [22] Syk функционирует как сигнал, усиливающий активность киназы, из-за того, что он нацелен на несколько белков и вызывает их активацию. [23] Это стимулированное антигеном фосфорилирование вызывает активацию других белков в каскаде сигнализации, опосредованном FcεR1. [24]
Важным адаптерным белком, активируемым на этапе фосфорилирования Syk, является линкер для активации Т-клеток (LAT). LAT может быть модифицирован путем фосфорилирования для создания новых участков связывания. [23] Фосфолипаза C гамма (PLCγ) становится фосфорилированной после связывания с LAT, а затем используется для катализа распада фосфатидилинозитолбисфосфата с образованием инозитолтрифосфата (IP3) и диациглицерина (DAG). IP3 повышает уровень кальция, а DAG активирует протеинкиназу C (PKC). Это не единственный способ создания PKC. Тирозинкиназа FYN фосфорилирует Grb2-ассоциированный-связывающий белок 2 (Gab2), который связывается с фосфоинозитид-3-киназой , которая активирует PKC. PKC приводит к активации движения гранул фосфорилирования легкой цепи миозина, что разбирает комплексы актин-миозин, позволяя гранулам вступать в контакт с плазматической мембраной. [22] Теперь гранула тучной клетки может сливаться с плазматической мембраной. Растворимый комплекс рецептора белка прикрепления слияния, чувствительный к N-этилмалеимиду SNARE, опосредует этот процесс. Различные белки SNARE взаимодействуют, образуя различные комплексы, которые катализируют слияние. Гуанозинтрифосфатазы Rab3 и ассоциированные с Rab киназы и фосфатазы регулируют слияние мембран гранул в покоящихся тучных клетках.
Рецептор тучных клеток человека, связанный с G-белком MRGPRX2, играет ключевую роль в распознавании патоген-ассоциированных молекулярных паттернов (PAMP) и инициировании антибактериального ответа. MRGPRX2 способен связываться с пептидом, стимулирующим компетентность (CSP) 1 — молекулой, чувствительной к кворуму (QSM), продуцируемой грамположительными бактериями. [25] Это приводит к передаче сигнала на G-белок и активации тучных клеток. Активация тучных клеток вызывает высвобождение антибактериальных медиаторов, включая ROS, TNF-α и PRGD2, которые запускают набор других иммунных клеток для ингибирования роста бактерий и образования биопленки .
Рецептор MRGPRX2 является возможной терапевтической мишенью и может быть фармакологически активирован с использованием агонистического соединения 48/80 для контроля бактериальной инфекции. [26] Также предполагается, что другие QSM и даже сигналы грамотрицательных бактерий могут активировать этот рецептор. Это может быть особенно актуально во время хронических инфекций Bartonella , когда в симптоматологии человека ясно видно, что у всех этих пациентов есть синдром активации тучных клеток из-за наличия еще не определенной молекулы, чувствительной к кворуму (самого базального гистамина?). Эти пациенты склонны к пищевой непереносимости, вызванной другим менее специфичным путем, чем путь рецептора IgE: определенно путем MRGPRX2. У этих пациентов также наблюдается циклическая кожная патергия и дермографизм, каждый раз, когда бактерия покидает свое скрытое внутриклеточное местоположение.
Тучные клетки активируются в ответ на заражение патогенными паразитами, такими как некоторые гельминты и простейшие , посредством сигнализации IgE .
Расстройства активации тучных клеток ( MCAD ) представляют собой спектр иммунных расстройств , которые не связаны с патогенной инфекцией и включают в себя схожие симптомы, возникающие из-за секретируемых промежуточных продуктов тучных клеток, но немного отличаются по своей патофизиологии , подходу к лечению и отличительным симптомам. [27] [28] Классификация расстройств активации тучных клеток была изложена в 2010 году. [27] [28]
Аллергии опосредуются сигнализацией IgE , которая запускает дегрануляцию тучных клеток. [27] В последнее время считается, что IgE-независимые « псевдоаллергические » реакции также опосредуются активацией рецептора MRGPRX2 тучных клеток (например, такие препараты, как миорелаксанты , опиоиды , икатибант и фторхинолоны ). [29]
Многие формы кожной и слизистых аллергий в значительной степени опосредованы тучными клетками; они играют центральную роль в астме , экземе , зуде (различных причин), аллергическом рините и аллергическом конъюнктивите . Антигистаминные препараты действуют, блокируя действие гистамина на нервные окончания. Препараты на основе кромогликата (кромогликат натрия, недокромил) блокируют кальциевый канал, необходимый для дегрануляции тучных клеток, стабилизируя клетку и предотвращая высвобождение гистамина и связанных с ней медиаторов. Антагонисты лейкотриенов (такие как монтелукаст и зафирлукаст ) блокируют действие медиаторов лейкотриенов и все чаще используются при аллергических заболеваниях. [7]
Кальций запускает секрецию гистамина из тучных клеток после предыдущего воздействия фторида натрия. Секреторный процесс можно разделить на этап активации фторидом и этап секреции, вызванный кальцием. Было отмечено, что этап активации фторидом сопровождается повышением уровня циклического аденозинмонофосфата (цАМФ) в клетках. Достигнутые высокие уровни цАМФ сохраняются во время высвобождения гистамина. Было также обнаружено, что катехоламины не оказывают заметного влияния на высвобождение гистамина, вызванное фторидом. Также было подтверждено, что второй, но не первый этап секреции гистамина, вызванной фторидом натрия, ингибируется теофиллином. [30] Вазодилатация и повышенная проницаемость капилляров являются результатом как типов рецепторов H1, так и H2. [31]
Стимуляция гистамина активирует чувствительную к гистамину (H2) аденилатциклазу кислотообразующих клеток, и происходит быстрое увеличение клеточного [цАМФ], который участвует в активации транспорта H+ и других связанных с этим изменениях кислотообразующих клеток. [32]
При анафилаксии (тяжелой системной реакции на аллергены , такие как орехи, укусы пчел или лекарства) дегрануляция тучных клеток по всему телу приводит к вазодилатации и, в тяжелых случаях, к симптомам опасного для жизни шока . [ необходима цитата ]
Гистамин — сосудорасширяющее вещество, выделяющееся при анафилаксии. [31]
Тучные клетки могут быть вовлечены в патологию, связанную с аутоиммунными, воспалительными заболеваниями суставов. Было показано, что они участвуют в привлечении воспалительных клеток в суставы (например, ревматоидный артрит ) и кожу (например, буллезный пемфигоид ), и эта активность зависит от антител и компонентов комплемента. [33]
Мастоцитоз — редкое клональное заболевание тучных клеток, при котором наблюдается наличие слишком большого количества тучных клеток ( мастоцитов ) и предшественников тучных клеток CD34 +. [34] Мутации в гене c-Kit связаны с мастоцитозом. [27] Более конкретно, у большинства пациентов с мастоцитозом наблюдается мутация в кодоне 816 в домене киназы KIT, известная как мутация KIT D816V. [35] Наиболее часто поражаемыми органами при мастоцитозе являются кожа и костный мозг. [36]
Мастоцитомы , или опухоли тучных клеток, могут секретировать избыточное количество продуктов дегрануляции. [27] [28] Они часто наблюдаются у собак и кошек. [37] Другие неопластические заболевания, связанные с тучными клетками, включают саркому тучных клеток и лейкоз тучных клеток .
Синдром активации тучных клеток (MCAS) — это идиопатическое иммунное расстройство , которое включает рецидивирующую и чрезмерную дегрануляцию тучных клеток и вызывает симптомы, похожие на другие расстройства активации тучных клеток. [27] [28] Синдром диагностируется на основании четырех наборов критериев, включающих ответ на лечение, симптомы, дифференциальную диагностику и биомаркеры дегрануляции тучных клеток. [27] [28]
Тучные клетки были впервые описаны Полом Эрлихом в его докторской диссертации 1878 года на основе их уникальных характеристик окрашивания и крупных гранул. Эти гранулы также привели его к неверному убеждению, что они существуют для питания окружающих тканей, поэтому он назвал их Mastzellen (от немецкого Mast 'откорм', как у животных). [38] [39] Сейчас они считаются частью иммунной системы .
Исследование иммунологического вклада в аутизм предполагает, что дети с расстройствами аутистического спектра (РАС) могут иметь проблемы, похожие на аллергические, при отсутствии повышенного уровня сывороточного IgE и хронической крапивницы , что предполагает неаллергическую активацию тучных клеток в ответ на экологические и стрессовые триггеры. Эта активация тучных клеток может способствовать воспалению мозга и проблемам неврологического развития. [40]
Толуидиновый синий : один из наиболее распространенных красителей для кислых мукополисахаридов и гликоаминогликанов , компонентов гранул тучных клеток. [41]
Бисмарк коричневый: окрашивает гранулы тучных клеток в коричневый цвет. [42]
Поверхностные маркеры: маркеры клеточной поверхности тучных клеток подробно обсуждались Хенебергом [43], который утверждал, что тучные клетки могут быть непреднамеренно включены в изоляты стволовых или прогениторных клеток, поскольку часть из них положительна для антигена CD34. Классические маркеры тучных клеток включают высокоаффинный рецептор IgE, CD117 (c-Kit) и CD203c (для большинства популяций тучных клеток). Экспрессия некоторых молекул может меняться в ходе активации тучных клеток. [44]
Тучные клетки и энтерохромаффинные клетки являются источником большей части серотонина в желудке у грызунов . [45]
Тучные клетки могут распознавать патогены с помощью различных механизмов, включая прямое связывание патогенов или их компонентов с рецепторами PAMP на поверхности тучных клеток, связывание антител или покрытых комплементом бактерий с рецепторами комплемента или иммуноглобулина или распознавание эндогенных пептидов, продуцируемых инфицированными или поврежденными клетками (Hofmann and Abraham 2009). Характер экспрессии этих рецепторов значительно различается среди различных подтипов тучных клеток. TLR (1–7 и 9), NLR, RLR и рецепторы комплемента отвечают за большинство врожденных реакций тучных клеток.
MC происходят из костномозгового предшественника и впоследствии локально развивают различные фенотипические характеристики в тканях. Их спектр функций широк и включает участие в аллергических реакциях, врожденном и адаптивном иммунитете, воспалении и аутоиммунитете [34]. В человеческом мозге МК могут располагаться в различных областях, таких как стебель гипофиза, эпифиз, area postrema, сосудистое сплетение, таламус, гипоталамус и срединное возвышение [35]. В мозговых оболочках они находятся в твердой мозговой оболочке в ассоциации с сосудами и окончаниями менингеальных ноцицепторов [36]. МК имеют отличительную особенность по сравнению с другими кроветворными клетками, поскольку они находятся в мозге [37]. MC содержат многочисленные гранулы и секретируют обилие предварительно сохраненных медиаторов, таких как кортиколиберин (CRH), нейротензин (NT), вещество P (SP), триптаза, химаза, вазоактивный интестинальный пептид (VIP), фактор роста эндотелия сосудов (VEGF), TNF, простагландины, лейкотриены и различные хемокины и цитокины, некоторые из которых, как известно, нарушают целостность гематоэнцефалического барьера (ГЭБ) [38–40].
Ключевая роль MC в воспалении [34] и в нарушении ГЭБ [41–43] предполагает области, имеющие важное значение для исследований новой терапии. Все больше доказательств также указывают на то, что MC участвуют в нейровоспалении напрямую [44–46] и через стимуляцию микроглии [47], способствуя патогенезу таких состояний, как головные боли, [48] аутизм [49] и синдром хронической усталости [50]. Фактически, недавний обзор показал, что периферические воспалительные стимулы могут вызывать активацию микроглии [51], таким образом, возможно, вовлекая МК за пределами мозга.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка )Для MC описаны два типа дегрануляции: частичная дегрануляция (PMD) и анафилактическая дегрануляция (AND) (рисунки 1 и 2). Как PMD, так и AND встречаются in vivo, ex vivo и in vitro в MC у человека (78–82), мыши (83) и крысы (84). PMD представляет собой избирательное высвобождение частей содержимого гранул без слияний гранул с гранулами и/или гранул с плазматической мембраной. ... В отличие от PMD, AND представляет собой взрывной выброс содержимого гранул или целых гранул наружу из клеток после слияния гранул с гранулами и/или гранул с плазматической мембраной (рисунки 1 и 2). Ультраструктурные исследования показывают, что AND начинается с набухания гранул и изменения матрикса после соответствующей стимуляции (например, сшивания FcεRI).
Рецепторы P2X представляют собой лиганд-зависимые неселективные катионные каналы, которые активируются внеклеточным АТФ. ... Повышенные локальные концентрации АТФ, вероятно, присутствуют вокруг тучных клеток в воспаленных тканях из-за его высвобождения через повреждение или смерть клеток и активацию тромбоцитов [40]. Кроме того, сами тучные клетки хранят АТФ в секреторных гранулах, который высвобождается при активации [41]. Следовательно, существует потенциал для значительного притока Ca2+ в тучные клетки через рецепторы P2X. Члены семейства P2X различаются как по концентрации АТФ, необходимой для активации, так и по степени, в которой они десенсибилизируются после активации агонистом [37, 38]. Это открывает возможность того, что, экспрессируя ряд различных рецепторов P2X, тучные клетки могут адаптировать свой ответ на АТФ в зависимости от концентрации [37].
В пищеварительной ткани H. pylori может изменять сигнализацию в оси мозг-кишечник тучными клетками, основным эффектором оси мозг-кишечник
Функциональные желудочно-кишечные расстройства (ФЖКР) характеризуются хроническими жалобами, возникающими из-за дезорганизованных взаимодействий мозга и кишечника, приводящих к нарушению моторики и гиперчувствительности. Двумя наиболее распространенными ФЖКР, поражающими до 16–26% населения мира, являются функциональная диспепсия и синдром раздраженного кишечника. ... Хорошо известно, что активация тучных клеток может вызывать эпителиальную и нейромышечную дисфункцию и способствовать висцеральной гиперчувствительности и измененным моделям моторики при ФЖКР, послеоперационной непроходимости кишечника, пищевой аллергии и воспалительном заболевании кишечника.
▸ Тучные клетки играют центральную патофизиологическую роль при СРК и, возможно, при функциональной диспепсии, хотя она еще не до конца определена.
▸ Повышенная активация тучных клеток является распространенной находкой в слизистой оболочке пациентов с функциональными расстройствами ЖКТ. ...
▸ Лечение стабилизаторами тучных клеток представляет собой достаточно безопасный и многообещающий вариант лечения пациентов с СРК, не отвечающих на традиционные подходы, хотя необходимы будущие исследования для оценки эффективности и показаний.
Таблица 1
Классификация заболеваний, связанных с активацией тучных клеток, по Akin et al. [14]
1. Первичные
а. Анафилаксия с ассоциированным клональным расстройством тучных клеток
б. Синдром моноклональной активации тучных клеток (MMAS), см. текст для объяснения
2. Вторичные
а. Аллергические расстройства
б. Активация тучных клеток, связанная с хроническими воспалительными или неопластическими расстройствами
в. Физическая крапивница (требует первичной стимуляции)
г. Хроническая аутоиммунная крапивница
3. Идиопатическая (когда зафиксирована дегрануляция тучных клеток; может быть как первичной, так и вторичной. Ангионевротический отек может быть связан с наследственным или приобретенным ангионевротическим отеком, где он может быть независимым от тучных клеток и возникать в результате выработки кининов)
а. Анафилаксия
б. Ангионевротический
отек в. Крапивница
г. Синдром активации тучных клеток (MCAS)...
Рецидивирующая идиопатическая анафилаксия проявляется аллергическими признаками и симптомами — крапивницей и ангионевротическим отеком, что является отличительной чертой — исключает идентифицируемые аллергические этиологии, рассматривает мастоцитоз и карциноидный синдром и лечится антигистаминными препаратами H1 и H2, адреналином и стероидами [21, 22].