
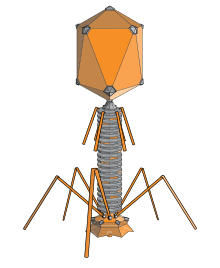

Бактериофаг ( / b æ k ˈ t ɪər i oʊ f eɪ dʒ / ), также известный неофициально как фаг ( / ˈ f eɪ dʒ / ), представляет собой вирус , который заражает и размножается внутри бактерий и архей . Термин происходит от древнегреческого φαγεῖν (phagein) «пожирать» и бактерий . Бактериофаги состоят из белков , которые инкапсулируют геном ДНК или РНК , и могут иметь как простые, так и сложные структуры. Их геномы могут кодировать всего четыре гена (например, MS2 ) и до сотен генов . Фаги реплицируются внутри бактерии после инъекции их генома в ее цитоплазму .
Бактериофаги являются одними из самых распространенных и разнообразных сущностей в биосфере . [2] Бактериофаги являются вездесущими вирусами, которые встречаются везде, где существуют бактерии. По оценкам, на планете насчитывается более 10 31 бактериофагов, больше, чем всех остальных организмов на Земле, включая бактерии, вместе взятых. [3] Вирусы являются наиболее распространенной биологической сущностью в водной толще мировых океанов и вторым по величине компонентом биомассы после прокариот , [4] где в микробных матах на поверхности было обнаружено до 9x10 8 вирионов на миллилитр, [5] и до 70% морских бактерий могут быть инфицированы бактериофагами. [6]
Бактериофаги использовались с 1920-х годов в качестве альтернативы антибиотикам в бывшем Советском Союзе и Центральной Европе, а также во Франции. [7] [8] Они рассматриваются как возможная терапия против штаммов многих бактерий с множественной лекарственной устойчивостью (см. фаговая терапия ). [9] [10] [11] [12]
Известно, что бактериофаги взаимодействуют с иммунной системой как косвенно, через бактериальную экспрессию кодируемых фагом белков, так и напрямую, влияя на врожденный иммунитет и бактериальную очистку. [13] Взаимодействия фаг-хозяин становятся все более важными областями исследований. [14]
Бактериофаги широко распространены в биосфере, с различными геномами и образом жизни. Фаги классифицируются Международным комитетом по таксономии вирусов (ICTV) в соответствии с морфологией и нуклеиновой кислотой.


Было высказано предположение, что представители Picobirnaviridae заражают бактерии, но не млекопитающих. [16]
Существует также много нераспределенных родов класса Leviviricetes : Chimpavirus , Hohglivirus , Mahrahvirus , Meihzavirus , Nicedsevirus , Sculuvirus , Skrubnovirus , Tetipavirus и Winunavirus, содержащих линейные геномы одноцепочечной РНК [17], а также нераспределенный род Lilyvirus порядка Caudovirales , содержащий линейный геном двухцепочечной ДНК.

В 1896 году Эрнест Ханбери Ханкин сообщил, что что-то в водах рек Ганг и Ямуна в Индии имело выраженное антибактериальное действие против холеры и могло проходить через очень тонкий фарфоровый фильтр. [18] В 1915 году британский бактериолог Фредерик Творт , суперинтендант Института Брауна в Лондоне, обнаружил небольшой агент, который заражал и убивал бактерии. Он считал, что агент должен быть одним из следующих:
Исследования Творта были прерваны началом Первой мировой войны , а также нехваткой финансирования и открытием антибиотиков.
Независимо от него, франко-канадский микробиолог Феликс д'Эрелль , работавший в Институте Пастера в Париже , объявил 3 сентября 1917 года, что он открыл «невидимый, антагонистический микроб дизентерийной палочки ». Для д'Эрелля не было никаких сомнений относительно природы его открытия: «В одно мгновение я понял: то, что вызвало мои светлые пятна, на самом деле было невидимым микробом... вирусом, паразитирующим на бактериях». [20] Д'Эрелль назвал вирус бактериофагом, пожирателем бактерий (от греческого phagein , что означает «пожирать»). Он также записал драматический рассказ о человеке, страдающем дизентерией, которого бактериофаги вернули к хорошему здоровью. [21] Именно д'Эрелль провел много исследований бактериофагов и ввел концепцию фаговой терапии . [22] В 1919 году в Париже, Франция, д'Эрелль провел первое клиническое применение бактериофага, а первое зарегистрированное использование в Соединенных Штатах было в 1922 году. [23]
В 1969 году Макс Дельбрюк , Альфред Херши и Сальвадор Лурия были удостоены Нобелевской премии по физиологии и медицине за открытия репликации вирусов и их генетической структуры. [24] В частности, работа Херши, как участника эксперимента Херши–Чейза в 1952 году, предоставила убедительные доказательства того, что ДНК, а не белок, является генетическим материалом жизни. Дельбрюк и Лурия провели эксперимент Лурии–Дельбрюка , который статистически продемонстрировал, что мутации у бактерий происходят случайным образом и, таким образом, следуют дарвиновским, а не ламарковским принципам.

Было обнаружено, что фаги являются антибактериальными средствами и применялись в бывшей Советской Республике Грузия (пионером в этом деле был Георгий Элиава при содействии соавтора открытия бактериофагов Феликса д'Эрелля ) в 1920-х и 1930-х годах для лечения бактериальных инфекций.
Д'Эрелль «быстро понял, что бактериофаги встречаются везде, где процветают бактерии: в канализации, в реках, которые собирают сточные воды из труб, и в стуле выздоравливающих пациентов». [25]
Они имели широкое применение, в том числе для лечения солдат Красной Армии . [26] Однако на Западе от них отказались по нескольким причинам:
Использование фагов продолжалось с момента окончания холодной войны в России, [28] Грузии и других странах Центральной и Восточной Европы. Первое регулируемое, рандомизированное, двойное слепое клиническое исследование было опубликовано в журнале Journal of Wound Care в июне 2009 года, в котором оценивалась безопасность и эффективность коктейля бактериофагов для лечения инфицированных венозных язв ног у пациентов. [29] FDA одобрило исследование как клиническое исследование фазы I. Результаты исследования продемонстрировали безопасность терапевтического применения бактериофагов, но не показали эффективности. Авторы объяснили, что использование определенных химических веществ, которые являются частью стандартного ухода за ранами (например, лактоферрина или серебра), могло повлиять на жизнеспособность бактериофагов. [29] Вскоре после этого в журнале Clinical Otolaryngology в августе 2009 года было опубликовано еще одно контролируемое клиническое исследование в Западной Европе (лечение ушных инфекций, вызванных Pseudomonas aeruginosa ). [30] В исследовании сделан вывод о том, что препараты бактериофагов безопасны и эффективны для лечения хронических ушных инфекций у людей. Кроме того, были проведены многочисленные экспериментальные клинические испытания на животных и другие испытания, оценивающие эффективность бактериофагов при различных заболеваниях, таких как инфицированные ожоги и раны, а также легочные инфекции, связанные с кистозным фиброзом, среди прочих. [30] С другой стороны, было показано, что фаги Inoviridae усложняют биопленки, вовлеченные в пневмонию и кистозный фиброз , и защищают бактерии от лекарств, предназначенных для искоренения болезни, тем самым способствуя персистирующей инфекции. [31]
Тем временем исследователи бактериофагов разрабатывают генно-инженерные вирусы для преодоления устойчивости к антибиотикам и генно-инженерные фаговые гены, ответственные за кодирование ферментов, разрушающих матрицу биопленки, структурных белков фагов и ферментов, ответственных за лизис клеточной стенки бактерий. [5] [6] [7] Были получены результаты, показывающие, что фаги T4, которые имеют небольшие размеры и короткий хвост, могут быть полезны для обнаружения E. coli в организме человека. [32]
Терапевтическая эффективность фагового коктейля была оценена на мышиной модели с носовой инфекцией мультирезистентного (МЛУ) A. baumannii . Мыши, обработанные фаговым коктейлем, показали в 2,3 раза более высокую выживаемость по сравнению с теми, кто не был обработан, через семь дней после заражения. [33]
В 2017 году 68-летний пациент с диабетом и некротическим панкреатитом, осложненным псевдокистой, инфицированной штаммами A. baumannii с множественной лекарственной устойчивостью, в течение 4 месяцев проходил лечение коктейлем из азитромицина, рифампицина и колистина безрезультатно, а общее состояние здоровья быстро ухудшалось.
Поскольку началось обсуждение клинической бесполезности дальнейшего лечения, в качестве последней попытки, по крайней мере, получить ценные медицинские данные из ситуации, был подан и одобрен экстренный исследовательский новый препарат (eIND), поэтому он был подвергнут фаговой терапии с использованием чрескожно (ПК) введенного коктейля, содержащего девять различных фагов, которые были идентифицированы как эффективные против первичного штамма инфекции с помощью методов быстрой изоляции и тестирования (процесс, который занял менее дня). Это оказалось эффективным в течение очень короткого периода, хотя пациент оставался невосприимчивым, а его здоровье продолжало ухудшаться; вскоре изоляты штамма A. baumannii были собраны из дренажа кисты, который показал устойчивость к этому коктейлю, и был добавлен второй коктейль, который был проверен на эффективность против этого нового штамма, на этот раз путем внутривенной (IV) инъекции, поскольку стало ясно, что инфекция была более распространенной, чем первоначально предполагалось. [34]
После комбинации внутривенной и ПК терапии нисходящая клиническая траектория пациента обратилась вспять, и в течение двух дней он проснулся от комы и стал реагировать. Когда его иммунная система начала функционировать, его пришлось временно отстранить от коктейля, потому что его лихорадка поднялась до более чем 104 °F (40 °C), но через два дня фаговые коктейли были снова введены на уровнях, которые он мог переносить. Первоначальный коктейль из трех антибиотиков был заменен миноциклином после того, как было обнаружено, что бактериальный штамм не устойчив к нему, и он быстро восстановил полную ясность сознания, хотя его не выписывали из больницы примерно через 145 дней после начала фаговой терапии. К концу терапии было обнаружено, что бактерии стали устойчивыми к обоим первоначальным фаговым коктейлям, но их продолжали, потому что они, по-видимому, предотвращали развитие устойчивости к миноциклину в собранных бактериальных образцах, поэтому имели полезный синергический эффект. [34]
Фаги все чаще используются для защиты пищевых продуктов и предотвращения порчи бактерий . [35] С 2006 года Управление по контролю за продуктами питания и лекарственными средствами США (FDA) и Министерство сельского хозяйства США (USDA) одобрили несколько продуктов бактериофагов. LMP-102 (Intralytix) был одобрен для обработки готовых к употреблению (RTE) продуктов из птицы и мяса. В том же году FDA одобрило LISTEX (разработанный и произведенный Micreos ) с использованием бактериофагов на сыре для уничтожения бактерий Listeria monocytogenes , чтобы дать им общепризнанный статус безопасных (GRAS). [36] В июле 2007 года те же бактериофаги были одобрены для использования на всех пищевых продуктах. [37] В 2011 году USDA подтвердило, что LISTEX является технологическим средством с чистой этикеткой и включен в USDA. [38] Исследования в области безопасности пищевых продуктов продолжаются, чтобы выяснить, являются ли литические фаги жизнеспособным вариантом для контроля других пищевых патогенов в различных пищевых продуктах. [39]
Бактериофаги, в том числе специфичные для Escherichia coli , использовались в качестве индикаторов фекального загрязнения в источниках воды. Благодаря своим общим структурным и биологическим характеристикам колифаги могут служить прокси для вирусного фекального загрязнения и наличия патогенных вирусов, таких как ротавирус, норовирус и HAV. Исследования, проведенные на системах очистки сточных вод, выявили значительные различия в поведении колифагов по сравнению с фекальными колиформами, продемонстрировав отчетливую корреляцию с восстановлением патогенных вирусов по завершении очистки. Устанавливая безопасный порог сброса, исследования определили, что сбросы ниже 3000 БОЕ/100 мл считаются безопасными с точки зрения ограничения выброса патогенных вирусов. [40]
В 2011 году FDA одобрило первый продукт на основе бактериофага для диагностики in vitro. [41] Тест на культуру крови KeyPath MRSA/MSSA использует коктейль из бактериофагов для обнаружения Staphylococcus aureus в положительных культурах крови и определения устойчивости или восприимчивости к метициллину . Тест возвращает результаты примерно через пять часов, по сравнению с двумя-тремя днями для стандартных методов идентификации микробов и тестирования восприимчивости. Это был первый ускоренный тест на восприимчивость к антибиотикам, одобренный FDA. [42]
Правительственные агентства на Западе в течение нескольких лет обращались к Грузии и бывшему Советскому Союзу за помощью в использовании фагов для противодействия биологическому оружию и токсинам, таким как сибирская язва и ботулизм . [43] Продолжаются разработки среди исследовательских групп в США. Другие области применения включают распыление в садоводстве для защиты растений и овощных продуктов от гниения и распространения бактериальных заболеваний. Другие области применения бактериофагов - в качестве биоцидов для поверхностей окружающей среды, например, в больницах, и в качестве профилактической обработки катетеров и медицинских приборов перед использованием в клинических условиях. В настоящее время существует технология нанесения фагов на сухие поверхности, например, униформу, шторы или даже швы для хирургии. Клинические испытания, описанные в Clinical Otolaryngology [30], показывают успех в ветеринарном лечении домашних собак с отитом .
Метод обнаружения и идентификации бактерий с помощью каскадов ионов, запускаемых фагами (SEPTIC), использует ионную эмиссию и ее динамику во время заражения фагом и обеспечивает высокую специфичность и скорость обнаружения. [44]
Фаговый дисплей — это другой способ использования фагов, включающий библиотеку фагов с вариабельным пептидом, связанным с поверхностным белком. Каждый геном фага кодирует вариант белка, отображаемого на его поверхности (отсюда и название), обеспечивая связь между вариантом пептида и его кодирующим геном. Вариантные фаги из библиотеки могут быть отобраны по их связывающей аффинности с иммобилизованной молекулой (например, токсином ботулизма) для ее нейтрализации. Связанные, отобранные фаги могут быть размножены путем повторного заражения восприимчивого бактериального штамма, что позволяет им извлекать закодированные в них пептиды для дальнейшего изучения. [45]
Фаговые белки часто обладают антимикробной активностью и могут служить в качестве отправных точек для пептидомиметиков , т.е. препаратов, которые имитируют пептиды. [46] Технология фаг-лиганд использует фаговые белки для различных целей, таких как связывание бактерий и бактериальных компонентов (например, эндотоксина ) и лизис бактерий. [47]
Бактериофаги являются важными модельными организмами для изучения принципов эволюции и экологии . [48]
Бактериофаги, присутствующие в окружающей среде, могут привести к тому, что сыр не будет ферментироваться. Чтобы избежать этого, можно использовать смешанные штаммы заквасок и режимы ротации культур. [49] Генная инженерия культурных микробов, особенно Lactococcus lactis и Streptococcus thermophilus , изучалась для генетического анализа и модификации с целью повышения устойчивости к фагам . Особое внимание уделялось плазмидным и рекомбинантным хромосомным модификациям. [50] [35]
Некоторые исследования были сосредоточены на потенциале бактериофагов как противомикробных средств против пищевых патогенов и образования биопленки в молочной промышленности. Поскольку распространение устойчивости к антибиотикам является основной проблемой в молочной промышленности, фаги могут служить многообещающей альтернативой. [51]

Жизненный цикл бактериофагов имеет тенденцию быть либо литическим циклом , либо лизогенным циклом . Кроме того, некоторые фаги демонстрируют псевдолизогенное поведение. [13]
С помощью литических фагов , таких как фаг Т4 , бактериальные клетки разрушаются (лизируются) и уничтожаются после немедленной репликации вириона. Как только клетка разрушена, потомство фага может найти новых хозяев для заражения. [13] Литические фаги больше подходят для фаговой терапии . Некоторые литические фаги подвергаются явлению, известному как ингибирование лизиса, когда завершенное потомство фага не будет немедленно лизироваться из клетки, если внеклеточные концентрации фага высоки. Этот механизм не идентичен механизму перехода умеренного фага в состояние покоя и обычно является временным. [52]
Напротив, лизогенный цикл не приводит к немедленному лизису клетки-хозяина. Те фаги, которые способны подвергаться лизогении, известны как умеренные фаги . Их вирусный геном будет интегрироваться с ДНК хозяина и реплицироваться вместе с ней, относительно безвредно, или даже может стать плазмидой . Вирус остается в состоянии покоя до тех пор, пока условия хозяина не ухудшатся, возможно, из-за истощения питательных веществ, затем эндогенные фаги (известные как профаги ) становятся активными. В этот момент они инициируют репродуктивный цикл, что приводит к лизису клетки-хозяина. Поскольку лизогенный цикл позволяет клетке-хозяину продолжать выживать и размножаться, вирус реплицируется во всех потомках клетки. Примером бактериофага, который, как известно, следует лизогенному циклу и литическому циклу, является фаг лямбда E. coli. [53]
Иногда профаги могут приносить пользу бактерии-хозяину, пока они находятся в состоянии покоя, добавляя новые функции в бактериальный геном , в феномене, называемом лизогенной конверсией . Примерами являются преобразование безвредных штаммов Corynebacterium diphtheriae или Vibrio cholerae бактериофагами в высоковирулентные, вызывающие дифтерию или холеру соответственно. [54] [55] Были предложены стратегии борьбы с некоторыми бактериальными инфекциями путем воздействия на эти кодирующие токсины профаги. [56]

Бактериальные клетки защищены клеточной стенкой из полисахаридов , которые являются важными факторами вирулентности, защищающими бактериальные клетки как от иммунной защиты хозяина, так и от антибиотиков . [57] Чтобы проникнуть в клетку-хозяина, бактериофаги связываются со специфическими рецепторами на поверхности бактерий, включая липополисахариды , тейхоевые кислоты , белки или даже жгутики . Эта специфичность означает, что бактериофаг может инфицировать только определенные бактерии, несущие рецепторы, с которыми они могут связываться, что, в свою очередь, определяет диапазон хозяев фага. Ферменты, разрушающие полисахариды, представляют собой белки, связанные с вирионами, которые ферментативно разрушают капсульный внешний слой своих хозяев на начальном этапе жестко запрограммированного процесса инфицирования фагом. [ необходима цитата ] Условия роста хозяина также влияют на способность фага прикрепляться и внедряться в них. [58] Поскольку вирионы фага не движутся независимо, они должны полагаться на случайные встречи с правильными рецепторами в растворе, такими как кровь, лимфатическая циркуляция, орошение, почвенная вода и т. д. [ необходима цитата ]
Бактериофаги миовирусов используют движение, похожее на подкожный шприц, для инъекции своего генетического материала в клетку. После контакта с соответствующим рецептором волокна хвоста сгибаются, чтобы приблизить базовую пластину к поверхности клетки. Это известно как обратимое связывание. После полного прикрепления инициируется необратимое связывание, и хвост сокращается, возможно, с помощью АТФ , присутствующего в хвосте, [6] инъецируя генетический материал через бактериальную мембрану. [59] Инъекция осуществляется посредством своего рода изгибающего движения в стержне, идущего в сторону, сжимающегося ближе к клетке и выталкивающегося обратно вверх. У подовирусов отсутствует удлиненная хвостовая оболочка, как у миовируса, поэтому вместо этого они используют свои маленькие, похожие на зуб хвостовые волокна ферментативно, чтобы разрушить часть клеточной мембраны перед вставкой своего генетического материала.
В течение нескольких минут бактериальные рибосомы начинают транслировать вирусную мРНК в белок. Для фагов на основе РНК РНК-репликаза синтезируется на ранней стадии процесса. Белки модифицируют бактериальную РНК-полимеразу , так что она предпочтительно транскрибирует вирусную мРНК. Нормальный синтез белков и нуклеиновых кислот хозяина нарушается, и он вынужден производить вирусные продукты вместо этого. Эти продукты затем становятся частью новых вирионов внутри клетки, вспомогательных белков, которые способствуют сборке новых вирионов, или белков, участвующих в лизисе клеток . В 1972 году Уолтер Фирс ( Университет Гента , Бельгия ) был первым, кто установил полную нуклеотидную последовательность гена, а в 1976 году — вирусного генома бактериофага MS2 . [60] Некоторые двухцепочечные ДНК- бактериофаги кодируют рибосомальные белки, которые, как полагают, модулируют трансляцию белков во время фаговой инфекции. [61]
В случае фага Т4 построение новых вирусных частиц включает помощь вспомогательных белков, которые действуют каталитически во время морфогенеза фага . [62] Сначала собираются базовые пластины, а затем на них надстраиваются хвосты. Головные капсиды, построенные отдельно, будут спонтанно собираться с хвостами. Во время сборки вириона фага Т4 морфогенетические белки, кодируемые генами фага , взаимодействуют друг с другом в характерной последовательности. Поддержание соответствующего баланса в количествах каждого из этих белков, продуцируемых во время вирусной инфекции, по-видимому, имеет решающее значение для нормального морфогенеза фага Т4 . [63] ДНК эффективно упаковывается в головки. [64] Весь процесс занимает около 15 минут.
Ранние исследования бактериофага T4 (1962-1964) предоставили возможность получить представление практически обо всех генах, которые необходимы для роста бактериофага в лабораторных условиях. [65] [66] Эти исследования стали возможными благодаря наличию двух классов условных летальных мутантов . [67] Один класс таких мутантов был назван янтарными мутантами . [67] Другой класс условных летальных мутантов был назван температурно-чувствительными мутантами . [68] Исследования этих двух классов мутантов привели к значительному пониманию функций и взаимодействий белков, используемых в механизмах репликации , репарации и рекомбинации ДНК , а также того, как вирусы собираются из компонентов белка и нуклеиновой кислоты (молекулярный морфогенез ).
Фаги могут высвобождаться посредством лизиса клеток, экструзии или, в некоторых случаях, почкования. Лизис хвостатых фагов достигается ферментом, называемым эндолизином , который атакует и разрушает пептидогликан клеточной стенки . Совершенно другой тип фагов, нитевидный фаг , заставляет клетку-хозяина непрерывно секретировать новые вирусные частицы. Высвобождаемые вирионы описываются как свободные и, если только они не дефектны, способны заражать новую бактерию. Почкование связано с определенными фагами Mycoplasma . В отличие от высвобождения вирионов, фаги, демонстрирующие лизогенный цикл, не убивают хозяина, а вместо этого становятся долгосрочными резидентами в качестве профагов . [69]
Исследования 2017 года показали, что бактериофаг Φ3T производит короткий вирусный белок, который сигнализирует другим бактериофагам о необходимости оставаться в состоянии покоя, а не убивать бактерию-хозяина. Arbitrium — это название, данное этому белку исследователями, которые его открыли. [70] [71]
Учитывая миллионы различных фагов в окружающей среде, геномы фагов бывают разных форм и размеров. РНК-фаги, такие как MS2, имеют самые маленькие геномы, всего несколько килобаз. Однако некоторые ДНК-фаги, такие как T4 , могут иметь большие геномы с сотнями генов; размер и форма капсида варьируются вместе с размером генома. [72] Самые большие геномы бактериофагов достигают размера 735 кб. [73]
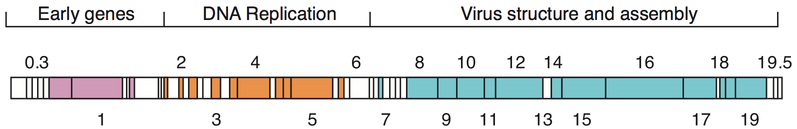
Геномы бактериофагов могут быть в высокой степени мозаичными , то есть геном многих видов фагов, по-видимому, состоит из многочисленных отдельных модулей. Эти модули могут быть обнаружены в других видах фагов в различных расположениях. Микобактериофаги , бактериофаги с хозяевами -микобактериями , предоставили прекрасные примеры этого мозаицизма. В этих микобактериофагах генетический ассортимент может быть результатом повторяющихся случаев сайт-специфической рекомбинации и незаконной рекомбинации (результат приобретения геномом фага генетических последовательностей бактериального хозяина). [75] Эволюционные механизмы формирования геномов бактериальных вирусов различаются между различными семействами и зависят от типа нуклеиновой кислоты, характеристик структуры вириона, а также режима жизненного цикла вируса. [76]
Некоторые морские фаги roseobacter содержат дезоксиуридин (dU) вместо дезокситимидина (dT) в своей геномной ДНК. Есть некоторые доказательства того, что этот необычный компонент является механизмом уклонения от защитных механизмов бактерий, таких как эндонуклеазы рестрикции и системы CRISPR/Cas , которые эволюционировали для распознавания и расщепления последовательностей внутри вторгающихся фагов, тем самым инактивируя их. Давно известно, что другие фаги используют необычные нуклеотиды. В 1963 году Такахаши и Мармур идентифицировали фаг Bacillus , в геноме которого dU заменяет dT [77] , а в 1977 году Кирнос и др. идентифицировали цианофаг , содержащий 2-аминоаденин (Z) вместо аденина (A). [78]
Область системной биологии изучает сложные сети взаимодействий внутри организма, обычно с использованием вычислительных инструментов и моделирования. [79] Например, геном фага, который попадает в бактериальную клетку-хозяина, может экспрессировать сотни фаговых белков, которые будут влиять на экспрессию многочисленных генов хозяина или метаболизм хозяина . Все эти сложные взаимодействия можно описать и смоделировать в компьютерных моделях. [79]
Например, заражение Pseudomonas aeruginosa умеренным фагом PaP3 изменило экспрессию 38% (2160/5633) генов его хозяина. Многие из этих эффектов, вероятно, косвенные, поэтому проблема заключается в выявлении прямых взаимодействий между бактериями и фагом. [80]
Было предпринято несколько попыток картировать белок-белковые взаимодействия между фагом и его хозяином. Например, было обнаружено, что бактериофаг лямбда взаимодействует со своим хозяином, E. coli , посредством десятков взаимодействий. Опять же, значение многих из этих взаимодействий остается неясным, но эти исследования предполагают, что, скорее всего, существует несколько ключевых взаимодействий и множество косвенных взаимодействий, роль которых остается не охарактеризованной. [81]
Бактериофаги представляют собой серьезную угрозу для бактерий, и прокариоты выработали многочисленные механизмы для блокировки инфекции или репликации бактериофагов в клетках-хозяевах. Система CRISPR является одним из таких механизмов, как ретроны и кодируемая ими антитоксиновая система. [82] Известно, что система защиты Thoeris реализует уникальную стратегию устойчивости к бактериальным антифагам посредством деградации NAD+ . [83]
Умеренные фаги — это бактериофаги, которые интегрируют свой генетический материал в хозяина в виде внехромосомных эписом или в виде профага во время лизогенного цикла . [84] [85] [86] Некоторые умеренные фаги могут предоставлять преимущества в плане приспособленности своему хозяину различными способами, включая обеспечение устойчивости к антибиотикам посредством передачи или внедрения генов устойчивости к антибиотикам (ARG), [85] [87] защиту хозяев от фагоцитоза, [88] [89] защиту хозяев от вторичной инфекции посредством исключения суперинфекции, [90] [91] [92] усиление патогенности хозяина, [84] [93] или усиление метаболизма или роста бактерий. [94] [95] [96] [97] Симбиоз бактериофага и хозяина может приносить пользу бактериям, предоставляя селективные преимущества при пассивной репликации генома фага. [98]
Метагеномика позволила обнаружить бактериофаги в воде, что ранее было невозможно. [99]
Также бактериофаги использовались в гидрологическом отслеживании и моделировании в речных системах, особенно там, где происходят взаимодействия поверхностных и грунтовых вод . Использование фагов предпочтительнее, чем более традиционный маркер -краситель , поскольку они значительно меньше поглощаются при прохождении через грунтовые воды и легко обнаруживаются при очень низких концентрациях. [100] Незагрязненная вода может содержать приблизительно 2×10 8 бактериофагов на мл. [101]
Считается, что бактериофаги вносят большой вклад в горизонтальный перенос генов в естественных условиях, в основном посредством трансдукции , но также и посредством трансформации . [102] Исследования на основе метагеномики также показали, что виромы из различных сред содержат гены устойчивости к антибиотикам, включая те, которые могут обеспечивать множественную лекарственную устойчивость . [103]
Недавние открытия выявили сложный и переплетенный арсенал средств защиты от фагов у бактерий окружающей среды. [104]
Хотя фаги не заражают людей, в организме человека имеется бесчисленное множество фаговых частиц, учитывая обширный микробиом человека . Популяция фагов человека называется человеческим фагомом , включая «здоровый кишечный фагом» (HGP) и «больной человеческий фагом» (DHP). [105] Активный фагом здорового человека (т. е. активно реплицирующийся, в отличие от нереплицирующегося, интегрированного профага ) по оценкам включает в себя от десятков до тысяч различных вирусов. [106] Имеются доказательства того, что бактериофаги и бактерии взаимодействуют в микробиоме кишечника человека как антагонистически, так и полезно. [107]
Предварительные исследования показали, что общие бактериофаги обнаруживаются в среднем у 62% здоровых людей, в то время как их распространенность была снижена на 42% и 54% в среднем у пациентов с язвенным колитом (ЯК) и болезнью Крона (БК). [105] Обилие фагов также может снижаться у пожилых людей. [107]
Наиболее распространенными фагами в кишечнике человека, обнаруженными во всем мире, являются crAssphages . CrAssphages передаются от матери к ребенку вскоре после рождения, и есть некоторые данные, предполагающие, что они могут передаваться локально. У каждого человека развиваются свои собственные уникальные кластеры crAssphage. CrAss-подобные фаги также могут присутствовать у приматов , помимо людей. [107]
Среди бесчисленных фагов лишь немногие были подробно изучены, включая некоторые исторически важные фаги, которые были открыты на заре микробной генетики. Они, особенно Т-фаг, помогли открыть важные принципы структуры и функционирования генов.
{{cite journal}}: CS1 maint: бот: исходный статус URL неизвестен ( ссылка )