
Карбонат кальция — это химическое соединение с химической формулой Ca CO 3 . Это распространенное вещество, встречающееся в горных породах в виде минералов кальцита и арагонита , особенно в меле и известняке , яичной скорлупе , раковинах брюхоногих моллюсков , скелетах моллюсков и жемчуге . Материалы, содержащие много карбоната кальция или напоминающие его, описываются как известковые . Карбонат кальция является активным ингредиентом в сельскохозяйственной извести и образуется, когда ионы кальция в жесткой воде реагируют с ионами карбоната с образованием известкового налета . Он имеет медицинское применение в качестве кальциевой добавки или как антацидное средство , но чрезмерное потребление может быть опасным и вызывать гиперкальциемию и проблемы с пищеварением. [8]
Карбонат кальция имеет типичные свойства других карбонатов . В частности, он
Карбонат кальция реагирует с водой, насыщенной углекислым газом, образуя растворимый бикарбонат кальция .
Эта реакция играет важную роль в эрозии карбонатных пород , образовании пещер и приводит к образованию жесткой воды во многих регионах.
Необычной формой карбоната кальция является гексагидрат икаит , CaCO3 · 6H2O . Икаит стабилен только при температуре ниже 8 °C .
Подавляющее большинство карбоната кальция, используемого в промышленности, добывается путем добычи или карьерной добычи. Чистый карбонат кальция (например, для пищевых или фармацевтических целей) может быть получен из чистого добываемого источника (обычно мрамора ).
В качестве альтернативы карбонат кальция получают из оксида кальция . Добавляют воду, чтобы получить гидроксид кальция , затем через этот раствор пропускают углекислый газ, чтобы осадить желаемый карбонат кальция, называемый в промышленности осажденным карбонатом кальция (PCC). Этот процесс называется карбонизацией : [9]
В лаборатории карбонат кальция можно легко кристаллизовать из хлорида кальция ( CaCl 2 ), поместив водный раствор CaCl 2 в эксикатор вместе с карбонатом аммония [NH 4 ] 2 CO 3 . [10] В эксикаторе карбонат аммония подвергается воздействию воздуха и разлагается на аммиак , диоксид углерода и воду . Затем диоксид углерода диффундирует в водный раствор хлорида кальция, реагирует с ионами кальция и водой и образует карбонат кальция.
Термодинамически стабильной формой CaCO 3 при нормальных условиях является гексагональная β- CaCO 3 (минерал кальцит ). Могут быть получены и другие формы, более плотная (2,83 г/см 3 ) орторомбическая λ- CaCO 3 (минерал арагонит ) и гексагональная μ- CaCO 3 , встречающаяся в виде минерала ватерита . Форму арагонита можно получить осаждением при температурах выше 85 °C; форму ватерита можно получить осаждением при 60 °C. Кальцит содержит атомы кальция, координированные шестью атомами кислорода; в арагоните они координированы девятью атомами кислорода. [ необходима цитата ] Структура ватерита не полностью изучена. [11] Карбонат магния ( MgCO 3 ) имеет структуру кальцита, тогда как карбонат стронция ( SrCO 3 ) и карбонат бария ( BaCO 3 ) принимают структуру арагонита, что отражает их большие ионные радиусы . [ необходима ссылка ]
Карбонат кальция кристаллизуется в трех безводных полиморфных модификациях , [12] [13] из которых кальцит является термодинамически наиболее стабильным при комнатной температуре, арагонит лишь немного менее стабилен, а ватерит наименее стабилен. [14]
Кристаллическая структура кальцита тригональная , с пространственной группой R 3 c (№ 167 в Международных таблицах кристаллографии [15] ), и символом Пирсона hR10. [16] Арагонит орторомбический , с пространственной группой Pmcn (№ 62), и символом Пирсона oP20. [17] Фатерит состоит по крайней мере из двух различных сосуществующих кристаллографических структур. Основная структура демонстрирует гексагональную симметрию в пространственной группе P6 3 /mmc, второстепенная структура до сих пор неизвестна. [18]

Все три полиморфа кристаллизуются одновременно из водных растворов в условиях окружающей среды. [14] В водных растворах без добавок кальцит легко образуется как основной продукт, тогда как арагонит появляется только как второстепенный продукт.
При высокой насыщенности ватерит обычно является первой осаждаемой фазой, за которой следует трансформация ватерита в кальцит. [19] Такое поведение, по-видимому, следует правилу Оствальда , в котором наименее стабильный полиморф кристаллизуется первым, а затем следует кристаллизация различных полиморфов через последовательность все более стабильных фаз. [20] Однако арагонит, стабильность которого находится между стабильностью ватерита и кальцита, по-видимому, является исключением из этого правила, поскольку арагонит не образуется как предшественник кальцита в условиях окружающей среды. [14]

Арагонит встречается в большинстве случаев, когда условия реакции ингибируют образование кальцита и/или способствуют зародышеобразованию арагонита. Например, образование арагонита стимулируется присутствием ионов магния [21] или использованием белков и пептидов, полученных из биологического карбоната кальция. [22] Было показано, что некоторые полиамины, такие как кадаверин и поли(этиленимин), способствуют образованию арагонита над кальцитом. [14]
Организмы, такие как моллюски и членистоногие , продемонстрировали способность выращивать все три кристаллических полиморфа карбоната кальция, в основном в качестве защиты (раковины) и прикрепления мышц. [23] Более того, они демонстрируют замечательную способность к фазовому отбору по сравнению с кальцитом и арагонитом, и некоторые организмы могут переключаться между двумя полиморфами. Способность к фазовому отбору обычно приписывается использованию такими организмами определенных макромолекул или комбинаций макромолекул. [24] [25] [26]

Кальцит , арагонит и фатерит являются чистыми минералами карбоната кальция. Промышленно важные исходные породы, которые в основном состоят из карбоната кальция, включают известняк , мел , мрамор и травертин .

Яичная скорлупа , раковины улиток и большинство морских ракушек в основном состоят из карбоната кальция и могут использоваться в качестве промышленных источников этого химического вещества. [28] Раковины устриц недавно получили признание в качестве источника диетического кальция, но также являются практичным промышленным источником. [29] [30] Темно -зеленые овощи, такие как брокколи и капуста, содержат диетически значительное количество карбоната кальция, но они не являются практичным промышленным источником. [31]
Кольчатые черви семейства Lumbricidae , дождевые черви, обладают региональным расположением пищеварительного тракта, называемым кальциевыми железами, Kalkdrüsen или glandes de Morren, которые перерабатывают кальций и CO2 в карбонат кальция , который позже выделяется в почву. [32] Функция этих желез неизвестна, но считается, что они служат механизмом регуляции CO2 в тканях животных. [33] Этот процесс имеет экологическое значение, стабилизируя pH кислых почв . [34]
За пределами Земли, убедительные доказательства указывают на присутствие карбоната кальция на Марсе . Признаки карбоната кальция были обнаружены в нескольких местах (особенно в кратерах Гусева и Гюйгенса ). Это дает некоторые доказательства присутствия жидкой воды в прошлом. [35] [36]

Карбонат часто встречается в геологических условиях и представляет собой огромный резервуар углерода . Карбонат кальция встречается в виде арагонита , кальцита и доломита как важных компонентов цикла кальция . Карбонатные минералы образуют типы горных пород: известняк , мел , мрамор , травертин , туф и другие.

В теплых, чистых тропических водах кораллы более многочисленны, чем в направлении полюсов, где вода холодная. Источники карбоната кальция, включая планктон (такой как кокколиты и планктонные фораминиферы ), кораллиновые водоросли , губки , брахиоподы , иглокожие , мшанки и моллюски , обычно встречаются в мелководных средах, где больше солнечного света и фильтруемой пищи. Холодноводные карбонаты существуют в более высоких широтах, но имеют очень медленную скорость роста. Процессы кальцификации изменяются подкислением океана .
Там, где океаническая кора погружается под континентальную плиту, осадки будут переноситься вниз в более теплые зоны в астеносфере и литосфере . В этих условиях карбонат кальция разлагается с образованием углекислого газа , который вместе с другими газами вызывает взрывные вулканические извержения .
Глубина компенсации карбоната (CCD) — это точка в океане, где скорость осаждения карбоната кальция уравновешивается скоростью растворения из-за имеющихся условий. Глубоко в океане температура падает, а давление увеличивается. Увеличение давления также увеличивает растворимость карбоната кальция. Карбонат кальция необычен тем, что его растворимость увеличивается с уменьшением температуры. [37] Глубина компенсации карбоната колеблется от 4000 до 6000 метров ниже уровня моря в современных океанах, и различные полиморфы (кальцит, арагонит) имеют разные глубины компенсации в зависимости от их стабильности. [38]
Карбонат кальция может сохранять окаменелости посредством перминерализации . Большинство окаменелостей позвоночных формации Two Medicine — геологической формации, известной своими яйцами динозавров с утконосым клювом — сохраняются посредством перминерализации CaCO3 . [39] Этот тип сохранения сохраняет высокий уровень детализации, даже вплоть до микроскопического уровня. Однако он также делает образцы уязвимыми к выветриванию при воздействии на поверхность. [39]
Когда-то считалось, что популяции трилобитов составляли большую часть водной жизни в кембрии , поскольку их богатые карбонатом кальция панцири сохранялись легче, чем панцири других видов, [40] у которых были чисто хитиновые панцири.
Основное применение карбоната кальция — в строительной промышленности, либо как строительный материал, либо как известняковый заполнитель для строительства дорог, как ингредиент цемента или как исходный материал для приготовления строительной извести путем обжига в печи . Однако из-за выветривания, вызванного в основном кислотными дождями , [41] карбонат кальция (в форме известняка) больше не используется в строительных целях сам по себе, а только как сырое первичное вещество для строительных материалов.
Карбонат кальция также используется при очистке железа из железной руды в доменной печи . Карбонат прокаливается на месте, давая оксид кальция , который образует шлак с различными присутствующими примесями и отделяется от очищенного железа. [42]
В нефтяной промышленности карбонат кальция добавляется в буровые растворы в качестве связующего агента для образования и герметизации фильтрационной корки; он также является утяжеляющим материалом, который увеличивает плотность буровых растворов для контроля давления в скважине. Карбонат кальция добавляется в плавательные бассейны в качестве корректора pH для поддержания щелочности и компенсации кислотных свойств дезинфицирующего средства. [43]
Он также используется в качестве сырья при очистке сахара из сахарной свеклы ; он прокаливается в печи с антрацитом для получения оксида кальция и диоксида углерода. Затем эта обожженная известь гасится в пресной воде для получения суспензии гидроксида кальция для осаждения примесей в сыром соке во время карбонизации . [44]
Карбонат кальция в форме мела традиционно является основным компонентом мела для школьных досок . Однако современный изготовленный мел в основном представляет собой гипс , гидратированный сульфат кальция CaSO 4 ·2H 2 O. Карбонат кальция является основным источником для выращивания биокамней . Осажденный карбонат кальция (PCC), предварительно диспергированный в виде суспензии , является распространенным наполнителем для латексных перчаток с целью достижения максимальной экономии на материале и производственных затратах. [45]
Тонкодисперсный карбонат кальция (GCC) является важным ингредиентом микропористой пленки, используемой в подгузниках и некоторых строительных пленках, поскольку поры зарождаются вокруг частиц карбоната кальция во время изготовления пленки путем двуосного растяжения. GCC и PCC используются в качестве наполнителя в бумаге, поскольку они дешевле древесного волокна . Бумага для печати и письма может содержать 10–20% карбоната кальция. В Северной Америке карбонат кальция начал заменять каолин при производстве глянцевой бумаги . Европа практикует это как щелочное производство бумаги или бескислотное производство бумаги в течение нескольких десятилетий. PCC, используемый для наполнения бумаги и бумажных покрытий, осаждается и готовится в различных формах и размерах, имеющих характерное узкое распределение размеров частиц и эквивалентные сферические диаметры от 0,4 до 3 микрометров. [ необходима цитата ]
Карбонат кальция широко используется в качестве наполнителя в красках , [46] в частности, в матовой эмульсионной краске , где обычно 30% по весу краски составляет мел или мрамор. Он также является популярным наполнителем в пластмассах. [46] Некоторые типичные примеры включают около 15–20% загрузки мела в непластифицированных поливинилхлоридных (uPVC) водосточных трубах , 5–15% загрузки покрытого стеаратом мела или мрамора в оконном профиле uPVC. Кабели из ПВХ могут использовать карбонат кальция при загрузке до 70 phr (частей на сто частей смолы) для улучшения механических свойств (прочность на разрыв и удлинение) и электрических свойств (объемное удельное сопротивление). [ требуется ссылка ] Полипропиленовые соединения часто заполняются карбонатом кальция для повышения жесткости, требование, которое становится важным при высоких температурах использования. [47] Здесь процент часто составляет 20–40%. Он также обычно используется в качестве наполнителя в термореактивных смолах (компаунды для формования листов и объемов) [47] , а также смешивается с АБС и другими ингредиентами для формирования некоторых типов прессованных «глиняных» фишек для покера . [48] Осажденный карбонат кальция, полученный путем добавления оксида кальция в воду, используется сам по себе или с добавками в качестве белой краски, известной как побелка . [49] [50]
Карбонат кальция добавляют в широкий спектр торговых и самодельных клеев, герметиков и декоративных наполнителей. [46] Керамические клеи для плитки обычно содержат от 70% до 80% известняка. Декоративные наполнители трещин содержат схожие уровни мрамора или доломита. Его также смешивают с замазкой при установке витражей и в качестве резиста для предотвращения прилипания стекла к полкам печи при обжиге глазури и красок при высокой температуре. [51] [52] [53] [54]
В керамической глазури карбонат кальция известен как белила [ 46] и является распространенным ингредиентом для многих глазурей в его белой порошкообразной форме. Когда глазурь, содержащая этот материал, обжигается в печи, белила действуют как флюсовый материал в глазури. Молотый карбонат кальция является абразивом (как чистящий порошок, так и ингредиент бытовых чистящих кремов), в частности, в форме кальцита, который имеет относительно низкий уровень твердости 3 по шкале Мооса , и поэтому не царапает стекло и большинство других видов керамики , эмали , бронзы , железа и стали , и оказывает умеренное воздействие на более мягкие металлы, такие как алюминий и медь . Паста, приготовленная из карбоната кальция и деионизированной воды, может использоваться для очистки потускнения на серебре [55] .

Карбонат кальция широко используется в медицине как недорогая пищевая добавка кальция для желудочного антацида [56] (например, Tums и Eno ). Он может использоваться как связывающее фосфат вещество для лечения гиперфосфатемии (в первую очередь у пациентов с хронической почечной недостаточностью ). Он используется в фармацевтической промышленности как инертный наполнитель для таблеток и других фармацевтических препаратов . [57]
Карбонат кальция используется в производстве оксида кальция, а также зубной пасты и вновь стал использоваться в качестве пищевого консерванта и фиксатора цвета при использовании в таких продуктах, как органические яблоки, или вместе с ними. [58]
Карбонат кальция используется в терапевтических целях в качестве фосфатсвязывающего средства у пациентов, находящихся на поддерживающем гемодиализе . Это наиболее распространенная форма фосфатсвязывающего средства, назначаемая, особенно при хронической болезни почек без диализа. Карбонат кальция является наиболее часто используемым фосфатсвязывающим средством, но врачи все чаще назначают более дорогие фосфатсвязывающие средства не на основе кальция, в частности севеламер .
Избыток кальция из добавок, обогащенной пищи и диет с высоким содержанием кальция может вызвать молочно-щелочной синдром , который имеет серьезную токсичность и может быть смертельным. В 1915 году Бертрам Сиппи представил «режим Сиппи» с ежечасным приемом молока и сливок и постепенным добавлением яиц и вареных хлопьев в течение 10 дней в сочетании с щелочными порошками, что обеспечивало симптоматическое облегчение язвенной болезни. В течение следующих нескольких десятилетий режим Сиппи привел к почечной недостаточности , алкалозу и гиперкальциемии , в основном у мужчин с язвенной болезнью. Эти побочные эффекты были устранены, когда режим был прекращен, но он был фатальным для некоторых пациентов с затяжной рвотой. Молочно-щелочной синдром снизился у мужчин после того, как возникли эффективные методы лечения язвенной болезни. С 1990-х годов это чаще всего наблюдалось у женщин, принимающих добавки кальция сверх рекомендуемого диапазона от 1,2 до 1,5 граммов в день для профилактики и лечения остеопороза, [59] [60] и усугубляется обезвоживанием . Кальций добавляют в безрецептурные препараты, что способствует непреднамеренному чрезмерному потреблению. Чрезмерное потребление кальция может привести к гиперкальциемии, осложнения которой включают рвоту, боли в животе и измененное психическое состояние. [61]
Как пищевая добавка , она обозначена как E170 [62] и имеет номер INS 170. Используется как регулятор кислотности , антислеживающий агент , стабилизатор или краситель , одобрен для использования в ЕС, [63] США [64] , Австралии и Новой Зеландии . [65] Она «добавляется по закону во все виды британской молотой хлебопекарной муки, за исключением цельнозерновой». [66] [67] Она используется в некоторых продуктах из соевого молока и миндального молока как источник диетического кальция; по крайней мере одно исследование предполагает, что карбонат кальция может быть таким же биодоступным, как кальций в коровьем молоке . [68] Карбонат кальция также используется в качестве укрепляющего агента во многих консервированных и бутилированных овощных продуктах.
Было задокументировано, что несколько формул добавок кальция содержат химический элемент свинец , [69] представляющий опасность для общественного здравоохранения . [70] Свинец обычно содержится в природных источниках кальция. [69]
Сельскохозяйственная известь , порошкообразный мел или известняк, используется как дешевый метод нейтрализации кислой почвы , что делает ее пригодной для посадки, а также используется в аквакультуре для регулирования pH почвы пруда перед началом выращивания. [71] Существует интерес к пониманию того, может ли она влиять на адсорбцию и десорбцию пестицидов в известковой почве. [72]
Карбонат кальция является ключевым ингредиентом многих бытовых чистящих порошков, таких как Comet , и используется в качестве чистящего средства.
В 1989 году исследователь Кен Симмонс ввел CaCO 3 в ручей Уэтстоун в Массачусетсе . [73] Он надеялся, что карбонат кальция будет противостоять кислоте в ручье от кислотных дождей и спасет форель, которая перестала нереститься. Хотя его эксперимент был успешным, он увеличил количество ионов алюминия в области ручья, которая не была обработана известняком. Это показывает, что CaCO 3 можно добавлять для нейтрализации последствий кислотных дождей в речных экосистемах. В настоящее время карбонат кальция используется для нейтрализации кислотных условий как в почве, так и в воде. [74] [75] [76] С 1970-х годов такое известкование практикуется в больших масштабах в Швеции для смягчения закисления, и несколько тысяч озер и ручьев неоднократно известкуются. [77]
Карбонат кальция также используется в процессах десульфурации дымовых газов, устраняя вредные выбросы SO 2 и NO 2 от угля и других видов ископаемого топлива, сжигаемого на крупных электростанциях, работающих на ископаемом топливе. [74]
Карбонат кальция обычно используется в пластиковой промышленности в качестве наполнителя. Когда он включен в пластиковый материал, он может улучшить твердость, жесткость, размерную стабильность и технологичность материала. [78]
Кальцинирование известняка с использованием углей для получения негашеной извести практиковалось с древних времен культурами по всему миру. Температура, при которой известняк выделяет оксид кальция, обычно указывается как 825 °C, но указание абсолютного порога вводит в заблуждение. Карбонат кальция существует в равновесии с оксидом кальция и углекислым газом при любой температуре. При каждой температуре существует парциальное давление углекислого газа, которое находится в равновесии с карбонатом кальция. При комнатной температуре равновесие в подавляющем большинстве благоприятствует карбонату кальция, поскольку равновесное давление CO 2 составляет лишь малую часть парциального давления CO 2 в воздухе, которое составляет около 0,035 кПа.
При температуре выше 550 °C равновесное давление CO2 начинает превышать давление CO2 в воздухе. Поэтому выше 550 °C карбонат кальция начинает выделять CO2 в воздух. Однако в печи, работающей на древесном угле, концентрация CO2 будет намного выше, чем в воздухе. Действительно, если весь кислород в печи сгорит в огне, то парциальное давление CO2 в печи может достигать 20 кПа. [ 79]
Таблица показывает, что это парциальное давление достигается только при температуре около 800 °C. Для того, чтобы выделение CO 2 из карбоната кальция происходило с экономически полезной скоростью, равновесное давление должно значительно превышать давление CO 2 в окружающей среде . А для того, чтобы это происходило быстро, равновесное давление должно превышать общее атмосферное давление 101 кПа, что происходит при 898 °C.

Карбонат кальция плохо растворяется в чистой воде (47 мг/л при нормальном парциальном давлении CO2 в атмосфере , как показано ниже).
Равновесие его раствора определяется уравнением (с растворенным карбонатом кальция справа):
где произведение растворимости для [Ca 2+ ][CO2−3] задается как где угодно от K sp =3,7 × 10 −9 в K sp =8,7 × 10−9 при 25 °C, в зависимости от источника данных. [80] [81] Это уравнение означает, что произведение молярной концентрации ионов кальция ( моль растворенного Ca2 + на литр раствора) на молярную концентрацию растворенного CO2−3не может превышать значение K sp . Это, казалось бы, простое уравнение растворимости, однако, должно рассматриваться вместе с более сложным равновесием углекислого газа с водой (см. угольная кислота ). Часть CO2−3соединяется с H + в растворе согласно
ХСО−3известен как ион бикарбоната . Бикарбонат кальция во много раз более растворим в воде, чем карбонат кальция, — фактически он существует только в растворе.
Некоторые из HCO−3соединяется с H + в растворе согласно
Часть H 2 CO 3 распадается на воду и растворенный углекислый газ в соответствии с
А растворенный углекислый газ находится в равновесии с атмосферным углекислым газом согласно
Для окружающего воздуха P CO 2 составляет около3,5 × 10−4 атм ( или эквивалентно 35 Па ). Последнее уравнение выше фиксирует концентрацию растворенного CO2 как функцию PCO2 , независимо от концентрации растворенного CaCO3 . При атмосферном парциальном давлении CO2 концентрация растворенного CO2 равна1,2 × 10−5 моль на литр . Уравнение перед этим фиксирует концентрацию H2CO3 как функцию концентрации CO2 . Для [ CO2 ] =1,2 × 10−5 , это приводит к [ H 2 CO 3 ] =2,0 × 10−8 моль на литр. Когда [H 2 CO 3 ] известно, оставшиеся три уравнения вместе с
(что справедливо для всех водных растворов) и ограничение, что раствор должен быть электрически нейтральным, т. е. общий заряд растворенных положительных ионов [Ca 2+ ] + 2 [H + ] должен быть компенсирован общим зарядом растворенных отрицательных ионов [HCO−3] + [СО2−3] + [OH − ] , позволяют одновременно решить оставшиеся пять неизвестных концентраций (ранее упомянутая форма нейтральности действительна только в том случае, если карбонат кальция был приведен в контакт с чистой водой или с нейтральным pH-раствором; в случае, когда исходный pH-растворителя воды не является нейтральным, баланс не является нейтральным).
В соседней таблице показаны результаты для [Ca 2+ ] и [H + ] (в виде pH) в зависимости от парциального давления CO 2 в окружающей среде ( K sp =Для расчета было принято значение 4,47 × 10−9 ) .
Эффект последнего особенно очевиден в повседневной жизни людей, у которых жесткая вода. Вода в водоносных горизонтах под землей может подвергаться воздействию уровней CO2 , намного превышающих атмосферные. Поскольку такая вода просачивается через карбонат кальция, CaCO3 растворяется в соответствии с одной из вышеописанных тенденций. Когда эта же вода затем выходит из крана, со временем она приходит в равновесие с уровнями CO2 в воздухе, выделяя избыток CO2 . В результате карбонат кальция становится менее растворимым, а избыток выпадает в осадок в виде известкового налета. Этот же процесс отвечает за образование сталактитов и сталагмитов в известняковых пещерах.
Две гидратированные фазы карбоната кальция, моногидрокальцит CaCO 3 ·H 2 O и икаит CaCO 3 ·6H 2 O , могут осаждаться из воды при условиях окружающей среды и сохраняться в виде метастабильных фаз.
В отличие от сценария открытого равновесия, описанного выше, многие бассейны управляются путем добавления бикарбоната натрия ( NaHCO3 ) до концентрации около 2 ммоль/л в качестве буфера, затем контролируют pH с помощью HCl, NaHSO4, Na2CO3 , NaOH или хлорных составов , которые являются кислотными или основными . В этой ситуации растворенный неорганический углерод ( общий неорганический углерод ) далек от равновесия с атмосферным CO2 . Прогресс в достижении равновесия путем дегазации CO2 замедляется
В этой ситуации константы диссоциации для гораздо более быстрых реакций
позволяют прогнозировать концентрации каждого растворенного неорганического углерода в растворе, исходя из добавленной концентрации HCO−3(что составляет более 90% видов участка Бьеррума от pH 7 до pH 8 при 25 °C в пресной воде). [83] Добавление HCO−3увеличит выбросы CO2−3концентрация при любом pH. Переставляя уравнения, приведенные выше, мы можем увидеть, что [Ca 2+ ] = К сп/[ КО2−3] , и [ CO2−3] = К а2 [ НСО−3]/[ Н + ] . Поэтому, когда HCO−3Если концентрация известна, то максимальную концентрацию ионов Ca2 + до выпадения осадка CaCO3 можно предсказать по формуле:
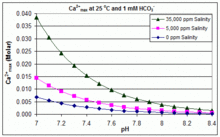
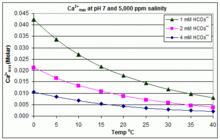
Произведение растворимости CaCO 3 ( K sp ) и константы диссоциации растворенных неорганических видов углерода (включая K a2 ) существенно зависят от температуры и солености [83] , при этом общий эффект заключается в том, что [ Ca 2+ ] max увеличивается от пресной воды к соленой и уменьшается с ростом температуры, pH или добавленного уровня бикарбоната, как показано на прилагаемых графиках.
Тенденции иллюстративны для управления бассейном, но то, происходит ли образование накипи, также зависит от других факторов, включая взаимодействие с Mg 2+ , [B(OH) 4 ] − и другими ионами в бассейне, а также эффекты перенасыщения. [84] [85] Образование накипи обычно наблюдается в электролитических генераторах хлора, где имеется высокий pH вблизи поверхности катода, а осаждение накипи еще больше увеличивает температуру. Это одна из причин, по которой некоторые операторы бассейнов предпочитают борат бикарбонату в качестве основного буфера pH и избегают использования химикатов для бассейнов, содержащих кальций. [86]
Растворы сильных ( HCl ), умеренно сильных ( сульфаминовая ) или слабых ( уксусная , лимонная , сорбиновая , молочная , фосфорная ) кислот имеются в продаже. Они обычно используются в качестве средств для удаления накипи для удаления известковых отложений. Максимальное количество CaCO 3 , которое может быть «растворено» одним литром раствора кислоты, можно рассчитать с помощью приведенных выше уравнений равновесия.


{{cite web}}: CS1 maint: архивная копия как заголовок ( ссылка ){{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite book}}: |journal=проигнорировано ( помощь )