

Карбонилы металлов представляют собой координационные комплексы переходных металлов с лигандами оксида углерода . Карбонилы металлов используются в органическом синтезе и в качестве катализаторов или предшественников катализаторов в гомогенном катализе , таком как гидроформилирование и химия Реппе . В процессе Монда тетракарбонил никеля используется для получения чистого никеля . В металлоорганической химии карбонилы металлов служат предшественниками для получения других металлоорганических комплексов.
Карбонилы металлов токсичны при контакте с кожей, вдыхании или проглатывании, отчасти из-за их способности карбонилировать гемоглобин , образуя карбоксигемоглобин , который препятствует связыванию кислорода . [1]
Номенклатура карбонилов металлов зависит от заряда комплекса, числа и типа центральных атомов, числа и типа лигандов и их способов связывания. Они встречаются в виде нейтральных комплексов, положительно заряженных катионов карбонилов металлов или отрицательно заряженных карбонилатов металлов . Лиганд оксида углерода может быть связан терминально с одним атомом металла или соединяться с двумя или более атомами металла. Эти комплексы могут быть гомолептическими , содержащими только лиганды CO, такие как тетракарбонил никеля (Ni(CO) 4 ), но чаще карбонилы металлов являются гетеролептическими и содержат смесь лигандов. [ необходима цитата ]
Моноядерные карбонилы металлов содержат только один атом металла в качестве центрального атома. За исключением гексакарбонила ванадия , только металлы с четным атомным числом, такие как хром , железо , никель и их гомологи, образуют нейтральные моноядерные комплексы. Полиядерные карбонилы металлов образуются из металлов с нечетным атомным числом и содержат связь металл-металл . [2] Комплексы с разными металлами, но только с одним типом лиганда, называются изолептическими. [2]
Угарный газ имеет различные способы связывания в карбонилах металлов. Они различаются по тактильности , обозначаемой η , и по способу связывания. В комплексах η 2 -CO и углерод, и кислород связаны с металлом. Чаще всего связан только углерод, и в этом случае тактильность не упоминается. [3]
Карбонильный лиганд участвует в широком диапазоне режимов связывания в димерах и кластерах карбонилов металлов. В наиболее распространенном режиме связывания, обозначаемом μ 2 или просто μ , лиганд CO связывает пару металлов. Этот режим связывания наблюдается в широко распространенных карбонилах металлов: Co 2 (CO) 8 , Fe 2 (CO) 9 , Fe 3 (CO) 12 и Co 4 (CO) 12 . [1] [4] В некоторых кластерах с более высокой нуклеарностью CO связывает три или даже четыре металла. Эти лиганды обозначаются μ 3 -CO и μ 4 -CO. Менее распространены режимы связывания, в которых и C, и O связываются с металлом, например μ 3 η 2 . [ необходима цитата ]

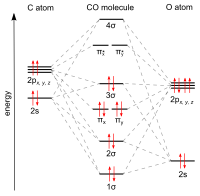
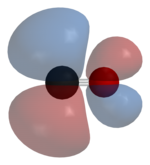
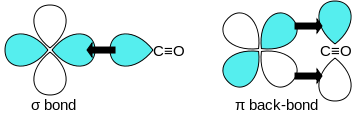
Оксид углерода связывается с переходными металлами с помощью «синергетической обратной связи pi* ». Связь M–C состоит из трех компонентов, что приводит к частичной тройной связи. Связь сигма (σ) возникает из-за перекрытия несвязывающей (или слабо антисвязывающей) sp-гибридизованной электронной пары на углероде со смесью d- , s- и p-орбиталей на металле. Пара связей pi (π) возникает из-за перекрытия заполненных d-орбиталей на металле с парой π*- антисвязывающих орбиталей, выступающих из атома углерода CO. Последний вид связи требует, чтобы металл имел d-электроны и чтобы металл находился в относительно низкой степени окисления (0 или +1), что делает благоприятным обратное донорство электронной плотности. Поскольку электроны из металла заполняют π-антисвязывающую орбиталь CO, они ослабляют связь углерод-кислород по сравнению со свободной окисью углерода, в то время как связь металл-углерод усиливается. Из-за характера множественной связи связи M–CO расстояние между металлом и атомом углерода относительно короткое, часто менее 1,8 Å, что примерно на 0,2 Å короче, чем связь металл– алкил . Расстояние M-CO и MC-O чувствительно к другим лигандам на металле. Иллюстрацией этих эффектов являются следующие данные для расстояний Mo-C и CO в Mo(CO) 6 и Mo(CO) 3 (4-метилпиридин) 3 : 2,06 против 1,90 и 1,11 против 1,18 Å. [5]
Инфракрасная спектроскопия является чувствительным зондом для обнаружения мостиковых карбонильных лигандов. Для соединений с двойными мостиковыми лигандами CO, обозначаемыми μ 2 -CO или часто просто μ -CO, частота растяжения связи ν CO обычно смещена на 100–200 см −1 в сторону более низкой энергии по сравнению с сигнатурами терминального CO, которые находятся в области 1800 см −1 . Полосы для лигандов CO с покрытием лицевой стороны ( μ 3 ) появляются при еще более низких энергиях. В дополнение к симметричным мостиковым модам можно обнаружить, что CO образует мостики асимметрично или посредством донорства с d-орбитали металла на π*-орбиталь CO. [6] [7] [8] Увеличенное π-связывание из-за обратного донорства от нескольких металлических центров приводит к дальнейшему ослаблению связи C–O. [ необходима цитата ]
Большинство моноядерных карбонильных комплексов представляют собой бесцветные или бледно-желтые, летучие жидкости или твердые вещества, которые являются легковоспламеняющимися и токсичными. [9] Гексакарбонил ванадия , уникально стабильный 17-электронный металлический карбонил, представляет собой сине-черное твердое вещество. [1] Диметаллические и полиметаллические карбонилы, как правило, имеют более глубокую окраску. Трижелезододекакарбонил (Fe 3 (CO) 12 ) образует темно-зеленые кристаллы. Кристаллические карбонилы металлов часто сублимируются в вакууме, хотя этот процесс часто сопровождается деградацией. Карбонилы металлов растворимы в неполярных и полярных органических растворителях, таких как бензол , диэтиловый эфир , ацетон , ледяная уксусная кислота и четыреххлористый углерод . Некоторые соли катионных и анионных карбонилов металлов растворимы в воде или низших спиртах. [10]

Помимо рентгеновской кристаллографии , важными аналитическими методами для характеристики карбонилов металлов являются инфракрасная спектроскопия и спектроскопия ЯМР 13 C. Эти два метода предоставляют структурную информацию в двух совершенно разных временных масштабах. Инфракрасно-активные колебательные моды , такие как колебания растяжения CO, часто быстры по сравнению с внутримолекулярными процессами, тогда как переходы ЯМР происходят на более низких частотах и, таким образом, образцы структур в масштабе времени, который, как оказывается, сопоставим со скоростью внутримолекулярных процессов обмена лигандами. Данные ЯМР предоставляют информацию о «структурах, усредненных по времени», тогда как ИК является мгновенным «снимком». [11] Иллюстрируя различные временные масштабы, исследование октакарбонила дикобальта (Co 2 (CO) 8 ) с помощью инфракрасной спектроскопии дает 13 ν CO полос, что намного больше, чем ожидалось для одного соединения. Эта сложность отражает присутствие изомеров с мостиковыми лигандами CO и без них. Спектр ЯМР 13 C того же вещества демонстрирует только один сигнал при химическом сдвиге 204 ppm. Эта простота указывает на то, что изомеры быстро (по шкале времени ЯМР) взаимопревращаются. [ необходима цитата ]
Пентакарбонил железа демонстрирует только один сигнал 13 C ЯМР из-за быстрого обмена аксиальными и экваториальными лигандами CO псевдовращением Берри . [ необходима ссылка ]

Важным методом характеристики карбонилов металлов является инфракрасная спектроскопия . [13] Колебание C–O, обычно обозначаемое ν CO , происходит при 2143 см −1 для газа окиси углерода. Энергии полосы ν CO для карбонилов металлов коррелируют с прочностью связи углерод–кислород и обратно коррелируют с прочностью π-обратной связи между металлом и углеродом. π-основность металлического центра зависит от множества факторов; в изоэлектронном ряду ( от титана до железа ) в нижней части этого раздела гексакарбонилы показывают уменьшение π-обратной связи по мере увеличения (делания более положительным) заряда на металле. π-основные лиганды увеличивают плотность π-электронов на металле, а улучшенная обратная связь снижает ν CO . Электронный параметр Толмена использует фрагмент Ni(CO) 3 для упорядочивания лигандов по их π-донорным способностям. [14] [15]
Число колебательных мод комплекса карбонила металла может быть определено с помощью теории групп . Только колебательные моды, которые преобразуются как оператор электрического диполя, будут иметь ненулевые прямые продукты и наблюдаются. Таким образом, можно предсказать число наблюдаемых ИК-переходов (но не их энергии). [16] [17] [18] Например, лиганды CO октаэдрических комплексов, таких как Cr(CO) 6 , преобразуются как a 1g , e g , и t 1u , но только мода t 1u (антисимметричное растяжение апикальных карбонильных лигандов) является ИК-разрешенной. Таким образом, в ИК-спектрах октаэдрических гексакарбонилов металлов наблюдается только одна полоса ν CO . Спектры для комплексов с более низкой симметрией более сложные. Например, ИК-спектр Fe 2 (CO) 9 отображает полосы CO при 2082, 2019 и 1829 см −1 . Число ИК-наблюдаемых колебательных мод для некоторых карбонилов металлов показано в таблице. Доступны исчерпывающие таблицы. [13] Эти правила применяются к карбонилам металлов в растворе или газовой фазе. Низкополярные растворители идеальны для высокого разрешения. Для измерений на твердых образцах карбонилов металлов число полос может увеличиваться отчасти из-за симметрии участка. [19]
Карбонилы металлов часто характеризуются с помощью спектроскопии ЯМР 13 C. Для повышения чувствительности этого метода комплексы часто обогащаются 13 CO. Типичный диапазон химического сдвига для терминально связанных лигандов составляет от 150 до 220 ppm. Мостиковые лиганды резонируют между 230 и 280 ppm. [1] Сигналы 13 C смещаются в сторону более высоких полей с увеличением атомного номера центрального металла.
ЯМР-спектроскопия может быть использована для экспериментального определения текучести . [ 26]
Энергию активации процессов обмена лигандами можно определить по температурной зависимости уширения линии. [27]
Масс-спектрометрия дает информацию о структуре и составе комплексов. Спектры поликарбонилов металлов часто легко интерпретируются, поскольку доминирующим процессом фрагментации является потеря карбонильных лигандов ( m / z = 28).
Электронная ионизация является наиболее распространенным методом для характеристики нейтральных карбонилов металлов. Нейтральные карбонилы металлов могут быть преобразованы в заряженные виды путем дериватизации , что позволяет использовать ионизацию электрораспылением (ESI), приборы для которой часто широко доступны. Например, обработка карбонила металла алкоксидом генерирует анионный металлоформиат , который поддается анализу с помощью ESI-MS:
Некоторые карбонилы металлов реагируют с азидом , образуя изоцианатные комплексы с выделением азота . [28] Регулируя напряжение конуса или температуру, можно контролировать степень фрагментации. Можно определить молярную массу исходного комплекса, а также информацию о структурных перестройках, включающих потерю карбонильных лигандов в условиях ESI-MS. [29]
Масс-спектрометрия в сочетании с инфракрасной фотодиссоциационной спектроскопией может предоставить колебательную информацию для ионных карбонильных комплексов в газовой фазе. [30]

При исследовании инфракрасного спектра Галактического центра Млечного Пути были обнаружены колебания оксида железа карбонилов в межзвездных пылевых облаках. [32] Кластеры карбонилов железа также наблюдались в хондритах Jiange H5, идентифицированных с помощью инфракрасной спектроскопии. Для терминальных и мостиковых лигандов оксида углерода были обнаружены четыре инфракрасные частоты растяжения. [33]
В богатой кислородом атмосфере Земли карбонилы металлов подвергаются окислению до оксидов металлов. Обсуждается, образовывались ли такие комплексы в восстановительных гидротермальных средах добиологической предыстории и могли ли они быть доступны в качестве катализаторов для синтеза критических биохимических соединений, таких как пировиноградная кислота . [34] Следы карбонилов железа, никеля и вольфрама были обнаружены в газообразных эманациях из канализационного ила муниципальных очистных сооружений . [35]
Ферменты гидрогеназы содержат CO, связанный с железом. Считается, что CO стабилизирует низкие степени окисления, что облегчает связывание водорода . Ферменты дегидрогеназа оксида углерода и ацетил-КоА-синтаза также участвуют в биопроцессинге CO. [36] Комплексы, содержащие оксид углерода, используются для токсичности CO и сигнализации. [37]
Синтез карбонилов металлов является широко изучаемым предметом металлоорганических исследований. Со времени работы Монда, а затем Хибера было разработано много процедур для получения моноядерных карбонилов металлов, а также гомо- и гетерометаллических карбонильных кластеров. [38]
Тетракарбонил никеля и пентакарбонил железа можно получить по следующим уравнениям путем реакции тонкоизмельченного металла с оксидом углерода : [39]
Тетракарбонил никеля образуется с оксидом углерода уже при 80 °C и атмосферном давлении, тонкодисперсное железо реагирует при температурах от 150 до 200 °C и давлении оксида углерода 50–200 бар. [40] Другие карбонилы металлов получают менее прямыми методами. [41]
Некоторые карбонилы металлов получаются путем восстановления галогенидов металлов в присутствии высокого давления оксида углерода. Используются различные восстановители, включая медь , алюминий , водород , а также алкилы металлов, такие как триэтилалюминий . Показательным является образование гексакарбонила хрома из безводного хлорида хрома(III) в бензоле с алюминием в качестве восстановителя и хлоридом алюминия в качестве катализатора: [39]
Использование алкилов металлов, таких как триэтилалюминий и диэтилцинк , в качестве восстановителя приводит к окислительной связи алкильного радикала с образованием димерного алкана :
Соли вольфрама , молибдена , марганца и родия могут быть восстановлены с помощью алюмогидрида лития . Гексакарбонил ванадия получают с натрием в качестве восстановителя в хелатирующих растворителях, таких как диглим . [9]
В водной фазе соли никеля или кобальта могут быть восстановлены, например, дитионитом натрия . В присутствии оксида углерода соли кобальта количественно преобразуются в анион тетракарбонилкобальта(−1): [9]
Некоторые карбонилы металлов получаются с использованием CO непосредственно в качестве восстановителя . Таким образом, Хибер и Фукс впервые получили декакарбонил дирения из оксида: [42]
При использовании оксидов металлов в качестве продукта реакции образуется диоксид углерода . При восстановлении хлоридов металлов оксидом углерода образуется фосген , как при получении карбонилхлорида осмия из хлоридных солей. [38] Окись углерода также подходит для восстановления сульфидов , где побочным продуктом является карбонилсульфид .
Фотолиз или термолиз моноядерных карбонилов приводит к образованию ди- и полиметаллических карбонилов, таких как динонакарбонил железа (Fe 2 (CO) 9 ). [43] [44] При дальнейшем нагревании продукты в конечном итоге распадаются на металл и оксид углерода. [ необходима ссылка ]
Термическое разложение додекакарбонила триосмия (Os 3 (CO) 12 ) дает кластеры карбонила осмия с более высоким ядерным числом, такие как Os 4 (CO) 13 , Os 6 (CO) 18 вплоть до Os 8 (CO) 23 . [9]
Смешанные лигандные карбонилы рутения , осмия , родия и иридия часто генерируются путем абстрагирования CO из растворителей, таких как диметилформамид (ДМФА) и 2-метоксиэтанол . Типичным является синтез IrCl(CO)(PPh3 ) 2 из реакции хлорида иридия(III) и трифенилфосфина в кипящем растворе ДМФА. [45]
Реакция солевого метатезиса солей, таких как KCo(CO) 4 с [Ru(CO) 3Cl2 ] 2, селективно приводит к образованию смешанных металлических карбонилов , таких как RuCo2 ( CO) 11 . [46]
Синтез ионных карбонильных комплексов возможен путем окисления или восстановления нейтральных комплексов. Анионные карбонилаты металлов могут быть получены, например, путем восстановления двуядерных комплексов с натрием. Известным примером является натриевая соль тетракарбонилата железа (Na2Fe ( CO) 4 , реагент Коллмана ), которая используется в органическом синтезе. [47]
Катионные гексакарбонильные соли марганца , технеция и рения можно получить из карбонилгалогенидов под давлением оксида углерода путем реакции с кислотой Льюиса .
Использование сильных кислот позволило получить карбонильные катионы золота, такие как [Au(CO) 2 ] + , которые используются в качестве катализатора для карбонилирования алкенов . [48] Катионный карбонильный комплекс платины [Pt(CO) 4 ] 2+ может быть получен при работе в так называемых суперкислотах, таких как пентафторид сурьмы . [49] Хотя CO обычно рассматривается как лиганд для низковалентных ионов металлов, комплекс четырехвалентного железа [Cp* 2 Fe] 2+ (комплекс с 16 валентными электронами) количественно связывает CO, образуя диамагнитный Fe(IV)-карбонил [Cp* 2 FeCO] 2+ (комплекс с 18 валентными электронами). [50]
Карбонилы металлов являются важными предшественниками для синтеза других металлоорганических комплексов. Обычными реакциями являются замещение оксида углерода другими лигандами, реакции окисления или восстановления металлического центра и реакции на лиганде оксида углерода. [1]
Замещение лигандов CO может быть вызвано термически или фотохимически донорными лигандами. Диапазон лигандов велик и включает фосфины , цианид (CN − ), доноры азота и даже эфиры, особенно хелатирующие. Алкены , особенно диены , являются эффективными лигандами, которые дают синтетически полезные производные. Замещение 18-электронных комплексов обычно следует диссоциативному механизму , включающему 16-электронные промежуточные соединения. [51]
Замещение происходит по диссоциативному механизму :
Энергия диссоциации составляет 105 кДж/моль (25 ккал/моль) для тетракарбонила никеля и 155 кДж/моль (37 ккал/моль) для гексакарбонила хрома . [1]
Замещение в 17-электронных комплексах, которые встречаются редко, происходит по ассоциативным механизмам с 19-электронными промежуточными соединениями.
Скорость замещения в 18-электронных комплексах иногда катализируется каталитическими количествами окислителей посредством переноса электронов . [52]
Карбонилы металлов реагируют с восстановителями, такими как металлический натрий или амальгама натрия, с образованием анионов карбонилметаллата (или карбонилирования):
Для пентакарбонила железа получается тетракарбонилферрат с потерей CO:
Ртуть может встраиваться в связи металл–металл некоторых многоядерных карбонилов металлов:
Лиганд CO часто подвержен атаке нуклеофилов . Например, оксид триметиламина и бис(триметилсилил)амид калия преобразуют лиганды CO в CO 2 и CN − соответственно. В « реакции основания Хибера » ион гидроксида атакует лиганд CO, давая металлакарбоновую кислоту , за которой следует высвобождение диоксида углерода и образование гидридов металлов или карбонилметаллатов. Хорошо изученным примером этого нуклеофильного присоединения является превращение пентакарбонила железа в анион гидридожелеза тетракарбонила :
Гидридные реагенты также атакуют лиганды CO, особенно в катионных металлических комплексах, образуя формильное производное :
Литийорганические реагенты присоединяются к карбонилам металлов к ацилметаллическим карбонильным анионам. O - Алкилирование этих анионов, например, солями Меервейна , дает карбены Фишера .
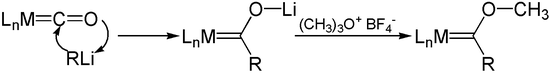
Несмотря на то, что они находятся в низких формальных степенях окисления , карбонилы металлов относительно нереактивны по отношению ко многим электрофилам . Например, они устойчивы к воздействию алкилирующих агентов, слабых кислот и слабых окислителей . Большинство карбонилов металлов подвергаются галогенированию . Например, пентакарбонил железа образует галогениды карбонилов железа:
Связи металл-металл расщепляются галогенами. В зависимости от используемой схемы подсчета электронов это можно рассматривать как окисление атомов металла:
Большинство комплексов карбонилов металлов содержат смесь лигандов. Примерами служат исторически важный IrCl(CO)(P(C 6 H 5 ) 3 ) 2 и антидетонационный агент (CH 3 C 5 H 4 )Mn(CO) 3 . Исходными соединениями для многих из этих комплексов смешанных лигандов являются бинарные карбонилы, те виды формулы [M x (CO) n ] z , многие из которых коммерчески доступны. Формулы многих карбонилов металлов можно вывести из правила 18 электронов .
Также хорошо известны крупные анионные кластеры никеля , палладия и платины . Многие анионы карбонила металлов могут быть протонированы с образованием гидридов карбонила металлов .
Неклассический описывает те карбонильные комплексы, где ν CO выше, чем для свободного оксида углерода. В неклассических комплексах CO расстояние CO короче, чем для свободного CO (113,7 пм). Структура [Fe(CO) 6 ] 2+ с d C-O = 112,9 пм иллюстрирует этот эффект. Эти комплексы обычно катионные, иногда дикатионные. [58]

Карбонилы металлов используются в нескольких промышленных процессах. Возможно, самым ранним применением было извлечение и очистка никеля через тетракарбонил никеля по процессу Монда (см. также карбонильная металлургия ). [ необходима цитата ]
Аналогичным способом карбонильное железо , порошок металла высокой чистоты, получают путем термического разложения пентакарбонила железа. Карбонильное железо используется, в частности, для приготовления индукторов , пигментов , в качестве пищевых добавок , [59] в производстве радиопоглощающих материалов в технологии «стелс» , [60] и в термическом напылении . [ требуется ссылка ]
Карбонилы металлов используются в ряде промышленно важных реакций карбонилирования . В оксо-процессе алкен , водородный газ и оксид углерода реагируют вместе с катализатором (таким как октакарбонил дикобальта ) , давая альдегиды . Показательным является производство масляного альдегида из пропилена :
Бутиральдегид преобразуется в промышленных масштабах в 2-этилгексанол , предшественник пластификаторов ПВХ , путем альдольной конденсации с последующим гидрированием полученного гидроксиальдегида. «Оксоальдегиды», получаемые в результате гидроформилирования, используются для крупномасштабного синтеза жирных спиртов, которые являются предшественниками моющих средств . Гидроформилирование — это реакция с высокой атомной экономией , особенно если реакция протекает с высокой региоселективностью . [ требуется цитата ]
Другая важная реакция, катализируемая карбонилами металлов, — гидрокарбоксилирование . Ниже приведен пример синтеза акриловой кислоты и эфиров акриловой кислоты:
Также циклизация ацетилена в циклооктатетраен использует металлокарбонильные катализаторы: [61]
В процессах Monsanto и Cativa уксусная кислота производится из метанола, оксида углерода и воды с использованием йодистого водорода , а также родиевых и иридиевых карбонильных катализаторов соответственно. Связанные реакции карбонилирования дают уксусный ангидрид . [62]
Молекулы, выделяющие оксид углерода, представляют собой комплексы карбонила металла, которые разрабатываются как потенциальные препараты для высвобождения CO. При низких концентрациях CO действует как сосудорасширяющее и противовоспалительное средство. CO-RM были задуманы как фармакологический стратегический подход к переносу и доставке контролируемых количеств CO в ткани и органы. [63]
Известно, что многие лиганды образуют гомолептические и смешанные лигандные комплексы , которые аналогичны карбонилам металлов. [ необходима цитата ]
Металлические нитрозилы, соединения с лигандами NO , многочисленны. Однако, в отличие от металлических карбонилов, гомолептические металлические нитрозилы редки. NO является более сильным π-акцептором, чем CO. Хорошо известные нитрозилкарбонилы включают CoNO(CO) 3 и Fe(NO) 2 (CO) 2 , которые являются аналогами Ni(CO) 4 . [64]
Комплексы, содержащие CS , известны, но редки. [65] [66] Редкость таких комплексов частично объясняется тем, что очевидный исходный материал, моносульфид углерода , нестабилен. Таким образом, синтез тиокарбонильных комплексов требует косвенных путей, таких как реакция динатрий тетракарбонилферрата с тиофосгеном :
Были охарактеризованы комплексы CSe и CTe. [67]
Изоцианиды также образуют обширные семейства комплексов, которые связаны с металлическими карбонилами. Типичными изоцианидными лигандами являются метилизоцианид и t -бутилизоцианид (Me 3 CNC). Особым случаем является CF 3 NC , нестабильная молекула, которая образует стабильные комплексы, поведение которых очень похоже на поведение металлических карбонилов. [68]
Токсичность карбонилов металлов обусловлена токсичностью оксида углерода , металла, и из-за летучести и нестабильности комплексов любая присущая металлу токсичность, как правило, становится намного более серьезной из-за легкости воздействия. Воздействие происходит при вдыхании, или для жидких карбонилов металлов при проглатывании или из-за хорошей жирорастворимости при резорбции кожей. Большая часть клинического опыта была получена при токсикологическом отравлении тетракарбонилом никеля и пентакарбонилом железа из-за их использования в промышленности. Тетракарбонил никеля считается одним из сильнейших ингаляционных ядов. [69]
Вдыхание тетракарбонила никеля вызывает острые неспецифические симптомы , похожие на отравление угарным газом , такие как тошнота , кашель , головная боль , лихорадка и головокружение . Через некоторое время возникают тяжелые легочные симптомы, такие как кашель, тахикардия и цианоз , или проблемы с желудочно-кишечным трактом . Помимо патологических изменений в легких, таких как металлизация альвеол, наблюдаются повреждения в мозге, печени, почках, надпочечниках и селезенке. Отравление карбонилом металла часто требует длительного восстановления. [70]
Хроническое воздействие путем вдыхания низких концентраций тетракарбонила никеля может вызвать неврологические симптомы, такие как бессонница, головные боли, головокружение и потеря памяти. [70] Тетракарбонил никеля считается канцерогенным, но с момента начала воздействия до клинического проявления рака может пройти от 20 до 30 лет. [71]

Первые эксперименты по реакции оксида углерода с металлами были проведены Юстусом фон Либихом в 1834 году. Пропуская оксид углерода над расплавленным калием, он получил вещество с эмпирической формулой KCO, которое он назвал Kohlenoxidkalium . [72] Как было показано позже, соединение было не карбонилом, а калиевой солью бензолгексола (K 6 C 6 O 6 ) и калиевой солью ацетилендиола (K 2 C 2 O 2 ). [38]

Синтез первого истинного гетеролептического комплекса карбонила металла был осуществлен Паулем Шютценбергером в 1868 году путем пропускания хлора и оксида углерода над платиновой чернью , при этом образовывался дикарбонилдихлорплатина (Pt(CO) 2Cl2 ) . [73]
Людвиг Монд , один из основателей Imperial Chemical Industries , исследовал в 1890-х годах вместе с Карлом Лангером и Фридрихом Квинке различные процессы восстановления хлора, который терялся в процессе Сольве никелевыми металлами, оксидами и солями. [38] В рамках своих экспериментов группа обрабатывала никель оксидом углерода. Они обнаружили, что полученный газ окрашивал газовое пламя горелки в зеленовато-желтый цвет; при нагревании в стеклянной трубке он образовывал никелевое зеркало. Газ можно было конденсировать в бесцветную, прозрачную как вода жидкость с температурой кипения 43 °C. Таким образом, Монд и его коллега открыли первый чистый, гомолептический карбонил металла, тетракарбонил никеля (Ni(CO) 4 ). [74] Необычно высокая летучесть металлического соединения тетракарбонила никеля привела Кельвина к утверждению, что Монд «дал крылья тяжелым металлам». [75]
В следующем году Монд и Марселен Бертело независимо друг от друга открыли пентакарбонил железа , который производится по той же схеме, что и тетракарбонил никеля. Монд осознал экономический потенциал этого класса соединений, которые он коммерчески использовал в процессе Монда и финансировал дополнительные исследования родственных соединений. Генрих Хиртц и его коллега М. Далтон Кауэп синтезировали карбонилы металлов кобальта , молибдена , рутения и нонакарбонил дижелеза . [76] [77] В 1906 году Джеймс Дьюар и Х. О. Джонс смогли определить структуру нонакарбонила дижелеза, который производится из пентакарбонила железа под действием солнечного света. [78] После смерти Монда в 1909 году химия карбонилов металлов на несколько лет была забыта. В 1924 году компания BASF начала промышленное производство пентакарбонила железа по технологии, разработанной Элвином Митташем . Пентакарбонил железа использовался для производства железа высокой чистоты, так называемого карбонильного железа , и пигмента оксида железа . [40] Только в 1927 году А. Джобу и А. Кассалю удалось получить гексакарбонил хрома и гексакарбонил вольфрама , что стало первым синтезом других гомолептических карбонилов металлов. [ требуется ссылка ]
Вальтер Хибер сыграл в последующие годы 1928 года решающую роль в развитии химии карбонилов металлов. Он систематически исследовал и открыл, среди прочего, реакцию основания Хибера , первый известный путь к гидридам карбонилов металлов и синтетические пути, ведущие к карбонилам металлов, таким как декакарбонил дирения . [79] Хибер, который с 1934 года был директором Института неорганической химии в Техническом университете Мюнхена, опубликовал за четыре десятилетия 249 статей по химии карбонилов металлов. [38]
Также в 1930-х годах Вальтер Реппе , промышленный химик и позднее член правления BASF, открыл ряд гомогенных каталитических процессов, таких как гидрокарбоксилирование , в котором олефины или алкины реагируют с оксидом углерода и водой с образованием таких продуктов, как ненасыщенные кислоты и их производные. [38] В этих реакциях, например, тетракарбонил никеля или карбонилы кобальта действуют как катализаторы. [80] Реппе также открыл циклотримеризацию и тетрамеризацию ацетилена и его производных в бензол и производные бензола с карбонилами металлов в качестве катализаторов. BASF построила в 1960-х годах производственную установку для акриловой кислоты по процессу Реппе, который был заменен только в 1996 году более современными методами, основанными на каталитическом окислении пропилена . [ необходима цитата ]

Для рационального проектирования новых комплексов концепция изолобальной аналогии оказалась полезной. Роальд Хоффман был удостоен Нобелевской премии по химии за разработку этой концепции. Она описывает фрагменты карбонилов металлов M(CO) n как части октаэдрических строительных блоков по аналогии с тетраэдрическими фрагментами CH 3 –, CH 2 – или CH– в органической химии. В примере декакарбонил димарганца образуется в терминах изолобальной аналогии двух фрагментов d 7 Mn(CO) 5 , которые изолобальны метильному радикалу CH•
3. По аналогии с тем, как метильные радикалы объединяются, образуя этан , они могут объединяться в димарганцевый декакарбонил . Наличие изолобальных аналоговых фрагментов не означает, что желаемые структуры могут быть синтезированы. В своей Нобелевской лекции Хоффманн подчеркнул, что изолобальная аналогия является полезной, но простой моделью, и в некоторых случаях не приводит к успеху. [81]
Экономические выгоды от катализируемых металлами карбонилирований , таких как химия Реппе и гидроформилирование , привели к росту этой области. Карбонильные соединения металлов были обнаружены в активных центрах трех встречающихся в природе ферментов. [82]
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite journal}}: Отсутствует или пусто |title=( помощь )