Цепь переноса электронов ( ETC [1] ) представляет собой серию белковых комплексов и других молекул, которые переносят электроны от доноров электронов к акцепторам электронов посредством окислительно-восстановительных реакций (как восстановление, так и окисление происходят одновременно ) и связывают этот перенос электронов с переносом протонов ( ионы H + ) через мембрану . Многие ферменты цепи переноса электронов встроены в мембрану .
Поток электронов через электронтранспортную цепь представляет собой экзергонический процесс . Энергия окислительно-восстановительных реакций создает электрохимический градиент протонов , который стимулирует синтез аденозинтрифосфата (АТФ). При аэробном дыхании поток электронов заканчивается молекулярным кислородом в качестве конечного акцептора электронов. При анаэробном дыхании используются другие акцепторы электронов, например сульфат .
В цепи переноса электронов окислительно-восстановительные реакции обусловлены разницей в свободной энергии Гиббса реагентов и продуктов. Свободная энергия, высвобождаемая, когда донор и акцептор электронов с более высокой энергией преобразуются в продукты с более низкой энергией, в то время как электроны переходят от более низкого окислительно-восстановительного потенциала к более высокому , используется комплексами в цепи переноса электронов для создания электрохимического градиента ионов. . Именно этот электрохимический градиент управляет синтезом АТФ посредством сочетания с окислительным фосфорилированием с АТФ-синтазой . [2]
У эукариотических организмов цепь переноса электронов и участок окислительного фосфорилирования находятся на внутренней мембране митохондрий . Энергия, выделяемая в результате реакций кислорода и восстановленных соединений, таких как цитохром с и (косвенно) НАДН и ФАДН2 , используется цепью переноса электронов для перекачки протонов в межмембранное пространство , создавая электрохимический градиент на внутренней митохондриальной мембране . У фотосинтезирующих эукариот цепь переноса электронов находится на мембране тилакоида . Здесь световая энергия управляет транспортом электронов через протонный насос , и возникающий в результате протонный градиент вызывает последующий синтез АТФ. У бактерий цепь переноса электронов может различаться у разных видов, но она всегда представляет собой набор окислительно-восстановительных реакций, которые связаны с синтезом АТФ посредством генерации электрохимического градиента и окислительного фосфорилирования с помощью АТФ-синтазы. [3]

Большинство эукариотических клеток имеют митохондрии , которые производят АТФ в результате реакций кислорода с продуктами цикла лимонных кислот , метаболизма жирных кислот и метаболизма аминокислот . На внутренней мембране митохондрий электроны от НАДН и ФАДН 2 проходят через цепь переноса электронов к кислороду, который обеспечивает энергию, управляющую процессом, поскольку он восстанавливается до воды. [4] Цепь переноса электронов состоит из ферментативного ряда доноров и акцепторов электронов. Каждый донор электронов передает электроны акцептору с более высоким окислительно-восстановительным потенциалом, который, в свою очередь, передает эти электроны другому акцептору, и этот процесс продолжается в последовательности до тех пор, пока электроны не перейдут к кислороду, конечному акцептору электронов в цепи. Каждая реакция высвобождает энергию, поскольку донор и акцептор с более высокой энергией преобразуются в продукты с более низкой энергией. Посредством перенесенных электронов эта энергия используется для создания градиента протонов через митохондриальную мембрану путем «закачки» протонов в межмембранное пространство, создавая состояние с более высокой свободной энергией, которое потенциально может совершать работу. Весь этот процесс называется окислительным фосфорилированием, поскольку АДФ фосфорилируется до АТФ с использованием электрохимического градиента, который устанавливается окислительно-восстановительными реакциями цепи переноса электронов, вызванными реакциями высвобождения энергии кислорода.
Энергия, связанная с переносом электронов по цепи переноса электронов, используется для перекачки протонов из митохондриального матрикса в межмембранное пространство, создавая электрохимический градиент протонов ( ΔpH ) через внутреннюю митохондриальную мембрану. Этот протонный градиент в значительной степени, но не исключительно, отвечает за мембранный потенциал митохондрий (ΔΨ M ). [5] Это позволяет АТФ-синтазе использовать поток H + через фермент обратно в матрикс для генерации АТФ из аденозиндифосфата (АДФ) и неорганического фосфата . Комплекс I (НАДН-коэнзим Q-редуктаза; обозначен I) принимает электроны от переносчика электронов цикла Кребса никотинамидадениндинуклеотида (НАДН) и передает их коферменту Q ( убихинон ; обозначен Q), который также получает электроны от Комплекса II ( сукцинатдегидрогеназа ; обозначен II). Q передает электроны Комплексу III ( комплекс цитохрома bc 1 ; обозначен III), который передает их цитохрому c (cyt c ). Cyt c передает электроны комплексу IV ( цитохром с оксидаза ; обозначен IV).
В митохондриях идентифицированы четыре мембраносвязанных комплекса. Каждый из них представляет собой чрезвычайно сложную трансмембранную структуру, встроенную во внутреннюю мембрану. Три из них — протонные насосы . Структуры электрически связаны жирорастворимыми переносчиками электронов и водорастворимыми переносчиками электронов. Общую цепь переноса электронов можно резюмировать следующим образом:
НАДН, Н + → Комплекс I → Q → Комплекс III → цитохром с → Комплекс IV → H 2 O ↑ Комплекс II ↑ сукцинат
В Комплексе I (НАДН-убихинон-оксидоредуктаза, НАДН-дегидрогеназа I типа или митохондриальный комплекс I; EC 1.6.5.3) два электрона отрываются от НАДН и передаются на жирорастворимый носитель - убихинон (Q). Восстановленный продукт, убихинол (QH 2 ), свободно диффундирует внутри мембраны, а Комплекс I перемещает четыре протона (H + ) через мембрану, создавая таким образом протонный градиент. Комплекс I является одним из основных мест, где происходит преждевременная утечка электронов к кислороду, и, таким образом, является одним из основных мест образования супероксида . [6]
Путь электронов следующий:
НАДН окисляется до НАД + путем восстановления флавинмононуклеотида до FMNH2 за одну двухэлектронную стадию. FMNH 2 затем окисляется в две одноэлектронные стадии через промежуточный семихинон . Таким образом, каждый электрон переходит от FMNH 2 к кластеру Fe-S , от кластера Fe-S к убихинону (Q). Перенос первого электрона приводит к образованию свободнорадикальной ( семихиноновой ) формы Q, а перенос второго электрона восстанавливает семихиноновую форму до убихинольной формы QH 2 . Во время этого процесса четыре протона перемещаются из митохондриального матрикса в межмембранное пространство. [7] Когда электроны движутся через комплекс, электронный ток создается вдоль ширины комплекса 180 Ангстрем внутри мембраны. Этот ток обеспечивает активный транспорт четырех протонов в межмембранное пространство на два электрона от НАДН. [8]
В Комплексе II ( сукцинатдегидрогеназа или сукцинат-CoQ-редуктаза; КФ 1.3.5.1) дополнительные электроны доставляются в хиноновый пул (Q), происходящий от сукцината, и передаются (через флавинадениндинуклеотид (FAD) ) к Q. Комплекс II состоит из четырех белковые субъединицы: сукцинатдегидрогеназа (SDHA); сукцинатдегидрогеназа [убихинон] железо-серная субъединица митохондрий (SDHB); субъединица C сукцинатдегидрогеназного комплекса (SDHC); и субъединицу D сукцинатдегидрогеназного комплекса (SDHD). Другие доноры электронов (например, жирные кислоты и глицерин-3-фосфат) также направляют электроны в Q (через FAD). Комплекс II представляет собой параллельный путь транспорта электронов к Комплексу I, но, в отличие от Комплекса I, по этому пути протоны не транспортируются в межмембранное пространство. Следовательно, путь через Комплекс II вносит меньше энергии в общий процесс цепи переноса электронов.
В Комплексе III ( комплекс цитохрома bc 1 или CoQH 2 -цитохром c редуктаза; EC 1.10.2.2) Q-цикл способствует протонному градиенту за счет асимметричного поглощения/высвобождения протонов. Два электрона отрываются от QH 2 в месте Q O и последовательно передаются двум молекулам цитохрома с — водорастворимого переносчика электронов, расположенного в межмембранном пространстве. Два других электрона последовательно переходят через белок к сайту Q i , где хиноновая часть убихинона восстанавливается до хинола. Протонный градиент образуется в результате окисления одного хинола ( ) в сайте Q o с образованием одного хинона ( ) в сайте Q i . (Всего транслоцируется четыре протона: два протона восстанавливают хинон до хинола и два протона высвобождаются из двух молекул убихинола.)
Когда перенос электронов снижается (из-за высокого мембранного потенциала или ингибиторов дыхания, таких как антимицин А), Комплекс III может переносить электроны к молекулярному кислороду, что приводит к образованию супероксида.
Этот комплекс ингибируется димеркапролом (British Antilewisite, BAL), нафтохиноном и антимицином.
В Комплексе IV ( цитохром с оксидаза ; EC 1.9.3.1), иногда называемом цитохромом АА3, четыре электрона отрываются от четырех молекул цитохрома с и передаются молекулярному кислороду (O 2 ) и четырем протонам, образуя две молекулы воды. Комплекс содержит координированные ионы меди и несколько гемовых групп. В то же время восемь протонов удаляются из митохондриального матрикса (хотя через мембрану транслоцируются только четыре), что способствует образованию протонного градиента. Точные детали протонной накачки в Комплексе IV все еще изучаются. [9] Цианид является ингибитором Комплекса IV.
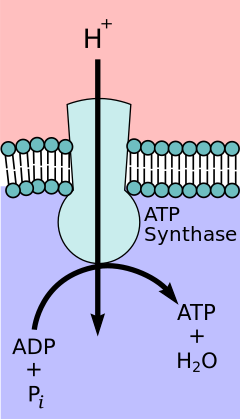
Согласно гипотезе хемиосмотического взаимодействия , предложенной лауреатом Нобелевской премии по химии Питером Д. Митчеллом , цепь переноса электронов и окислительное фосфорилирование связаны протонным градиентом через внутреннюю митохондриальную мембрану. Отток протонов из митохондриального матрикса создает электрохимический градиент (протонный градиент). Этот градиент используется АТФ-синтазным комплексом F O F 1 для образования АТФ посредством окислительного фосфорилирования. АТФ-синтазу иногда называют Комплексом V цепи переноса электронов. [10] Компонент FO АТФ - синтазы действует как ионный канал , обеспечивающий поток протонов обратно в митохондриальный матрикс. Он состоит из субъединиц a, b и c. Протоны в межмембранном пространстве митохондрий сначала попадают в АТФ-синтазный комплекс через субъединичный канал. Затем протоны переходят к субъединицам c. [11] Число c-субъединиц определяет, сколько протонов необходимо, чтобы F O сделал один полный оборот. Например, у человека имеется 8 субъединиц c, следовательно, требуется 8 протонов. [12] После субъединиц c протоны, наконец, попадают в матрикс через канал субъединицы a , который открывается в митохондриальный матрикс. [11] Этот рефлюкс высвобождает свободную энергию , образующуюся при генерации окисленных форм переносчиков электронов (NAD + и Q) с энергией, обеспечиваемой O 2 . Свободная энергия используется для запуска синтеза АТФ, катализируемого компонентом F 1 комплекса. [13] Соединение с окислительным фосфорилированием является ключевым этапом производства АТФ. Однако в определенных случаях разъединение этих двух процессов может быть биологически полезным. Разобщающий белок термогенин , присутствующий во внутренней митохондриальной мембране бурой жировой ткани , обеспечивает альтернативный поток протонов обратно во внутренний митохондриальный матрикс. Тироксин также является естественным разобщителем. Этот альтернативный поток приводит к термогенезу , а не к производству АТФ. [14]
Обратный поток электронов — это перенос электронов по цепи переноса электронов посредством обратных окислительно-восстановительных реакций. Обычно требуя значительного количества энергии, это может уменьшить окисленные формы доноров электронов. Например, НАД + может быть восстановлен до НАДН с помощью Комплекса I. [15] Было показано, что существует несколько факторов, вызывающих обратный поток электронов. Однако для подтверждения этого необходимо провести дополнительную работу. Одним из примеров является блокировка АТФ-синтазы, что приводит к накоплению протонов и, следовательно, к более высокой протондвижущей силе , вызывающей обратный поток электронов . [16]
У эукариот НАДН является важнейшим донором электронов. Связанная цепь переноса электронов: НАДН → Комплекс I → Q → Комплекс III → цитохром с → Комплекс IV → O 2 , где Комплексы I, III и IV являются протонными насосами, а Q и цитохром с являются переносчиками мобильных электронов. Акцептором электронов в этом процессе является молекулярный кислород.
У прокариот ( бактерий и архей ) ситуация сложнее, поскольку имеется несколько разных доноров электронов и несколько разных акцепторов электронов. Обобщенная цепь переноса электронов у бактерий:
Донор Донор Донор ↓ ↓ ↓ дегидрогеназа → хинон → bc 1 → цитохром ↓ ↓ оксидаза (редуктаза) оксидаза (редуктаза) ↓ ↓ Акцептор Акцептор
Электроны могут входить в цепь на трех уровнях: на уровне дегидрогеназы , на уровне хинонового пула или на уровне мобильного переносчика электронов цитохрома . Эти уровни соответствуют последовательному увеличению положительных окислительно-восстановительных потенциалов или последовательному уменьшению разности потенциалов относительно терминального акцептора электронов. Другими словами, они соответствуют последовательно меньшим изменениям свободной энергии Гиббса для общей окислительно-восстановительной реакции.
Отдельные бактерии используют несколько цепей переноса электронов, часто одновременно. Бактерии могут использовать ряд различных доноров электронов, ряд различных дегидрогеназ, ряд различных оксидаз и редуктаз, а также ряд различных акцепторов электронов. Например, E. coli (при аэробном росте с использованием глюкозы и кислорода в качестве источника энергии) использует две разные НАДН-дегидрогеназы и две разные хинолоксидазы, в результате чего одновременно действуют четыре разные цепи переноса электронов.
Общей чертой всех цепей переноса электронов является наличие протонного насоса, создающего электрохимический градиент над мембраной. Цепи переноса электронов бактерий могут содержать как три протонных насоса, как и митохондрии, так и два или хотя бы один.
В современной биосфере наиболее распространенными донорами электронов являются органические молекулы. Организмы, использующие органические молекулы в качестве источника электронов, называются органотрофами . Хемоорганотрофы (животные, грибы, простейшие) и фотолитотрофы (растения и водоросли) составляют подавляющее большинство всех известных форм жизни.
Некоторые прокариоты могут использовать неорганические вещества в качестве источника электронов. Такой организм называется (хемо)литотрофом («пожирателем камней»). Неорганические доноры электронов включают водород , окись углерода , аммиак , нитрит , серу , сульфид , оксид марганца и двухвалентное железо . Литотрофы были обнаружены растущими в скальных образованиях на глубине тысяч метров под поверхностью Земли. Из-за своего объема распространения литотрофы могут фактически превосходить численность органотрофов и фототрофов в нашей биосфере .
Использование неорганических доноров электронов, таких как водород, в качестве источника энергии представляет особый интерес для изучения эволюции . Логически этот тип метаболизма должен был предшествовать использованию органических молекул и кислорода в качестве источника энергии.
Бактерии могут использовать несколько разных доноров электронов. Когда источником электронов является органическое вещество, донором может быть НАДН или сукцинат, и в этом случае электроны попадают в цепь переноса электронов через НАДН-дегидрогеназу (аналогично Комплексу I в митохондриях) или сукцинатдегидрогеназу (аналогично Комплексу II ). Для переработки различных источников энергии могут использоваться и другие дегидрогеназы: формиатдегидрогеназа, лактатдегидрогеназа, глицеральдегид-3-фосфатдегидрогеназа, Н 2 дегидрогеназа ( гидрогеназа ), цепь переноса электронов. Некоторые дегидрогеназы также являются протонными насосами, тогда как другие перенаправляют электроны в пул хинонов. Большинство дегидрогеназ демонстрируют индуцированную экспрессию в бактериальной клетке в ответ на метаболические потребности, вызванные средой, в которой растут клетки. В случае лактатдегидрогеназы в E. coli фермент используется аэробно и в сочетании с другими дегидрогеназами. Он индуцибелен и экспрессируется при высокой концентрации DL-лактата в клетке. [ нужна цитата ]
Хиноны представляют собой мобильные жирорастворимые переносчики, которые переносят электроны (и протоны) между большими, относительно неподвижными макромолекулярными комплексами, встроенными в мембрану. Бактерии используют убихинон (коэнзим Q, тот же хинон, который используют митохондрии) и родственные ему хиноны, такие как менахинон (витамин К2 ) . Археи рода Sulfolobus используют кальдариэллахинон. [17] Использование различных хинонов обусловлено небольшими изменениями окислительно-восстановительных потенциалов, вызванными изменениями в структуре. Изменение окислительно-восстановительных потенциалов этих хинонов может быть связано с изменениями акцепторов электронов или вариациями окислительно-восстановительных потенциалов в бактериальных комплексах. [18]
Протонный насос — это любой процесс, который создает градиент протонов на мембране. Протоны могут физически перемещаться через мембрану, как это видно в митохондриальных комплексах I и IV . Тот же эффект можно получить, перемещая электроны в противоположном направлении. Результатом является исчезновение протона из цитоплазмы и появление протона в периплазме. Митохондриальный комплекс III — это второй тип протонного насоса, который опосредуется хиноном ( цикл Q ).
Некоторые дегидрогеназы являются протонными насосами, а другие нет. Большинство оксидаз и редуктаз являются протонными насосами, но некоторые нет. Цитохром bc 1 представляет собой протонный насос, обнаруженный у многих, но не у всех бактерий (не у E. coli ). Как следует из названия, бактериальный bc 1 похож на митохондриальный bc 1 ( Комплекс III ).
Цитохромы – это белки, содержащие железо. Они встречаются в двух совершенно разных средах.
Некоторые цитохромы являются водорастворимыми переносчиками, которые переносят электроны к крупным неподвижным макромолекулярным структурам, встроенным в мембрану, и обратно. Подвижным переносчиком электронов цитохрома в митохондриях является цитохром с . Бактерии используют ряд различных мобильных переносчиков электронов цитохрома.
Другие цитохромы встречаются в макромолекулах, таких как Комплекс III и Комплекс IV . Они также функционируют как переносчики электронов, но в совершенно другой, внутримолекулярной, твердотельной среде.
Электроны могут входить в электрон-транспортную цепь на уровне мобильного цитохромного или хинонового переносчика. Например, электроны от неорганических доноров электронов (нитрита, двухвалентного железа, цепи переноса электронов) поступают в цепь переноса электронов на уровне цитохрома. Когда электроны входят на окислительно-восстановительный уровень выше, чем НАДН, цепь переноса электронов должна работать в обратном направлении, чтобы произвести эту необходимую молекулу с более высокой энергией.
Поскольку существует множество различных доноров электронов (органическое вещество у органотрофов, неорганическое вещество у литотрофов), существует множество различных акцепторов электронов, как органических, так и неорганических. Как и на других этапах внеземной цивилизации, для облегчения этого процесса требуется фермент.
Если кислород доступен, он чаще всего используется в качестве терминального акцептора электронов у аэробных бактерий и факультативных анаэробов. Оксидаза восстанавливает O 2 до воды , одновременно окисляя что-то еще. В митохондриях концевой мембранный комплекс ( Комплекс IV ) представляет собой цитохромоксидазу, которая окисляет цитохром. Аэробные бактерии используют ряд различных терминальных оксидаз. Например, E. coli ( факультативный анаэроб) не имеет цитохромоксидазы или комплекса bc1 . В аэробных условиях он использует две разные терминальные хинолоксидазы (обе – протонные насосы) для восстановления кислорода до воды.
Бактериальные терминальные оксидазы можно разделить на классы в зависимости от того, молекулы действуют как терминальные акцепторы электронов. Оксидазы класса I представляют собой цитохромоксидазы и используют кислород в качестве терминального акцептора электронов. Оксидазы класса II представляют собой хинолоксидазы и могут использовать различные концевые акцепторы электронов. Оба этих класса можно разделить на категории в зависимости от того, какие окислительно-восстановительные компоненты они содержат. Например, концевые оксидазы Heme aa3 класса 1 намного более эффективны, чем терминальные оксидазы класса 2. [2]
В основном в анаэробных средах используются различные акцепторы электронов, в том числе нитраты, нитриты, трехвалентное железо, сульфат, диоксид углерода и небольшие органические молекулы, такие как фумарат. Когда бактерии растут в анаэробной среде, терминальный акцептор электронов восстанавливается ферментом, называемым редуктазой. E. coli может использовать фумаратредуктазу, нитратредуктазу, нитритредуктазу, ДМСО-редуктазу или триметиламин-N-оксидредуктазу, в зависимости от наличия этих акцепторов в окружающей среде.
Большинство терминальных оксидаз и редуктаз индуцибельны . Они синтезируются организмом по мере необходимости, в ответ на конкретные условия окружающей среды.
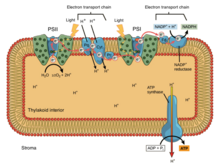
При окислительном фосфорилировании электроны передаются от донора электронов, такого как НАДН, к акцептору, такому как О 2 , через цепь переноса электронов, высвобождая энергию. При фотофосфорилировании энергия солнечного света используется для создания высокоэнергетического донора электронов, который впоследствии может восстанавливать окисленные компоненты и соединяться с синтезом АТФ посредством транслокации протонов с помощью цепи переноса электронов. [9]
Фотосинтетические цепи переноса электронов, подобно митохондриальной цепи, можно рассматривать как частный случай бактериальных систем. Они используют подвижные жирорастворимые хиноновые носители ( филлохинон и пластохинон ) и подвижные водорастворимые носители ( цитохромы ). Они также содержат протонный насос . Протонный насос во всех фотосинтетических цепях напоминает митохондриальный Комплекс III . Общепринятая теория симбиогенеза предполагает, что обе органеллы произошли от бактерий.
{{cite journal}}: Требуется цитировать журнал |journal=( помощь ){{cite book}}: |journal=игнорируется ( помощь )