В неорганической химии бикарбонат ( рекомендованная ИЮПАК номенклатура: гидрокарбонат [2] ) является промежуточной формой в депротонировании угольной кислоты . Это многоатомный анион с химической формулой H C O−
3.
Бикарбонат играет важную биохимическую роль в физиологической системе буферизации pH . [3]
Термин «бикарбонат» был придуман в 1814 году английским химиком Уильямом Хайдом Волластоном . [4] [5] Название до сих пор существует как тривиальное название .
Бикарбонат-ион (гидрокарбонат-ион) — это анион с эмпирической формулой HCO−
3и молекулярная масса 61,01 дальтон ; он состоит из одного центрального атома углерода, окруженного тремя атомами кислорода в тригональной плоской конфигурации, с атомом водорода, присоединенным к одному из атомов кислорода. Он изоэлектронен с азотной кислотой HNO
3. Ион бикарбоната несет отрицательный формальный заряд и является амфипротонным видом, который обладает как кислотными, так и основными свойствами. Он является как сопряженным основанием угольной кислоты H
2КО
3; и сопряженная кислота CO2−
3, карбонат- ион, как показано в этих равновесных реакциях:
Бикарбонатная соль образуется, когда положительно заряженный ион присоединяется к отрицательно заряженным атомам кислорода иона, образуя ионное соединение . Многие бикарбонаты растворимы в воде при стандартной температуре и давлении ; в частности, бикарбонат натрия вносит вклад в общее количество растворенных твердых веществ , общий параметр для оценки качества воды . [6]
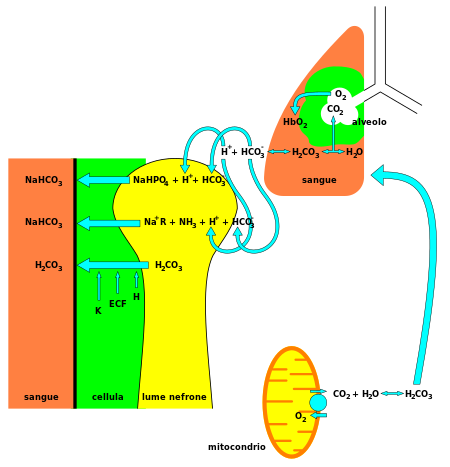
Бикарбонат ( HCO−
3) является жизненно важным компонентом буферной системы pH [3] человеческого организма (поддержание кислотно-щелочного гомеостаза ). 70%–75 % CO 2 в организме преобразуется в угольную кислоту (H 2 CO 3 ), которая является сопряженной кислотой HCO−
3и может быстро в него превратиться. [ необходима цитата ]
С угольной кислотой в качестве центрального промежуточного вида , бикарбонат – в сочетании с водой, ионами водорода и диоксидом углерода – образует эту буферную систему, которая поддерживается в нестабильном равновесии [3], необходимом для обеспечения быстрой устойчивости к изменениям pH как в кислом, так и в основном направлении. Это особенно важно для защиты тканей центральной нервной системы , где изменения pH слишком далеко за пределами нормального диапазона в любом направлении могут оказаться катастрофическими (см. ацидоз или алкалоз ). Недавно также было продемонстрировано, что клеточный метаболизм бикарбоната может регулироваться сигнализацией mTORC1. [7]
Кроме того, бикарбонат играет ключевую роль в пищеварительной системе. Он повышает внутренний pH желудка после того, как сильнокислотные пищеварительные соки закончили переваривать пищу. Бикарбонат также действует, регулируя pH в тонком кишечнике. Он выделяется из поджелудочной железы в ответ на гормон секретин, чтобы нейтрализовать кислый химус, поступающий в двенадцатиперстную кишку из желудка. [8]
Бикарбонат является доминирующей формой растворенного неорганического углерода в морской воде, [9] и в большинстве пресных вод. Как таковой, он является важным поглотителем в углеродном цикле .
Некоторые растения, такие как Chara, используют карбонат и производят карбонат кальция (CaCO3 ) в результате биологического метаболизма. [10]
В экологии пресной воды сильная фотосинтетическая активность пресноводных растений при дневном свете выделяет газообразный кислород в воду и в то же время производит ионы бикарбоната. Они повышают pH до тех пор, пока в определенных обстоятельствах степень щелочности не станет токсичной для некоторых организмов или не сделает другие химические компоненты, такие как аммиак, токсичными. В темноте, когда фотосинтез не происходит, процессы дыхания выделяют углекислый газ, и новые ионы бикарбоната не производятся, что приводит к быстрому падению pH. [ необходима цитата ]
Поток ионов бикарбоната из горных пород, выветренных угольной кислотой дождевой воды, является важной частью углеродного цикла .
Наиболее распространенной солью иона бикарбоната является бикарбонат натрия , NaHCO3 , который обычно известен как пищевая сода . При нагревании или воздействии кислоты, такой как уксусная кислота ( уксус ), бикарбонат натрия выделяет диоксид углерода . Он используется в качестве разрыхлителя в выпечке . [ требуется цитата ]
Бикарбонат аммония используется в производстве диетического печенья . [ необходима цитата ]
В диагностической медицине показатель бикарбоната в крови является одним из нескольких показателей состояния кислотно-щелочной физиологии в организме. Он измеряется вместе с хлоридом , калием и натрием для оценки уровня электролитов в тесте на электролитную панель (который имеет Текущую процедурную терминологию , CPT, код 80051). [ необходима цитата ]
Параметр стандартной концентрации бикарбоната (SBC e ) представляет собой концентрацию бикарбоната в крови при давлении P a CO 2 40 мм рт. ст. (5,33 кПа), полном насыщении кислородом и температуре 36 °C. [11]

Наиболее распространенным показателем качества воды является концентрация общих растворенных твердых веществ (TDS).