Транскрипция — это процесс копирования сегмента ДНК в РНК. Некоторые сегменты ДНК транскрибируются в молекулы РНК, которые могут кодировать белки , называемые матричной РНК (мРНК). Другие сегменты ДНК транскрибируются в молекулы РНК, называемые некодирующими РНК (нкРНК).
И ДНК , и РНК являются нуклеиновыми кислотами , которые используют пары оснований нуклеотидов в качестве комплементарного языка. Во время транскрипции последовательность ДНК считывается РНК- полимеразой , которая производит комплементарную, антипараллельную цепь РНК, называемую первичным транскриптом .
В вирусологии термин транскрипция используется, когда речь идет о синтезе мРНК из вирусной молекулы РНК. Геном многих РНК-вирусов [a] состоит из отрицательно-полярной РНК, которая действует как шаблон для положительно-полярной вирусной информационной РНК - необходимого шага в синтезе вирусных белков, необходимых для вирусной репликации . Этот процесс катализируется вирусной РНК-зависимой РНК-полимеразой . [1]
Единица транскрипции ДНК, кодирующая белок, может содержать как кодирующую последовательность , которая будет транслироваться в белок, так и регуляторные последовательности , которые направляют и регулируют синтез этого белка. Регуляторная последовательность перед ( выше по течению ) кодирующей последовательностью называется пятью основными нетранслируемыми областями (5'UTR); последовательность после ( ниже по течению ) кодирующей последовательности называется тремя основными нетранслируемыми областями (3'UTR). [2]
В отличие от репликации ДНК , транскрипция приводит к образованию РНК-комплемента, включающего нуклеотид урацил (U) во всех случаях, когда в ДНК-комплементе должен был присутствовать тимин (T). [3]
Только одна из двух цепей ДНК служит матрицей для транскрипции. Антисмысловая цепь ДНК считывается РНК-полимеразой от 3'-конца к 5'-концу во время транскрипции (3' → 5'). Комплементарная РНК создается в противоположном направлении, в направлении 5' → 3', совпадая с последовательностью смысловой цепи, за исключением переключения урацила на тимин. Эта направленность обусловлена тем, что РНК-полимераза может добавлять нуклеотиды только к 3'-концу растущей цепи мРНК. Такое использование только 3' → 5' цепи ДНК устраняет необходимость во фрагментах Оказаки , которые наблюдаются при репликации ДНК. [2] Это также устраняет необходимость в РНК-праймере для инициации синтеза РНК, как это имеет место при репликации ДНК.
Не - шаблонная (смысловая) цепь ДНК называется кодирующей цепью , поскольку ее последовательность такая же, как и у вновь созданного транскрипта РНК (за исключением замены урацила на тимин). Это цепь, которая используется по соглашению при представлении последовательности ДНК. [4]
Транскрипция имеет некоторые механизмы проверки, но их меньше и они менее эффективны, чем контрольные элементы для копирования ДНК. В результате, транскрипция имеет более низкую точность копирования, чем репликация ДНК. [5]
Транскрипция делится на инициацию , выход из промотора , элонгацию и терминацию . [6]

Настройка транскрипции у млекопитающих регулируется многими цис-регуляторными элементами , включая основной промотор и промоторно-проксимальные элементы , которые расположены вблизи мест начала транскрипции генов. Основные промоторы в сочетании с общими факторами транскрипции достаточны для управления инициацией транскрипции, но, как правило, имеют низкую базальную активность. [7] Другие важные цис-регуляторные модули локализованы в областях ДНК, которые удалены от мест начала транскрипции. К ним относятся энхансеры , сайленсеры , инсуляторы и элементы привязки. [8] Среди этого созвездия элементов энхансеры и связанные с ними факторы транскрипции играют ведущую роль в инициации транскрипции генов. [9] Энхансер, локализованный в области ДНК, удаленной от промотора гена, может оказывать очень большое влияние на транскрипцию генов, при этом некоторые гены подвергаются 100-кратному увеличению транскрипции из-за активированного энхансера. [10]
Энхансеры — это области генома, которые являются основными элементами регуляции генов. Энхансеры контролируют программы транскрипции генов, специфичные для типа клеток, чаще всего, прокладывая петли на больших расстояниях, чтобы физически приблизиться к промоторам своих целевых генов. [11] Хотя существуют сотни тысяч областей ДНК энхансеров, [12] для определенного типа ткани только определенные энхансеры приближаются к промоторам, которые они регулируют. В исследовании нейронов коры головного мозга было обнаружено 24 937 петель, приближающих энхансеры к их целевым промоторам. [10] Множественные энхансеры, каждый из которых часто находится на расстоянии десятков или сотен тысяч нуклеотидов от своих целевых генов, прокладывают петли к своим целевым промоторам генов и могут координировать друг с другом, чтобы контролировать транскрипцию их общего целевого гена. [11]
Схематическая иллюстрация в этом разделе показывает энхансер, образующий петлю, чтобы приблизиться к промотору целевого гена. Петля стабилизируется димером соединительного белка (например, димером CTCF или YY1 ), при этом один член димера прикреплен к своему связывающему мотиву на энхансере, а другой член прикреплен к своему связывающему мотиву на промоторе (представлен красными зигзагами на иллюстрации). [13] Несколько факторов транскрипции, специфичных для клеточных функций (в человеческой клетке насчитывается около 1600 факторов транскрипции [14] ), обычно связываются со специфическими мотивами на энхансере [15], и небольшая комбинация этих связанных с энхансером факторов транскрипции, когда они приближаются к промотору с помощью петли ДНК, регулируют уровень транскрипции целевого гена. Медиатор (комплекс, обычно состоящий из около 26 белков во взаимодействующей структуре) передает регуляторные сигналы от факторов транскрипции, связанных с ДНК-энхансером, непосредственно ферменту РНК-полимеразе II (pol II), связанному с промотором. [16]
Активные энхансеры обычно транскрибируются с обеих цепей ДНК с помощью РНК-полимераз, действующих в двух разных направлениях, производя две энхансерные РНК (eRNA), как показано на рисунке. [17] Неактивный энхансер может быть связан с неактивным фактором транскрипции. Фосфорилирование фактора транскрипции может активировать его, и этот активированный фактор транскрипции может затем активировать энхансер, с которым он связан (см. маленькую красную звездочку, представляющую фосфорилирование фактора транскрипции, связанного с энхансером на рисунке). [18] Активированный энхансер начинает транскрипцию своей РНК перед активацией транскрипции информационной РНК со своего целевого гена. [19]

Регуляция транскрипции примерно в 60% промоторов также контролируется метилированием цитозинов в динуклеотидах CpG (где за 5' цитозином следует 3' гуанин или сайты CpG ). 5-метилцитозин (5-mC) представляет собой метилированную форму цитозина основания ДНК (см. рисунок). 5-mC представляет собой эпигенетический маркер, обнаруженный преимущественно в сайтах CpG. В геноме человека встречается около 28 миллионов динуклеотидов CpG. [20] В большинстве тканей млекопитающих в среднем от 70% до 80% цитозинов CpG метилированы (образуя 5-метилCpG или 5-mCpG). [21] Однако неметилированные цитозины в последовательностях 5' цитозин-гуанин 3' часто встречаются группами, называемыми островками CpG , на активных промоторах. Около 60% последовательностей промотора имеют остров CpG, тогда как только около 6% последовательностей энхансера имеют остров CpG. [22] Острова CpG представляют собой регуляторные последовательности, поскольку, если островки CpG метилированы в промоторе гена, это может снизить или остановить транскрипцию гена. [23]
Метилирование ДНК регулирует транскрипцию генов посредством взаимодействия с белками домена связывания метила (MBD), такими как MeCP2, MBD1 и MBD2. Эти белки MBD наиболее прочно связываются с высокометилированными островками CpG . [24] Эти белки MBD имеют как домен связывания метил-CpG, так и домен репрессии транскрипции. [24] Они связываются с метилированной ДНК и направляют или направляют белковые комплексы с ремоделированием хроматина и/или модифицирующей гистон активностью к метилированным островкам CpG. Белки MBD обычно подавляют локальный хроматин, например, катализируя введение репрессивных гистоновых меток или создавая общую репрессивную хроматиновую среду посредством ремоделирования нуклеосом и реорганизации хроматина. [24]

Как отмечалось в предыдущем разделе, факторы транскрипции — это белки, которые связываются с определенными последовательностями ДНК для регулирования экспрессии гена. Связывающая последовательность для фактора транскрипции в ДНК обычно имеет длину около 10 или 11 нуклеотидов. Как было подытожено в 2009 году, Вакеризас и др. указали, что существует около 1400 различных факторов транскрипции, закодированных в геноме человека генами, которые составляют около 6% всех генов, кодирующих человеческие белки. [25] Около 94% участков связывания факторов транскрипции (TFBS), которые связаны с генами, реагирующими на сигнал, находятся в энхансерах, тогда как только около 6% таких TFBS находятся в промоторах. [15]
Белок EGR1 является особым фактором транскрипции, который важен для регуляции метилирования CpG-островков. Сайт связывания фактора транскрипции EGR1 часто располагается в последовательностях энхансера или промотора. [26] В геноме млекопитающих имеется около 12 000 сайтов связывания EGR1, и около половины сайтов связывания EGR1 расположены в промоторах, а половина — в энхансерах. [26] Связывание EGR1 с его сайтом связывания целевой ДНК нечувствительно к метилированию цитозина в ДНК. [26]
В то время как в нестимулированных клетках обнаруживаются лишь небольшие количества белка фактора транскрипции EGR1, трансляция гена EGR1 в белок через час после стимуляции резко повышается. [27] Выработка белков фактора транскрипции EGR1 в различных типах клеток может стимулироваться факторами роста, нейротрансмиттерами, гормонами, стрессом и травмой. [27] В мозге, когда нейроны активируются, белки EGR1 активируются и связываются с (рекрутируют) уже существующими ферментами TET1 , которые в больших количествах вырабатываются в нейронах. Ферменты TET могут катализировать деметилирование 5-метилцитозина. Когда факторы транскрипции EGR1 переносят ферменты TET1 к сайтам связывания EGR1 в промоторах, ферменты TET могут деметилировать метилированные островки CpG на этих промоторах. После деметилирования эти промоторы могут инициировать транскрипцию своих целевых генов. Сотни генов в нейронах дифференциально экспрессируются после активации нейронов посредством привлечения EGR1 TET1 к метилированным регуляторным последовательностям в их промоторах. [26]
Метилирование промоторов также изменяется в ответ на сигналы. Три ДНК-метилтрансферазы млекопитающих (DNMT1, DNMT3A и DNMT3B) катализируют добавление метильных групп к цитозинам в ДНК. В то время как DNMT1 является поддерживающей метилтрансферазой, DNMT3A и DNMT3B могут осуществлять новые метилирования. Также существуют две изоформы белков сплайсинга , продуцируемые геном DNMT3A : белки ДНК-метилтрансферазы DNMT3A1 и DNMT3A2. [28]
Изоформа сплайсинга DNMT3A2 ведет себя как продукт классического немедленно-раннего гена и, например, она прочно и временно продуцируется после нейрональной активации. [29] То, где изоформа ДНК-метилтрансферазы DNMT3A2 связывается и добавляет метильные группы к цитозинам, по-видимому, определяется посттрансляционными модификациями гистонов. [30] [31] [32]
С другой стороны, нейронная активация вызывает деградацию DNMT3A1, сопровождающуюся снижением метилирования по крайней мере одного оцененного целевого промотора. [33]
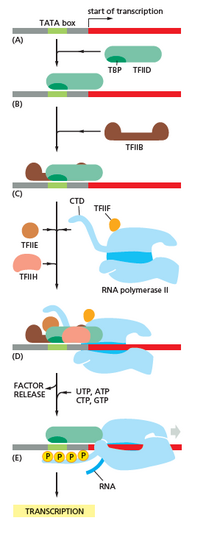
Транскрипция начинается с РНК-полимеразы и одного или нескольких общих факторов транскрипции, связывающихся с последовательностью промотора ДНК , чтобы сформировать закрытый комплекс РНК-полимераза-промотор. В закрытом комплексе ДНК промотора все еще полностью двухцепочечная. [6]
РНК-полимераза, при содействии одного или нескольких общих факторов транскрипции, затем раскручивает приблизительно 14 пар оснований ДНК, образуя открытый комплекс РНК-полимеразы-промотора. В открытом комплексе ДНК промотора частично раскручена и является одноцепочечной. Выставленная одноцепочечная ДНК называется «транскрипционным пузырем». [6]
Затем РНК-полимераза, при содействии одного или нескольких общих факторов транскрипции, выбирает сайт начала транскрипции в транскрипционном пузыре, связывается с инициирующим NTP и удлиняющим NTP (или коротким РНК- праймером и удлиняющим NTP), комплементарными последовательности сайта начала транскрипции, и катализирует образование связи, в результате чего получается начальный продукт РНК. [6]
У бактерий голофермент РНК-полимеразы состоит из пяти субъединиц: 2 α-субъединицы, 1 β-субъединица, 1 β'-субъединица и 1 ω-субъединица. У бактерий есть один общий фактор транскрипции РНК, известный как сигма-фактор . Основной фермент РНК-полимеразы связывается с бактериальным общим фактором транскрипции (сигма) для образования голофермента РНК-полимеразы, а затем связывается с промотором. [6] (РНК-полимераза называется голоферментом, когда сигма-субъединица присоединена к основному ферменту, который состоит только из 2 α-субъединиц, 1 β-субъединицы, 1 β'-субъединицы). В отличие от эукариот, инициирующий нуклеотид зарождающейся бактериальной мРНК не закрыт модифицированным гуаниновым нуклеотидом. Инициирующий нуклеотид бактериальных транскриптов несет 5′ трифосфат (5′-PPP), который можно использовать для картирования участков инициации транскрипции по всему геному. [35]
У архей и эукариот РНК-полимераза содержит субъединицы, гомологичные каждой из пяти субъединиц РНК-полимеразы у бактерий, а также содержит дополнительные субъединицы. У архей и эукариот функции бактериального общего фактора транскрипции сигма выполняются несколькими общими факторами транскрипции, которые работают вместе. [6] У архей есть три общих фактора транскрипции: TBP , TFB и TFE . У эукариот в транскрипции, зависящей от РНК-полимеразы II , есть шесть общих факторов транскрипции: TFIIA , TFIIB ( ортолог архейного TFB), TFIID (мультисубъединичный фактор, в котором ключевая субъединица, TBP , является ортологом архейного TBP), TFIIE ( ортолог архейного TFE), TFIIF и TFIIH . TFIID является первым компонентом, который связывается с ДНК из-за связывания TBP, в то время как TFIIH является последним компонентом, который будет рекрутирован. У архей и эукариот закрытый комплекс РНК-полимеразы-промотора обычно называют « комплексом преинициации ». [36]
Инициация транскрипции регулируется дополнительными белками, известными как активаторы и репрессоры , а в некоторых случаях — ассоциированными коактиваторами или корепрессорами , которые модулируют формирование и функционирование комплекса инициации транскрипции. [6]
После синтеза первой связи РНК-полимераза должна уйти от промотора. В это время наблюдается тенденция к высвобождению транскрипта РНК и образованию укороченных транскриптов. Это называется абортивной инициацией и характерно как для эукариот, так и для прокариот. [37] Абортивная инициация продолжается до тех пор, пока не синтезируется продукт РНК пороговой длины приблизительно в 10 нуклеотидов, после чего происходит уход от промотора и формируется комплекс удлинения транскрипции. [ необходима цитата ]
Механистически, выход промотора происходит посредством сжатия ДНК , что обеспечивает энергию, необходимую для разрыва взаимодействий между голоферментом РНК-полимеразы и промотором. [38]
В бактериях исторически считалось, что сигма-фактор определенно высвобождается после того, как происходит клиренс промотора. Эта теория была известна как модель обязательного высвобождения. Однако более поздние данные показали, что при и после клиренса промотора сигма-фактор высвобождается в соответствии со стохастической моделью, известной как модель стохастического высвобождения . [39]
У эукариот на промоторе, зависимом от РНК-полимеразы II, при очистке промотора TFIIH фосфорилирует серин 5 на карбоксиконцевом домене РНК-полимеразы II, что приводит к привлечению кэпирующего фермента (CE). [40] [41] Точный механизм того, как CE индуцирует очистку промотора у эукариот, пока не известен.

Одна нить ДНК, нить матрицы (или некодирующая нить), используется в качестве матрицы для синтеза РНК. По мере транскрипции РНК-полимераза пересекает нить матрицы и использует комплементарность пар оснований с матрицей ДНК для создания копии РНК (которая удлиняется во время прохождения). Хотя РНК-полимераза пересекает нить матрицы от 3' → 5', кодирующая (не матрица) нить и вновь образованная РНК также могут использоваться в качестве контрольных точек, поэтому транскрипцию можно описать как происходящую от 5' → 3'. Это производит молекулу РНК от 5' → 3', точную копию кодирующей нити (за исключением того, что тимины заменены урацилами , а нуклеотиды состоят из рибозного (5-углеродного) сахара, тогда как ДНК имеет дезоксирибозу (на один атом кислорода меньше) в своем сахарофосфатном остове). [3]
Транскрипция мРНК может включать несколько РНК-полимераз на одной матрице ДНК и несколько раундов транскрипции (амплификация определенной мРНК), поэтому из одной копии гена может быть быстро получено много молекул мРНК. [ требуется ссылка ] Характерные скорости удлинения у прокариот и эукариот составляют около 10–100 нуклеотидов/сек. [42] Однако у эукариот нуклеосомы выступают в качестве основных барьеров для транскрибирующих полимераз во время удлинения транскрипции. [43] [44] У этих организмов пауза, вызванная нуклеосомами, может регулироваться факторами удлинения транскрипции, такими как TFIIS. [44]
Удлинение также включает в себя механизм корректуры, который может заменить неправильно включенные основания. У эукариот это может соответствовать коротким паузам во время транскрипции, которые позволяют соответствующим факторам редактирования РНК связываться. Эти паузы могут быть присущи РНК-полимеразе или быть следствием структуры хроматина. [ необходима цитата ]
Двухцепочечные разрывы в активно транскрибируемых областях ДНК восстанавливаются посредством гомологичной рекомбинации во время фаз S и G2 клеточного цикла . [45] [46] Поскольку транскрипция повышает доступность ДНК к экзогенным химическим веществам и внутренним метаболитам, которые могут вызывать рекомбиногенные повреждения, гомологичная рекомбинация определенной последовательности ДНК может сильно стимулироваться транскрипцией. [47]
Бактерии используют две различные стратегии терминации транскрипции – Rho-независимую терминацию и Rho-зависимую терминацию. При Rho-независимой терминации транскрипция РНК останавливается, когда вновь синтезированная молекула РНК образует богатую GC шпильковую петлю , за которой следует бег Us. Когда формируется шпилька, механическое напряжение разрывает слабые связи rU-dA, теперь заполняя гибрид ДНК–РНК. Это вытягивает поли-U-транскрипт из активного центра РНК-полимеразы, завершая транскрипцию. При Rho-зависимой терминации Rho , белковый фактор, дестабилизирует взаимодействие между шаблоном и мРНК, тем самым высвобождая вновь синтезированную мРНК из комплекса удлинения. [48]
Окончание транскрипции у эукариот изучено меньше, чем у бактерий, но включает расщепление нового транскрипта с последующим независимым от шаблона добавлением аденинов на его новом 3'-конце в процессе, называемом полиаденилированием . [49]
Помимо терминации последовательностями терминатора (которые являются частью гена ) , транскрипция также может нуждаться в прекращении, когда она сталкивается с такими условиями, как повреждение ДНК или активная репликативная вилка . У бактерий Mfd АТФаза может удалить РНК-полимеразу, остановившуюся на повреждении, открыв ее зажим. Она также привлекает механизм репарации нуклеотидов эксцизией для восстановления повреждения. Предполагается, что Mfd также разрешает конфликты между репликацией ДНК и транскрипцией. [50] У эукариот АТФаза TTF2 помогает подавлять действие РНК-полимеразы I и II во время митоза , предотвращая ошибки в хромосомной сегрегации. [51] У архей предполагается, что Eta АТФаза играет аналогичную роль. [52]
РНК-полимераза играет важнейшую роль на всех этапах, включая посттранскрипционные изменения РНК.
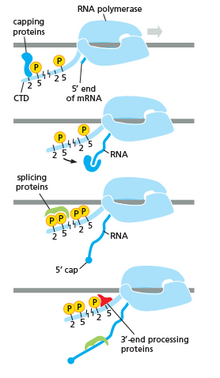
Как показано на изображении справа, очевидно, что CTD (C-концевой домен) представляет собой хвост, который меняет свою форму; этот хвост будет использоваться в качестве носителя сплайсинга, кэпирования и полиаденилирования , как показано на изображении слева. [53]
Ингибиторы транскрипции могут использоваться в качестве антибиотиков против, например, патогенных бактерий ( антибактериальные ) и грибков ( противогрибковые ). Примером такого антибактериального средства является рифампицин , который ингибирует бактериальную транскрипцию ДНК в мРНК путем ингибирования ДНК-зависимой РНК-полимеразы путем связывания ее бета-субъединицы, в то время как 8-гидроксихинолин является противогрибковым ингибитором транскрипции. [54] Эффекты метилирования гистонов также могут работать на ингибирование действия транскрипции. Мощные, биоактивные натуральные продукты, такие как триптолид, которые ингибируют транскрипцию млекопитающих посредством ингибирования субъединицы XPB общего фактора транскрипции TFIIH, недавно были описаны как конъюгат глюкозы для нацеливания на гипоксические раковые клетки с повышенной выработкой транспортера глюкозы. [55]
У позвоночных большинство генных промоутеров содержат остров CpG с многочисленными сайтами CpG . [56] Когда многие из сайтов промотора гена CpG метилированы, ген становится подавленным (замолкающим). [57] Колоректальный рак обычно имеет от 3 до 6 мутаций драйвера и от 33 до 66 мутаций попутчика или пассажира. [58] Однако транскрипционное ингибирование (замолкание) может иметь большее значение, чем мутация, в возникновении прогрессирования рака. Например, при колоректальном раке около 600-800 генов транскрипционно подавлены метилированием острова CpG (см. регуляция транскрипции при раке ). Транскрипционная репрессия при раке может также происходить другими эпигенетическими механизмами, такими как измененная продукция микроРНК . [59] При раке молочной железы подавление транскрипции BRCA1 может происходить чаще из-за избыточной продукции микроРНК-182, чем из-за гиперметилирования промотора BRCA1 (см. Низкая экспрессия BRCA1 при раке молочной железы и яичников ). [ необходима цитата ]
Активные транскрипционные единицы сгруппированы в ядре, в дискретных участках, называемых транскрипционными фабриками или эухроматином . Такие участки можно визуализировать, позволив задействованным полимеразам расширить свои транскрипты в меченых предшественниках (Br-UTP или Br-U) и иммуномаркируя меченую зарождающуюся РНК. Транскрипционные фабрики также можно локализовать с помощью флуоресцентной гибридизации in situ или пометить антителами, направленными против полимераз. В нуклеоплазме клетки HeLa находится ~10 000 фабрик , среди которых ~8 000 фабрик полимеразы II и ~2 000 фабрик полимеразы III. Каждая фабрика полимеразы II содержит ~8 полимераз. Поскольку большинство активных транскрипционных единиц связаны только с одной полимеразой, каждая фабрика обычно содержит ~8 различных транскрипционных единиц. Эти единицы могут быть связаны через промоторы и/или энхансеры, с петлями, образующими «облако» вокруг фактора. [60]
Молекула, которая позволяет генетическому материалу реализоваться в виде белка, была впервые выдвинута Франсуа Жакобом и Жаком Моно . Северо Очоа получил Нобелевскую премию по физиологии и медицине в 1959 году за разработку процесса синтеза РНК in vitro с полинуклеотидфосфорилазой , который был полезен для взлома генетического кода . Синтез РНК с помощью РНК-полимеразы был установлен in vitro несколькими лабораториями к 1965 году; однако РНК, синтезированная этими ферментами, обладала свойствами, которые предполагали существование дополнительного фактора, необходимого для правильного завершения транскрипции. [ необходима цитата ]
Роджер Д. Корнберг получил Нобелевскую премию по химии 2006 года «за исследования молекулярных основ эукариотической транскрипции ». [61]

Транскрипцию можно измерить и обнаружить различными способами: [ необходима ссылка ]

Некоторые вирусы (например, ВИЧ , причина СПИДа ) обладают способностью транскрибировать РНК в ДНК. ВИЧ имеет геном РНК, который обратно транскрибируется в ДНК. Полученная ДНК может быть объединена с геномом ДНК клетки-хозяина. Основной фермент, ответственный за синтез ДНК из шаблона РНК, называется обратной транскриптазой . [64]
В случае ВИЧ обратная транскриптаза отвечает за синтез комплементарной цепи ДНК (кДНК) к геному вирусной РНК. Затем фермент рибонуклеаза H расщепляет цепь РНК, а обратная транскриптаза синтезирует комплементарную цепь ДНК, образуя структуру двойной спирали ДНК (кДНК). КДНК интегрируется в геном клетки-хозяина ферментом интегразой , что заставляет клетку-хозяина генерировать вирусные белки, которые повторно собираются в новые вирусные частицы. При ВИЧ после этого клетка-хозяин подвергается запрограммированной клеточной смерти, или апоптозу , Т-клеток . [65] Однако у других ретровирусов клетка-хозяин остается нетронутой, пока вирус отпочковывается от клетки. [ необходима цитата ]
Некоторые эукариотические клетки содержат фермент с обратной транскрипционной активностью, называемый теломеразой . Теломераза переносит РНК-шаблон, с которого она синтезирует теломеры , повторяющуюся последовательность ДНК, на конец линейных хромосом. Это важно, поскольку каждый раз, когда линейная хромосома дублируется, она укорачивается. При наличии теломеров на концах хромосом укорачивание устраняет часть несущественных, повторяющихся последовательностей, а не последовательность ДНК, кодирующую белок, которая находится дальше от конца хромосомы.
Теломераза часто активируется в раковых клетках, чтобы позволить раковым клеткам бесконечно дублировать свои геномы, не теряя важную последовательность ДНК, кодирующую белок. Активация теломеразы может быть частью процесса, который позволяет раковым клеткам стать бессмертными. Было доказано, что бессмертный фактор рака через удлинение теломер из-за теломеразы встречается в 90% всех канцерогенных опухолей in vivo, а оставшиеся 10% используют альтернативный путь поддержания теломер, называемый ALT или альтернативное удлинение теломер. [66]