Костные морфогенетические белки ( BMP ) представляют собой группу факторов роста, также известных как цитокины и метабологены . [1] Первоначально обнаруженные благодаря их способности индуцировать образование костей и хрящей , BMP теперь считаются группой основных морфогенетических сигналов, управляющих архитектурой тканей по всему телу. [2] Важное функционирование сигналов BMP в физиологии подчеркивается множеством ролей дисрегулируемой передачи сигналов BMP в патологических процессах. Раковое заболевание часто связано с нарушением регуляции сигнальной системы BMP. Отсутствие передачи сигналов BMP является, например, важным фактором прогрессирования рака толстой кишки [3] и, наоборот, чрезмерная активация передачи сигналов BMP после эзофагита, индуцированного рефлюксом, провоцирует пищевод Барретта и, таким образом, играет важную роль в развитии аденокарциномы пищевода . [4]
Рекомбинантные человеческие BMP (rhBMP) используются в ортопедических целях, таких как спондилодез , несращения и оральная хирургия. rhBMP-2 и rhBMP-7 одобрены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) для некоторых применений. rhBMP-2 вызывает большее разрастание костей, чем любые другие BMP, и широко используется не по назначению .
BMP для клинического использования производятся с использованием технологии рекомбинантной ДНК (рекомбинантные BMP человека; rhBMP). Рекомбинантные BMP-2 и BMP-7 в настоящее время одобрены для использования человеком. [5]
rhBMPs используются в хирургических операциях в полости рта. [6] [7] [8] BMP-7 также недавно нашел применение при лечении хронической болезни почек (ХБП). На моделях мышей было показано, что BMP-7 обращает вспять потерю клубочков вследствие склероза .
Исследование, проведенное в 2022 году исследователями из клиники Майо , Маастрихтского университета и биотехнологической компании Ethris GmBH, специализирующейся на РНК-терапии, показало, что химически модифицированная мРНК, кодирующая BMP-2, способствует дозозависимому заживлению остеотомии бедренной кости у самцов крыс. Молекулы мРНК образовывали комплекс с невирусными липидными частицами , загружали на губки и хирургически имплантировали в дефекты кости. Они оставались локализованными вокруг места нанесения. По сравнению с прямым получением rhBMP-2, костные ткани, регенерированные после обработки мРНК, демонстрировали более высокую прочность и меньшее образование массивной мозоли. [9]
Хотя rhBMP-2 и rhBMP-7 используются для лечения различных заболеваний, связанных с костями, включая спондилодез и несращения позвонков , риски этого неправомерного лечения не изучены. [10] Хотя rhBMP одобрены для конкретных применений (спондилодез позвоночника с передним доступом и несращение большеберцовой кости), до 85% всех случаев использования BMP происходит не по назначению . [10] rhBMP-2 широко используется в других методах спондилодеза поясничного отдела позвоночника (например, с использованием заднего доступа, переднего или заднего шейного спондилодеза [10] ).
В 2001 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило rhBMP-7 (также известный как OP-1 ; Stryker Biotech ) для освобождения от использования гуманитарных устройств в качестве альтернативы аутотрансплантату при несращении длинных костей. [10] В 2004 году освобождение от использования гуманитарных устройств было продлено в качестве альтернативы аутотрансплантату при заднелатеральном спондилодезе. [10] В 2002 году rhBMP-2 (Infuse; Medtronic ) был одобрен для использования в переднем поясничном межтеловом спондилодезе (ALIF) с помощью устройства для поясничного спондилодеза. [10] В 2008 году был одобрен метод лечения задне-латерального поясничного псевдоартроза , открытых переломов диафиза большеберцовой кости с интрамедуллярной фиксацией гвоздями . [10] В этих продуктах BMP доставляются к месту перелома путем включения в костный имплантат и постепенно высвобождаются, обеспечивая формирование кости, поскольку стимуляция роста BMP должна быть локализована и поддерживаться в течение нескольких недель. BMP элюируются через очищенную коллагеновую матрицу, которую имплантируют в место перелома. [5] rhBMP-2 способствует росту костей лучше, чем любой другой rhBMP, поэтому он гораздо шире используется в клинической практике. [5] Существует «мало споров или разногласий» по поводу эффективности rhBMP-2 для роста костей для достижения спондилодеза, [5] и Medtronic генерирует 700 миллионов долларов годового дохода от своего продукта. [11]
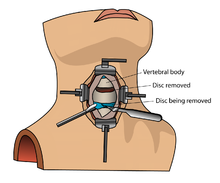
Костный морфогенетический белок (rhBMP) не следует рутинно использовать при любом типе спондилодеза переднего шейного отдела позвоночника, например, при передней дискэктомии шейного отдела позвоночника и спондилодезе . [12] Есть сообщения о том, что эта терапия вызывает отек мягких тканей , что, в свою очередь, может вызвать опасные для жизни осложнения из-за затруднения глотания и давления на дыхательные пути . [12]
BMP взаимодействуют со специфическими рецепторами на поверхности клеток, называемыми рецепторами костных морфогенетических белков (BMPR).
Передача сигнала через BMPRs приводит к мобилизации членов семейства белков SMAD . Сигнальные пути, включающие BMP, BMPR и SMAD, важны для развития сердца, центральной нервной системы и хрящей, а также постнатального развития костей.
Они играют важную роль во время эмбрионального развития в формировании эмбрионального паттерна и раннем формировании скелета. Таким образом, нарушение передачи сигналов BMP может повлиять на строение тела развивающегося эмбриона. Например, BMP4 и его ингибиторы noggin и chordin помогают регулировать полярность эмбриона (т.е. формирование рисунка задом наперед). В частности, BMP-4 и его ингибиторы играют важную роль в нейруляции и развитии нервной пластинки . BMP-4 сигнализирует клеткам эктодермы о развитии в клетки кожи, но секреция ингибиторов подлежащей мезодермой блокирует действие BMP-4, позволяя эктодерме продолжать нормальный курс развития нервных клеток. Кроме того, секреция BMPs крышей развивающегося спинного мозга помогает специфицировать дорсальные сенсорные интернейроны. [13]
Будучи членом суперсемейства трансформирующих факторов роста-бета, передача сигналов BMP регулирует различные паттерны эмбрионального развития во время развития плода и эмбриона. Например, передача сигналов BMP контролирует раннее формирование мюллерова протока (MD), который представляет собой трубчатую структуру на ранней стадии эмбрионального развития и в конечном итоге становится женскими репродуктивными путями. Химическое ингибирование сигналов BMP в курином эмбрионе вызывало нарушение инвагинации MD и блокировало утолщение эпителия области, формирующей MD, указывая на то, что сигналы BMP играют роль в раннем развитии MD. [14] Более того, передача сигналов BMP участвует в формировании передней и задней кишки, [15] формировании паттерна кишечных ворсин и дифференцировке эндокарда. Ворсинки способствуют повышению эффективного всасывания питательных веществ за счет увеличения площади поверхности тонкой кишки. Приобретение или потеря функции передачи сигналов BMP изменяло формирование паттерна кластеров и появление ворсинок на модели кишечника мышей. [16] Сигнал BMP, полученный из миокарда, также участвует в дифференцировке эндокарда во время развития сердца. Ингибирование сигнала BMP на эмбриональной модели рыбок данио вызывало сильное снижение дифференцировки эндокарда, но оказывало лишь незначительный эффект на развитие миокарда. [17] Кроме того, перекрестные помехи Notch-Wnt-Bmp необходимы для формирования радиального паттерна во время развития улитки мыши антагонистическим образом. [18]
Мутации BMP и их ингибиторов связаны с рядом заболеваний человека, влияющих на скелет.
Некоторые BMP также называются «морфогенетическим белками хрящевого происхождения» (CDMP), тогда как другие называются « факторами дифференциации роста » (GDF).
BMP также участвуют в адипогенезе и функциональной регуляции жировой ткани. [19] BMP4 способствует адипогенезу белого цвета, тогда как BMP7 активирует функциональность бурого жира; Ингибиторы BMP также участвуют в этой регуляции [19].
Первоначально было обнаружено семь таких белков. Из них шесть (от BMP2 до BMP7) принадлежат к суперсемейству белков трансформирующего фактора роста бета . BMP1 представляет собой металлопротеазу . С тех пор было обнаружено еще тринадцать BMP, все из которых относятся к семейству TGF-бета, в результате чего их общее число достигло двадцати. [5] Текущая номенклатура признает только 13, так как многие другие вместо этого отнесены к факторам дифференциации роста.

Со времен Гиппократа было известно, что кость обладает значительным потенциалом регенерации и восстановления. Николас Сенн, хирург из Медицинского колледжа Раш в Чикаго, описал полезность антисептических декальцинированных костных имплантатов при лечении остеомиелита и некоторых деформаций костей. [21] Пьер Лакруа предположил, что может существовать гипотетическое вещество остеогенин, которое может инициировать рост костей. [22]
Биологическую основу костного морфогенеза показал Маршалл Р. Урист . Урист сделал ключевое открытие: деминерализованные, лиофилизированные сегменты кости вызывают образование новой кости при имплантации в мышечные мешочки кроликов. Это открытие было опубликовано в 1965 году журналом Urist in Science . [23] Урист предложил название «костный морфогенетический белок» в научной литературе в « Журнале стоматологических исследований» в 1971 году. [24]
Костная индукция представляет собой последовательный многоступенчатый каскад. Ключевыми этапами этого каскада являются хемотаксис , митоз и дифференцировка . Ранние исследования Хари Редди раскрыли последовательность событий, связанных с морфогенезом кости, вызванным костным матриксом. [25] На основании вышеизложенной работы казалось вероятным, что морфогены присутствуют в костном матриксе. Используя серию биоанализов костеобразования, было проведено систематическое исследование с целью выделения и очистки предполагаемых костных морфогенетических белков.
Основным камнем преткновения на пути очистки была нерастворимость деминерализованного костного матрикса. Чтобы преодолеть это препятствие, Хари Редди и Кубер Сампат использовали диссоциативные экстрагенты, такие как 4M гуанидина HCL , 8M мочевина или 1% SDS . [26] Только растворимый экстракт или нерастворимые остатки были неспособны к индукции новой кости. Эта работа предположила, что оптимальная остеогенная активность требует синергии между растворимым экстрактом и нерастворимым коллагеновым субстратом. Это не только представляло собой значительный прогресс в окончательной очистке костных морфогенетических белков в лаборатории Редди [27] [28] , но в конечном итоге также позволило Джону Возни и его коллегам из Института генетики клонировать BMP. [29]
При цене от 6000 до 10 000 долларов США за типичное лечение BMP может быть дорогостоящим по сравнению с другими методами, такими как костная пластика . [ нужна цитация ] Однако эта стоимость часто намного меньше, чем затраты, необходимые при ортопедической ревизии при нескольких операциях.
Хотя мало споров о клиническом успехе rhBMP, [5] существуют разногласия по поводу их использования. Хирургам-ортопедам обычно платят за вклад в разработку нового продукта, [30] [31] , но некоторые из хирургов, ответственных за оригинальные исследования эффективности rhBMP-2 при поддержке Medtronic, были обвинены в предвзятость и конфликт интересов. [32] Например, один хирург, ведущий автор четырех из этих исследовательских работ, не раскрыл никаких финансовых связей с компанией в трех из них; [33] компания Medtronic заплатила ему более 4 миллионов долларов. [33] В другом исследовании ведущий автор не раскрыл никаких финансовых связей с Medtronic; компания заплатила ему не менее 11 миллионов долларов. [33] В серии из 12 публикаций средние финансовые связи авторов с Medtronic составили 12–16 миллионов долларов. [34] В тех исследованиях, в которых участвовало более 20 и 100 пациентов, один или несколько авторов имели финансовые связи в размере 1 миллиона долларов и 10 миллионов долларов США соответственно. [34] В ранних клинических исследованиях с использованием rhBMP-2 не сообщалось о побочных эффектах, связанных с лечением. В 13 оригинальных публикациях, спонсируемых промышленностью, посвященных безопасности, у 780 пациентов не было зарегистрировано никаких побочных эффектов. [34] С тех пор было обнаружено, что в результате использования могут возникнуть потенциальные осложнения, включая смещение имплантата, проседание, инфекцию , урогенитальные явления и ретроградную эякуляцию . [33] [34]
По данным исследования, проведенного кафедрой семейной медицины Орегонского университета здравоохранения и науки, использование BMP быстро возросло: с 5,5% случаев слияния в 2003 году до 28,1% случаев слияния в 2008 году. Использование BMP было выше среди пациентов с предыдущим хирургическое вмешательство и среди тех, кто перенес сложные процедуры спондилодеза (комбинированный передний и задний доступ или более 2 уровней диска). Основные медицинские осложнения, раневые осложнения и частота 30-дневных повторных госпитализаций были практически одинаковыми как с BMP, так и без него. Частота повторных операций также была очень похожей, даже после стратификации по предыдущей операции или сложности хирургического вмешательства, а также после поправки на демографические и клинические особенности. В среднем скорректированные больничные расходы на операции с использованием BMP были примерно на 15 000 долларов больше, чем больничные расходы на спондилодез без BMP, хотя возмещение в рамках системы диагностических групп Medicare в среднем составляло всего лишь примерно на 850 долларов больше. Значительно меньше пациентов, получавших BMP, были выписаны в учреждения квалифицированного сестринского ухода. [35]