Азот – химический элемент ; он имеет символ N и атомный номер 7. Азот — неметалл и самый легкий член группы 15 таблицы Менделеева , часто называемый пниктогенами. Это распространенный элемент во Вселенной , занимающий седьмое место по общему распространению в Млечном Пути и Солнечной системе . При стандартных температуре и давлении два атома элемента связываются с образованием N 2 , двухатомного газа без цвета и запаха . N 2 составляет около 78% атмосферы Земли , что делает его самым распространенным несвязанным элементом в воздухе. Из-за летучести соединений азота азот относительно редко встречается в твердых частях Земли.
Впервые он был обнаружен и выделен шотландским врачом Дэниелом Резерфордом в 1772 году и независимо Карлом Вильгельмом Шееле и Генри Кавендишем примерно в то же время. Название нитроген было предложено французским химиком Жаном-Антуаном-Клодом Шапталем в 1790 году, когда было обнаружено, что азот присутствует в азотной кислоте и нитратах . Антуан Лавуазье предложил вместо этого название « азот » от древнегреческого : ἀζωτικός «нет жизни», так как это удушающий газ ; это название используется во многих языках и появляется в английских названиях некоторых соединений азота, таких как гидразин , азиды и азосоединения .
Элементарный азот обычно получают из воздуха с помощью технологии адсорбции при переменном давлении . Около 2/3 коммерчески производимого элементарного азота используется в качестве инертного (бескислородного) газа для коммерческих целей, таких как упаковка пищевых продуктов, а большая часть остального используется в виде жидкого азота в криогенных приложениях. Многие промышленно важные соединения, такие как аммиак , азотная кислота, органические нитраты ( горючие и взрывчатые вещества ), цианиды , содержат азот. Чрезвычайно сильная тройная связь в элементарном азоте (N≡N), вторая по силе связь в любой двухатомной молекуле после оксида углерода (CO), [6] доминирует в химии азота. Это создает трудности как для организмов, так и для промышленности в преобразовании N 2 в полезные соединения , но в то же время это означает, что сжигание, взрыв или разложение соединений азота с образованием газообразного азота высвобождает большое количество часто полезной энергии. Синтетически производимые аммиак и нитраты являются ключевыми промышленными удобрениями , а нитраты удобрений являются ключевыми загрязнителями при эвтрофикации водных систем. Помимо использования в удобрениях и хранилищах энергии, азот входит в состав таких разнообразных органических соединений, как кевлар , используемый в высокопрочных тканях, и цианакрилат, используемый в суперклее .
Азот встречается во всех организмах, прежде всего в аминокислотах (и, следовательно, в белках ), в нуклеиновых кислотах ( ДНК и РНК ) и в молекуле-переносчике энергии аденозинтрифосфате . В организме человека содержится около 3% азота по массе, это четвертый по распространенности элемент в организме после кислорода, углерода и водорода. Азотный цикл описывает движение элемента из воздуха в биосферу и органические соединения, а затем обратно в атмосферу. Азот входит в состав каждого основного класса фармакологических препаратов, включая антибиотики . Многие лекарства являются имитаторами или пролекарствами природных азотсодержащих сигнальных молекул : например, органические нитраты нитроглицерин и нитропруссид контролируют кровяное давление путем метаболизма в оксид азота . Многие известные азотсодержащие наркотики, такие как природный кофеин и морфин или синтетические амфетамины , действуют на рецепторы нейротрансмиттеров животных .

Соединения азота имеют очень долгую историю: хлорид аммония был известен еще Геродоту . Они были известны еще в средние века. Алхимики знали азотную кислоту как aqua fortis (крепкая вода), а также другие соединения азота, такие как соли аммония и нитраты . Смесь азотной и соляной кислот была известна как царская водка (царская вода) и славилась своей способностью растворять золото , короля металлов. [7]
Открытие азота приписывается шотландскому врачу Дэниелу Резерфорду в 1772 году, который назвал его вредным воздухом . [8] [9] Хотя он не признавал в нем совершенно другое химическое вещество, он четко отличал его от «неподвижного воздуха» Джозефа Блэка или углекислого газа. [10] Тот факт, что в воздухе существует компонент, не поддерживающий горение , был ясен Резерфорду, хотя он и не подозревал, что это элемент. Азот также изучался примерно в то же время Карлом Вильгельмом Шееле , [11] Генри Кавендишем , [12] и Джозефом Пристли , [13] , которые называли его сожженным воздухом или флогистифицированным воздухом . Французский химик Антуан Лавуазье называл азот «токсичным воздухом» или азотом , от греческого слова άζωτικός (azotikos), «нет жизни», поскольку он удушающий . [14] [15] В атмосфере чистого азота погибли животные и потушилось пламя. Хотя имя Лавуазье не было принято в английском языке, поскольку было указано, что все газы, кроме кислорода, либо удушливы, либо откровенно токсичны, оно используется во многих языках (французском, итальянском, португальском, польском, русском, албанском, турецком и т. д.; Немецкий Stickstoff аналогичным образом относится к той же характеристике, а именно ersticken «задушить или удушить») и до сих пор остается в английском языке в общих названиях многих соединений азота, таких как гидразин и соединения азид- иона. Наконец, это привело к названию группы, возглавляемой азотом, « пниктогенами », от греческого πνίγειν «душить». [7]
Английское слово азот (1794) вошло в язык от французского nitrogène , придуманного в 1790 году французским химиком Жаном-Антуаном Шапталем (1756–1832), [16] от французского селитра ( нитрат калия , также называемый селитрой ) и французского суффикса -ген , «производящий», от греческого -γενής (-гены, «рожденный»). Смысл Шапталя заключался в том, что азот является неотъемлемой частью азотной кислоты , которая, в свою очередь, вырабатывается из селитры . Раньше селитру путали с египетским «натроном» ( карбонатом натрия ), который по-гречески назывался νίτρον (нитрон), который, несмотря на название, не содержал нитратов. [17]
Самые ранние военные, промышленные и сельскохозяйственные применения соединений азота использовали селитру ( нитрат натрия или нитрат калия), особенно в порохе , а затем в качестве удобрения . В 1910 году лорд Рэлей обнаружил, что электрический разряд в газообразном азоте производит «активный азот», одноатомный аллотроп азота. [18] «Вращающееся облако ярко-желтого света», созданное его аппаратом, вступало в реакцию с ртутью с образованием взрывчатого нитрида ртути . [19]
Долгое время источники соединений азота были ограничены. Природные источники возникли либо из биологии, либо из отложений нитратов, образующихся в результате атмосферных реакций. Фиксация азота с помощью промышленных процессов, таких как процесс Франка-Каро (1895–1899) и процесс Габера-Боша (1908–1913), облегчила эту нехватку соединений азота до такой степени, что половина мирового производства продуктов питания теперь зависит от синтетических азотных удобрений. [20] В то же время использование процесса Оствальда (1902 г.) для получения нитратов путем промышленной азотфиксации позволило крупномасштабное промышленное производство нитратов в качестве сырья при производстве взрывчатых веществ в мировых войнах 20 века. [21] [22]

Атом азота имеет семь электронов. В основном состоянии они расположены в электронной конфигурации 1s2
2 с2
2р1
х2р1
год2р1
з. Следовательно, он имеет пять валентных электронов на 2s- и 2p-орбиталях, три из которых (p-электроны) неспарены. Он имеет одну из самых высоких электроотрицательностей среди элементов (3,04 по шкале Полинга), уступая только хлору (3,16), кислороду (3,44) и фтору (3,98). (Легкие благородные газы , гелий , неон и аргон , предположительно, также будут более электроотрицательными и фактически находятся на шкале Аллена.) [23] Следуя периодическим тенденциям, его ковалентный радиус одинарной связи 71 пм меньше, чем у бора (84 пм) и углерода (76 пм ) , при этом он больше, чем у кислорода (66 пм) и фтора (57 пм). Нитридный анион N 3- намного больше при 146 пм, подобно анионам оксида ( O 2- : 140 пм) и фторида ( F - : 133 пм). [23] Первые три энергии ионизации азота составляют 1,402, 2,856 и 4,577 МДж·моль -1 , а сумма четвертой и пятой равна16,920 МДж·моль -1 . Из-за этих очень высоких цифр азот не имеет простой катионной химии. [24]
Отсутствие радиальных узлов в подоболочке 2p напрямую отвечает за многие аномальные свойства первого ряда p -блока , особенно в азоте, кислороде и фторе. Подоболочка 2p очень мала и имеет очень похожий радиус с оболочкой 2s, что способствует орбитальной гибридизации . Это также приводит к очень большим электростатическим силам притяжения между ядром и валентными электронами в 2s- и 2p-оболочках, что приводит к очень высокой электроотрицательности. Гипервалентность почти неизвестна в 2p-элементах по той же причине, поскольку из-за высокой электроотрицательности маленькому атому азота трудно быть центральным атомом в богатой электронами трехцентровой четырехэлектронной связи, поскольку он будет иметь тенденцию притягивать электроны. сильно про себя. Таким образом, несмотря на положение азота во главе 15-й группы периодической таблицы, его химический состав сильно отличается от химического состава его более тяжелых собратьев: фосфора , мышьяка , сурьмы и висмута . [25]
Азот можно сравнить с его горизонтальными соседями, углеродом и кислородом, а также с его вертикальными соседями в столбце пниктогена: фосфором, мышьяком, сурьмой и висмутом. Хотя каждый элемент периода 2, от лития до кислорода, демонстрирует некоторое сходство с элементом периода 3 в следующей группе (от магния до хлора; это известно как диагональные отношения ), их степень резко падает за парой бор-кремний. Сходство азота с серой в основном ограничивается кольцевыми соединениями нитрида серы, когда присутствуют только оба элемента. [26]
Азот не разделяет склонности углерода к соединению . Как и углерод, азот имеет тенденцию образовывать ионные или металлические соединения с металлами. Азот образует с углеродом обширный ряд нитридов, в том числе с цепочечной, графитовой и фуллереноподобной структурой. [27]
Он напоминает кислород своей высокой электроотрицательностью и сопутствующей способностью образовывать водородные связи , а также способностью образовывать координационные комплексы , отдавая свои неподеленные пары электронов. Есть некоторые параллели между химией аммиака NH 3 и воды H 2 O. Например, способность обоих соединений протонироваться с образованием NH 4 + и H 3 O + или депротонироваться с образованием NH 2 - и OH - , при этом все это можно выделить в твердые соединения. [28]
Азот, как и оба его горизонтальных соседа, предпочитает образовывать множественные связи, обычно с атомами углерода, кислорода или других атомов азота, посредством pπ –pπ - взаимодействий . [26] Так, например, азот встречается в виде двухатомных молекул и, следовательно, имеет гораздо более низкие температуры плавления (-210 °C) и кипения (-196 °C), чем остальная часть его группы, поскольку молекулы N 2 удерживаются только вместе слабыми взаимодействиями Ван-дер-Ваальса , и существует очень мало электронов, способных создать значительные мгновенные диполи. Это невозможно для его вертикальных соседей; так, оксиды азота , нитриты , нитраты , нитро- , нитрозо- , азо- и диазо -соединения, азиды , цианаты , тиоцианаты и иминопроизводные не находят отклика с фосфором, мышьяком, сурьмой и висмутом. Однако по той же причине сложность оксокислот фосфора не находит отклика в азоте. [26] Если отбросить различия, азот и фосфор образуют друг с другом обширный ряд соединений; они имеют цепную, кольцевую и клеточную структуру. [29]
Таблица теплофизических свойств азота (N 2 ) при атмосферном давлении: [30] [31]

Азот имеет два стабильных изотопа : 14 N и 15 N. Первый встречается гораздо чаще, составляя 99,634% природного азота, а второй (который немного тяжелее) составляет оставшиеся 0,366%. Это приводит к атомному весу около 14,007 ед. [23] Оба этих стабильных изотопа производятся в цикле CNO в звездах , но 14 N встречается чаще, поскольку захват его протона является стадией, ограничивающей скорость. 14 N — один из пяти стабильных нечетно-нечетных нуклидов (нуклид, имеющий нечетное число протонов и нейтронов); остальные четыре — 2 H , 6 Li, 10 B и 180m Ta. [32]
Относительное содержание 14 N и 15 N практически постоянно в атмосфере, но может варьироваться в других местах из-за естественного фракционирования изотопов в результате биологических окислительно-восстановительных реакций и испарения природного аммиака или азотной кислоты . [33] Биологически опосредованные реакции (например, ассимиляция , нитрификация и денитрификация ) строго контролируют динамику азота в почве. Эти реакции обычно приводят к обогащению субстрата 15 N и истощению продукта . [34]
Тяжелый изотоп 15 N был впервые открыт С. М. Науде в 1929 г., а вскоре после этого были открыты тяжелые изотопы соседних элементов — кислорода и углерода . [35] Он представляет собой одно из самых низких сечений захвата тепловых нейтронов среди всех изотопов. [36] Он часто используется в спектроскопии ядерного магнитного резонанса (ЯМР) для определения структуры азотсодержащих молекул из-за его дробного ядерного спина , равного половине, что дает преимущества для ЯМР, такие как более узкая ширина линии. 14 N, хотя он также теоретически пригоден для использования, имеет целочисленный ядерный спин, равный единице, и, следовательно, имеет квадрупольный момент , который приводит к более широким и менее полезным спектрам. [23] Тем не менее, 15 N ЯМР имеет осложнения, не встречающиеся при более распространенной 1 H и 13 C ЯМР спектроскопии. Низкое естественное содержание 15 N (0,36%) значительно снижает чувствительность, проблема, которая только усугубляется его низким гиромагнитным отношением (всего 10,14% от 1 H). В результате отношение сигнал/шум для 1 H примерно в 300 раз больше, чем для 15 N при той же напряженности магнитного поля. [37] Это может быть несколько смягчено изотопным обогащением 15 N путем химического обмена или фракционной перегонки. 15 N-обогащенные соединения имеют то преимущество, что в стандартных условиях они не подвергаются химическому обмену атомов азота с атмосферным азотом, в отличие от соединений с мечеными изотопами водорода , углерода и кислорода, которые необходимо хранить вдали от атмосферы. [23] Соотношение 15 N: 14 N обычно используется в анализе стабильных изотопов в области геохимии , гидрологии , палеоклиматологии и палеоокеанографии , где оно называется δ 15 N . [38]
Из тринадцати других изотопов, полученных синтетическим путем, в диапазоне от 9 N до 23 N, 13 N имеют период полураспада десять минут, а остальные изотопы имеют период полураспада менее восьми секунд. [39] [40] Учитывая разницу в периоде полураспада, 13 N является наиболее важным радиоизотопом азота, он достаточно долгоживущий, чтобы его можно было использовать в позитронно-эмиссионной томографии (ПЭТ), хотя период его полураспада все еще короток, и, следовательно, он должен производиться на месте проведения ПЭТ, например, в циклотроне путем бомбардировки протонами 16 O с образованием 13 N и альфа-частицы . [41]
Радиоизотоп 16 N является преобладающим радионуклидом в теплоносителе водо-водяных реакторов или реакторов с кипящей водой при нормальной эксплуатации. Он производится из 16 O (в воде) посредством реакции (n,p) , в которой атом 16 O захватывает нейтрон и выбрасывает протон. Он имеет короткий период полураспада, около 7,1 с, [40] , но его распад до 16 O приводит к высокоэнергетическому гамма-излучению (от 5 до 7 МэВ). [40] [42] Из-за этого доступ к трубопроводу теплоносителя первого контура в водо-водяном реакторе должен быть ограничен во время работы реактора на мощности. [42] Это чувствительный и непосредственный индикатор утечек из системы теплоносителя первого контура во вторичный паровой цикл, а также основное средство обнаружения таких утечек. [42]

Атомарный азот, также известный как активный азот, обладает высокой реакционной способностью и представляет собой трирадикал с тремя неспаренными электронами. Свободные атомы азота легко вступают в реакцию с большинством элементов с образованием нитридов, и даже когда два свободных атома азота сталкиваются с образованием возбужденной молекулы N 2 , они могут высвободить столько энергии при столкновении даже с такими стабильными молекулами, как углекислый газ и вода , что вызовет гомолитическое деление. на радикалы, такие как CO и O или OH и H. Атомный азот получают путем пропускания электрического разряда через газообразный азот при давлении 0,1–2 мм рт. ст., в результате чего образуется атомарный азот вместе с персиково-желтым излучением, которое медленно затухает в виде послесвечения в течение нескольких минут. даже после прекращения разряда. [26]
Учитывая большую реакционную способность атомарного азота, элементарный азот обычно встречается в виде молекулярного N 2 , динитрогена. Эта молекула представляет собой диамагнитный газ без цвета, запаха и вкуса при стандартных условиях: плавится при -210 °С и кипит при -196 °С. [26] Динитрог в основном нереакционноспособен при комнатной температуре, но, тем не менее, он будет реагировать с металлическим литием и некоторыми комплексами переходных металлов . Это связано с его связью, которая уникальна среди двухатомных элементов в стандартных условиях, поскольку имеет тройную связь N≡N . Тройные связи имеют короткую длину связи (в данном случае 109,76 пм) и высокую энергию диссоциации (в данном случае 945,41 кДж/моль) и, таким образом, очень прочные, что объясняет низкий уровень химической реакционной способности динитрогена. [26] [43]
Возможны другие олигомеры и полимеры азота. Если бы их можно было синтезировать, они могли бы найти потенциальное применение в качестве материалов с очень высокой плотностью энергии, которые можно было бы использовать в качестве мощного топлива или взрывчатых веществ. [44] При чрезвычайно высоких давлениях (1,1 миллиона атм ) и высоких температурах (2000 К), производимых в ячейке с алмазными наковальнями , азот полимеризуется в односвязную кубическую кристаллическую структуру. Эта структура похожа на структуру алмаза , и оба имеют чрезвычайно прочные ковалентные связи , в результате чего его прозвали «азотным алмазом». [45]

При атмосферном давлении молекулярный азот конденсируется ( сжижается ) при 77 К (-195,79 ° С ) и замерзает при 63 К (-210,01 °С) [46] в бета- гексагональную плотноупакованную кристаллическую аллотропную форму. Ниже 35,4 К (-237,6 ° C) азот принимает кубическую кристаллическую аллотропную форму (называемую альфа-фазой). [47] Жидкий азот — бесцветная жидкость, по внешнему виду напоминающая воду, но с плотностью 80,8 % (плотность жидкого азота при температуре кипения 0,808 г/мл) — обычный криоген . [48] Твердый азот имеет множество кристаллических модификаций. Он образует значительное динамическое покрытие поверхности Плутона [49] и внешних спутников Солнечной системы, таких как Тритон . [50] Даже при низких температурах твердый азот довольно летуч и может сублимироваться с образованием атмосферы или конденсироваться обратно в азотный иней. Он очень слабый и потоки в виде ледников и гейзеров азота на Тритоне исходят из области полярных льдов. [51]

Первым примером открытого азотистого комплекса был [Ru(NH 3 ) 5 (N 2 )] 2+ (см. рисунок справа), и вскоре было обнаружено множество других таких комплексов. Эти комплексы , в которых молекула азота отдает по крайней мере одну неподеленную пару электронов центральному катиону металла, иллюстрируют, как N 2 может связываться с металлом(ами) в нитрогеназе и катализаторе процесса Габера : эти процессы, включающие активацию динитрога, жизненно важно в биологии и производстве удобрений. [52] [53]
Динитроген способен координироваться с металлами пятью различными способами. Более хорошо охарактеризованными способами являются концевые M ←N≡N ( η 1 ) и M ←N≡N→M ( ц , бис- η 1 ), в которых неподеленные пары атомов азота отдаются в дар катион металла. Менее изученные способы включают пары электронов, отдающих азот из тройной связи, либо в качестве мостикового лиганда к двум катионам металлов ( μ , бис- η 2 ), либо только к одному ( η 2 ). Пятый и уникальный метод включает тройную координацию в качестве мостикового лиганда, отдавая все три пары электронов тройной связи ( μ 3 -N 2 ). Некоторые комплексы содержат несколько лигандов N 2 , а некоторые содержат N 2 , связанный несколькими способами. Поскольку N 2 изоэлектронен монооксиду углерода (СО) и ацетилену (C 2 H 2 ), связь в диазотистых комплексах тесно связана со связью в карбонильных соединениях, хотя N 2 является более слабым σ -донором и π -акцептором, чем CO. Теоретические исследования показывают, что донорство σ является более важным фактором, позволяющим сформировать связь M–N, чем обратное донорство π , которое в основном только ослабляет связь N–N, и донорство с конца ( η 1 ) осуществляется легче, чем побочное ( η 2 ) пожертвование. [26]
Сегодня диазотистые комплексы известны практически для всех переходных металлов , насчитывая несколько сотен соединений. Обычно их готовят тремя способами: [26]
Иногда связь N≡N может образовываться непосредственно внутри металлокомплекса, например, путем непосредственной реакции координированного аммиака (NH 3 ) с азотистой кислотой (HNO 2 ), но это обычно не применимо. Большинство диазотистых комплексов имеют цвета в диапазоне бело-желтый-оранжевый-красно-коричневый; известно несколько исключений, таких как синий [{Ti( η 5 -C 5 H 5 ) 2 } 2 -(N 2 )]. [26]
Азот связывается почти со всеми элементами таблицы Менделеева, за исключением первых двух благородных газов , гелия и неона , а также некоторых очень короткоживущих элементов после висмута , создавая огромное разнообразие бинарных соединений с различными свойствами и применением. [26] Известны многие бинарные соединения: за исключением гидридов, оксидов и фторидов азота, их обычно называют нитридами . Для большинства элементов обычно присутствует множество стехиометрических фаз (например, MnN, Mn 6 N 5 , Mn 3 N 2 , Mn 2 N, Mn 4 N и Mn x N для 9,2 < x < 25,3). Их можно классифицировать как «солеподобные» (в основном ионные), ковалентные, «алмазоподобные» и металлические (или межузельные ), хотя эта классификация имеет ограничения, обычно вытекающие из непрерывности типов связи вместо дискретных и отдельных типов. что это подразумевает. Обычно их получают путем прямой реакции металла с азотом или аммиаком (иногда после нагревания) или термическим разложением амидов металлов: [54]
Возможны многие варианты этих процессов. Наиболее ионными из этих нитридов являются нитриды щелочных и щелочноземельных металлов Li 3 N (Na, K, Rb и Cs не образуют устойчивых нитридов по стерическим причинам) и M 3 N 2 (M = Be, Mg, Са, Ср, Ба). Формально их можно рассматривать как соли аниона N 3- , хотя разделение зарядов на самом деле не является полным даже для этих высокоэлектроположительных элементов. Однако азиды щелочных металлов NaN 3 и KN 3 , обладающие линейным N−
3анионы, а также Sr(N 3 ) 2 и Ba(N 3 ) 2 . Азиды металлов B-подгруппы ( группы с 11 по 16 ) гораздо менее ионны, имеют более сложную структуру и легко детонируют при ударе. [54]
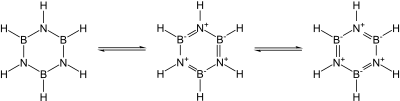
Известно множество ковалентных бинарных нитридов. Примеры включают цианоген ((CN) 2 ), пентанитрид трифосфора (P 3 N 5 ), динитрид дисеры (S 2 N 2 ) и тетранитрид тетрасеры (S 4 N 4 ). Известны также по существу ковалентные нитрид кремния (Si 3 N 4 ) и нитрид германия (Ge 3 N 4 ): нитрид кремния, в частности, мог бы стать многообещающей керамикой, если бы не трудности с ним работы и спекания. В частности, нитриды группы 13 , большинство из которых являются перспективными полупроводниками , изоэлектронны графиту, алмазу и карбиду кремния и имеют сходную структуру: их связь меняется от ковалентной до частично ионной и металлической по мере нисхождения группы. В частности, поскольку единица B–N изоэлектронна по отношению к C–C, а углерод по существу занимает промежуточное положение по размеру между бором и азотом, большая часть органической химии находит отклик в химии бора и азота, например, в боразине («неорганический бензол ») . ). Тем не менее аналогия не точна из-за легкости нуклеофильной атаки на бор из-за его дефицита электронов, что невозможно в полностью углеродсодержащем кольце. [54]
Самой большой категорией нитридов являются нитриды внедрения формул MN, M 2 N и M 4 N (хотя вполне возможен переменный состав), где мелкие атомы азота расположены в промежутках в металлической кубической или гексагональной плотноупакованной решетке . . Они непрозрачны, очень тверды и химически инертны и плавятся только при очень высоких температурах (обычно выше 2500 °C). Они имеют металлический блеск и проводят электричество, как металлы. Они очень медленно гидролизуются с образованием аммиака или азота. [54]
Нитрид-анион (N 3- ) является самым сильным донором π , известным среди лигандов (второй по силе - O 2- ). Нитридокомплексы обычно образуются путем термического разложения азидов или депротонирования аммиака и обычно включают концевую группу {≡N} 3- . Линейный азид-анион ( N−
3), будучи изоэлектронным с закисью азота , углекислым газом и цианатом , образует множество координационных комплексов. Дальнейшая цепочка встречается редко, хотя N4−
4(изоэлектронен карбонату и нитрату ). [54]

В промышленности аммиак (NH 3 ) является наиболее важным соединением азота, и его получают в больших количествах, чем любое другое соединение, поскольку он вносит значительный вклад в удовлетворение пищевых потребностей наземных организмов, служа предшественником продуктов питания и удобрений. Это бесцветный щелочной газ с характерным резким запахом. Наличие водородных связей оказывает очень существенное влияние на аммиак, придавая ему высокие температуры плавления (-78 ° C) и кипения (-33 ° C). В жидком виде это очень хороший растворитель с высокой теплотой испарения (что позволяет использовать его в вакуумных колбах), который также имеет низкую вязкость и электропроводность, высокую диэлектрическую проницаемость и менее плотен, чем вода. Однако водородная связь в NH 3 слабее, чем в H 2 O, из-за меньшей электроотрицательности азота по сравнению с кислородом и наличия только одной неподеленной пары в NH 3 , а не двух в H 2 O. Это слабое основание. в водном растворе ( p K b 4,74); его сопряженная кислота — аммоний , NH+
4. Он также может действовать как чрезвычайно слабая кислота, теряя протон с образованием амидного аниона NH .−
2. Таким образом, он подвергается самодиссоциации, подобно воде, с образованием аммония и амида. Аммиак горит на воздухе или в кислороде, хотя и с трудом, с образованием газообразного азота; он горит во фторе зеленовато-желтым пламенем с образованием трифторида азота . Реакции с другими неметаллами очень сложны и имеют тенденцию приводить к образованию смеси продуктов. Аммиак при нагревании реагирует с металлами с образованием нитридов. [56]
Известно множество других бинарных гидридов азота, но наиболее важными являются гидразин (N 2 H 4 ) и азид водорода (HN 3 ). Хотя гидроксиламин (NH 2 OH) не является гидридом азота, он по свойствам и строению также подобен аммиаку и гидразину. Гидразин — дымящая бесцветная жидкость, по запаху напоминающая аммиак. Его физические свойства очень похожи на свойства воды (температура плавления 2,0 °С, температура кипения 113,5 °С, плотность 1,00 г/см 3 ). Несмотря на то, что это эндотермическое соединение, оно кинетически стабильно. Он быстро и полностью сгорает на воздухе очень экзотермически с образованием азота и водяного пара. Это очень полезный и универсальный восстановитель, более слабое основание, чем аммиак. [57] Он также широко используется в качестве ракетного топлива. [58]
Гидразин обычно получают реакцией аммиака со щелочным гипохлоритом натрия в присутствии желатина или клея: [57]
(Атака гидроксида и аммиака может быть обращена вспять, проходя вместо этого через промежуточный NHCl − .) Причина добавления желатина заключается в том, что он удаляет ионы металлов, таких как Cu 2+ , который катализирует разрушение гидразина в результате реакции с монохлорамином (NH 2 Cl) для получения хлорида аммония и азота. [57]
Азид водорода (HN 3 ) был впервые получен в 1890 году окислением водного гидразина азотистой кислотой. Он очень взрывоопасен, и даже разбавленные растворы могут быть опасны. Он имеет неприятный и раздражающий запах и является потенциально смертельным (но не кумулятивным) ядом. Ее можно рассматривать как кислоту, сопряженную с азид-анионом, и она аналогична галогенводородным кислотам . [57]

Известны все четыре простых тригалогенида азота. Известно несколько смешанных галогенидов и гидрогалогенидов, но они в основном нестабильны; примеры включают NClF 2 , NCl 2 F, NBrF 2 , NF 2 H, NFH 2 , NCl 2 H и NClH 2 . [59]
Трифторид азота (NF 3 , впервые полученный в 1928 году) представляет собой бесцветный газ без запаха, который термодинамически стабилен и наиболее легко получается электролизом расплавленного фторида аммония , растворенного в безводном фтористом водороде . Как и тетрафторид углерода , он совсем не реакционноспособен и стабилен в воде или разбавленных водных кислотах или щелочах. Только при нагревании он действует как фторирующий агент, а с медью , мышьяком, сурьмой и висмутом при контакте при высоких температурах реагирует с образованием тетрафторгидразина (N 2 F 4 ). Катионы NF+
4и н
2Ф+
3также известны (последний в результате реакции тетрафторгидразина с сильными акцепторами фторида, такими как пентафторид мышьяка ), как и ONF 3 , который вызвал интерес из-за короткого расстояния NO-O, подразумевающего частичную двойную связь, и высокополярных и длинных N-F связь. Тетрафторгидразин, в отличие от самого гидразина, может диссоциировать при комнатной температуре и выше с образованием радикала NF 2 •. Азид фтора (FN 3 ) очень взрывоопасен и термически нестабилен. Дифторид азота (N 2 F 2 ) существует в виде термически взаимопревращаемых цис- и транс- изомеров и впервые был обнаружен как продукт термического разложения FN 3 . [59]
Трихлорид азота (NCl 3 ) представляет собой плотную, летучую и взрывоопасную жидкость, физические свойства которой аналогичны свойствам четыреххлористого углерода , хотя одно отличие состоит в том, что NCl 3 легко гидролизуется водой, а CCl 4 - нет. Впервые он был синтезирован в 1811 году Пьером Луи Дюлонгом , который потерял три пальца и глаз из-за его взрывных тенденций. В разбавленном виде он менее опасен и поэтому используется в промышленности для отбеливания и стерилизации муки. Трибромид азота (NBr 3 ), впервые полученный в 1975 году, представляет собой темно-красное, чувствительное к температуре, летучее твердое вещество, взрывоопасное даже при -100 °C. Трииодид азота (NI 3 ) еще более нестабилен и был получен только в 1990 году. Его аддукт с аммиаком, известный ранее, очень чувствителен к ударам: его можно зажечь прикосновением пера, смещением воздушных потоков или даже альфа-частицы . [59] [60] По этой причине небольшие количества трииодида азота иногда синтезируются в качестве демонстрации студентам-химикам старших классов или в качестве акта «химической магии». [61] Азид хлора (ClN 3 ) и азид брома (BrN 3 ) чрезвычайно чувствительны и взрывоопасны. [62] [63]
Известны два ряда оксогалогенидов азота: нитрозилгалогениды (XNO) и нитрилгалогениды (XNO 2 ). Первый — это очень химически активные газы, которые можно получить путем прямого галогенирования закиси азота. Нитрозилфторид (NOF) бесцветен и является сильным фторирующим агентом. Нитрозилхлорид (NOCl) ведет себя примерно таким же образом и часто используется в качестве ионизирующего растворителя. Нитрозилбромид (NOBr) имеет красный цвет. Реакции нитрилгалогенидов во многом схожи: фторид нитрила (FNO 2 ) и хлорид нитрила (ClNO 2 ) также являются химически активными газами и сильными галогенирующими агентами. [59]

Азот образует девять молекулярных оксидов, некоторые из которых были первыми газами, которые были идентифицированы: N 2 O ( закись азота ), NO ( оксид азота ), N 2 O 3 ( триоксид азота ), NO 2 ( диоксид азота ), N 2 O 4 ( тетроксид диазота ), N 2 O 5 ( пятиокись азота ), N 4 O ( нитрозилазид ), [64] и N(NO 2 ) 3 ( тринитрамид ). [65] Все они термически нестабильны по отношению к разложению на свои элементы. Еще одним возможным оксидом, который еще не синтезирован, является оксатетразол (N 4 O), ароматическое кольцо. [64]
Закись азота (N 2 O), более известная как веселящий газ, получается термическим разложением расплавленного нитрата аммония при температуре 250°C. Это окислительно-восстановительная реакция, поэтому в качестве побочных продуктов также образуются оксид азота и азот. Он в основном используется в качестве пропеллента и аэратора для распыляемых взбитых сливок в банках , а раньше широко использовался в качестве анестетика. Несмотря на внешний вид, его нельзя считать ангидридом азотистой кислоты ( H 2 N 2 O 2 ), поскольку эта кислота не образуется при растворении закиси азота в воде. Он довольно инертен (не реагирует с галогенами, щелочными металлами и озоном при комнатной температуре, хотя реакционная способность увеличивается при нагревании) и имеет несимметричную структуру N–N–O (N≡N + O − ↔ − N=N + =O): выше 600 °C он диссоциирует, разрывая более слабую связь N–O. [64] Оксид азота (NO) — простейшая стабильная молекула с нечетным числом электронов. У млекопитающих, включая человека, это важная клеточная сигнальная молекула , участвующая во многих физиологических и патологических процессах. [66] Он образуется в результате каталитического окисления аммиака. Это бесцветный парамагнитный газ, который, будучи термодинамически нестабильным, разлагается на газообразный азот и кислород при 1100–1200 °С. Его связь аналогична связи в азоте, но к разрыхляющей орбитали π * добавляется один дополнительный электрон, и, таким образом, порядок связи снижается примерно до 2,5; следовательно, димеризация до O=N–N=O невыгодна, за исключением случаев, когда температура ниже точки кипения (где цис -изомер более стабилен), поскольку она фактически не увеличивает общий порядок связей и поскольку неспаренный электрон делокализуется поперек молекулы NO, что дает возможность стабильность. Есть также свидетельства существования асимметричного красного димера O = N – O = N, когда оксид азота конденсируется с полярными молекулами. Он реагирует с кислородом с образованием коричневого диоксида азота и с галогенами с образованием нитрозилгалогенидов. Он также реагирует с соединениями переходных металлов с образованием нитрозильных комплексов, большинство из которых имеют яркую окраску. [64]
Синий триоксид азота (N 2 O 3 ) доступен только в твердом виде, поскольку он быстро диссоциирует при температуре выше точки плавления с образованием оксида азота, диоксида азота (NO 2 ) и тетроксида азота (N 2 O 4 ). Последние два соединения несколько трудно изучать по отдельности из-за равновесия между ними, хотя иногда тетраоксид диазота может реагировать путем гетеролитического деления с образованием нитрозония и нитрата в среде с высокой диэлектрической проницаемостью. Диоксид азота — едкий, едкий коричневый газ. Оба соединения можно легко получить разложением сухого нитрата металла. Оба реагируют с водой с образованием азотной кислоты . Четырехокись азота очень полезна для получения безводных нитратов металлов и нитратокомплексов, и к концу 1950-х годов она стала предпочтительным хранимым окислителем для многих ракет как в Соединенных Штатах, так и в СССР . Это связано с тем, что это гиперголическое топливо в сочетании с ракетным топливом на основе гидразина , и его можно легко хранить, поскольку оно находится в жидком состоянии при комнатной температуре. [64]
Термически нестабильный и очень реакционноспособный пятиокись азота (N 2 O 5 ) представляет собой ангидрид азотной кислоты и может быть получен из нее путем дегидратации пятиокисью фосфора . Представляет интерес для приготовления взрывчатых веществ. [67] Это расплывчатое бесцветное кристаллическое твердое вещество, чувствительное к свету. В твердом состоянии он ионный со структурой [NO 2 ] + [NO 3 ] − ; в газе и в растворе – молекулярный O 2 N–O–NO 2 . Гидратация до азотной кислоты происходит легко, как и аналогичная реакция с перекисью водорода с образованием пероксонитовой кислоты (HOONO 2 ). Это сильный окислитель. Газообразная пятиокись азота разлагается следующим образом: [64]
Известно множество азотистых оксокислот , однако большинство из них в чистом виде нестабильны и известны только в виде водных растворов или солей. Гипонитистая кислота (H 2 N 2 O 2 ) — слабая дипротонная кислота со структурой HON=NOH (p K a1 6,9, p K a2 11,6). Кислые растворы довольно стабильны, но при pH выше 4 происходит разложение, катализируемое основаниями, через [HONNO] - на закись азота и гидроксид-анион. Гипонитриты (с участием N
2О2−
2анион) устойчивы к восстановителям и чаще сами действуют как восстановители. Они являются промежуточной стадией окисления аммиака в нитрит, происходящего в круговороте азота . Гипонитрит может действовать как мостиковый или хелатирующий бидентатный лиганд. [68]
Азотистая кислота (HNO 2 ) не известна как чистое соединение, но является обычным компонентом в газовом равновесии и важным водным реагентом: ее водные растворы могут быть получены путем подкисления холодного водного нитрита ( NO−
2, изогнутые) растворы, хотя уже при комнатной температуре диспропорция нитратов и оксида азота значительна. Это слабая кислота с pK 3,35 при 18 °C. Их можно анализировать титриметрически по окислению до нитрата перманганатом . Они легко восстанавливаются до закиси азота и оксида азота диоксидом серы , до азотистой кислоты оловом ( II), до аммиака сероводородом . Соли гидразиния N
2ЧАС+
5реагируют с азотистой кислотой с образованием азидов, которые в дальнейшем реагируют с образованием закиси азота и азота. Нитрит натрия умеренно токсичен в концентрациях выше 100 мг/кг, но небольшие количества часто используются для консервирования мяса и в качестве консерванта, чтобы избежать бактериальной порчи. Его также используют для синтеза гидроксиламина и диазотирования первичных ароматических аминов следующим образом: [68]
Нитрит также является распространенным лигандом, который может координироваться пятью способами. Наиболее распространенными являются нитро (связанные с азотом) и нитрито (связанные с кислородом). Распространена изомерия нитро-нитрито, при этом нитрито-форма обычно менее стабильна. [68]

Азотная кислота (HNO 3 ) на сегодняшний день является наиболее важной и наиболее стабильной из азотистых оксокислот. Это одна из трех наиболее часто используемых кислот (две другие — серная кислота и соляная кислота ), впервые обнаруженная алхимиками в 13 веке. Его получают путем каталитического окисления аммиака до оксида азота, который окисляется до диоксида азота, а затем растворяется в воде с образованием концентрированной азотной кислоты. В Соединенных Штатах Америки ежегодно производится более семи миллионов тонн азотной кислоты, большая часть которой используется, среди прочего, для производства нитратов для удобрений и взрывчатых веществ. Безводную азотную кислоту можно получить перегонкой концентрированной азотной кислоты с пятиокисью фосфора при низком давлении в стеклянном аппарате в темноте. Ее можно производить только в твердом состоянии, так как при плавлении она самопроизвольно разлагается на диоксид азота, а жидкая азотная кислота подвергается самоионизации в большей степени, чем любая другая ковалентная жидкость, следующим образом: [68]
Известны два гидрата, HNO 3 ·H 2 O и HNO 3 ·3H 2 O, которые поддаются кристаллизации. Это сильная кислота, а концентрированные растворы являются сильными окислителями, хотя золото , платина , родий и иридий невосприимчивы к воздействию. Смесь концентрированной соляной и азотной кислот в соотношении 3:1, называемая царской водкой , еще сильнее и успешно растворяет золото и платину, поскольку образуются свободный хлор и нитрозилхлорид, а хлорид-анионы могут образовывать прочные комплексы. В концентрированной серной кислоте азотная кислота протонируется с образованием нитрония , который может действовать как электрофил при ароматическом нитровании: [68]
Термическая стабильность нитратов (с участием тригонального плоского NO−
3анион) зависит от основности металла, как и продукты разложения (термолиза), которые могут варьироваться между нитритом (например, натрия), оксидом (калий и свинец ) или даже самим металлом ( серебро ) в зависимости от их относительной стабильности. Нитрат также является распространенным лигандом со многими способами координации. [68]
Наконец, хотя ортонитровой кислоты (H 3 NO 4 ), которая была бы аналогом ортофосфорной кислоты , не существует, тетраэдрический ортонитрат- анион NO3−
4известен в виде натриевых и калиевых солей: [68]
Эти белые кристаллические соли очень чувствительны к водяному пару и углекислому газу в воздухе: [68]
Несмотря на ограниченный химический состав, ортонитрат-анион интересен со структурной точки зрения из-за его правильной тетраэдрической формы и короткой длины связи N–O, что предполагает значительный полярный характер связи. [68]
Азот — один из важнейших элементов органической химии . Многие органические функциональные группы включают связь углерод-азот , например амиды (RCONR 2 ), амины (R 3 N), имины (RC(=NR)R), имиды (RCO) 2 NR, азиды (RN 3 ), азо соединения (RN 2 R), цианаты (ROCN), изоцианаты (RNCO), нитраты (RONO 2 ), нитрилы (RCN), изонитрилы (RNC), нитриты (RONO), нитросоединения (RNO 2 ), нитрозосоединения (RNO) , оксимы (RC(=NOH)R) и производные пиридина . Связи C–N сильно поляризованы в сторону азота. В этих соединениях азот обычно трехвалентен (хотя он может быть четырехвалентным в солях четвертичного аммония , R 4 N + ) с неподеленной парой, которая может придавать основность соединению, координируясь с протоном. Это может быть компенсировано другими факторами: например, амиды не являются основными, поскольку неподеленная пара делокализована в двойную связь (хотя они могут действовать как основания при очень низком pH, будучи протонированными по атому кислорода), а пиррол не является основным, потому что неподеленная пара делокализована как часть ароматического кольца. [69] Количество азота в химическом веществе можно определить методом Кьельдаля . [70] В частности, азот является важным компонентом нуклеиновых кислот , аминокислот и, следовательно , белков , а также переносящей энергию молекулы аденозинтрифосфата и, таким образом, жизненно важен для всей жизни на Земле. [69]

Азот является наиболее распространенным чистым элементом на Земле, составляя 78,1% объема атмосферы [ 7] (75,5% по массе), около 3,89 миллиона гигатонн . Несмотря на это, его не так много в земной коре, составляя где-то около 19 частей на миллион , наравне с ниобием , галлием и литием . (Это составляет от 300 000 до миллиона гигатонн азота, в зависимости от массы земной коры. [71] ) Единственными важными азотистыми минералами являются селитра ( нитрат калия , селитра) и селитра натрия ( нитрат натрия , чилийская селитра). Однако они не были важным источником нитратов с 1920-х годов, когда стал обычным явлением промышленный синтез аммиака и азотной кислоты. [72]
Соединения азота постоянно обмениваются между атмосферой и живыми организмами. Азот сначала необходимо переработать или « фиксировать » в форму, пригодную для использования в растениях, обычно аммиак. Некоторая фиксация азота осуществляется ударами молнии, производящими оксиды азота, но большая часть осуществляется диазотрофными бактериями с помощью ферментов, известных как нитрогеназы (хотя сегодня промышленная фиксация азота до аммиака также имеет большое значение). Когда аммиак поглощается растениями, он используется для синтеза белков. Эти растения затем перевариваются животными, которые используют соединения азота для синтеза белков и выделения азотсодержащих отходов. Наконец, эти организмы умирают и разлагаются, подвергаясь бактериальному и экологическому окислению и денитрификации , возвращая свободный азот в атмосферу. Промышленная фиксация азота методом Габера в основном используется в качестве удобрения, хотя избыток азотсодержащих отходов при выщелачивании приводит к эвтрофикации пресной воды и созданию морских мертвых зон , поскольку рост бактерий, вызванный азотом, истощает водный кислород до такой степени, что все высшие организмы погибают. Кроме того, закись азота, образующаяся при денитрификации, разрушает озоновый слой атмосферы . [72]
Многие морские рыбы производят большое количество оксида триметиламина , чтобы защитить их от сильного осмотического воздействия окружающей среды; Преобразование этого соединения в диметиламин ответственно за ранний запах несвежей морской рыбы. [73] У животных свободный радикал оксида азота (полученный из аминокислоты ) служит важной регуляторной молекулой кровообращения. [74]
Быстрая реакция оксида азота с водой у животных приводит к образованию его метаболита нитрита . Метаболизм азота в белках у животных , как правило, приводит к выделению мочевины , тогда как метаболизм нуклеиновых кислот у животных приводит к выделению мочевины и мочевой кислоты . Характерный запах разложения мяса животных вызван образованием длинноцепочечных азотсодержащих аминов , таких как путресцин и кадаверин , которые являются продуктами распада аминокислот орнитина и лизина соответственно при разложении белков. [75]
Газообразный азот — это промышленный газ , получаемый фракционной перегонкой жидкого воздуха или механическим способом с использованием газообразного воздуха ( мембрана обратного осмоса под давлением или адсорбция с переменным давлением ). Генераторы азотного газа, использующие мембраны или адсорбцию при переменном давлении (PSA), обычно более экономичны и энергоэффективны, чем азот, доставляемый в больших количествах. [76] Технический азот часто является побочным продуктом обработки воздуха для промышленной концентрации кислорода для производства стали и других целей. При поставке в сжатом виде в баллонах его часто называют ОФН (бескислородный азот). [77] Технический азот уже содержит не более 20 частей на миллион кислорода, также доступны специально очищенные сорта, содержащие не более 2 частей на миллион кислорода и 10 частей на миллион аргона . [78]
В химической лаборатории его готовят обработкой водного раствора хлорида аммония нитритом натрия . [79]
В этой реакции также образуются небольшие количества примесей NO и HNO 3 . Примеси можно удалить, пропуская газ через водную серную кислоту, содержащую дихромат калия . [79]
Его также можно получить термическим разложением дихромата аммония . [80]
Очень чистый азот можно получить термическим разложением азида бария или азида натрия . [81]
Применение соединений азота, естественно, чрезвычайно широко разнообразно из-за огромного размера этого класса: поэтому здесь будут рассматриваться только применения самого чистого азота. Две трети (2/3) азота, производимого промышленностью, продается в виде газа, а оставшаяся треть (1/3) – в жидком виде.
Газ в основном используется в качестве безопасной атмосферы с низкой реакционной способностью там, где кислород в воздухе может представлять опасность пожара, взрыва или окисления. Вот некоторые примеры: [78]
Азот обычно используется при подготовке проб в химическом анализе . Он используется для концентрации и уменьшения объема жидких проб. Направление потока газообразного азота под давлением перпендикулярно поверхности жидкости приводит к испарению растворителя, оставляя при этом растворенное вещество(а) и неиспарившийся растворитель. [87]
Азот можно использовать в качестве замены или в сочетании с углекислым газом для создания давления в кегах с некоторыми сортами пива , особенно со стаутами и британскими элями , поскольку он образует меньшие пузырьки , что делает разливаемое пиво более гладким и пьянящим . [88] Чувствительная к давлению азотная капсула, известная как « виджет », позволяет упаковывать заряженное азотом пиво в банки и бутылки . [89] [90] Баллоны с азотом также заменяют углекислый газ в качестве основного источника энергии для пейнтбольных ружей . Азот должен храниться под более высоким давлением, чем CO 2 , что делает резервуары с азотом тяжелее и дороже. [91]
Некоторое строительное оборудование использует газообразный азот под давлением, чтобы помочь гидравлической системе обеспечить дополнительную мощность для таких устройств, как гидравлический молот . Газообразный азот, образующийся при разложении азида натрия , используется для надувания подушек безопасности . [92]
Поскольку азот сам по себе является удушающим газом, в некоторых юрисдикциях удушение путем вдыхания чистого азота рассматривается как средство смертной казни (в качестве замены смертельной инъекции ). [93] [94] [95] В январе 2024 года Кеннет Юджин Смит стал первым человеком, казненным путем удушья азотом. [96]
Жидкий азот — криогенная жидкость , похожая на воду . При изоляции в соответствующих контейнерах, таких как сосуды Дьюара , его можно транспортировать и хранить с низким уровнем потерь от испарения . [97]

Как и сухой лед , жидкий азот в основном используется для охлаждения до низких температур. Он используется при криоконсервации биологических материалов, таких как кровь и репродуктивные клетки ( сперма и яйцеклетки ). Его используют в криотерапии для удаления кист и бородавок на коже путем их замораживания. [98] Он используется в лабораторных холодных ловушках и крионасосах для получения более низкого давления в вакуумных системах. Он используется для охлаждения термочувствительной электроники, такой как инфракрасные детекторы и детекторы рентгеновского излучения . Другие области применения включают шлифовку замораживанием и обработку материалов, которые являются мягкими или эластичными при комнатной температуре, термоусадочную посадку и сборку инженерных компонентов, а также, в более общем плане, для достижения очень низких температур, где это необходимо. Из-за своей низкой стоимости жидкий азот часто используется для охлаждения, даже когда такие низкие температуры не являются строго необходимыми, например, охлаждение продуктов питания, замораживание скота, замораживание труб для остановки потока при отсутствии клапанов и уплотнение нестабильной почвы путем замерзает всякий раз, когда под ним ведутся раскопки. [78]
Хотя азот нетоксичен, при попадании в закрытое пространство он может вытеснять кислород и, следовательно, представляет опасность удушья . Это может произойти с небольшим количеством предупредительных симптомов, поскольку каротидное тело человека представляет собой относительно плохую и медленную систему восприятия низкого уровня кислорода (гипоксии). [99] Пример произошел незадолго до запуска первой миссии «Спейс Шаттл» 19 марта 1981 года, когда два техника умерли от удушья после того, как вошли в пространство, расположенное на мобильной пусковой платформе «Спейс шаттл» , где в качестве давления находился чистый азот. меры предосторожности против пожара. [100]
При вдыхании при высоких парциальных давлениях (более примерно 4 бар, встречается на глубинах ниже 30 м при подводном плавании с аквалангом ) азот является анестетиком, вызывающим азотный наркоз — временное состояние психического расстройства, похожее на интоксикацию закисью азота . [101] [102]
Азот растворяется в крови и жирах организма. Быстрая декомпрессия (например, когда дайверы слишком быстро всплывают или космонавты слишком быстро декомпрессируют давление в кабине до давления в скафандре) может привести к потенциально смертельному состоянию, называемому декомпрессионной болезнью (ранее известной как кессонная болезнь или изгибы ), когда в кровотоке образуются пузырьки азота, нервы, суставы и другие чувствительные или жизненно важные области. [103] [104] Пузырьки других «инертных» газов (газов, отличных от углекислого газа и кислорода) вызывают те же эффекты, поэтому замена азота в дыхательных газах может предотвратить азотный наркоз, но не предотвращает декомпрессионную болезнь. [105]
Как криогенная жидкость, жидкий азот может быть опасен, вызывая холодные ожоги при контакте, хотя эффект Лейденфроста обеспечивает защиту при очень коротком воздействии (около одной секунды). [106] Проглатывание жидкого азота может привести к серьезным внутренним повреждениям. Например, в 2012 году молодой женщине в Англии пришлось удалить желудок после того, как она приняла коктейль из жидкого азота. [107]
Поскольку коэффициент расширения азота из жидкости в газ составляет 1:694 при 20 °C, при быстром испарении жидкого азота в закрытом пространстве может возникнуть огромная сила. Во время инцидента, произошедшего 12 января 2006 года в Техасском университете A&M , устройства сброса давления в резервуаре с жидким азотом вышли из строя и позже были опломбированы. В результате последующего повышения давления резервуар катастрофически вышел из строя. Силы взрыва было достаточно, чтобы пробить резервуар через потолок непосредственно над ним, разрушить железобетонную балку непосредственно под ним и снести стены лаборатории на высоту 0,1–0,2 м от фундамента. [108]
Жидкий азот легко испаряется с образованием газообразного азота, поэтому меры предосторожности, связанные с газообразным азотом, применимы и к жидкому азоту. [109] [110] [111] Например, датчики кислорода иногда используются в качестве меры предосторожности при работе с жидким азотом, чтобы предупредить рабочих о разливах газа в замкнутом пространстве. [112]
Сосуды, содержащие жидкий азот, могут конденсировать кислород из воздуха. Жидкость в таком сосуде становится все более обогащенной кислородом (температура кипения -183 ° C, выше, чем у азота) по мере испарения азота, и может вызвать бурное окисление органических материалов. [113]
Мониторы дефицита кислорода используются для измерения уровня кислорода в замкнутых пространствах и в любом месте, где хранится или используется газообразный или жидкий азот. В случае утечки азота и снижения содержания кислорода до заданного уровня сигнализации монитор дефицита кислорода можно запрограммировать на подачу звуковых и визуальных сигналов тревоги, тем самым обеспечивая оповещение о возможной надвигающейся опасности. Чаще всего персоналу следует предупредить уровень кислорода, когда уровень кислорода падает ниже 19,5%. OSHA указывает, что к опасной атмосфере может относиться атмосфера, в которой концентрация кислорода ниже 19,5% или выше 23,5%. [114] Мониторы дефицита кислорода могут быть закреплены, закреплены на стене и жестко подключены к электросети здания, либо просто подключены к розетке, либо к портативному ручному или носимому монитору.
{{cite book}}: CS1 maint: числовые имена: список авторов ( ссылка ){{cite journal}}: CS1 maint: неподходящий URL ( ссылка ){{cite journal}}: CS1 maint: неподходящий URL ( ссылка ){{cite journal}}: CS1 maint: неподходящий URL ( ссылка ){{cite journal}}: CS1 maint: неподходящий URL ( ссылка )