Ацетальдегид (систематическое название этаналь по ИЮПАК ) представляет собой органическое химическое соединение с формулой CH 3 CHO , иногда сокращенно Me CHO. Это бесцветная жидкость или газ, температура кипения которого близка к комнатной. Это один из важнейших альдегидов , широко встречающийся в природе и производимый в больших масштабах в промышленности. Ацетальдегид в природе встречается в кофе, хлебе и спелых фруктах [11] и вырабатывается растениями. Он также образуется в результате частичного окисления этанола ферментом печени алкогольдегидрогеназой и является одной из причин похмелья после употребления алкоголя . Пути воздействия включают воздух, воду, землю или грунтовые воды, а также питье и дым. [12] Потребление дисульфирама ингибирует ацетальдегиддегидрогеназу , фермент, ответственный за метаболизм ацетальдегида, тем самым вызывая его накопление в организме.
Международное агентство по изучению рака (IARC) отнесло ацетальдегид к канцерогенам первой группы . [13] Ацетальдегид является «одним из наиболее часто встречающихся воздушных токсинов, риск рака которого превышает один на миллион». [14]
Ацетальдегид впервые наблюдал шведский фармацевт/химик Карл Вильгельм Шееле (1774 г.); [15] затем его исследовали французские химики Антуан Франсуа, граф де Фуркруа и Луи Николя Воклен (1800), [16] и немецкие химики Иоганн Вольфганг Дёберейнер (1821, 1822, 1832) [17] и Юстус фон Либих ( 1835). [18] [19] В 1835 году Либих назвал его «альдегидом»; [20] позже название было изменено на «ацетальдегид». [21]
В 2003 году мировое производство составило около 1 миллиона тонн. [ нужна цитация ] До 1962 года этанол и ацетилен были основными источниками ацетальдегида. С тех пор этилен является доминирующим сырьем . [22]
Основным методом производства является окисление этена по процессу Вакера , который предполагает окисление этена с использованием гомогенной каталитической системы палладий/медь:
В 1970-х годах мировая мощность процесса прямого окисления Wacker-Hoechst превышала 2 миллиона тонн в год.
Меньшие количества можно получить путем частичного окисления этанола в экзотермической реакции. Этот процесс обычно проводится на серебряном катализаторе при температуре около 500–650 ° C. [22]
Этот метод является одним из старейших способов промышленного получения ацетальдегида.
До появления процесса Вакера и появления дешевого этилена ацетальдегид получали путем гидратации ацетилена . [23] Эту реакцию катализируют соли ртути(II) :
Механизм включает посредничество винилового спирта , который таутомеризуется до ацетальдегида. Реакцию проводят при 90–95 °С, образовавшийся ацетальдегид отделяют от воды и ртути и охлаждают до 25–30 °С. В процессе мокрого окисления сульфат железа (III) используется для повторного окисления ртути обратно в соль ртути (II). Полученный сульфат железа(II) окисляют в отдельном реакторе азотной кислотой . [22]
Традиционно ацетальдегид получали частичным дегидрированием этанола:
В этом эндотермическом процессе пары этанола пропускают при температуре 260–290 ° C над катализатором на основе меди. Когда-то этот процесс был привлекателен из-за ценности побочного продукта водорода [22] , но в наше время он экономически нежизнеспособен.
Гидроформилирование метанола с использованием таких катализаторов , как соли кобальта, никеля или железа, также дает ацетальдегид, хотя этот процесс не имеет промышленного значения. Столь же неконкурентоспособен ацетальдегид, который образуется из синтез-газа с умеренной селективностью. [22]

Как и многие другие карбонильные соединения , ацетальдегид таутомеризуется с образованием енола ( винилового спирта ; название IUPAC: этенол):
Константа равновесия составляет 6 × 10 -7 при комнатной температуре, поэтому относительное количество енольной формы в образце ацетальдегида очень мало. [24] При комнатной температуре ацетальдегид (CH 3 CH=O) более стабилен, чем виниловый спирт (CH 2 =CHOH) на 42,7 кДж/моль: [25] В целом таутомеризация кето-енолов происходит медленно, но катализируется кислотами.
Фотоиндуцированная таутомеризация кето-енолов возможна в атмосферных или стратосферных условиях. Эта фототаутомеризация актуальна для атмосферы Земли, поскольку считается, что виниловый спирт является предшественником карбоновых кислот в атмосфере. [26] [27]
Ацетальдегид — распространенный электрофил в органическом синтезе . [28] Кроме того, реакции ацетальдегида являются прохиральными . Он используется главным образом в качестве источника синтона «CH 3 C + H (OH)» в альдольных реакциях и связанных с ними реакциях конденсации . [29] Реактивы Гриньяра и литийорганические соединения реагируют с MeCHO с образованием гидроксиэтильных производных. [30] В одной из наиболее впечатляющих реакций присоединения формальдегид в присутствии гидроксида кальция присоединяется к MeCHO с образованием пентаэритрита , C(CH 2 OH) 4 и формиата . [31]
В реакции Стрекера ацетальдегид конденсируется с цианидом и аммиаком , образуя после гидролиза аминокислоту аланин . [32] Ацетальдегид может конденсироваться с аминами с образованием иминов ; например, с циклогексиламином с получением N -этилиденциклогексиламина. Эти имины можно использовать для управления последующими реакциями, такими как альдольная конденсация. [33]
Это также строительный блок в синтезе гетероциклических соединений . В одном примере он превращается при обработке аммиаком в 5 -этил-2-метилпиридин («альдегид-коллидин»). [34]
Три молекулы ацетальдегида конденсируются с образованием « паральдегида », циклического тримера, содержащего одинарные связи CO. Аналогично конденсация четырех молекул ацетальдегида дает циклическую молекулу метальдегида . Паральдегид можно получить с хорошими выходами, используя катализатор на основе серной кислоты. Металдегид получают лишь с выходом в несколько процентов и при охлаждении, часто используя в качестве катализатора HBr, а не H 2 SO 4 . При -40°С в присутствии кислотных катализаторов образуется полиацетальдегид. [22] Существует два стереомера паральдегида и четыре метальдегида.
Немецкий химик Валентин Герман Вейденбуш (1821–1893) синтезировал паральдегид в 1848 году обработкой ацетальдегида кислотой (серной или азотной) и охлаждением до 0°С. Он нашел весьма примечательным, что при нагревании паральдегида со следами той же кислоты реакция пошла в другую сторону, воссоздавая ацетальдегид. [35]
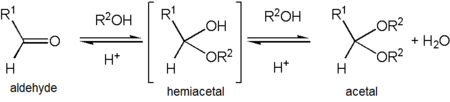
Ацетальдегид образует стабильный ацеталь при реакции с этанолом в условиях, способствующих дегидратации. Продукт CH 3 CH(OCH 2 CH 3 ) 2 официально называется 1,1-диэтоксиэтан , но обычно его называют «ацеталем». [36] Это может вызвать путаницу, поскольку слово «ацеталь» чаще используется для описания соединений с функциональными группами RCH(OR') 2 или RR'C(OR'') 2 , а не для обозначения этого конкретного соединения – фактически, 1 ,1-диэтоксиэтан также называют диэтилацеталем ацетальдегида.
Ацетальдегид является предшественником винилфосфоновой кислоты , которая используется для изготовления клеев и ионопроводящих мембран. Последовательность синтеза начинается с реакции с трихлоридом фосфора : [37]
В печени фермент алкогольдегидрогеназа окисляет этанол в ацетальдегид , который затем далее окисляется до безвредной уксусной кислоты под действием ацетальдегиддегидрогеназы . Эти две реакции окисления сопровождаются восстановлением НАД + до НАДН . [38] В головном мозге фермент каталаза отвечает в первую очередь за окисление этанола в ацетальдегид, а алкогольдегидрогеназа играет второстепенную роль. [38] Последние этапы спиртового брожения у бактерий, растений и дрожжей включают превращение пирувата в ацетальдегид и углекислый газ ферментом пируватдекарбоксилазой с последующим превращением ацетальдегида в этанол. Последняя реакция снова катализируется алкогольдегидрогеназой, действующей теперь в противоположном направлении.
Многие жители Восточной Азии имеют мутацию ALDH2 , которая делает их значительно менее эффективными в окислении ацетальдегида. При употреблении алкоголя их организм склонен накапливать чрезмерное количество ацетальдегида, вызывая так называемую реакцию алкогольного прилива . [39] У них появляется характерный румянец на лице и теле, а также «тошнота, головная боль и общий физический дискомфорт». [40] Прием препарата дисульфирам , который ингибирует ALDH2, приводит к аналогичной реакции. См. раздел #Отягчающие факторы ниже. [41]
Традиционно ацетальдегид в основном использовался в качестве предшественника уксусной кислоты. Это применение было отклонено, поскольку уксусная кислота более эффективно производится из метанола с помощью процессов Monsanto и Cativa . Ацетальдегид является важным предшественником производных пиридина , пентаэритрита и кротональдегида . Мочевина и ацетальдегид в сочетании образуют полезную смолу . Уксусный ангидрид реагирует с ацетальдегидом с образованием этилидендиацетата , предшественника винилацетата , который используется для производства поливинилацетата . [22]
Мировой рынок ацетальдегида сокращается. На спрос повлияли изменения в производстве спиртов-пластификаторов, которое изменилось, поскольку н -бутиральдегид реже производят из ацетальдегида, а вместо этого получают путем гидроформилирования пропилена . Аналогичным образом, уксусная кислота , когда-то полученная из ацетальдегида, производится преимущественно с помощью более дешевого процесса карбонилирования метанола. [42] Влияние на спрос привело к росту цен и, как следствие, к замедлению рынка.

Китай является крупнейшим потребителем ацетальдегида в мире, на его долю в 2012 году пришлось почти половина мирового потребления. Основным его применением является производство уксусной кислоты. Ожидается, что другие области применения, такие как пиридины и пентаэритрит, будут расти быстрее, чем уксусная кислота, но объемы недостаточно велики, чтобы компенсировать снижение потребления уксусной кислоты. Как следствие, общее потребление ацетальдегида в Китае может немного вырасти на 1,6% в год до 2018 года. Западная Европа является вторым по величине потребителем ацетальдегида в мире, на ее долю приходится 20% мирового потребления в 2012 году. Как и в случае с Китаем, западноевропейский рынок ацетальдегида Ожидается, что рынок будет расти лишь незначительно, на 1% в год в течение 2012–2018 годов. Однако Япония может стать потенциальным потребителем ацетальдегида в ближайшие пять лет благодаря новому использованию бутадиена в коммерческом производстве . Поставки бутадиена в Японии и других странах Азии были нестабильными. Это должно обеспечить столь необходимый импульс для плоского рынка по состоянию на 2013 год. [43]
Пороговое предельное значение составляет 25 частей на миллион (STEL/потолочное значение), а MAK (максимальная концентрация на рабочем месте) составляет 50 частей на миллион. При концентрации ацетальдегида 50 ppm не наблюдается раздражения или местного повреждения тканей слизистой оболочки носа . Поступая в организм, ацетальдегид быстро метаболизируется в печени до уксусной кислоты. Лишь небольшая часть выдыхается в неизмененном виде. После внутривенного введения период полувыведения в крови составляет примерно 90 секунд. [22]
Зафиксировано множество тяжелых случаев острой интоксикации. [22] Ацетальдегид естественным образом расщепляется в организме человека. [12] [44]
Ацетальдегид раздражает кожу, глаза, слизистые оболочки, горло и дыхательные пути. Это происходит при концентрациях всего 1000 частей на миллион. Симптомы воздействия этого соединения включают тошноту , рвоту и головную боль . Эти симптомы могут проявиться не сразу. Порог восприятия ацетальдегида в воздухе находится в диапазоне от 0,07 до 0,25 частей на миллион. [22] При таких концентрациях очевиден фруктовый запах ацетальдегида. Раздражение конъюнктивы наблюдалось после 15-минутного воздействия концентраций 25 и 50 ppm, однако сообщалось о преходящих конъюнктивитах и раздражении дыхательных путей после воздействия 200 ppm ацетальдегида в течение 15 минут.
Ацетальдегид канцерогенен для человека. [45] [46] В 1988 году Международное агентство по исследованию рака заявило: «Имеется достаточно доказательств канцерогенности ацетальдегида (основного метаболита этанола) у экспериментальных животных ». [47] В октябре 2009 года Международное агентство по изучению рака обновило классификацию ацетальдегида, заявив, что ацетальдегид, входящий в состав алкогольных напитков и образующийся эндогенно из них , является канцерогеном для человека группы I. [48] Кроме того, ацетальдегид повреждает ДНК [49] и вызывает аномальное развитие мышц, поскольку он связывается с белками. [50]
Ацетальдегид индуцирует межцепочечные сшивки ДНК, форму повреждения ДНК. Их можно восстановить с помощью любого из двух путей репарации ДНК, связанных с репликацией. [51] Первый путь называется FA, поскольку в нем используются генные продукты, дефектные у пациентов с анемией Фанкони . Этот путь восстановления приводит к увеличению частоты мутаций и изменению спектра мутаций. [51] Второй путь репарации требует конвергенции репликационной вилки, разрыва ацетальдегидной поперечной связи, синтеза транслезии с помощью ДНК-полимеразы Y-семейства и гомологичной рекомбинации. [51]
Люди с генетическим дефицитом фермента, ответственного за превращение ацетальдегида в уксусную кислоту , могут иметь больший риск болезни Альцгеймера . «Эти результаты показывают, что дефицит ALDH2 является фактором риска НАГРУЗКИ (болезни Альцгеймера с поздним началом)…» [52]
Исследование 818 алкоголиков показало, что те, кто подвергается воздействию большего количества ацетальдегида, чем обычно, из-за генетического варианта гена, кодирующего ADH1C , ADH1C*1, подвергаются большему риску развития рака верхних отделов желудочно-кишечного тракта и печени. [53]
Препарат дисульфирам (Антабус) ингибирует ацетальдегиддегидрогеназу, фермент, окисляющий соединение в уксусную кислоту. Метаболизм этанола образует ацетальдегид раньше, чем ацетальдегиддегидрогеназа образует уксусную кислоту, но при ингибировании фермента ацетальдегид накапливается. Если употреблять этанол во время приема дисульфирама, похмельный эффект этанола ощущается быстрее и интенсивнее ( реакция дисульфирам-алкоголь ). Таким образом, дисульфирам иногда используется в качестве сдерживающего средства для алкоголиков, желающих оставаться трезвыми. [41]
Ацетальдегид является потенциальным загрязнителем на рабочем месте, в помещении и окружающей среде. Более того, большинство людей проводят более 90% своего времени в помещениях, что увеличивает любое воздействие и риск для здоровья человека. [54]
В исследовании, проведенном во Франции , средняя концентрация ацетальдегида в помещении, измеренная в 16 домах, была примерно в семь раз выше, чем концентрация ацетальдегида снаружи. В гостиной средняя концентрация составляла 18,1±17,5 мкг/ м3 , в спальне - 18,2±16,9 мкг/ м3 , тогда как средняя концентрация в наружном воздухе составляла 2,3±2,6 мкг/ м3 . [ нужна цитата ]
Был сделан вывод, что летучие органические соединения (ЛОС), такие как бензол, формальдегид, ацетальдегид, толуол и ксилолы , следует считать приоритетными загрязнителями с точки зрения их воздействия на здоровье. Отмечено, что в отремонтированных или совершенно новых зданиях уровни концентрации ЛОС зачастую на несколько порядков выше. Основными источниками ацетальдегидов в домах являются строительные материалы, ламинат, полы из ПВХ, лакированные деревянные полы и лакированные полы из пробки или сосны (содержащиеся в лаке, а не в древесине). Он также содержится в пластмассах, красках на масляной и водной основе, в композитных деревянных потолках, ДСП, фанере, обработанной сосновой древесине и мебели из ламинированного ДСП. [55]
Использование ацетальдегида широко распространено в различных отраслях промышленности, при этом в процессе производства, использования, транспортировки и хранения он может попадать в сточные воды или воздух. Источники ацетальдегида включают выбросы от сжигания топлива стационарных двигателей внутреннего сгорания и электростанций, сжигающих ископаемое топливо, древесину или мусор, предприятия по добыче нефти и газа, нефтеперерабатывающие заводы, цементные печи, лесопильные и деревообрабатывающие заводы, а также бумажные фабрики. [56] Ацетальдегид также присутствует в выхлопах автомобилей и дизельных двигателей . [57] В результате ацетальдегид является «одним из наиболее часто встречающихся токсичных веществ в воздухе, риск рака которого превышает один на миллион». [14]
Было показано, что природные полисахариды табака , включая целлюлозу , являются основными предшественниками, благодаря которым ацетальдегид является важной составляющей табачного дыма . [58] [59] В исследованиях зависимости на грызунах было продемонстрировано его синергетический эффект с никотином . [60] [61] Ацетальдегид также является наиболее распространенным канцерогеном в табачном дыме; он растворяется в слюне во время курения.
Ацетальдегид был обнаружен в дыме каннабиса . Это открытие стало возможным благодаря использованию новых химических методов, которые продемонстрировали, что присутствующий ацетальдегид вызывает повреждение ДНК в лабораторных условиях. [62]
Многие микробы производят ацетальдегид из этанола, но они обладают меньшей способностью удалять ацетальдегид, что может привести к накоплению ацетальдегида в слюне, желудочной кислоте и содержимом кишечника. Ферментированные продукты и многие алкогольные напитки также могут содержать значительное количество ацетальдегида. Ацетальдегид, образующийся в результате окисления этанола, табачного дыма и пищи в слизистой оболочке или микробов, по-видимому, действует как кумулятивный канцероген в верхних отделах пищеварительного тракта человека. [63] Согласно «Мнениям об ацетальдегиде» (2012) Научного комитета Европейской комиссии по безопасности потребителей (SCCS), предел особого риска для косметических продуктов составляет 5 мг/л, и ацетальдегид не следует использовать в средствах для полоскания рта . [64]
Ацетальдегид можно получить фотоокислением полиэтилентерефталата ( ПЭТ ) по реакции Норриша типа II . [65]
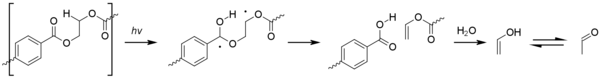
Хотя уровни, образующиеся в результате этого процесса, незначительны, ацетальдегид имеет чрезвычайно низкий порог вкуса / запаха , составляющий около 20–40 частей на миллиард, и может вызывать неприятный привкус в воде в бутылках. [66] Уровень, при котором средний потребитель может обнаружить ацетальдегид, по-прежнему значительно ниже, чем любая токсичность. [67]
Было показано , что Candida albicans у пациентов с потенциально канцерогенными заболеваниями полости рта производит ацетальдегид в количествах, достаточных для возникновения проблем. [68]