Тиамин , также известный как тиамин и витамин B1 , является витамином , необходимым микроэлементом для людей и животных. [3] [4] Он содержится в пище и синтезируется в коммерческих целях в качестве пищевой добавки или лекарства . [1] [5] Фосфорилированные формы тиамина необходимы для некоторых метаболических реакций , включая расщепление глюкозы и аминокислот . [1]
Пищевые источники тиамина включают цельное зерно , бобовые , а также некоторые виды мяса и рыбы. [1] [6] Обработка зерна удаляет большую часть витаминного содержания, поэтому во многих странах крупы и мука обогащаются тиамином . [1] Добавки и лекарства доступны для лечения и профилактики дефицита тиамина и расстройств, которые являются его результатом, таких как бери-бери и энцефалопатия Вернике . Они также используются для лечения болезни кленового сиропа мочи и синдрома Лея . Добавки и лекарства обычно принимаются внутрь , но также могут вводиться внутривенно или внутримышечно . [7]
Добавки тиамина обычно хорошо переносятся. Аллергические реакции , включая анафилаксию , могут возникнуть при введении повторных доз путем инъекции. [7] [8] Тиамин включен в Список основных лекарственных средств Всемирной организации здравоохранения . [9] Он доступен как дженерик , а в некоторых странах как безрецептурная диетическая добавка. [7]
Тиамин является одним из витаминов группы В и также известен как витамин B1 . [ 3] [4] Это катион , который обычно поставляется в виде хлоридной соли . Он растворим в воде, метаноле и глицерине , но практически нерастворим в менее полярных органических растворителях . [10] [11] В организме тиамин может образовывать производные ; наиболее хорошо охарактеризованным из которых является тиаминпирофосфат (ТПФ), кофермент в катаболизме сахаров и аминокислот. [3]
Химическая структура состоит из аминопиримидинового и тиазолиевого кольца, связанных метиленовым мостиком . Тиазол замещен метильной и гидроксиэтильной боковыми цепями . Тиамин стабилен при кислом pH , но нестабилен в щелочных растворах и при воздействии тепла . [10] [11] Он сильно реагирует в реакциях типа Майяра . [10] Окисление дает флуоресцентное производное тиохром , которое можно использовать для определения количества витамина, присутствующего в биологических образцах. [12]
Известные расстройства, вызванные дефицитом тиамина, включают бери-бери , синдром Вернике-Корсакова , нейропатию зрительного нерва , болезнь Лея , африканскую сезонную атаксию (или нигерийскую сезонную атаксию) и центральный понтинный миелинолиз . [13] Симптомы включают недомогание , потерю веса, раздражительность и спутанность сознания. [10] [14] [15]
В западных странах хронический алкоголизм является фактором риска дефицита. Также в группе риска находятся пожилые люди, лица с ВИЧ/СПИД или диабетом , а также те, кто перенес бариатрическую операцию . [1] Различные степени недостаточности тиамина были связаны с длительным использованием диуретиков . [16] [17]

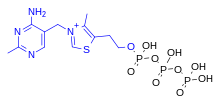
Известно пять природных производных фосфата тиамина: тиаминмонофосфат (ThMP), тиаминпирофосфат (TPP), тиаминтрифосфат (ThTP), аденозинтиаминдифосфат (AThDP) и аденозинтиаминтрифосфат (AThTP). Они участвуют во многих клеточных процессах. [18] Наиболее охарактеризованной формой является TPP, кофермент в катаболизме сахаров и аминокислот. Хотя его роль хорошо известна, некоферментное действие тиамина и производных может быть реализовано посредством связывания с белками, которые не используют этот механизм. [19] Физиологическая роль монофосфата неизвестна, за исключением промежуточного звена в клеточном превращении тиамина в ди- и трифосфаты. [20]
Тиаминпирофосфат (TPP), также называемый тиаминдифосфатом (ThDP), участвует в качестве кофермента в метаболических реакциях, включая те, в которых происходит инверсия полярности . [21] Его синтез катализируется ферментом тиаминдифосфокиназой в соответствии с реакцией тиамин + АТФ → TPP + AMP (EC 2.7.6.2). TPP является коферментом для нескольких ферментов, которые катализируют перенос двухуглеродных единиц и, в частности, дегидрирование ( декарбоксилирование и последующее сопряжение с коферментом A ) 2-оксокислот (альфа-кетокислот). Механизм действия TPP как кофермента основан на его способности образовывать илид . [ 22] Примеры включают:
Ферменты транскетолаза, пируватдегидрогеназа (ПДГ) и 2-оксоглутаратдегидрогеназа (ОГДГ) играют важную роль в метаболизме углеводов . ПДГ связывает гликолиз с циклом лимонной кислоты . ОГДГ катализирует общее превращение 2-оксоглутарата (альфа-кетоглутарата) в сукцинил-КоА и CO2 в цикле лимонной кислоты . Реакция, катализируемая ОГДГ, является этапом, ограничивающим скорость в цикле лимонной кислоты. Цитозольный фермент транскетолаза играет центральную роль в пентозофосфатном пути , основном маршруте биосинтеза пентозных сахаров дезоксирибозы и рибозы . Митохондриальные ПДГ и ОГДГ являются частью биохимических путей, которые приводят к образованию аденозинтрифосфата (АТФ), который является основной молекулой переноса энергии для клетки. В нервной системе ПДГ также участвует в синтезе миелина и нейромедиатора ацетилхолина . [11]
ThTP участвует в активации хлоридных каналов в нейронах млекопитающих и других животных, хотя его роль не до конца понятна. [20] ThTP был обнаружен в бактериях, грибах и растениях, что позволяет предположить, что он выполняет и другие клеточные функции. [23] В Escherichia coli он участвует в реакции на аминокислотное голодание. [24]
AThDP присутствует в небольших количествах в печени позвоночных, но его роль остается неизвестной. [24]
AThTP присутствует в E. coli , где он накапливается в результате углеродного голодания. В этой бактерии AThTP может составлять до 20% от общего количества тиамина. Он также присутствует в меньших количествах в дрожжах , корнях высших растений и тканях животных. [24]
Во время беременности тиамин поступает к плоду через плаценту . Беременные женщины нуждаются в этом витамине больше, чем другие взрослые, особенно в третьем триместре . Беременные женщины с гиперемезисом беременных подвержены повышенному риску дефицита тиамина из-за потерь при рвоте. [25] У кормящих женщин тиамин поступает в грудное молоко, даже если это приводит к дефициту тиамина у матери. [4] [26]
Тиамин важен не только для развития митохондриальной мембраны , но и для функционирования синаптической мембраны . [27] Также было высказано предположение, что дефицит препятствует развитию мозга у младенцев и может быть причиной синдрома внезапной детской смерти . [20]
Национальная академия медицины США обновила Оценочные средние потребности (EAR) и Рекомендуемые диетические нормы (RDA) для тиамина в 1998 году. EAR для тиамина для женщин и мужчин в возрасте 14 лет и старше составляют 0,9 мг/день и 1,1 мг/день соответственно; RDA составляют 1,1 и 1,2 мг/день соответственно. RDA выше, чем EAR, чтобы обеспечить адекватные уровни потребления для лиц с более высокими, чем средние, потребностями. RDA во время беременности и для кормящих женщин составляет 1,4 мг/день. Для младенцев в возрасте до 12 месяцев адекватное потребление (AI) составляет 0,2–0,3 мг/день, а для детей в возрасте 1–13 лет RDA увеличивается с возрастом от 0,5 до 0,9 мг/день. [4]
Европейское агентство по безопасности пищевых продуктов (EFSA) называет коллективный набор информации Диетическими референтными значениями , с Референтными значениями потребления для населения (PRI) вместо RDA и Средними требованиями вместо EAR. Для женщин (включая беременных или кормящих), мужчин и детей PRI составляет 0,1 мг тиамина на мегаджоуль (МДж) энергии в их рационе. Поскольку преобразование составляет 1 МДж = 239 ккал, взрослый человек, потребляющий 2390 килокалорий, должен потреблять 1,0 мг тиамина. Это немного ниже, чем RDA в США. [29]
Ни Национальная академия медицины, ни EFSA не установили верхний уровень потребления тиамина, поскольку отсутствуют данные о побочных эффектах от высоких доз у людей. [4] [28]
Тиамин обычно хорошо переносится и нетоксичен при пероральном приеме . [7] Имеются редкие сообщения о неблагоприятных побочных эффектах при внутривенном введении тиамина , включая аллергические реакции, тошноту , летаргию и нарушение координации . [28] [3]
Для маркировки пищевых продуктов и диетических добавок в США количество в порции выражается в процентах от дневной нормы. С 27 мая 2016 года дневная норма составляет 1,2 мг, в соответствии с RDA. [30] [31]
Тиамин содержится в самых разных обработанных и цельных продуктах, [18] включая чечевицу , горох , цельное зерно , свинину и орехи . [6] [32] Типичный ежедневный пренатальный витаминный продукт содержит около 1,5 мг тиамина. [33]
Некоторые страны требуют или рекомендуют обогащение зерновых продуктов, таких как пшеница , рис или кукуруза (кукуруза), поскольку обработка снижает содержание витаминов. [34] По состоянию на февраль 2022 года 59 стран, в основном в Северной и южных районах Африки, требуют обогащения пищевых продуктов из пшеницы, риса или кукурузы тиамином или мононитратом тиамина. Указанные количества варьируются от 2,0 до 10,0 мг/кг. [35] Еще 18 стран имеют добровольную программу обогащения. Например, правительство Индии рекомендует 3,5 мг/кг для муки «майда» (белая) и «атта» (цельнозерновая) . [36]
Биосинтез тиамина происходит у бактерий, некоторых простейших, растений и грибов. [37] [38] Тиазольные и пиримидиновые фрагменты биосинтезируются отдельно, а затем объединяются, образуя ThMP под действием тиаминфосфатсинтазы .
Система пиримидинового кольца образуется в реакции, катализируемой фосфометилпиримидинсинтазой (ThiC), ферментом в радикальном суперсемействе SAM железо-серных белков , которые используют S-аденозилметионин в качестве кофактора . [39] [40]
Исходным материалом является 5-аминоимидазолриботид , который подвергается реакции перегруппировки через радикальные промежуточные соединения, которые включают синие, зеленые и красные фрагменты, показанные в продукте. [41] [42]
Кольцо тиазола образуется в реакции, катализируемой тиазолсинтазой (EC 2.8.1.10). [39] Конечными предшественниками являются 1-дезокси-D-ксилулоза 5-фосфат, 2-иминоацетат и белок-переносчик серы, называемый ThiS. Дополнительный белок, ThiG, также требуется для объединения всех компонентов кольца в активном центре фермента. [43]

Последний шаг в образовании ThMP включает декарбоксилирование промежуточного тиазола, который реагирует с пирофосфатным производным фосфометилпиримидина, который сам по себе является продуктом киназы , фосфометилпиримидинкиназы . [39]
Биосинтетические пути различаются у разных организмов. В E. coli и других энтеробактериях ThMP фосфорилируется до кофактора TPP тиаминфосфаткиназой ( ThMP + АТФ → TPP + АДФ). [39] В большинстве бактерий и эукариот ThMP гидролизуется до тиамина, а затем пирофосфорилируется до TPP тиаминдифосфокиназой (тиамин + АТФ → TPP + AMP). [44]
Биосинтетические пути регулируются рибопереключателями . [3] Если в клетке присутствует достаточное количество тиамина, то тиамин связывается с мРНК для ферментов, которые требуются в пути, и предотвращает их трансляцию . Если тиамина нет, то ингибирования нет, и ферменты, необходимые для биосинтеза, производятся. Конкретный рибопереключатель, рибопереключатель TPP , является единственным известным рибопереключателем, обнаруженным как в эукариотических, так и в прокариотических организмах. [45]
В первом полном синтезе в 1936 году этил 3-этоксипропаноат обрабатывали этилформиатом, получая промежуточное дикарбонильное соединение, которое при реакции с ацетамидином образовывало замещенный пиримидин . Превращение его гидроксильной группы в аминогруппу осуществлялось путем нуклеофильного ароматического замещения , сначала в хлоридное производное с использованием оксихлорида фосфора , а затем обработкой аммиаком . Затем этокси- группу преобразовывали в бромное производное с использованием бромистоводородной кислоты . На заключительном этапе в реакции алкилирования с использованием 4-метил-5-(2-гидроксиэтил)тиазола образовывался тиамин (в виде его дибромидной соли) . [46] : 7 [47]

Merck & Co. адаптировала лабораторный синтез 1936 года, что позволило им производить тиамин в Рауэе в 1937 году. [47] Однако альтернативный путь с использованием промежуточного диамина Греве (5-(аминометил)-2-метил-4-пиримидинамин), впервые опубликованного в 1937 году, [48] был исследован Хоффманом Ла Рошем , и последовали конкурентоспособные производственные процессы. Эффективные пути к диамину продолжают представлять интерес. [47] [49] В Европейской экономической зоне тиамин зарегистрирован в соответствии с регламентом REACH , и там производится или импортируется от 100 до 1000 тонн в год. [50]
Многие аналоги витамина B 1 , такие как бенфотиамин , фурсультиамин и сульбутиамин , являются синтетическими производными тиамина. Большинство из них были разработаны в Японии в 1950-х и 1960-х годах как формы, предназначенные для улучшения абсорбции по сравнению с тиамином. [51] Некоторые из них одобрены для использования в некоторых странах в качестве лекарственного средства или безрецептурной пищевой добавки для лечения диабетической невропатии или других заболеваний. [52] [53] [54]
В верхнем отделе тонкого кишечника тиаминфосфатные эфиры, присутствующие в пище, гидролизуются ферментами щелочной фосфатазы . При низких концентрациях процесс абсорбции опосредован переносчиками. При более высоких концентрациях абсорбция также происходит посредством пассивной диффузии . [3] Активный транспорт может быть ингибирован употреблением алкоголя или дефицитом фолиевой кислоты . [10]
Большая часть тиамина в сыворотке связана с белками, в основном с альбумином . Примерно 90% от общего количества тиамина в крови находится в эритроцитах . В сыворотке крыс был выявлен специфический связывающий белок, называемый тиамин-связывающим белком, который, как полагают, является гормонально-регулируемым белком-носителем, важным для распределения тиамина в тканях. [14] Поглощение тиамина клетками крови и других тканей происходит посредством активного транспорта и пассивной диффузии. [10] Два члена семейства транспортных белков, кодируемых генами SLC19A2 и SLC19A3, способны транспортировать тиамин. [20] В некоторых тканях поглощение и секреция тиамина, по-видимому, опосредуются Na + -зависимым транспортером и трансклеточным протонным градиентом. [14]
У человека запас тиамина составляет около 25–30 мг, с наибольшей концентрацией в скелетных мышцах, сердце, мозге, печени и почках. ThMP и свободный (нефосфорилированный) тиамин присутствуют в плазме, молоке, спинномозговой жидкости и, как предполагается, во всех внеклеточных жидкостях . В отличие от высокофосфорилированных форм тиамина, ThMP и свободный тиамин способны пересекать клеточные мембраны. Было показано, что кальций и магний влияют на распределение тиамина в организме, а дефицит магния , как было показано, усугубляет дефицит тиамина. [20] Содержание тиамина в тканях человека меньше, чем у других видов. [14] [55]
Тиамин и его метаболиты (2-метил-4-амино-5-пиримидинкарбоновая кислота, 4-метилтиазол-5-уксусная кислота и другие) выводятся в основном с мочой. [3]
Биодоступность тиамина в пищевых продуктах может быть нарушена различными способами. Сульфиты , добавляемые в пищевые продукты в качестве консерванта, [56] атакуют тиамин по метиленовому мостику, расщепляя пиримидиновое кольцо от тиазольного кольца. Скорость этой реакции увеличивается в кислых условиях. [14] Тиамин расщепляется термолабильными тиаминазами, присутствующими в некоторых видах рыб, моллюсков и других продуктах. [10] Куколки африканского шелкопряда Anaphe venata являются традиционной пищей в Нигерии. Потребление приводит к дефициту тиамина. [57] В более старой литературе сообщалось, что в Таиланде потребление ферментированной, сырой рыбы вызывало дефицит тиамина, но либо воздержание от употребления рыбы в пищу, либо ее предварительное нагревание устраняли дефицит. [58] У жвачных животных кишечные бактерии синтезируют тиамин и тиаминазу. Бактериальные тиаминазы являются ферментами клеточной поверхности, которые должны диссоциировать от клеточной мембраны перед активацией; диссоциация может происходить у жвачных животных в ацидотических условиях . У молочных коров перекармливание зерном вызывает подострый ацидоз рубца и повышенное высвобождение тиаминазы бактериями рубца, что приводит к дефициту тиамина. [59]
Согласно отчетам о двух небольших исследованиях, проведенных в Таиланде, жевание ломтиков ореха арека , завернутых в листья бетеля , и жевание листьев чая снижают биодоступность тиамина из пищи посредством механизма, который может включать танины . [58] [60]
Известно, что бариатрическая хирургия для снижения веса нарушает усвоение витаминов. [61] Метаанализ показал, что 27% людей, перенесших бариатрические операции, испытывают дефицит витамина B1 . [ 62]
Тиамин был первым из водорастворимых витаминов, который был выделен. [63] Самые ранние наблюдения за людьми и курами показали, что диета, состоящая в основном из шлифованного белого риса, вызывала бери-бери, но не приписывали это отсутствию ранее неизвестного необходимого питательного вещества. [64] [65]
В 1884 году Такаки Канехиро , главный хирург Императорского флота Японии , отверг предыдущую микробную теорию бери-бери и предположил, что болезнь была вызвана недостатками в рационе. [64] Меняя диету на военном корабле, он обнаружил, что замена диеты, состоящей только из белого риса, на диету, содержащую также ячмень, мясо, молоко, хлеб и овощи, почти устранила бери-бери за девятимесячное морское путешествие. Однако Такаки добавил много продуктов к успешной диете и ошибочно приписал пользу повышенному потреблению белка, поскольку витамины в то время были неизвестны. Военно-морской флот не был убежден в необходимости такой дорогостоящей программы улучшения питания, и многие мужчины продолжали умирать от бери-бери даже во время русско-японской войны 1904–1905 годов. Только в 1905 году, после того как был обнаружен антибери-бери фактор в рисовых отрубях (удалённых шлифовкой в белый рис ) и в ячменных отрубях, эксперимент Такаки был вознаграждён. Он был сделан бароном в японской системе пэрства, после чего его ласково называли «Ячменным бароном». [64]
Конкретная связь с зерном была установлена в 1897 году Кристианом Эйкманом , военным врачом в Голландской Ост-Индии , который обнаружил, что у домашней птицы, питающейся приготовленным шлифованным рисом, развивается паралич, который можно обратить вспять, прекратив шлифовку риса. [65] Он приписал бери-бери высокому уровню крахмала в рисе, который является токсичным. Он считал, что токсичность была нейтрализована соединением, присутствующим в шлифовке риса. [66] Его коллега Геррит Грайнс правильно интерпретировал связь между чрезмерным потреблением шлифованного риса и бери-бери в 1901 году: он пришел к выводу, что рис содержит необходимое питательное вещество во внешних слоях зерна, которое удаляется при шлифовке. [67] В конечном итоге Эйкман был удостоен Нобелевской премии по физиологии и медицине в 1929 году, потому что его наблюдения привели к открытию витаминов.
В 1910 году японский агрохимик из Токийского императорского университета Уметаро Судзуки выделил водорастворимое соединение тиамина из рисовых отрубей, которое он назвал абериновой кислотой . (Позже он переименовал его в оризанин .) Он описал это соединение не только как фактор против бери-бери, но и как необходимое для питания человека; однако это открытие не получило огласки за пределами Японии, поскольку утверждение о том, что это соединение является новым открытием, было опущено в переводе его публикации с японского на немецкий язык. [63] В 1911 году польский биохимик Казимир Функ выделил из рисовых отрубей антиневритическое вещество (современный тиамин), которое он назвал «витамином» (из-за содержания в нем аминогруппы). [68] [69] Однако Функ не полностью охарактеризовал его химическую структуру. Голландские химики Баренд Коенрад Петрус Янсен и его ближайший коллега Виллем Фредерик Донат в 1926 году выделили и кристаллизовали активный агент, [70] структура которого была определена Робертом Раннелсом Уильямсом в 1934 году. Тиамин был назван командой Уильямса как портманто «тио» (что означает серосодержащий) и «витамин». Термин «витамин» косвенно, через Функа, пришел из аминогруппы самого тиамина (хотя к этому времени было известно, что витамины не всегда являются аминами, например, витамин С ). Тиамин также был синтезирован группой Уильямса в 1936 году. [71]
Сэр Рудольф Питерс в Оксфорде использовал голубей, чтобы понять, как дефицит тиамина приводит к патологически-физиологическим симптомам бери-бери. У голубей, которых кормили исключительно шлифованным рисом, развивался опистотонус — состояние, характеризующееся втягиванием головы. Если их не лечить, животные умирали через несколько дней. Введение тиамина после того, как наблюдался опистотонус, приводило к полному излечению в течение 30 минут. Поскольку никаких морфологических изменений не наблюдалось в мозге голубей до и после лечения тиамином, Питерс ввел концепцию биохимически-индуцированного повреждения. [72] В 1937 году Ломанн и Шустер показали, что дифосфорилированное производное тиамина, ТФП, является кофактором, необходимым для окислительного декарбоксилирования пирувата. [73]
Случаев неблагоприятных последствий избытка тиамина не зафиксировано... Несколько отдельных случаев пурита...