
Потенциал действия возникает, когда мембранный потенциал определенной клетки быстро повышается и понижается. [1] Затем эта деполяризация приводит к тому, что соседние участки деполяризуются аналогичным образом. Потенциалы действия возникают в нескольких типах возбудимых клеток , включая клетки животных , такие как нейроны и мышечные клетки , а также некоторые растительные клетки . Некоторые эндокринные клетки, такие как бета-клетки поджелудочной железы , и некоторые клетки передней доли гипофиза также являются возбудимыми клетками. [2]
В нейронах потенциалы действия играют центральную роль в межклеточной коммуникации , обеспечивая — или в отношении скачкообразной проводимости , помогая — распространению сигналов по аксону нейрона к синаптическим бутонам , расположенным на концах аксона; эти сигналы затем могут соединяться с другими нейронами в синапсах или с двигательными клетками или железами. В других типах клеток их основная функция — активировать внутриклеточные процессы. Например, в мышечных клетках потенциал действия является первым шагом в цепочке событий, приводящих к сокращению. В бета-клетках поджелудочной железы они вызывают выброс инсулина . [a] Потенциалы действия в нейронах также известны как « нервные импульсы » или « шипы », а временная последовательность потенциалов действия, генерируемых нейроном, называется его « цепью спайков ». Нейрон, который испускает потенциал действия или нервный импульс, часто говорят, что он «срабатывает».
Потенциалы действия генерируются особыми типами потенциалзависимых ионных каналов, встроенных в плазматическую мембрану клетки . [b] Эти каналы закрываются, когда мембранный потенциал близок к (отрицательному) потенциалу покоя клетки, но они быстро начинают открываться, если мембранный потенциал увеличивается до точно определенного порогового напряжения, деполяризуя трансмембранный потенциал. [b] Когда каналы открываются, они пропускают внутрь поток ионов натрия , что изменяет электрохимический градиент, который, в свою очередь, вызывает дальнейшее повышение мембранного потенциала до нуля. Затем это заставляет открываться больше каналов, создавая больший электрический ток через клеточную мембрану и так далее. Процесс продолжается взрывообразно, пока все доступные ионные каналы не откроются, что приводит к большому подъему мембранного потенциала. Быстрый приток ионов натрия вызывает изменение полярности плазматической мембраны, и ионные каналы затем быстро инактивируются. Когда натриевые каналы закрываются, ионы натрия больше не могут проникать в нейрон, и затем они активно транспортируются обратно из плазматической мембраны. Затем активируются калиевые каналы, и происходит выходящий ток ионов калия, возвращающий электрохимический градиент в состояние покоя. После возникновения потенциала действия происходит кратковременный отрицательный сдвиг, называемый постгиперполяризацией .
В клетках животных существует два основных типа потенциалов действия. Один тип генерируется потенциалзависимыми натриевыми каналами , другой — потенциалзависимыми кальциевыми каналами . Натриевые потенциалы действия обычно длятся менее одной миллисекунды, но кальциевые потенциалы действия могут длиться 100 миллисекунд и дольше. [ необходима цитата ] В некоторых типах нейронов медленные кальциевые спайки обеспечивают движущую силу для длительного всплеска быстро испускаемых натриевых спайков. С другой стороны, в клетках сердечной мышцы начальный быстрый натриевый спайк обеспечивает «праймер», чтобы спровоцировать быстрое начало кальциевого спайка, который затем вызывает сокращение мышцы. [3]

Почти все клеточные мембраны животных, растений и грибов поддерживают разницу потенциалов между внешней и внутренней частью клетки, называемую мембранным потенциалом . Типичное напряжение на мембране животной клетки составляет -70 мВ. Это означает, что внутренняя часть клетки имеет отрицательное напряжение относительно внешней части. В большинстве типов клеток мембранный потенциал обычно остается довольно постоянным. Однако некоторые типы клеток электрически активны в том смысле, что их напряжение колеблется с течением времени. В некоторых типах электрически активных клеток, включая нейроны и мышечные клетки, колебания напряжения часто принимают форму быстрого восходящего (положительного) скачка, за которым следует быстрое падение. Эти циклы подъема и спада известны как потенциалы действия . В некоторых типах нейронов весь цикл подъема и спада происходит за несколько тысячных секунды. В мышечных клетках типичный потенциал действия длится около одной пятой секунды. В растительных клетках потенциал действия может длиться три секунды или более. [4]
Электрические свойства клетки определяются структурой ее мембраны. Клеточная мембрана состоит из липидного бислоя молекул, в который встроены более крупные молекулы белка. Липидный бислой обладает высокой устойчивостью к движению электрически заряженных ионов, поэтому он функционирует как изолятор. Большие встроенные в мембрану белки, напротив, обеспечивают каналы, по которым ионы могут проходить через мембрану. Потенциалы действия приводятся в действие канальными белками, конфигурация которых переключается между закрытым и открытым состояниями в зависимости от разности потенциалов между внутренней и внешней частью клетки. Эти чувствительные к напряжению белки известны как потенциалзависимые ионные каналы . [ необходима цитата ]
Все клетки в тканях тела животных электрически поляризованы – другими словами, они поддерживают разность потенциалов на плазматической мембране клетки , известную как мембранный потенциал . Эта электрическая поляризация является результатом сложного взаимодействия между белковыми структурами, встроенными в мембрану, называемыми ионными насосами и ионными каналами . В нейронах типы ионных каналов в мембране обычно различаются в разных частях клетки, что придает дендритам , аксону и телу клетки разные электрические свойства. В результате некоторые части мембраны нейрона могут быть возбудимыми (способными генерировать потенциалы действия), тогда как другие – нет. Недавние исследования показали, что наиболее возбудимой частью нейрона является часть после аксонного холмика (точка, где аксон покидает тело клетки), которая называется начальным сегментом аксона , но аксон и тело клетки также возбудимы в большинстве случаев. [5]
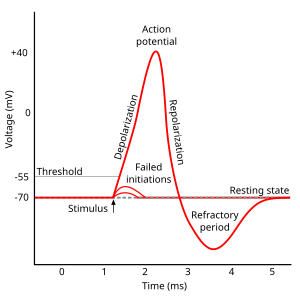
Каждый возбудимый участок мембраны имеет два важных уровня мембранного потенциала: потенциал покоя , который является значением, которое мембранный потенциал сохраняет до тех пор, пока ничто не возмущает клетку, и более высокое значение, называемое пороговым потенциалом . В аксонном холмике типичного нейрона потенциал покоя составляет около –70 милливольт (мВ), а пороговый потенциал составляет около –55 мВ. Синаптические входы в нейрон вызывают деполяризацию или гиперполяризацию мембраны ; то есть они вызывают повышение или понижение мембранного потенциала. Потенциалы действия запускаются, когда накапливается достаточно деполяризации, чтобы поднять мембранный потенциал до порогового значения. Когда запускается потенциал действия, мембранный потенциал резко подскакивает вверх, а затем столь же резко падает вниз, часто заканчиваясь ниже уровня покоя, где он остается в течение некоторого периода времени. Форма потенциала действия стереотипна; это означает, что подъем и падение обычно имеют примерно одинаковую амплитуду и временной ход для всех потенциалов действия в данной клетке. (Исключения обсуждаются далее в статье). В большинстве нейронов весь процесс происходит примерно за тысячную долю секунды. Многие типы нейронов постоянно испускают потенциалы действия со скоростью до 10–100 в секунду. Однако некоторые типы гораздо тише и могут в течение минут и дольше не испускать никаких потенциалов действия.
Потенциалы действия возникают в результате присутствия в клеточной мембране особых типов потенциалзависимых ионных каналов . [6] Потенциалзависимый ионный канал — это трансмембранный белок, обладающий тремя ключевыми свойствами:
Таким образом, потенциал-зависимый ионный канал имеет тенденцию быть открытым для некоторых значений мембранного потенциала и закрытым для других. Однако в большинстве случаев связь между мембранным потенциалом и состоянием канала является вероятностной и включает временную задержку. Ионные каналы переключаются между конформациями в непредсказуемые моменты времени: мембранный потенциал определяет скорость переходов и вероятность каждого типа перехода за единицу времени.

Потенциалзависимые ионные каналы способны производить потенциалы действия, поскольку они могут вызывать положительные обратные связи : мембранный потенциал контролирует состояние ионных каналов, но состояние ионных каналов контролирует мембранный потенциал. Таким образом, в некоторых ситуациях повышение мембранного потенциала может привести к открытию ионных каналов, тем самым вызывая дальнейшее повышение мембранного потенциала. Потенциал действия возникает, когда этот цикл положительной обратной связи ( цикл Ходжкина ) протекает взрывообразно. Временная и амплитудная траектория потенциала действия определяются биофизическими свойствами потенциалзависимых ионных каналов, которые его производят. Существует несколько типов каналов, способных производить положительную обратную связь, необходимую для генерации потенциала действия. Потенциалзависимые натриевые каналы отвечают за быстрые потенциалы действия, участвующие в нервной проводимости. Более медленные потенциалы действия в мышечных клетках и некоторых типах нейронов генерируются потенциалзависимыми кальциевыми каналами. Каждый из этих типов существует в нескольких вариантах с различной чувствительностью к напряжению и различной временной динамикой.
Наиболее интенсивно изучаемый тип потенциал-зависимых ионных каналов включает натриевые каналы, участвующие в быстрой нервной проводимости. Иногда их называют натриевыми каналами Ходжкина-Хаксли, поскольку они были впервые охарактеризованы Аланом Ходжкиным и Эндрю Хаксли в их удостоенных Нобелевской премии исследованиях биофизики потенциала действия, но их удобнее называть каналами Na V. («V» означает «напряжение».) Канал Na V имеет три возможных состояния: деактивированный , активированный и инактивированный . Канал проницаем только для ионов натрия, когда он находится в активированном состоянии. Когда мембранный потенциал низкий, канал проводит большую часть времени в деактивированном (закрытом) состоянии. Если мембранный потенциал повышается выше определенного уровня, канал показывает повышенную вероятность перехода в активированное (открытое) состояние. Чем выше мембранный потенциал, тем больше вероятность активации. После активации канала он в конечном итоге перейдет в инактивированное (закрытое) состояние. Затем он имеет тенденцию оставаться инактивированным в течение некоторого времени, но если мембранный потенциал снова становится низким, канал в конечном итоге перейдет обратно в деактивированное состояние. Во время потенциала действия большинство каналов этого типа проходят через цикл деактивированный → активированный → инактивированный → деактивированный . Однако это только среднее поведение популяции — отдельный канал в принципе может совершить любой переход в любое время. Однако вероятность перехода канала из инактивированного состояния непосредственно в активированное очень мала: канал в инактивированном состоянии является рефрактерным, пока он не перейдет обратно в деактивированное состояние.
Результатом всего этого является то, что кинетика каналов Na V регулируется матрицей перехода, скорости которой сложным образом зависят от напряжения. Поскольку сами эти каналы играют важную роль в определении напряжения, глобальную динамику системы может быть довольно сложно рассчитать. Ходжкин и Хаксли подошли к проблеме, разработав набор дифференциальных уравнений для параметров, которые управляют состояниями ионных каналов, известных как уравнения Ходжкина-Хаксли . Эти уравнения были значительно изменены более поздними исследованиями, но являются отправной точкой для большинства теоретических исследований биофизики потенциала действия.
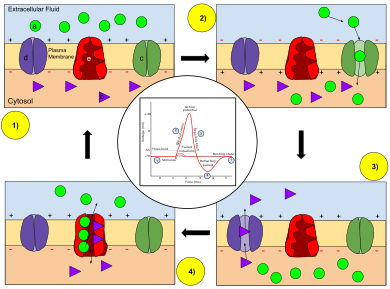
При увеличении мембранного потенциала открываются каналы ионов натрия , что позволяет ионам натрия проникать в клетку. За этим следует открытие каналов ионов калия , которые позволяют ионам калия выходить из клетки. Входящий поток ионов натрия увеличивает концентрацию положительно заряженных катионов в клетке и вызывает деполяризацию, при которой потенциал клетки выше, чем потенциал покоя клетки . Натриевые каналы закрываются на пике потенциала действия, в то время как калий продолжает покидать клетку. Отток ионов калия снижает мембранный потенциал или гиперполяризует клетку. При небольшом увеличении напряжения от покоя калиевый ток превышает натриевый ток, и напряжение возвращается к своему нормальному значению покоя, обычно -70 мВ. [7] [8] [9] Однако, если напряжение увеличивается сверх критического порога, обычно на 15 мВ выше значения покоя, доминирует натриевый ток. Это приводит к состоянию неуправляемости, при котором положительная обратная связь от натриевого тока активирует еще больше натриевых каналов. Таким образом, клетка активируется , создавая потенциал действия. [7] [10] [11] [примечание 1] Частоту, с которой нейрон вызывает потенциалы действия, часто называют частотой активации или частотой активации нейронов .
Токи, создаваемые открытием потенциалзависимых каналов в ходе потенциала действия, как правило, значительно больше, чем начальный стимулирующий ток. Таким образом, амплитуда, длительность и форма потенциала действия в значительной степени определяются свойствами возбудимой мембраны, а не амплитудой или длительностью стимула. Это свойство потенциала действия «все или ничего» отличает его от градуированных потенциалов, таких как рецепторные потенциалы , электротонические потенциалы , колебания подпорогового мембранного потенциала и синаптические потенциалы , которые масштабируются с величиной стимула. Разнообразие типов потенциала действия существует во многих типах клеток и клеточных компартментах, что определяется типами потенциалзависимых каналов, каналов утечки , распределениями каналов, ионными концентрациями, емкостью мембраны, температурой и другими факторами.
Основными ионами, участвующими в потенциале действия, являются катионы натрия и калия; ионы натрия входят в клетку, а ионы калия выходят, восстанавливая равновесие. Для того чтобы мембранное напряжение резко изменилось, через мембрану должно пройти относительно немного ионов. Таким образом, ионы, обмениваемые во время потенциала действия, вносят незначительное изменение во внутреннюю и внешнюю концентрацию ионов. Те немногие ионы, которые действительно пересекают, снова выкачиваются непрерывным действием натрий-калиевого насоса , который вместе с другими ионными транспортерами поддерживает нормальное соотношение концентраций ионов через мембрану. Катионы кальция и анионы хлора участвуют в нескольких типах потенциалов действия, таких как сердечный потенциал действия и потенциал действия в одноклеточной водоросли Acetabularia соответственно.
Хотя потенциалы действия генерируются локально на участках возбудимой мембраны, результирующие токи могут вызывать потенциалы действия на соседних участках мембраны, вызывая распространение, подобное домино. В отличие от пассивного распространения электрических потенциалов ( электротонического потенциала ), потенциалы действия генерируются заново вдоль возбудимых участков мембраны и распространяются без затухания. [12] Миелинизированные участки аксонов невозбудимы и не производят потенциалы действия, и сигнал распространяется пассивно как электротонический потенциал . Регулярно расположенные немиелинизированные участки, называемые перехватами Ранвье , генерируют потенциалы действия для усиления сигнала. Известный как скачкообразное проведение , этот тип распространения сигнала обеспечивает благоприятный компромисс между скоростью сигнала и диаметром аксона. Деполяризация окончаний аксонов , в целом, запускает высвобождение нейротрансмиттера в синаптическую щель . Кроме того, обратно распространяющиеся потенциалы действия были зарегистрированы в дендритах пирамидальных нейронов , которые повсеместно встречаются в неокортексе. [c] Считается, что они играют роль в пластичности, зависящей от времени спайков .
В модели емкости мембраны Ходжкина-Хаксли скорость передачи потенциала действия была неопределенной, и предполагалось, что соседние области деполяризуются из-за интерференции освобожденных ионов с соседними каналами. Измерения диффузии ионов и радиусов с тех пор показали, что это невозможно. [ необходима цитата ] Более того, противоречивые измерения изменений энтропии и времени оспаривали модель емкости как действующую в одиночку. [ необходима цитата ] В качестве альтернативы, гипотеза адсорбции Гилберта Линга утверждает, что мембранный потенциал и потенциал действия живой клетки обусловлены адсорбцией подвижных ионов на адсорбционных участках клеток. [13]
Способность нейрона генерировать и распространять потенциал действия изменяется в процессе развития . То, насколько сильно мембранный потенциал нейрона изменяется в результате импульса тока, является функцией входного сопротивления мембраны . По мере роста клетки к мембране добавляется больше каналов , что приводит к снижению входного сопротивления. Зрелый нейрон также претерпевает более короткие изменения мембранного потенциала в ответ на синаптические токи. Нейроны из латерального коленчатого ядра хорька имеют более длительную постоянную времени и большее отклонение напряжения в P0, чем в P30. [14] Одним из следствий уменьшения длительности потенциала действия является то, что точность сигнала может быть сохранена в ответ на высокочастотную стимуляцию. Незрелые нейроны более склонны к синаптической депрессии, чем к потенциации после высокочастотной стимуляции. [14]
На раннем этапе развития многих организмов потенциал действия на самом деле изначально переносится кальциевым током, а не натриевым током . Кинетика открытия и закрытия кальциевых каналов во время развития медленнее, чем у потенциалзависимых натриевых каналов, которые будут переносить потенциал действия в зрелых нейронах. Более длительное время открытия кальциевых каналов может привести к потенциалам действия, которые значительно медленнее, чем у зрелых нейронов. [14] Нейроны Xenopus изначально имеют потенциалы действия, которые занимают 60–90 мс. Во время развития это время уменьшается до 1 мс. Есть две причины этого резкого снижения. Во-первых, входящий ток в основном переносится натриевыми каналами. [15] Во-вторых, задержанный выпрямитель , ток калиевого канала , увеличивается в 3,5 раза от его первоначальной силы. [14]
Для того чтобы переход от кальций-зависимого потенциала действия к натрий-зависимому потенциалу действия мог произойти, необходимо добавить новые каналы к мембране. Если нейроны Xenopus выращиваются в среде с ингибиторами синтеза РНК или синтеза белка , этот переход предотвращается. [16] Даже электрическая активность самой клетки может играть роль в экспрессии каналов. Если потенциалы действия в миоцитах Xenopus блокируются, типичное увеличение плотности тока натрия и калия предотвращается или задерживается. [17]
Это созревание электрических свойств наблюдается у разных видов. Натриевые и калиевые токи Xenopus резко увеличиваются после того, как нейрон проходит через финальную фазу митоза . Плотность натриевого тока кортикальных нейронов крысы увеличивается на 600% в течение первых двух постнатальных недель. [14]
Несколько типов клеток поддерживают потенциал действия, такие как растительные клетки, мышечные клетки и специализированные клетки сердца (в которых происходит сердечный потенциал действия ). Однако, основной возбудимой клеткой является нейрон , который также имеет самый простой механизм для потенциала действия. [ необходима цитата ]
Нейроны — это электрически возбудимые клетки, состоящие, как правило, из одного или нескольких дендритов, одной сомы , одного аксона и одного или нескольких аксонных окончаний . Дендриты — это клеточные отростки, чья основная функция заключается в получении синаптических сигналов. Их выступы, известные как дендритные шипики , предназначены для захвата нейротрансмиттеров, высвобождаемых пресинаптическим нейроном. Они имеют высокую концентрацию лиганд-управляемых ионных каналов . Эти шипики имеют тонкую шейку, соединяющую луковицеобразный выступ с дендритом. Это гарантирует, что изменения, происходящие внутри шипика, с меньшей вероятностью повлияют на соседние шипики. Дендритный шипик может, за редким исключением (см. LTP ), действовать как независимая единица. Дендриты отходят от сомы, в которой находится ядро , и многие из «нормальных» эукариотических органелл. В отличие от шипиков, поверхность сомы заполнена ионными каналами, активируемыми напряжением. Эти каналы помогают передавать сигналы, генерируемые дендритами. Из сомы выходит аксонный холмик . Эта область характеризуется очень высокой концентрацией натриевых каналов, активируемых напряжением. В целом, она считается зоной инициации спайков для потенциалов действия, [18] т. е. триггерной зоной . Множественные сигналы, генерируемые шипиками и передаваемые сомой, сходятся здесь. Сразу за аксонным холмиком находится аксон. Это тонкий трубчатый выступ, отходящий от сомы. Аксон изолирован миелиновой оболочкой. Миелин состоит либо из шванновских клеток (в периферической нервной системе), либо из олигодендроцитов (в центральной нервной системе), которые являются типами глиальных клеток . Хотя глиальные клетки не участвуют в передаче электрических сигналов, они взаимодействуют и оказывают важную биохимическую поддержку нейронам. [19] Если говорить конкретно, миелин многократно обертывает аксональный сегмент, образуя толстый жировой слой, который предотвращает попадание ионов в аксон или выход из него. Эта изоляция предотвращает значительное затухание сигнала, а также обеспечивает более высокую скорость сигнала. Однако эта изоляция имеет ограничение, заключающееся в том, что на поверхности аксона не может быть каналов. Поэтому существуют регулярно расположенные участки мембраны, которые не имеют изоляции. Эти перехваты Ранвье можно считать «мини-аксонными холмиками», поскольку их цель — усилить сигнал, чтобы предотвратить значительное затухание сигнала. На самом дальнем конце аксон теряет изоляцию и начинает разветвляться на несколько аксонных терминалов. Эти пресинаптические терминали, или синаптические бутоны, представляют собой специализированную область внутри аксона пресинаптической клетки, которая содержит нейротрансмиттеры , заключенные в небольшие мембранные сферы, называемые синаптическими пузырьками . [ необходима цитата ]
Прежде чем рассматривать распространение потенциалов действия по аксонам и их окончание в синаптических узлах, полезно рассмотреть методы, с помощью которых потенциалы действия могут быть инициированы в аксонном холмике . Основное требование заключается в том, чтобы мембранное напряжение в холмике было выше порога для срабатывания. [7] [8] [20] [21] Существует несколько способов, с помощью которых может произойти эта деполяризация.

Потенциалы действия чаще всего инициируются возбуждающими постсинаптическими потенциалами от пресинаптического нейрона. [22] Обычно молекулы нейротрансмиттера высвобождаются пресинаптическим нейроном . Затем эти нейротрансмиттеры связываются с рецепторами на постсинаптической клетке. Это связывание открывает различные типы ионных каналов . Это открытие имеет дальнейший эффект изменения локальной проницаемости клеточной мембраны и, таким образом, мембранного потенциала. Если связывание увеличивает напряжение (деполяризует мембрану), синапс является возбуждающим. Если, однако, связывание уменьшает напряжение (гиперполяризует мембрану), он является ингибирующим. Независимо от того, увеличивается или уменьшается напряжение, изменение пассивно распространяется на близлежащие области мембраны (как описано уравнением кабеля и его уточнениями). Обычно стимул напряжения экспоненциально затухает с расстоянием от синапса и со временем от связывания нейротрансмиттера. Некоторая часть возбуждающего напряжения может достичь аксонного холмика и может (в редких случаях) деполяризовать мембрану достаточно, чтобы спровоцировать новый потенциал действия. Чаще всего возбуждающие потенциалы от нескольких синапсов должны работать вместе почти в одно и то же время , чтобы спровоцировать новый потенциал действия. Однако их совместные усилия могут быть сорваны противодействующими ингибирующими постсинаптическими потенциалами . [ необходима цитата ]
Нейротрансмиссия может также происходить через электрические синапсы . [23] Благодаря прямой связи между возбудимыми клетками в форме щелевых контактов , потенциал действия может передаваться напрямую от одной клетки к другой в любом направлении. Свободный поток ионов между клетками обеспечивает быструю нехимическую передачу. Выпрямительные каналы гарантируют, что потенциалы действия движутся только в одном направлении через электрический синапс. [ необходима цитата ] Электрические синапсы встречаются во всех нервных системах, включая человеческий мозг, хотя они составляют явное меньшинство. [24]
Амплитуда потенциала действия часто считается независимой от величины тока, который его произвел. Другими словами, более сильные токи не создают более сильные потенциалы действия. Поэтому говорят, что потенциалы действия являются сигналами типа « все или ничего» , поскольку они либо возникают полностью, либо не возникают вообще. [d] [e] [f] Это контрастирует с рецепторными потенциалами , амплитуды которых зависят от интенсивности стимула. [25] В обоих случаях частота потенциалов действия коррелирует с интенсивностью стимула.
Несмотря на классический взгляд на потенциал действия как на стереотипный, однородный сигнал, доминировавший в области нейронауки на протяжении многих десятилетий, новые данные свидетельствуют о том, что потенциалы действия — это более сложные события, которые действительно способны передавать информацию не только посредством своей амплитуды, но также своей продолжительности и фазы, иногда даже на расстояния, которые изначально считались невозможными. [26] [27] [28] [29]
В сенсорных нейронах внешний сигнал, такой как давление, температура, свет или звук, сочетается с открытием и закрытием ионных каналов , которые, в свою очередь, изменяют ионную проницаемость мембраны и ее напряжение. [30] Эти изменения напряжения снова могут быть возбуждающими (деполяризующими) или ингибирующими (гиперполяризующими), и в некоторых сенсорных нейронах их комбинированные эффекты могут деполяризовать аксонный холмик достаточно, чтобы спровоцировать потенциалы действия. Некоторые примеры у людей включают обонятельный рецепторный нейрон и тельце Мейсснера , которые имеют решающее значение для обоняния и осязания соответственно. Однако не все сенсорные нейроны преобразуют свои внешние сигналы в потенциалы действия; у некоторых даже нет аксона. [31] Вместо этого они могут преобразовывать сигнал в высвобождение нейротрансмиттера или в непрерывные градуированные потенциалы , любой из которых может стимулировать последующий нейрон(ы) к запуску потенциала действия. Например, в человеческом ухе волосковые клетки преобразуют входящий звук в открытие и закрытие механически управляемых ионных каналов , что может привести к высвобождению молекул нейротрансмиттера . Аналогичным образом, в сетчатке человека начальные фоторецепторные клетки и следующий слой клеток (состоящий из биполярных клеток и горизонтальных клеток ) не производят потенциалы действия; только некоторые амакриновые клетки и третий слой, ганглиозные клетки , производят потенциалы действия, которые затем перемещаются вверх по зрительному нерву . [ необходима цитата ]
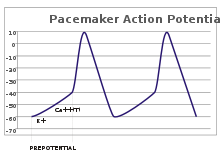
В сенсорных нейронах потенциалы действия возникают в результате внешнего стимула. Однако некоторым возбудимым клеткам такой стимул для активации не требуется: они спонтанно деполяризуют свой аксональный холмик и активируют потенциалы действия с постоянной скоростью, как внутренние часы. [32] Следы напряжения таких клеток известны как потенциалы водителя ритма . [33] Клетки водителя ритма сердца синоатриального узла в сердце являются хорошим примером. [g] Хотя такие потенциалы водителя ритма имеют естественный ритм , его можно регулировать внешними стимулами; например, частота сердечных сокращений может быть изменена фармацевтическими препаратами, а также сигналами от симпатических и парасимпатических нервов. [34] Внешние стимулы не вызывают повторную активацию клетки, а просто изменяют ее синхронизацию. [33] В некоторых случаях регуляция частоты может быть более сложной, что приводит к моделям потенциалов действия, таким как разрыв . [ необходима ссылка ]
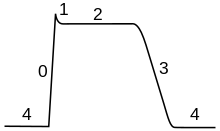
Ход потенциала действия можно разделить на пять частей: фаза роста, пиковая фаза, падающая фаза, фаза недоразряда и рефрактерный период. Во время фазы роста мембранный потенциал деполяризуется (становится более положительным). Точка, в которой деполяризация прекращается, называется пиковой фазой. На этой стадии мембранный потенциал достигает максимума. После этого наступает падающая фаза. На этой стадии мембранный потенциал становится более отрицательным, возвращаясь к потенциалу покоя. Фаза недоразряда, или постгиперполяризации , — это период, в течение которого мембранный потенциал временно становится более отрицательно заряженным, чем в состоянии покоя (гиперполяризованным). Наконец, время, в течение которого последующий потенциал действия невозможен или затруднен, называется рефрактерным периодом , который может перекрываться с другими фазами. [35]
Ход потенциала действия определяется двумя сопряженными эффектами. [36] Во-первых, потенциал-чувствительные ионные каналы открываются и закрываются в ответ на изменения мембранного напряжения V m . Это изменяет проницаемость мембраны для этих ионов. [37] Во-вторых, согласно уравнению Голдмана , это изменение проницаемости изменяет равновесный потенциал E m , и, таким образом, мембранное напряжение V m . [h] Таким образом, мембранный потенциал влияет на проницаемость, которая затем дополнительно влияет на мембранный потенциал. Это создает возможность для положительной обратной связи , которая является ключевой частью восходящей фазы потенциала действия. [7] [10] Осложняющим фактором является то, что один ионный канал может иметь несколько внутренних «ворот», которые реагируют на изменения V m противоположным образом или с разной скоростью. [38] [i] Например, хотя повышение V m открывает большинство ворот в чувствительном к напряжению натриевом канале, оно также закрывает «ворота инактивации» канала, хотя и медленнее. [39] Следовательно, когда V m резко повышается, натриевые каналы сначала открываются, но затем закрываются из-за более медленной инактивации.
Напряжения и токи потенциала действия во всех его фазах были точно смоделированы Аланом Ллойдом Ходжкиным и Эндрю Хаксли в 1952 году, [i] за что они были удостоены Нобелевской премии по физиологии и медицине в 1963 году. [lower-Greek 2] Однако их модель рассматривает только два типа чувствительных к напряжению ионных каналов и делает несколько предположений о них, например, что их внутренние ворота открываются и закрываются независимо друг от друга. В действительности существует много типов ионных каналов, [40] и они не всегда открываются и закрываются независимо. [j]
Типичный потенциал действия начинается в аксонном холмике [41] с достаточно сильной деполяризацией, например, стимулом, который увеличивает V m . Эта деполяризация часто вызывается инъекцией дополнительных катионов натрия в клетку; эти катионы могут поступать из самых разных источников, таких как химические синапсы , сенсорные нейроны или потенциалы водителя ритма . [ необходима цитата ]
Для нейрона в состоянии покоя существует высокая концентрация ионов натрия и хлора во внеклеточной жидкости по сравнению с внутриклеточной жидкостью , в то время как во внутриклеточной жидкости существует высокая концентрация ионов калия по сравнению с внеклеточной жидкостью. Разница в концентрациях, которая заставляет ионы перемещаться от высокой к низкой концентрации , и электростатические эффекты (притяжение противоположных зарядов) отвечают за движение ионов в нейрон и из него. Внутренняя часть нейрона имеет отрицательный заряд относительно внешней части клетки из-за движения K + из клетки. Мембрана нейрона более проницаема для K + , чем для других ионов, что позволяет этому иону избирательно перемещаться из клетки по ее градиенту концентрации. Этот градиент концентрации вместе с каналами утечки калия, присутствующими на мембране нейрона, вызывает отток ионов калия, делая потенциал покоя близким к E K ≈ –75 мВ. [42] Поскольку ионы Na + находятся в более высоких концентрациях вне клетки, разница в концентрации и напряжении заставляет их попадать в клетку, когда открываются каналы Na + . Деполяризация открывает как натриевые, так и калиевые каналы в мембране, позволяя ионам втекать и вытекать из аксона соответственно. Если деполяризация невелика (например, увеличение Vm с −70 мВ до −60 мВ), внешний калиевый ток подавляет внутренний натриевый ток, и мембрана реполяризуется обратно к своему нормальному потенциалу покоя около −70 мВ. [7] [8] [9] Однако, если деполяризация достаточно велика, внутренний натриевый ток увеличивается больше, чем внешний калиевый ток, и возникает состояние неуправляемости ( положительная обратная связь ): чем больше входящий ток, тем больше увеличивается Vm , что, в свою очередь, еще больше увеличивает входящий ток. [7] [10] Достаточно сильная деполяризация (увеличение Vm ) вызывает открытие чувствительных к напряжению натриевых каналов ; увеличение проницаемости для натрия приближает V m к напряжению равновесия натрия E Na ≈ +55 мВ. Увеличение напряжения в свою очередь приводит к открытию еще большего количества натриевых каналов, что толкает V m еще дальше к E Na . Эта положительная обратная связь продолжается до тех пор, пока натриевые каналы не откроются полностью и V m не приблизится к E Na . [7] [8] [20][21] Резкий рост V m и проницаемости натрия соответствует восходящей фазе потенциала действия. [7] [8] [20] [21]
Критическое пороговое напряжение для этого состояния разгона обычно составляет около −45 мВ, но оно зависит от недавней активности аксона. Клетка, которая только что запустила потенциал действия, не может немедленно запустить другой, поскольку каналы Na + не восстановились из инактивированного состояния. Период, в течение которого новый потенциал действия не может быть запущен, называется абсолютным рефрактерным периодом . [43] [44] [45] В более длительные периоды времени, после того как некоторые, но не все ионные каналы восстановились, аксон может быть стимулирован для создания другого потенциала действия, но с более высоким порогом, требующим гораздо более сильной деполяризации, например, до −30 мВ. Период, в течение которого потенциалы действия необычно трудно вызвать, называется относительным рефрактерным периодом . [43] [44] [45]
Положительная обратная связь восходящей фазы замедляется и останавливается, когда каналы ионов натрия становятся максимально открытыми. На пике потенциала действия проницаемость натрия максимальна, а мембранное напряжение V m почти равно равновесному напряжению натрия E Na . Однако то же самое повышенное напряжение, которое изначально открыло натриевые каналы, также медленно их закрывает, закрывая их поры; натриевые каналы становятся инактивированными . [39] Это снижает проницаемость мембраны для натрия относительно калия, возвращая мембранное напряжение к значению покоя. В то же время повышенное напряжение открывает чувствительные к напряжению калиевые каналы; увеличение проницаемости мембраны для калия перемещает V m к E K . [39] В совокупности эти изменения проницаемости натрия и калия вызывают быстрое падение V m , реполяризуя мембрану и создавая «падающую фазу» потенциала действия. [43] [46] [21] [47]
Деполяризованное напряжение открывает дополнительные потенциал-зависимые калиевые каналы, и некоторые из них не закрываются сразу, когда мембрана возвращается к своему нормальному напряжению покоя. Кроме того, дополнительные калиевые каналы открываются в ответ на приток ионов кальция во время потенциала действия. Внутриклеточная концентрация ионов калия временно необычно низка, делая мембранное напряжение V m еще ближе к равновесному напряжению калия E K . Мембранный потенциал опускается ниже мембранного потенциала покоя. Следовательно, происходит недобор или гиперполяризация , называемая постгиперполяризацией , которая сохраняется до тех пор, пока проницаемость мембраны для калия не вернется к своему обычному значению, восстанавливая мембранный потенциал до состояния покоя. [48] [46]
За каждым потенциалом действия следует рефрактерный период , который можно разделить на абсолютный рефрактерный период , в течение которого невозможно вызвать другой потенциал действия, и затем относительный рефрактерный период , в течение которого требуется более сильный, чем обычно, стимул. [43] [44] [45] Эти два рефрактерных периода вызваны изменениями в состоянии молекул натриевых и калиевых каналов. При закрытии после потенциала действия натриевые каналы переходят в «инактивированное» состояние , в котором их невозможно открыть независимо от мембранного потенциала — это приводит к абсолютному рефрактерному периоду. Даже после того, как достаточное количество натриевых каналов перешло обратно в состояние покоя, часто случается, что часть калиевых каналов остается открытой, что затрудняет деполяризацию мембранного потенциала и, таким образом, приводит к относительному рефрактерному периоду. Поскольку плотность и подтипы калиевых каналов могут сильно различаться у разных типов нейронов, продолжительность относительного рефрактерного периода сильно варьируется. [ необходима цитата ]
Абсолютный рефрактерный период в значительной степени отвечает за однонаправленное распространение потенциалов действия вдоль аксонов. [49] В любой момент времени участок аксона позади активно спайковой части является рефрактерным, но участок перед ним, не будучи недавно активированным, способен стимулироваться деполяризацией от потенциала действия.
Потенциал действия, генерируемый на аксонном холмике, распространяется как волна вдоль аксона. [50] Токи, текущие внутрь в точке аксона во время потенциала действия, распространяются вдоль аксона и деполяризуют соседние участки его мембраны. Если эта деполяризация достаточно сильна, она вызывает аналогичный потенциал действия на соседних участках мембраны. Этот базовый механизм был продемонстрирован Аланом Ллойдом Ходжкиным в 1937 году. После раздавливания или охлаждения нервных сегментов и, таким образом, блокирования потенциалов действия он показал, что потенциал действия, прибывающий с одной стороны блока, может спровоцировать другой потенциал действия с другой стороны, при условии, что заблокированный сегмент был достаточно коротким. [k]
После того, как потенциал действия возник на участке мембраны, участку мембраны нужно время, чтобы восстановиться, прежде чем он сможет снова активироваться. На молекулярном уровне этот абсолютный рефрактерный период соответствует времени, необходимому для того, чтобы активируемые напряжением натриевые каналы восстановились после инактивации, т. е. вернулись в закрытое состояние. [44] В нейронах существует много типов активируемых напряжением калиевых каналов. Некоторые из них инактивируются быстро (токи типа А), а некоторые инактивируются медленно или не инактивируются вообще; эта изменчивость гарантирует, что всегда будет доступный источник тока для реполяризации, даже если некоторые из калиевых каналов инактивируются из-за предшествующей деполяризации. С другой стороны, все активируемые напряжением нейронные натриевые каналы инактивируются в течение нескольких миллисекунд во время сильной деполяризации, что делает последующую деполяризацию невозможной до тех пор, пока значительная часть натриевых каналов не вернется в закрытое состояние. Хотя это ограничивает частоту активации, [51] абсолютный рефрактерный период гарантирует, что потенциал действия движется только в одном направлении вдоль аксона. [49] Токи, протекающие из-за потенциала действия, распространяются в обоих направлениях вдоль аксона. [52] Однако только неактивированная часть аксона может реагировать потенциалом действия; часть, которая только что активировалась, не реагирует до тех пор, пока потенциал действия не выйдет из зоны действия и не сможет повторно стимулировать эту часть. При обычной ортодромной проводимости потенциал действия распространяется от аксонного холмика к синаптическим выступам (аксональным окончаниям); распространение в противоположном направлении — известное как антидромная проводимость — встречается очень редко. [53] Однако, если лабораторный аксон стимулируется в его середине, обе половины аксона являются «свежими», т. е. неактивированными; тогда будут сгенерированы два потенциала действия, один из которых будет направлен к аксонному холмику, а другой — к синаптическим выступам.

Для обеспечения быстрой и эффективной передачи электрических сигналов в нервной системе некоторые нейронные аксоны покрыты миелиновыми оболочками. Миелин представляет собой многослойную мембрану, которая окутывает аксон в сегментах, разделенных интервалами, известными как перехваты Ранвье . Он вырабатывается специализированными клетками: шванновскими клетками исключительно в периферической нервной системе и олигодендроцитами исключительно в центральной нервной системе . Миелиновая оболочка снижает емкость мембраны и увеличивает сопротивление мембраны в межузловых интервалах, тем самым обеспечивая быстрое, скачкообразное перемещение потенциалов действия от узла к узлу. [l] [m] [n] Миелинизация встречается в основном у позвоночных , но аналогичная система была обнаружена у нескольких беспозвоночных, таких как некоторые виды креветок . [o] Не все нейроны позвоночных миелинизированы; например, аксоны нейронов, составляющих автономную нервную систему, в целом не миелинизированы.
Миелин предотвращает вход и выход ионов из аксона вдоль миелинизированных сегментов. Как правило, миелинизация увеличивает скорость проведения потенциалов действия и делает их более энергоэффективными. Независимо от того, скачущий он или нет, средняя скорость проведения потенциала действия колеблется от 1 метра в секунду (м/с) до более чем 100 м/с и, в общем, увеличивается с диаметром аксона. [p]
Потенциалы действия не могут распространяться через мембрану в миелинизированных сегментах аксона. Однако ток переносится цитоплазмой, что достаточно для деполяризации первого или второго последующего перехвата Ранвье . Вместо этого ионный ток от потенциала действия в одном узле Ранвье вызывает другой потенциал действия в следующем узле; это кажущееся «перескакивание» потенциала действия от узла к узлу известно как скачкообразное проведение . Хотя механизм скачкообразного проведения был предложен в 1925 году Ральфом Лилли [q] , первые экспериментальные доказательства скачкообразного проведения были получены Ичиджи Тасаки [r] и Тайджи Такеучи [s] [54] , а также Эндрю Хаксли и Робертом Стэмпфли. [t] Напротив, в немиелинизированных аксонах потенциал действия вызывает другой в мембране, непосредственно прилегающей к нему, и непрерывно движется вниз по аксону, как волна.

Миелин имеет два важных преимущества: высокая скорость проводимости и энергетическая эффективность. Для аксонов, диаметр которых больше минимального (примерно 1 микрометр ), миелинизация увеличивает скорость проводимости потенциала действия, как правило, в десять раз. [v] И наоборот, для заданной скорости проводимости миелинизированные волокна меньше, чем их немиелинизированные аналоги. Например, потенциалы действия движутся примерно с одинаковой скоростью (25 м/с) в миелинизированном аксоне лягушки и немиелинизированном гигантском аксоне кальмара , но аксон лягушки имеет примерно в 30 раз меньший диаметр и в 1000 раз меньшую площадь поперечного сечения. Кроме того, поскольку ионные токи ограничены перехватами Ранвье, гораздо меньше ионов «просачиваются» через мембрану, экономя метаболическую энергию. Эта экономия является значительным селективным преимуществом , поскольку нервная система человека использует примерно 20% метаболической энергии организма. [v]
Длина миелинизированных сегментов аксонов важна для успеха скачкообразной проводимости. Они должны быть как можно длиннее, чтобы максимизировать скорость проводимости, но не настолько длинными, чтобы поступающий сигнал был слишком слабым, чтобы спровоцировать потенциал действия в следующем узле Ранвье. В природе миелинизированные сегменты обычно достаточно длинны для того, чтобы пассивно распространяемый сигнал прошел по крайней мере два узла, сохраняя при этом достаточную амплитуду, чтобы запустить потенциал действия во втором или третьем узле. Таким образом, фактор безопасности скачкообразной проводимости высок, что позволяет передаче обходить узлы в случае травмы. Однако потенциалы действия могут преждевременно заканчиваться в определенных местах, где фактор безопасности низок, даже в немиелинизированных нейронах; распространенным примером является точка разветвления аксона, где он разделяется на два аксона. [56]
Некоторые заболевания разрушают миелин и нарушают скачкообразное проведение, снижая скорость проведения потенциалов действия. [w] Наиболее известным из них является рассеянный склероз , при котором разрушение миелина нарушает координацию движений. [57]

Течение токов внутри аксона можно количественно описать с помощью кабельной теории [58] и ее разработок, таких как компартментальная модель. [59] Кабельная теория была разработана в 1855 году лордом Кельвином для моделирования трансатлантического телеграфного кабеля [x] и была показана как имеющая отношение к нейронам Ходжкиным и Раштоном в 1946 году. [y] В простой кабельной теории нейрон рассматривается как электрически пассивный, идеально цилиндрический кабель передачи, который можно описать с помощью частного дифференциального уравнения [58]
где V ( x , t ) — напряжение на мембране в момент времени t и положение x вдоль длины нейрона, а λ и τ — характерные шкалы длины и времени, на которых эти напряжения затухают в ответ на стимул. Ссылаясь на схему цепи справа, эти шкалы можно определить из сопротивлений и емкостей на единицу длины. [60]
Эти временные и длиновые масштабы можно использовать для понимания зависимости скорости проводимости от диаметра нейрона в немиелинизированных волокнах. Например, временной масштаб τ увеличивается как с сопротивлением мембраны r m , так и с емкостью c m . По мере увеличения емкости для создания заданного трансмембранного напряжения необходимо передать больше заряда (по уравнению Q = CV ); по мере увеличения сопротивления за единицу времени передается меньше заряда, что замедляет уравновешивание. Аналогичным образом, если внутреннее сопротивление на единицу длины r i в одном аксоне ниже, чем в другом (например, потому что радиус первого больше), длина пространственного затухания λ становится больше, а скорость проводимости потенциала действия должна увеличиваться. Если трансмембранное сопротивление r m увеличивается, это снижает средний ток «утечки» через мембрану, аналогично заставляя λ становиться длиннее, увеличивая скорость проводимости.
В целом, потенциалы действия, достигающие синаптических выступов, вызывают высвобождение нейротрансмиттера в синаптическую щель. [z] Нейротрансмиттеры — это небольшие молекулы, которые могут открывать ионные каналы в постсинаптической клетке; большинство аксонов имеют один и тот же нейротрансмиттер на всех своих окончаниях. Поступление потенциала действия открывает чувствительные к напряжению кальциевые каналы в пресинаптической мембране; приток кальция заставляет везикулы, заполненные нейротрансмиттером, мигрировать к поверхности клетки и высвобождать свое содержимое в синаптическую щель . [aa] Этот сложный процесс ингибируется нейротоксинами тетаноспазмином и ботулиническим токсином , которые ответственны за столбняк и ботулизм соответственно. [ab]
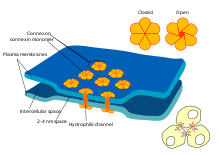
Некоторые синапсы обходятся без «посредника» нейротрансмиттера и соединяют пресинаптические и постсинаптические клетки вместе. [ac] Когда потенциал действия достигает такого синапса, ионные токи, текущие в пресинаптическую клетку, могут пересекать барьер двух клеточных мембран и попадать в постсинаптическую клетку через поры, известные как коннексоны . [ad] Таким образом, ионные токи пресинаптического потенциала действия могут напрямую стимулировать постсинаптическую клетку. Электрические синапсы обеспечивают более быструю передачу, поскольку они не требуют медленной диффузии нейротрансмиттеров через синаптическую щель. Следовательно, электрические синапсы используются всякий раз , когда быстрая реакция и координация времени имеют решающее значение, как в рефлексах побега , сетчатке позвоночных и сердце .
Особым случаем химического синапса является нервно-мышечное соединение , в котором аксон двигательного нейрона заканчивается на мышечном волокне . [ae] В таких случаях высвобождаемым нейротрансмиттером является ацетилхолин , который связывается с ацетилхолиновым рецептором, интегральным мембранным белком в мембране ( сарколемме ) мышечного волокна. [af] Однако ацетилхолин не остается связанным; скорее, он диссоциирует и гидролизуется ферментом ацетилхолинэстеразой , расположенным в синапсе. Этот фермент быстро снижает стимул к мышце, что позволяет деликатно регулировать степень и время мышечного сокращения. Некоторые яды инактивируют ацетилхолинэстеразу, чтобы предотвратить этот контроль, например, нервно-паралитические агенты зарин и табун , [ag] и инсектициды диазинон и малатион . [ah]
Потенциал действия сердца отличается от потенциала действия нейронов наличием расширенного плато, при котором мембрана удерживается под высоким напряжением в течение нескольких сотен миллисекунд, прежде чем она будет реполяризована током калия, как обычно. [ai] Это плато обусловлено действием более медленных кальциевых каналов, открывающихся и удерживающих мембранное напряжение вблизи своего равновесного потенциала даже после того, как натриевые каналы инактивированы.
Потенциал действия сердца играет важную роль в координации сокращения сердца. [ai] Сердечные клетки синоатриального узла обеспечивают потенциал водителя ритма , который синхронизирует сердце. Потенциалы действия этих клеток распространяются к атриовентрикулярному узлу (АВ-узлу) и через него, который обычно является единственным проводящим путем между предсердиями и желудочками . Потенциалы действия от АВ-узла проходят через пучок Гиса и оттуда к волокнам Пуркинье . [примечание 2] И наоборот, аномалии в сердечном потенциале действия — будь то из-за врожденной мутации или травмы — могут приводить к патологиям человека, особенно к аритмиям . [ai] Несколько антиаритмических препаратов действуют на сердечный потенциал действия, такие как хинидин , лидокаин , бета-блокаторы и верапамил . [aj]
Потенциал действия в нормальной клетке скелетной мышцы аналогичен потенциалу действия в нейронах. [61] Потенциалы действия возникают в результате деполяризации клеточной мембраны ( сарколеммы ), которая открывает потенциалозависимые натриевые каналы; они инактивируются, и мембрана реполяризуется посредством внешнего тока ионов калия. Потенциал покоя до потенциала действия обычно составляет -90 мВ, что несколько более отрицательно, чем у типичных нейронов. Потенциал действия мышцы длится примерно 2–4 мс, абсолютный рефрактерный период составляет примерно 1–3 мс, а скорость проведения вдоль мышцы составляет примерно 5 м/с. Потенциал действия высвобождает ионы кальция , которые освобождают тропомиозин и позволяют мышце сокращаться. Потенциалы действия мышцы провоцируются прибытием пресинаптического нейронального потенциала действия в нервно-мышечное соединение , которое является обычной мишенью для нейротоксинов . [ag]
Клетки растений и грибов [ak] также электрически возбудимы. Фундаментальное отличие от потенциалов действия животных заключается в том, что деполяризация в растительных клетках достигается не поглощением положительных ионов натрия, а высвобождением отрицательных ионов хлора . [al] [am] [an] В 1906 году Дж. К. Бозе опубликовал первые измерения потенциалов действия в растениях, которые ранее были обнаружены Бердоном-Сандерсоном и Дарвином. [62] Увеличение цитоплазматических ионов кальция может быть причиной высвобождения анионов в клетку. Это делает кальций предшественником ионных движений, таких как приток отрицательных ионов хлора и отток положительных ионов калия, как это наблюдается в листьях ячменя. [63]
Первоначальный приток ионов кальция также вызывает небольшую деполяризацию клеток, вызывая открытие потенциалзависимых ионных каналов и позволяя ионам хлора распространять полную деполяризацию.
Некоторые растения (например, Dionaea muscipula ) используют натриевые каналы для управления движениями растений и «подсчета» событий стимуляции, чтобы определить, достигнут ли порог движения. Dionaea muscipula , также известная как венерина мухоловка, встречается в субтропических водно-болотных угодьях Северной и Южной Каролины. [64] Когда почва бедна питательными веществами, мухоловка полагается на рацион из насекомых и животных. [65] Несмотря на исследования этого растения, отсутствует понимание молекулярной основы венерины мухоловки и плотоядных растений в целом. [66]
Тем не менее, было проведено множество исследований потенциалов действия и того, как они влияют на движение и часовой механизм венериной мухоловки. Для начала, потенциал покоя мембраны венериной мухоловки (−120 мВ) ниже, чем у клеток животных (обычно от −90 мВ до −40 мВ). [66] [67] Более низкий потенциал покоя облегчает активацию потенциала действия. Таким образом, когда насекомое приземляется на ловушку растения, оно активирует волоскообразный механорецептор. [66] Затем этот рецептор активирует потенциал действия, который длится около 1,5 мс. [68] Это вызывает увеличение положительных ионов кальция в клетке, слегка деполяризуя ее. Однако мухоловка не закрывается после одного срабатывания. Вместо этого она требует активации двух или более волосков. [65] [66] Если срабатывает только один волосок, он игнорирует активацию как ложноположительный. Далее, второй волосок должен быть активирован в течение определенного временного интервала (0,75–40 с), чтобы он зарегистрировал первую активацию. [66] Таким образом, начинается накопление кальция, а затем медленно падает после первого триггера. Когда второй потенциал действия запускается в течение временного интервала, он достигает порога кальция, чтобы деполяризовать клетку, закрывая ловушку на добыче в течение доли секунды. [66]
Вместе с последующим высвобождением положительных ионов калия потенциал действия в растениях включает осмотическую потерю соли (KCl). В то время как потенциал действия животных осмотически нейтрален, поскольку равные количества входящего натрия и выходящего калия осмотически компенсируют друг друга. Взаимодействие электрических и осмотических отношений в растительных клетках [ao] , по-видимому, возникло из осмотической функции электрической возбудимости у общих одноклеточных предков растений и животных в условиях изменяющейся солености. Кроме того, существующая функция быстрой передачи сигнала рассматривается как более новое достижение клеток метазоа в более стабильной осмотической среде. [69] Вероятно, что знакомая сигнальная функция потенциалов действия в некоторых сосудистых растениях (например, Mimosa pudica ) возникла независимо от таковой в возбудимых клетках метазоа.
В отличие от фазы роста и пика, фаза падения и после гиперполяризации, по-видимому, зависят в первую очередь от катионов, которые не являются кальцием. Для инициирования реполяризации клетке требуется перемещение калия из клетки посредством пассивного транспорта на мембране. Это отличается от нейронов, поскольку перемещение калия не доминирует над снижением мембранного потенциала. Для полной реполяризации растительной клетке требуется энергия в форме АТФ, чтобы помочь высвобождению водорода из клетки — используя транспортер, называемый протонной АТФазой . [70] [66]
Потенциалы действия встречаются во всех многоклеточных организмах , включая растения , беспозвоночных, таких как насекомые , и позвоночных, таких как рептилии и млекопитающие . [ap] Губки, по-видимому, являются основным типом многоклеточных эукариот , которые не передают потенциалы действия, хотя некоторые исследования предполагают, что эти организмы также имеют форму электрической сигнализации. [aq] Потенциал покоя, а также размер и продолжительность потенциала действия не сильно изменились в ходе эволюции, хотя скорость проведения существенно меняется в зависимости от диаметра аксона и миелинизации.
Учитывая его сохранение на протяжении эволюции, потенциал действия, по-видимому, дает эволюционные преимущества. Одной из функций потенциалов действия является быстрая передача сигналов на большие расстояния внутри организма; скорость проводимости может превышать 110 м/с, что составляет одну треть скорости звука . Для сравнения, молекула гормона, переносимая кровотоком, движется со скоростью примерно 8 м/с в крупных артериях. Частью этой функции является тесная координация механических событий, таких как сокращение сердца. Вторая функция — вычисления, связанные с его генерацией. Будучи сигналом «все или ничего», который не затухает с расстоянием передачи, потенциал действия имеет аналогичные преимущества для цифровой электроники . Интеграция различных дендритных сигналов в аксонном холмике и его пороговое значение для формирования сложной последовательности потенциалов действия — это еще одна форма вычислений, которая использовалась биологически для формирования центральных генераторов паттернов и имитировалась в искусственных нейронных сетях .
Считается, что общий прокариотический/эукариотический предок, живший, возможно, четыре миллиарда лет назад, имел потенциалзависимые каналы. Эта функциональность, вероятно, в какой-то более поздний момент была перекрестно направлена на обеспечение механизма коммуникации. Даже современные одноклеточные бактерии могут использовать потенциалы действия для коммуникации с другими бактериями в той же биопленке . [72]

Изучение потенциалов действия потребовало разработки новых экспериментальных методов. Первоначальная работа, до 1955 года, была выполнена в основном Аланом Ллойдом Ходжкиным и Эндрю Филдингом Хаксли , которые вместе с Джоном Кэрью Эклсом были удостоены Нобелевской премии по физиологии и медицине 1963 года за вклад в описание ионной основы нервной проводимости. Она была сосредоточена на трех целях: изоляция сигналов от отдельных нейронов или аксонов, разработка быстрой, чувствительной электроники и уменьшение электродов настолько, чтобы можно было регистрировать напряжение внутри одной клетки.
Первая проблема была решена путем изучения гигантских аксонов , обнаруженных в нейронах кальмара ( Loligo forbesii и Doryteuthis pealeii , в то время классифицированного как Loligo pealeii ). [ar] Эти аксоны настолько велики в диаметре (примерно 1 мм, или в 100 раз больше, чем типичный нейрон), что их можно увидеть невооруженным глазом, что позволяет легко их извлекать и манипулировать ими. [i] [as] Однако они не являются репрезентативными для всех возбудимых клеток, и были изучены многочисленные другие системы с потенциалами действия.
Вторая проблема была решена с помощью решающей разработки зажима напряжения , [at] , который позволил экспериментаторам изучать ионные токи, лежащие в основе потенциала действия в изоляции, и устранил ключевой источник электронного шума , ток I C, связанный с емкостью C мембраны. [74] Поскольку ток равен C, умноженному на скорость изменения трансмембранного напряжения V m , решение состояло в том, чтобы разработать схему, которая поддерживала V m фиксированным (нулевая скорость изменения) независимо от токов, протекающих через мембрану. Таким образом, ток, необходимый для поддержания V m на фиксированном значении, является прямым отражением тока, протекающего через мембрану. Другие электронные достижения включали использование клеток Фарадея и электроники с высоким входным импедансом , так что само измерение не влияло на измеряемое напряжение. [75]
Третья проблема, заключающаяся в получении электродов, достаточно малых для регистрации напряжений в пределах одного аксона, не нарушая его, была решена в 1949 году с изобретением стеклянного микропипеточного электрода, [au] который был быстро принят другими исследователями. [av] [aw] Усовершенствования этого метода позволяют производить кончики электродов, которые имеют размер до 100 Å (10 нм ), что также обеспечивает высокое входное сопротивление. [76] Потенциалы действия также могут быть зарегистрированы с помощью небольших металлических электродов, размещенных непосредственно рядом с нейроном, с помощью нейрочипов, содержащих EOSFET , или оптически с помощью красителей, которые чувствительны к Ca 2+ или к напряжению. [ax]

В то время как стеклянные микропипеточные электроды измеряют сумму токов, проходящих через множество ионных каналов, изучение электрических свойств одного ионного канала стало возможным в 1970-х годах с разработкой метода патч-кламп Эрвином Неером и Бертом Сакманном . За это открытие они были удостоены Нобелевской премии по физиологии и медицине в 1991 году . [нижний-греческий 3] Метод патч-кламп подтвердил, что ионные каналы имеют дискретные состояния проводимости, такие как открытый, закрытый и инактивированный.
В последние годы были разработаны технологии оптической визуализации для измерения потенциалов действия, либо посредством одновременной многосайтовой записи, либо с ультрапространственным разрешением. Используя чувствительные к напряжению красители , потенциалы действия были оптически зарегистрированы с крошечного участка мембраны кардиомиоцита . [ay]

Несколько нейротоксинов , как природных, так и синтетических, действуют, блокируя потенциал действия. Тетродотоксин из рыбы-собаки и сакситоксин из Gonyaulax ( род динофлагеллятов, ответственный за « красные приливы ») блокируют потенциалы действия, ингибируя чувствительный к напряжению натриевый канал; [az] аналогично, дендротоксин из черной мамбы ингибирует чувствительный к напряжению калиевый канал. Такие ингибиторы ионных каналов служат важной исследовательской цели, позволяя ученым «отключать» определенные каналы по желанию, тем самым изолируя вклады других каналов; они также могут быть полезны при очистке ионных каналов с помощью аффинной хроматографии или при анализе их концентрации. Однако такие ингибиторы также являются эффективными нейротоксинами и рассматривались для использования в качестве химического оружия . Нейротоксины, нацеленные на ионные каналы насекомых, были эффективными инсектицидами ; одним из примеров является синтетический перметрин , который продлевает активацию натриевых каналов, участвующих в потенциалах действия. Ионные каналы насекомых настолько отличаются от человеческих, что вызывают мало побочных эффектов у людей.

Роль электричества в нервной системе животных впервые наблюдал на препарированных лягушках Луиджи Гальвани , который изучал ее с 1791 по 1797 год. [ba] Результаты Гальвани вдохновили Алессандро Вольту на разработку вольтова столба — самой ранней известной электрической батареи , — с помощью которой он изучал животное электричество (например, электрических угрей ) и физиологические реакции на приложенное постоянное напряжение тока . [bb]
В 19 веке ученые изучали распространение электрических сигналов в целых нервах (то есть пучках нейронов ) и продемонстрировали, что нервная ткань состоит из клеток , а не из взаимосвязанной сети трубок ( ретикулума ). [77] Карло Маттеуччи продолжил исследования Гальвани и продемонстрировал, что поврежденные нервы и мышцы лягушек могут производить постоянный ток . Работа Маттеуччи вдохновила немецкого физиолога Эмиля дю Буа-Реймона , который в 1843 году обнаружил, что стимуляция этих мышечных и нервных препаратов приводит к заметному уменьшению их токов покоя, что сделало его первым исследователем, определившим электрическую природу потенциала действия. [78] Скорость проводимости потенциалов действия была затем измерена в 1850 году другом дю Буа-Реймона, Германом фон Гельмгольцем . [79] После этого прогресс в электрофизиологии застопорился из-за ограничений химической теории и экспериментальной практики. Чтобы установить, что нервная ткань состоит из отдельных клеток, испанский врач Сантьяго Рамон-и-Кахаль и его ученики использовали краситель, разработанный Камилло Гольджи, чтобы выявить бесчисленные формы нейронов, которые они кропотливо визуализировали. За свои открытия Гольджи и Рамон-и-Кахаль были удостоены Нобелевской премии по физиологии 1906 года . [нижний греческий 4] Их работа разрешила давний спор в нейроанатомии 19-го века; сам Гольджи выступал за сетевую модель нервной системы.
В 20 веке произошли значительные прорывы в электрофизиологии. В 1902 и 1912 годах Юлиус Бернштейн выдвинул гипотезу о том, что потенциал действия возникает в результате изменения проницаемости аксональной мембраны для ионов. [bc] [80] Гипотеза Бернштейна была подтверждена Кеном Коулом и Говардом Кертисом, которые показали, что проводимость мембраны увеличивается во время потенциала действия. [bd] В 1907 году Луи Лапик предположил, что потенциал действия генерируется при пересечении порога, [be] что позже будет показано как продукт динамических систем ионных проводимостей. В 1949 году Алан Ходжкин и Бернард Кац усовершенствовали гипотезу Бернштейна, рассмотрев, что аксональная мембрана может иметь различную проницаемость для разных ионов; в частности, они продемонстрировали решающую роль проницаемости натрия для потенциала действия. [bf] Они сделали первую фактическую запись электрических изменений через нейронную мембрану, которые опосредуют потенциал действия. [lower-Greek 5] Это направление исследований достигло кульминации в пяти работах 1952 года Ходжкина, Каца и Эндрю Хаксли , в которых они применили технику фиксации напряжения для определения зависимости проницаемости аксональной мембраны для ионов натрия и калия от напряжения и времени, из чего они смогли количественно реконструировать потенциал действия. [i] Ходжкин и Хаксли сопоставили свойства своей математической модели с дискретными ионными каналами , которые могли существовать в нескольких различных состояниях, включая «открытые», «закрытые» и «инактивированные». Их гипотезы были подтверждены в середине 1970-х и 1980-х годов Эрвином Неером и Бертом Сакманном , которые разработали технику фиксации напряжения для изучения состояний проводимости отдельных ионных каналов. [bg] В 21 веке исследователи начинают понимать структурную основу этих состояний проводимости и селективность каналов для их видов ионов [bh] с помощью кристаллических структур с атомным разрешением , [bi] измерений расстояния флуоресценции [bj] и исследований с помощью криоэлектронной микроскопии . [bk]
Юлиус Бернштейн также был первым, кто ввел уравнение Нернста для потенциала покоя через мембрану; оно было обобщено Дэвидом Э. Голдманом в одноименное уравнение Голдмана в 1943 году. [h] Натрий -калиевый насос был идентифицирован в 1957 году [bl] [нижн.-греч. 6] , и его свойства постепенно были выяснены, [bm] [bn] [bo] достигнув кульминации в определении его структуры с атомным разрешением с помощью рентгеновской кристаллографии . [bp] Кристаллические структуры связанных ионных насосов также были решены, что дало более широкое представление о том, как работают эти молекулярные машины . [bq]

Математические и вычислительные модели необходимы для понимания потенциала действия и предлагают прогнозы, которые могут быть проверены с помощью экспериментальных данных, обеспечивая строгую проверку теории. Наиболее важной и точной из ранних нейронных моделей является модель Ходжкина–Хаксли , которая описывает потенциал действия с помощью связанного набора из четырех обыкновенных дифференциальных уравнений (ОДУ). [i] Хотя модель Ходжкина–Хаксли может быть упрощением с небольшими ограничениями [81] по сравнению с реалистичной нервной мембраной, какой она существует в природе, ее сложность вдохновила несколько еще более упрощенных моделей, [82] [br] таких как модель Морриса–Лекара [bs] и модель ФицХью–Нагумо , [bt] обе из которых имеют только два связанных ОДУ. Свойства моделей Ходжкина-Хаксли и Фицхью-Нагумо и их родственников, таких как модель Бонхёффера-Ван дер Поля, [bu] были хорошо изучены в математике, [83] [bv] вычислениях [84] и электронике. [bw] Однако простые модели потенциала генератора и потенциала действия не могут точно воспроизвести околопороговую скорость и форму нейронных спайков, особенно для механорецепторов, таких как тельца Пачини . [85] Более современные исследования были сосредоточены на более крупных и более интегрированных системах; объединяя модели потенциала действия с моделями других частей нервной системы (таких как дендриты и синапсы), исследователи могут изучать нейронные вычисления [86] и простые рефлексы , такие как рефлексы избегания и другие, контролируемые центральными генераторами паттернов . [87] [bx]
{{cite book}}: CS1 maint: location missing publisher (link){{cite book}}: |journal=проигнорировано ( помощь ){{cite book}}: |journal=проигнорировано ( помощь )