
Синтетическая биология ( SynBio ) — это междисциплинарная область науки, которая фокусируется на живых системах и организмах и применяет инженерные принципы для разработки новых биологических частей, устройств и систем или для модернизации существующих систем, встречающихся в природе. [1]
Это отрасль науки, охватывающая широкий спектр методологий из различных дисциплин, таких как биохимия , биотехнология , биоматериалы , материаловедение/инженерия , генная инженерия , молекулярная биология , молекулярная инженерия , системная биология , мембранная наука , биофизика , химическая и биологическая инженерия , электротехника и вычислительная техника , техника управления и эволюционная биология .
Это включает в себя проектирование и создание биологических модулей , биологических систем и биологических машин , а также перепроектирование существующих биологических систем для полезных целей. [2]
Кроме того, это отрасль науки, которая фокусируется на новых возможностях инженерии существующих организмов с целью их переделки для полезных целей. [3]
Для того, чтобы производить предсказуемые и надежные системы с новыми функциями, которые еще не существуют в природе, также необходимо применить инженерную парадигму проектирования систем к биологическим системам. По данным Европейской комиссии , это, возможно, включает молекулярный ассемблер на основе биомолекулярных систем, таких как рибосома . [4]
1910: Первое заметное использование термина «синтетическая биология» в публикации Стефана Ледюка «Теория физико-химической теории жизни и спонтанных поколений» . [5] Он также отметил этот термин в другой публикации, La Biologie Synthétique , в 1912 году. [6]
1944 : Канадско-американский ученый Освальд Эвери показывает, что ДНК — это материал, из которого сделаны гены и хромосомы . Это становится основой, на которой строятся все последующие генетические исследования. [7]
1953 : Фрэнсис Крик и Джеймс Уотсон публикуют структуру ДНК в журнале Nature .
1961 : Жакоб и Моно постулируют клеточную регуляцию молекулярными сетями на основе своего исследования lac- оперона в E. coli и предполагают возможность сборки новых систем из молекулярных компонентов. [8]
1973 : Первое молекулярное клонирование и амплификация ДНК в плазмиде опубликованы в PNAS Коэном, Бойером и др., что ознаменовало начало синтетической биологии. [9]
1978 : Арбер , Натанс и Смит получают Нобелевскую премию по физиологии и медицине за открытие ферментов рестрикции , что побудило Шибальского дать редакционный комментарий в журнале Gene :
Работа над рестрикционными нуклеазами не только позволяет нам легко конструировать рекомбинантные молекулы ДНК и анализировать отдельные гены, но и ведет нас в новую эру синтетической биологии, где не только описываются и анализируются существующие гены, но и могут быть сконструированы и оценены новые расположения генов. [10]
1988 : Первая амплификация ДНК методом полимеразной цепной реакции (ПЦР) с использованием термостабильной ДНК-полимеразы опубликована в журнале Science Маллисом и др. [11]. Это позволило избежать добавления новой ДНК-полимеразы после каждого цикла ПЦР, что значительно упростило мутагенез и сборку ДНК.
2000 : Две статьи в журнале Nature сообщают о синтетических биологических цепях , генетическом переключателе и биологических часах, созданных путем объединения генов в клетках E. coli . [12] [13]
2003 : Том Найт изобрел наиболее широко используемые стандартизированные части ДНК, плазмиды BioBrick . [14] Эти части станут центральными в Международном конкурсе генетически модифицированных машин (iGEM), основанном в Массачусетском технологическом институте в следующем году.
2003 : Исследователи создают путь предшественника артемизинина в E. coli . [15]
2004 : В Массачусетском технологическом институте проводится первая международная конференция по синтетической биологии Synthetic Biology 1.0 (SB1.0).
2005 : Исследователи разрабатывают светочувствительную схему в E. coli . [16] Другая группа разрабатывает схемы, способные формировать многоклеточные узоры. [17]
2006 : Исследователи разрабатывают синтетическую схему, которая способствует бактериальному вторжению в опухолевые клетки. [18]
2010 : Исследователи публикуют в журнале Science первый синтетический бактериальный геном, названный M. mycoides JCVI-syn1.0. [19] [20] Геном создан из химически синтезированной ДНК с использованием рекомбинации дрожжей.
2011 : Функциональные синтетические плечи хромосом созданы в дрожжах. [21]
2012 : Лаборатории Шарпантье и Дудны публикуют в журнале Science программирование бактериального иммунитета CRISPR-Cas9 для направленного расщепления ДНК. [22] Эта технология значительно упростила и расширила редактирование эукариотических генов.
2019 : Ученые из Швейцарской высшей технической школы Цюриха сообщают о создании первого бактериального генома , названного Caulobacter ethensis-2.0 , полностью созданного компьютером, хотя родственной жизнеспособной формы C. ethensis-2.0 пока не существует. [23] [24]
2019 : Исследователи сообщают о создании новой синтетической (возможно, искусственной ) формы жизнеспособной жизни , варианта бактерии Escherichia coli , путем сокращения естественного числа 64 кодонов в бактериальном геноме до 59 кодонов, чтобы кодировать 20 аминокислот . [25] [26]
2020 : Ученые создали первого ксенобота — программируемый синтетический организм, полученный из клеток лягушки и спроектированный искусственным интеллектом. [27]
2021 : Ученые сообщили, что ксеноботы способны самовоспроизводиться, собирая свободные клетки в окружающей среде и затем формируя новых ксеноботов. [28]
Это область, сфера применения которой расширяется с точки зрения системной интеграции, создания организмов и практических результатов. [1]
Инженеры рассматривают биологию как технологию (другими словами, данная система включает биотехнологию или ее биологическую инженерию ). [29] Синтетическая биология включает в себя широкое переопределение и расширение биотехнологии с конечной целью иметь возможность проектировать и создавать инженерные живые биологические системы, которые обрабатывают информацию, манипулируют химическими веществами, изготавливают материалы и структуры, производят энергию, обеспечивают продовольствием и поддерживают и улучшают здоровье человека, а также продвигают фундаментальные знания о биологических системах и нашей окружающей среде. [30]
Исследователи и компании, работающие в области синтетической биологии, используют силу природы для решения проблем в сельском хозяйстве, производстве и медицине. [3]
Благодаря более мощным возможностям генной инженерии и снижению затрат на синтез и секвенирование ДНК , область синтетической биологии быстро растет. В 2016 году более 350 компаний в 40 странах активно занимались приложениями синтетической биологии; все эти компании имели предполагаемую чистую стоимость в 3,9 млрд долларов на мировом рынке. [31] Синтетическая биология в настоящее время не имеет общепринятого определения. Вот несколько примеров:
Это наука о возникающей генетической и физической инженерии для создания новых (и, следовательно, синтетических) форм жизни. Для разработки организмов с новыми или улучшенными характеристиками эта развивающаяся область исследований объединяет знания и методы биологии, инженерии и смежных дисциплин для проектирования химически синтезированной ДНК. [32] [33]
Биомолекулярная инженерия включает подходы, направленные на создание набора функциональных единиц, которые могут быть введены для представления новых технологических функций в живых клетках. Генная инженерия включает подходы к построению синтетических хромосом или минимальных организмов, таких как Mycoplasma laboratorium .
Биомолекулярный дизайн относится к общей идее de novo дизайна и аддитивного комбинирования биомолекулярных компонентов. Каждый из этих подходов имеет схожую задачу: разработать более синтетическую сущность на более высоком уровне сложности, изобретательно манипулируя более простой частью на предыдущем уровне. [34] [35] Оптимизация этих экзогенных путей в неестественных системах требует итеративной тонкой настройки отдельных биомолекулярных компонентов для выбора самых высоких концентраций желаемого продукта. [36]
С другой стороны, «переписчики» — это синтетические биологи, заинтересованные в проверке неприводимости биологических систем. Из-за сложности естественных биологических систем было бы проще перестроить естественные системы, представляющие интерес, с нуля; предоставить сконструированные суррогаты, которые легче понимать, контролировать и манипулировать. [37] Переписчики черпают вдохновение из рефакторинга , процесса, который иногда используется для улучшения компьютерного программного обеспечения.
Биоинженерия, синтетическая геномика, синтетическая биология протоклеток, нетрадиционная молекулярная биология и методы in silico — это пять категорий синтетической биологии. [38]
Необходимо рассмотреть различия и аналогии между категориями синтетической биологии для ее социальной и этической оценки, чтобы провести различие между вопросами, затрагивающими всю область, и вопросами, касающимися только одной конкретной области. [38]
Подотрасль биоинженерии концентрируется на создании новых метаболических и регуляторных путей и в настоящее время, вероятно, привлекает внимание большинства исследователей и финансирования. Она в первую очередь мотивирована желанием сделать биотехнологию законной инженерной дисциплиной. При упоминании этой области синтетической биологии слово «биоинженерия» не следует путать с «традиционной генной инженерией», которая подразумевает введение одного трансгена в предполагаемый организм. Биоинженеры адаптировали синтетическую биологию, чтобы обеспечить существенно более комплексную перспективу того, как изменять организмы или метаболические системы. [38]
Типичным примером генной инженерии с одним геном является вставка гена человеческого инсулина в бактерии для создания трансгенных белков. Создание совершенно новых сигнальных путей, содержащих многочисленные гены и регуляторные компоненты (такие как схема осциллятора для инициирования периодического производства зеленого флуоресцентного белка (GFP) в клетках млекопитающих), известно как биоинженерия как часть синтетической биологии. [38]
Используя упрощенные и абстрагированные метаболические и регуляторные модули, а также другие стандартизированные части, которые могут свободно комбинироваться для создания новых путей или существ, биоинженерия стремится создавать инновационные биологические системы. Помимо создания бесконечных возможностей для новых приложений, эта стратегия, как ожидается, сделает биоинженерию более предсказуемой и контролируемой, чем традиционная биотехнология. [38]
Формирование животных с химически созданным (минимальным) геномом является еще одной гранью синтетической биологии, которая выделяется синтетической геномикой. Эта область синтетической биологии стала возможной благодаря продолжающимся достижениям в технологии синтеза ДНК, которая теперь делает возможным производство молекул ДНК с тысячами пар оснований по разумной цене. Цель состоит в том, чтобы объединить эти молекулы в полные геномы и трансплантировать их в живые клетки, заменив геном клетки-хозяина и перепрограммировав ее метаболизм для выполнения различных функций. [38]
Ученые ранее продемонстрировали потенциал этого подхода, создав инфекционные вирусы путем синтеза геномов нескольких вирусов. Эти значительные достижения в науке и технике вызвали первоначальные опасения общественности относительно рисков, связанных с этой технологией. [38]
Простой геном может также работать как «геном шасси», который может быть быстро расширен путем включения генов, созданных для определенных задач. Такие «существа шасси» больше подходят для внедрения новых функций, чем дикие организмы, поскольку у них будет меньше биологических путей, которые могут потенциально конфликтовать с новыми функциями в дополнение к наличию определенных мест внедрения. Синтетическая геномика стремится создавать существа с новыми «архитектурами», во многом похожими на метод биоинженерии. Она принимает интегративную или целостную перспективу организма. В этом случае целью является создание геномов шасси на основе необходимых генов и других требуемых последовательностей ДНК, а не разработка метаболических или регуляторных путей на основе абстрактных критериев. [38]
Генерация синтетических клеток in vitro является протоклеточной ветвью синтетической биологии. Липидные везикулы, которые имеют все необходимые компоненты для функционирования в качестве полной системы, могут быть использованы для создания этих искусственных клеток. В конечном итоге, эти синтетические клетки должны соответствовать требованиям, чтобы считаться живыми, а именно, способность к саморепликации, самоподдержанию и эволюции. Метод протоклеток имеет это своей конечной целью, однако есть и другие промежуточные шаги, которые не соответствуют всем критериям живой клетки. Для того чтобы выполнять определенную функцию, эти липидные везикулы содержат клеточные экстракты или более конкретные наборы биологических макромолекул и сложных структур, таких как ферменты, нуклеиновые кислоты или рибосомы. Например, липосомы могут выполнять определенные полимеразные цепные реакции или синтезировать определенный белок. [38]
Синтетическая биология протоклеток делает искусственную жизнь на один шаг ближе к реальности, в конечном итоге синтезируя не только геном, но и каждый компонент клетки in vitro, в отличие от подхода синтетической геномики, который опирается на принуждение естественной клетки выполнять инструкции, закодированные введенным синтетическим геномом. Синтетические биологи в этой области рассматривают свою работу как базовое исследование условий, необходимых для существования жизни, и ее происхождения больше, чем в любой другой методике. Однако методика протоклеток также хорошо подходит для приложений; подобно другим побочным продуктам синтетической биологии, протоклетки могут быть использованы для производства биополимеров и лекарств. [38]
Целью стратегии «неестественной молекулярной биологии» является создание новых разновидностей жизни, которые основаны на другом виде молекулярной биологии, например, новых типов нуклеиновых кислот или нового генетического кода. Создание новых типов нуклеотидов, которые могут быть встроены в уникальные нуклеиновые кислоты, может быть достигнуто путем изменения определенных компонентов ДНК или РНК, таких как основания или остовные сахара. [38]
Нормальный генетический код изменяется путем вставки квадруплетных кодонов или изменения некоторых кодонов для кодирования новых аминокислот, что впоследствии позволит использовать неприродные аминокислоты с уникальными характеристиками в производстве белка. Это научная и технологическая проблема — настроить ферментативный аппарат клетки для обоих подходов. [38]
Новый вид жизни будет сформирован организмами с геномом, построенным на синтетических нуклеиновых кислотах или на совершенно новой системе кодирования синтетических аминокислот. Этот новый образ жизни будет иметь некоторые преимущества, но также и некоторые новые опасности. При выпуске в окружающую среду не будет горизонтального переноса генов или скрещивания генов с естественными видами. Более того, эти виды синтетических организмов могут быть созданы так, чтобы требовать неестественные материалы для синтеза белка или нуклеиновой кислоты, что сделает их неспособными процветать в дикой природе, если они случайно сбегут. [38]
С другой стороны, если бы эти организмы в конечном итоге смогли выжить за пределами контролируемого пространства, они могли бы иметь особое преимущество перед естественными организмами, поскольку они были бы устойчивы к хищным живым организмам или естественным вирусам, что могло бы привести к неконтролируемому распространению синтетических организмов. [38]
Синтетическая биология in silico и различные стратегии взаимосвязаны. Разработка сложных конструкций, будь то метаболические пути, фундаментальные клеточные процессы или шасси геномов, является одной из основных трудностей, с которыми сталкиваются четыре метода синтетической биологии, описанные выше. Из-за этого синтетическая биология имеет надежную ветвь in silico, похожую на системную биологию, которая направлена на создание вычислительных моделей для проектирования общих биологических компонентов или синтетических схем, которые по сути являются симуляциями синтетических организмов. [38]
Практическое применение симуляций и моделей через биоинженерию или другие области синтетической биологии является долгосрочной целью синтетической биологии in silico. Многие из вычислительных симуляций синтетических организмов до этого момента имели мало или вообще не имели прямой аналогии с живыми существами. В связи с этим синтетическая биология in silico рассматривается в этой статье как отдельная группа. [38]
Разумно объединить пять областей под эгидой синтетической биологии как единую область изучения. Хотя они и сосредоточены на различных аспектах жизни, таких как регуляция метаболизма, основные элементы или биохимический состав, все эти пять стратегий работают над одной целью: созданием новых типов живых организмов. Кроме того, различные методологии начинаются с многочисленных методологических подходов, что приводит к разнообразию подходов синтетической биологии. [38]
Синтетическая биология — это междисциплинарная область, которая черпает вдохновение из множества различных научных дисциплин, а не из одной области или метода. Все синтетические биологи имеют одну и ту же основную цель — проектирование и создание новых форм жизни, несмотря на то, что они могут использовать различные методологии, методы и исследовательские инструменты. Любая оценка синтетической биологии, независимо от того, изучает ли она этические, правовые или соображения безопасности, должна учитывать тот факт, что хотя некоторые вопросы, риски и проблемы являются уникальными для каждого метода, в других обстоятельствах необходимо принимать во внимание синтетическую биологию в целом. [38]
Синтетическая биология традиционно делится на четыре различных инженерных подхода: сверху вниз, параллельный, ортогональный и снизу вверх. [39]
Чтобы воспроизвести возникающее поведение из естественной биологии и построить искусственную жизнь, используются неестественные химикаты. Другой ищет взаимозаменяемые компоненты из биологических систем, чтобы собрать и создать системы, которые не работают естественным образом. В любом случае синтетическая цель заставляет исследователей рисковать в новой области, чтобы заниматься и решать проблемы, которые не могут быть легко решены анализом. Из-за этого новые парадигмы вынуждены возникать способами, которые анализ не может легко сделать. В дополнение к оборудованию, которое колеблется, ползает и играет в крестики-нолики, синтетическая биология создала диагностические инструменты, которые улучшают лечение пациентов с инфекционными заболеваниями. [40]
Он включает в себя использование методов метаболической и генной инженерии для придания новым функциям живым клеткам. [41] Сравнивая универсальные гены и устраняя несущественные для создания базового генома, этот метод стремится уменьшить сложность существующих клеток. Эти инициативы основаны на гипотезе единого генезиса клеточной жизни, так называемого Последнего Универсального Общего Предка , которая поддерживает наличие универсального минимального генома, давшего начало всем живым существам. Однако недавние исследования повышают вероятность того, что эукариотические и прокариотические клетки, составляющие древо жизни, могли эволюционировать из группы первичных клеток, а не из одной клетки. В результате, даже несмотря на то, что стремление к «минимальному геному», подобное Святому Граалю, стало неуловимым, исключение ряда несущественных функций ухудшает приспособленность организма и приводит к «хрупким» геномам. [39]
Этот подход предполагает создание новых биологических систем in vitro путем объединения «неживых» биомолекулярных компонентов [42] , часто с целью создания искусственной клетки .
Воспроизведение, репликация и сборка — три важнейших принципа самоорганизации, которые принимаются во внимание для достижения этого. Клетки, которые состоят из контейнера и метаболизма, считаются «аппаратным обеспечением» в определении воспроизводства, тогда как репликация происходит, когда система дублирует идеальную копию себя, как в случае ДНК, которая считается «программным обеспечением». Когда везикулы или контейнеры (например, коацерваты Опарина) образуются из крошечных капель молекул, которые являются органическими, такими как липиды или липосомы, возникают мембраноподобные структуры, включающие фосфолипиды, агрегат, сборку. [39]
Изучение протоклеток существует наряду с другими инициативами in vitro синтетической биологии, которые стремятся производить минимальные клетки, метаболические пути или «никогда не рождающиеся белки», а также имитировать физиологические функции, включая деление и рост клеток. Улучшение in vitro синтетических путей имеет потенциал для влияния на некоторые другие секторы синтетической биологии, включая метаболическую инженерию, несмотря на то, что оно больше не классифицируется как исследование синтетической биологии. Это исследование, которое в первую очередь необходимо, заслуживает надлежащего признания как исследование синтетической биологии. [39]
Параллельная инженерия также известна как биоинженерия. Базовый генетический код является основой для параллельных инженерных исследований, которые используют обычные биомолекулы, такие как нуклеиновые кислоты и 20 аминокислот, для построения биологических систем. Для различных приложений в биокомпьютинге, биоэнергетике, биотопливе, биоремедиации, оптогенетике и медицине, он включает стандартизацию компонентов ДНК, проектирование переключателей, биосенсоров, генетических схем, логических вентилей и операторов клеточной связи. Для управления экспрессией двух или более генов и/или белков большинство этих приложений часто полагаются на использование одного или нескольких векторов (или плазмид). Небольшие, кольцевые, двухцепочечные единицы ДНК, известные как плазмиды, которые в основном встречаются в прокариотических, но также иногда могут быть обнаружены в эукариотических клетках, могут реплицироваться автономно от хромосомной ДНК. [39]
Она также известна как перпендикулярная инженерия. Эта стратегия, также называемая «химической синтетической биологией», в основном стремится изменить или расширить генетические коды живых систем, используя искусственные основания ДНК и/или аминокислоты. Эта подобласть также связана с ксенобиологией , недавно разработанной областью, которая объединяет системную химию, синтетическую биологию, экзобиологию и исследования происхождения жизни. В последние десятилетия исследователи создали соединения, которые структурно похожи на канонические основания ДНК, чтобы увидеть, могут ли эти «чужеродные» или ксено (XNA) молекулы использоваться в качестве носителей генетической информации. Подобно этому, неканонические фрагменты заняли место сахара ДНК ( дезоксирибозы ). [39] Для того, чтобы выразить информацию, отличную от 20 обычных аминокислот белков, генетический код может быть изменен или увеличен. Один из методов включает включение указанной неестественной, неканонической или ксеноаминокислоты (XAA) в один или несколько белков в одном или нескольких точных местах с использованием ортогональных ферментов и адаптера РНК-переноса из другого организма. Используя «направленную эволюцию», которая влечет за собой повторные циклы генного мутагенеза (производство генотипического разнообразия), скрининг или отбор (определенного фенотипического признака) и амплификацию лучшего варианта для следующего итеративного раунда, производятся ортогональные ферменты. Многочисленные XAA были эффективно включены в белки в более сложных существах, таких как черви и мухи, а также в бактериях, дрожжах и клеточных линиях человека. В результате канонических изменений последовательности ДНК направленная эволюция также позволяет разрабатывать ортогональные рибосомы, которые облегчают включение XAA в белки или создание «зеркальной жизни» или биологических систем, которые содержат биомолекулы, состоящие из энантиомеров с различной хиральной ориентацией. [39]
Несколько новых технологий, обеспечивающих возможность, имели решающее значение для успеха синтетической биологии. Концепции включают стандартизацию биологических частей и иерархическую абстракцию, чтобы разрешить использование этих частей в синтетических системах. [43] ДНК служит руководством для того, как должны функционировать биологические процессы, подобно партитуре сложной симфонии жизни. Наша способность понимать и проектировать биологические системы претерпела значительные изменения в результате разработок за последние несколько десятилетий как в области чтения (секвенирования), так и в области записи (синтеза) последовательностей ДНК. Эти разработки привели к появлению новаторских методов проектирования, сборки и модификации генов, материалов, цепей и метаболических путей, кодируемых ДНК, что позволяет все больше контролировать биологические системы и даже целые организмы. [44]
Базовые технологии включают чтение и запись ДНК (секвенирование и изготовление). Для точного моделирования и автоматизированного проектирования (САПР) необходимы измерения в различных условиях .
Благодаря резкому снижению стоимости синтеза олигонуклеотидов («олиго») и появлению ПЦР, размеры конструкций ДНК из олиго увеличились до геномного уровня. [45] В 2000 году исследователи сообщили о синтезе генома вируса гепатита С размером 9,6 кбн (кило п.н.) из химически синтезированных 60-80-меров. [46] В 2002 году исследователям из Университета Стоуни-Брук удалось синтезировать геном полиовируса размером 7741 п.н. из его опубликованной последовательности, создав второй синтетический геном, работа над которым заняла два года. [47] В 2003 году геном бактериофага Phi X 174 размером 5386 п.н. был собран примерно за две недели. [48] В 2006 году та же группа в Институте Дж. Крейга Вентера сконструировала и запатентовала синтетический геном новой минимальной бактерии Mycoplasma laboratorium и работала над тем, чтобы заставить ее функционировать в живой клетке. [49] [50] [51]
В 2007 году сообщалось, что несколько компаний предлагали синтез генетических последовательностей длиной до 2000 пар оснований (п.н.) по цене около 1 доллара за п.н. и со сроком выполнения менее двух недель. [52] Олигонуклеотиды, собранные с ДНК-чипа, изготовленного с помощью фотолитографии или струйной печати, в сочетании с ПЦР и коррекцией ошибок несоответствия ДНК позволяют производить недорогие крупномасштабные изменения кодонов в генетических системах для улучшения экспрессии генов или включения новых аминокислот (см. проекты синтетических клеток Джорджа М. Чёрча и Энтони Форстера. [53] [54] ) . Это благоприятствует подходу синтеза с нуля.
Кроме того, система CRISPR/Cas появилась как многообещающий метод редактирования генов. Она была описана как «самое важное новшество в области синтетической биологии за последние 30 лет». [55] В то время как другие методы требуют месяцев или лет для редактирования последовательностей генов, CRISPR ускоряет это время до недель. [55] Однако из-за своей простоты использования и доступности она вызвала этические опасения, особенно связанные с ее использованием в биохакинге . [56] [57] [58]
Секвенирование ДНК определяет порядок нуклеотидных оснований в молекуле ДНК. Синтетические биологи используют секвенирование ДНК в своей работе несколькими способами. Во-первых, крупномасштабные усилия по секвенированию генома продолжают предоставлять информацию о встречающихся в природе организмах. Эта информация обеспечивает богатый субстрат, из которого синтетические биологи могут создавать детали и устройства. Во-вторых, секвенирование может подтвердить, что изготовленная система соответствует задуманному. В-третьих, быстрое, дешевое и надежное секвенирование может способствовать быстрому обнаружению и идентификации синтетических систем и организмов. [59]
Это способность системы или компонента работать независимо от контекста. [60]
Наиболее используемые [61] : 22–23 стандартизированные части ДНК — это плазмиды BioBrick , изобретенные Томом Найтом в 2003 году. [14] Biobricks хранятся в Реестре стандартных биологических частей в Кембридже, штат Массачусетс. Стандарт BioBrick использовался десятками тысяч студентов по всему миру в международном конкурсе Genetically Engineered Machine (iGEM). Стандарт сборки BioBrick 10 способствует модульности, позволяя кодирующим последовательностям BioBrick быть разделенными и замененными с помощью рестриктаз EcoRI или XbaI (префикс BioBrick) и SpeI и PstI (суффикс BioBrick). [61] : 22–23
Перекрытие последовательностей между двумя генетическими элементами ( генами или кодирующими последовательностями ), называемыми перекрывающимися генами , может предотвратить их индивидуальную манипуляцию. [62] Для повышения модульности генома практика рефакторинга генома или улучшения «внутренней структуры существующей системы для будущего использования, при одновременном сохранении внешней функции системы» [63] была принята в дисциплинах синтетической биологии. [62] Некоторые примечательные примеры рефакторинга включают кластер фиксации азота [64] и систему секреции типа III [65] вместе с бактериофагами T7 [63] и ΦX174. [66]
В то время как ДНК наиболее важна для хранения информации, большая часть активности клетки выполняется белками. Инструменты могут отправлять белки в определенные области клетки и связывать различные белки вместе. Сила взаимодействия между партнерами белка должна настраиваться от времени жизни в секундах (желательно для динамических событий сигнализации) до необратимого взаимодействия (желательно для стабильности устройства или устойчивости к суровым условиям). Такие взаимодействия, как спиральные спирали , [67] связывание домена SH3 с пептидом [68] или SpyTag/SpyCatcher [69] предлагают такой контроль. Кроме того, необходимо регулировать взаимодействия белок-белок в клетках, например, со светом (используя домены, чувствительные к свету-кислороду-напряжению ) или проницаемыми для клеток малыми молекулами путем химически индуцированной димеризации . [70]
В живой клетке молекулярные мотивы встроены в более крупную сеть с восходящими и нисходящими компонентами. Эти компоненты могут изменять сигнальные возможности модуля моделирования. В случае сверхчувствительных модулей вклад модуля в чувствительность может отличаться от чувствительности, которую модуль поддерживает в изоляции. [71] [72]
Модели информируют о разработке биологических систем путем лучшего прогнозирования поведения системы до ее изготовления. Синтетическая биология извлекает выгоду из лучших моделей того, как биологические молекулы связывают субстраты и катализируют реакции, как ДНК кодирует информацию, необходимую для спецификации клетки, и как ведут себя многокомпонентные интегрированные системы. Многомасштабные модели сетей регуляции генов фокусируются на приложениях синтетической биологии. Моделирование может моделировать все биомолекулярные взаимодействия в транскрипции , трансляции , регуляции и индукции сетей регуляции генов. [73] [74] [75] [76]
Только обширное моделирование может позволить исследовать динамическую экспрессию генов в форме, подходящей для исследования и проектирования из-за многочисленных вовлеченных видов и сложности их взаимоотношений. Динамическое моделирование всей биомолекулярной взаимосвязи, вовлеченной в регуляцию, транспорт, транскрипцию, индукцию и трансляцию, позволяет детализировать проекты на молекулярном уровне. В отличие от моделирования искусственных сетей a posteriori, это контрастирует. [77]
Микрофлюидика , в частности микрофлюидика капель, является новым инструментом, используемым для создания новых компонентов, а также для их анализа и характеристики. [78] [79] Она широко применяется в скрининговых анализах. [80]
Исследования рассматривали компоненты механизма транскрипции ДНК . Одним из желаний ученых, создающих синтетические биологические схемы , является возможность контролировать транскрипцию синтетической ДНК в одноклеточных организмах ( прокариотах ) и в многоклеточных организмах ( эукариотах ). В одном исследовании проверялась регулируемость синтетических факторов транскрипции (sTF) в областях транскрипционного выхода и кооперативная способность среди множественных комплексов факторов транскрипции. [81] Исследователи смогли мутировать функциональные области, называемые цинковыми пальцами , ДНК-специфический компонент sTF, чтобы уменьшить их сродство к определенным участкам последовательности ДНК оператора и, таким образом, уменьшить связанную с сайтом специфическую активность sTF (обычно транскрипционную регуляцию). Они также использовали цинковые пальцы в качестве компонентов комплексообразующих sTF, которые являются эукариотическими механизмами трансляции . [81]
Инициативы синтетической биологии часто направлены на перепроектирование организмов, чтобы они могли создавать материал, например, лекарство или топливо, или приобретать новую функцию, например, способность ощущать что-то в окружающей среде. Примеры того, что исследователи создают с помощью синтетической биологии, включают:
Биосенсор относится к сконструированному организму, обычно бактерии, которая способна сообщать о некоторых явлениях окружающей среды, таких как присутствие тяжелых металлов или токсинов. Одной из таких систем является оперон Lux Aliivibrio fischeri , [83] который кодирует фермент, являющийся источником бактериальной биолюминесценции , и может быть помещен после респондентного промотора для экспрессии генов люминесценции в ответ на определенный стимул окружающей среды. [84] Один из таких созданных датчиков состоял из биолюминесцентного бактериального покрытия на светочувствительном компьютерном чипе для обнаружения определенных нефтяных загрязнителей . Когда бактерии чувствуют загрязнитель, они люминесцируют. [85] Другим примером подобного механизма является обнаружение наземных мин сконструированным репортерным штаммом E.coli, способным обнаруживать ТНТ и его основной продукт распада ДНТ , и, следовательно, производить зеленый флуоресцентный белок ( GFP ). [86]
Модифицированные организмы могут воспринимать сигналы окружающей среды и посылать выходные сигналы, которые могут быть обнаружены и служить диагностическим целям. Были использованы микробные когорты. [87]
Биосенсоры также могут использоваться для обнаружения патогенных сигнатур, таких как SARS-CoV-2 , и могут быть носимыми . [88] [89]
Для обнаружения и реагирования на различные и временные факторы окружающей среды клетки разработали широкий спектр регуляторных схем, от транскрипционных до посттрансляционных. Эти схемы состоят из модулей преобразователей, которые фильтруют сигналы и активируют биологический ответ, а также тщательно разработанных чувствительных секций, которые прикрепляют аналиты и регулируют пороги обнаружения сигнала. Модульность и селективность запрограммированы в биосенсорных схемах на транскрипционном, трансляционном и посттрансляционном уровнях для достижения деликатного баланса двух основных сенсорных модулей. [90]
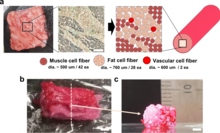
Однако не все синтетические продукты питания являются продуктами питания животного происхождения — например, по состоянию на 2021 год существуют также продукты из синтетического кофе , которые, как сообщается, близки к коммерциализации. [98] [99] [100] Похожие области исследований и производства, основанные на синтетической биологии, которые могут быть использованы для производства продуктов питания и напитков:
Фотосинтетические микробные клетки использовались в качестве шага к синтетическому производству паучьего шелка . [105] [106]
Биологический компьютер относится к сконструированной биологической системе, которая может выполнять операции, подобные компьютерным, что является доминирующей парадигмой в синтетической биологии. Исследователи построили и охарактеризовали множество логических вентилей в ряде организмов [107] и продемонстрировали как аналоговые, так и цифровые вычисления в живых клетках. Они продемонстрировали, что бактерии могут быть сконструированы для выполнения как аналоговых, так и/или цифровых вычислений. [108] [109] В 2007 году в человеческих клетках исследование продемонстрировало универсальный логический оценщик, который работает в клетках млекопитающих. [110] Впоследствии исследователи использовали эту парадигму для демонстрации концептуальной терапии, которая использует биологические цифровые вычисления для обнаружения и уничтожения раковых клеток человека в 2011 году. [111] В 2016 году другая группа исследователей продемонстрировала, что принципы компьютерной инженерии могут быть использованы для автоматизации проектирования цифровых схем в бактериальных клетках. [112] В 2017 году исследователи продемонстрировали систему «Булевой логики и арифметики через вырезание ДНК» (BLADE) для проектирования цифровых вычислений в клетках человека. [113] В 2019 году исследователи внедрили персептрон в биологические системы, открыв путь для машинного обучения в этих системах. [114]
Клетки используют взаимодействующие гены и белки, которые называются генными цепями, для реализации различных функций, таких как реагирование на сигналы окружающей среды, принятие решений и коммуникация. Вовлечены три ключевых компонента: ДНК, РНК и Синтетические биолог разработали генные цепи, которые могут контролировать экспрессию генов на нескольких уровнях, включая транскрипционный, посттранскрипционный и трансляционный уровни.
Традиционная метаболическая инженерия была подкреплена введением комбинаций чужеродных генов и оптимизацией посредством направленной эволюции. Это включает в себя инженерию E. coli и дрожжей для коммерческого производства предшественника противомалярийного препарата , артемизинина . [115]
Целые организмы еще не созданы с нуля, хотя живые клетки могут быть преобразованы с помощью новой ДНК. Несколько способов позволяют конструировать синтетические компоненты ДНК и даже целые синтетические геномы , но как только желаемый генетический код получен, он интегрируется в живую клетку, которая, как ожидается, проявит желаемые новые возможности или фенотипы во время роста и процветания. [116] Трансформация клеток используется для создания биологических схем , которыми можно манипулировать для получения желаемых результатов. [12] [13]
Объединив синтетическую биологию с материаловедением , можно будет использовать клетки как микроскопические молекулярные литейные цеха для производства материалов, свойства которых генетически закодированы. Реинжиниринг создал волокна Курли, амилоидный компонент внеклеточного материала биопленок , как платформу для программируемого наноматериала . Эти нановолокна были генетически сконструированы для определенных функций, включая адгезию к субстратам, шаблонизацию наночастиц и иммобилизацию белков. [117]

Природные белки могут быть сконструированы, например, путем направленной эволюции , могут быть получены новые структуры белков, которые соответствуют или улучшают функциональность существующих белков. Одна группа создала спиральный пучок , который был способен связывать кислород с аналогичными свойствами, как гемоглобин , но не связывал оксид углерода . [119] Подобная структура белка была создана для поддержки различных видов оксидоредуктазной активности [120], в то время как другая сформировала структурно и последовательно новую АТФазу . [121] Другая группа создала семейство рецепторов, сопряженных с G-белком, которые могли активироваться инертной малой молекулой клозапина N-оксида , но нечувствительны к нативному лиганду , ацетилхолину ; эти рецепторы известны как DREADD . [122] Новые функции или специфичность белка также могут быть сконструированы с использованием вычислительных подходов. Одно исследование смогло использовать два различных вычислительных метода: метод биоинформатики и молекулярного моделирования для добычи баз данных последовательностей и метод вычислительного проектирования ферментов для перепрограммирования специфичности ферментов. Оба метода привели к созданию ферментов с более чем 100-кратной специфичностью для производства спиртов с более длинной цепью из сахара. [123]
Другим распространенным исследованием является расширение естественного набора из 20 аминокислот . За исключением стоп-кодонов , было идентифицировано 61 кодон , но только 20 аминокислот кодируются в целом во всех организмах. Определенные кодоны спроектированы для кодирования альтернативных аминокислот, включая: нестандартные аминокислоты, такие как О- метилтирозин ; или экзогенные аминокислоты, такие как 4-фторфенилаланин. Обычно эти проекты используют перекодированные бессмысленные супрессорные пары тРНК - аминоацил тРНК синтетаза из других организмов, хотя в большинстве случаев требуется существенная инженерия. [124]
Другие исследователи исследовали структуру и функцию белка, сокращая нормальный набор из 20 аминокислот. Ограниченные библиотеки последовательностей белков создаются путем генерации белков, в которых группы аминокислот могут быть заменены одной аминокислотой. [125] Например, несколько неполярных аминокислот в белке могут быть заменены одной неполярной аминокислотой. [126] Один проект продемонстрировал, что сконструированная версия хоризмат-мутазы все еще имела каталитическую активность, когда использовались только девять аминокислот. [127]
Исследователи и компании практикуют синтетическую биологию для синтеза промышленных ферментов с высокой активностью, оптимальными выходами и эффективностью. Эти синтезированные ферменты направлены на улучшение таких продуктов, как моющие средства и безлактозные молочные продукты, а также на повышение их экономической эффективности. [128] Улучшения метаболической инженерии с помощью синтетической биологии являются примером биотехнологической техники, используемой в промышленности для открытия фармацевтических препаратов и ферментативных химикатов. Синтетическая биология может исследовать модульные системы путей в биохимическом производстве и увеличивать выходы метаболического производства. Искусственная ферментативная активность и последующие эффекты на скорости и выходы метаболических реакций могут разработать «эффективные новые стратегии для улучшения клеточных свойств ... для промышленно важного биохимического производства». [129]
Ученые могут кодировать цифровую информацию на одной нити синтетической ДНК . В 2012 году Джордж М. Чёрч закодировал одну из своих книг о синтетической биологии в ДНК. 5,3 Мб данных были более чем в 1000 раз больше, чем предыдущий наибольший объем информации, который можно было сохранить в синтезированной ДНК. [130] Похожий проект закодировал полные сонеты Уильяма Шекспира в ДНК. [131] В более общем плане, такие алгоритмы, как NUPACK, [132] ViennaRNA, [133] Ribosome Binding Site Calculator, [134] Cello, [135] и Non-Repetitive Parts Calculator [136], позволяют проектировать новые генетические системы.
Было разработано много технологий для включения неестественных нуклеотидов и аминокислот в нуклеиновые кислоты и белки как in vitro, так и in vivo. Например, в мае 2014 года исследователи объявили, что им удалось успешно ввести два новых искусственных нуклеотида в бактериальную ДНК. Включая отдельные искусственные нуклеотиды в культуральную среду, они смогли обменять бактерии 24 раза; они не генерировали мРНК или белки, способные использовать искусственные нуклеотиды. [137] [138] [139]
Синтетическая биология вызвала интерес у NASA , поскольку она могла бы помочь производить ресурсы для астронавтов из ограниченного набора соединений, отправленных с Земли. [140] [141] [142] На Марсе, в частности, синтетическая биология могла бы привести к производственным процессам, основанным на местных ресурсах, что сделало бы ее мощным инструментом в развитии оккупированных аванпостов с меньшей зависимостью от Земли. [140] Работа была направлена на разработку штаммов растений, которые способны справляться с суровой марсианской средой, используя методы, аналогичные тем, которые применяются для повышения устойчивости к определенным факторам окружающей среды в сельскохозяйственных культурах. [143]
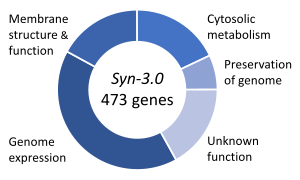
Одной из важных тем в синтетической биологии является синтетическая жизнь , которая касается гипотетических организмов, созданных in vitro из биомолекул и/или их химических аналогов . Эксперименты по синтетической жизни пытаются либо исследовать происхождение жизни , либо изучать некоторые свойства жизни, либо, что более амбициозно, воссоздать жизнь из неживых ( абиотических ) компонентов. Синтетическая биология жизни пытается создать живые организмы, способные выполнять важные функции, от производства фармацевтических препаратов до детоксикации загрязненной земли и воды. [145] В медицине это открывает перспективы использования спроектированных биологических частей в качестве отправной точки для новых классов терапий и диагностических инструментов. [145]
Живая «искусственная клетка» была определена как полностью синтетическая клетка, которая может захватывать энергию , поддерживать ионные градиенты , содержать макромолекулы , а также хранить информацию и иметь способность мутировать . [146] Никому не удалось создать такую клетку. [146]
Полностью синтетическая бактериальная хромосома была создана в 2010 году Крейгом Вентером , и его команда ввела ее в геномно опустошенные бактериальные клетки-хозяева. [19] Клетки-хозяева смогли расти и размножаться. [147] [148] Mycoplasma laboratorium — единственный живой организм с полностью сконструированным геномом.
Первый живой организм с «искусственным» расширенным кодом ДНК был представлен в 2014 году; команда использовала E. coli , геном которой был извлечен и заменен хромосомой с расширенным генетическим кодом. Добавленные нуклеозиды — d5SICS и dNaM . [139]
В мае 2019 года исследователи сообщили о создании новой синтетической (возможно, искусственной ) формы жизнеспособной жизни , варианта бактерии Escherichia coli , путем сокращения естественного числа кодонов в геноме бактерии с 64 до 59 кодонов, чтобы кодировать 20 аминокислот . [25] [26]
В 2017 году было начато международное крупномасштабное открытое исследовательское сотрудничество Build-a-Cell по созданию синтетических живых клеток [149] , за которым последовали национальные организации по синтетическим клеткам в нескольких странах, включая FabriCell, [150] MaxSynBio [151] и BaSyC. [152] Европейские усилия по синтетическим клеткам были объединены в 2019 году в инициативу SynCellEU [153] .
В 2023 году исследователям удалось создать первые синтетические человеческие эмбрионы, полученные из стволовых клеток. [154]
В терапии синтетическая биология достигла значительных успехов в изменении и упрощении сферы терапии за относительно короткий период времени. Фактически, новые терапевтические платформы, от открытия механизмов заболеваний и мишеней для лекарств до производства и транспортировки малых молекул, стали возможными благодаря логическому и управляемому моделями проектированию биологических компонентов. [60]
Устройства синтетической биологии были разработаны для использования в качестве терапии в терапевтическом лечении. Можно контролировать полностью созданные вирусы и организмы, чтобы нацеливаться на определенные патогены и болезненные пути. Таким образом, в двух независимых исследованиях 91,92 исследователи использовали генетически модифицированные бактериофаги для борьбы с бактериями, устойчивыми к антибиотикам, придавая им генетические особенности, которые специально нацелены и препятствуют бактериальной защите от действия антибиотиков. [155]
В терапии рака , поскольку обычные лекарства часто неизбирательно воздействуют на опухоли и нормальные ткани, могут быть полезны искусственно созданные вирусы и организмы, которые могут идентифицировать и связывать свое терапевтическое действие с патологическими сигналами. Например, активность пути p53 в человеческих клетках была введена в аденовирусы, чтобы контролировать, как они реплицируются. [155]
Бактерии уже давно используются в лечении рака. Bifidobacterium и Clostridium избирательно колонизируют опухоли и уменьшают их размер. [156] Недавно синтетические биологи перепрограммировали бактерии для восприятия и реагирования на определенное состояние рака. Чаще всего бактерии используются для доставки терапевтической молекулы непосредственно в опухоль, чтобы минимизировать побочные эффекты. Для нацеливания на опухолевые клетки пептиды , которые могут специфически распознавать опухоль, были экспрессированы на поверхности бактерий. Используемые пептиды включают молекулу аффибоди , которая специфически нацелена на рецептор человеческого эпидермального фактора роста 2 [157] и синтетический адгезин . [158] Другой способ заключается в том, чтобы позволить бактериям ощущать микросреду опухоли , например гипоксию, путем встраивания логического вентиля И в бактерии. [159] Затем бактерии высвобождают целевые терапевтические молекулы в опухоль только посредством лизиса [160] или бактериальной системы секреции . [161] Лизис имеет то преимущество, что он может стимулировать иммунную систему и контролировать рост. Могут использоваться различные типы систем секреции, а также другие стратегии. Система индуцируется внешними сигналами. Индукторы включают химические вещества, электромагнитные или световые волны.
В этих терапевтических средствах применяются многочисленные виды и штаммы. Наиболее часто используемые бактерии — Salmonella typhimurium , Escherichia coli , Bifidobacteria , Streptococcus , Lactobacillus , Listeria и Bacillus subtilis . Каждый из этих видов обладает собственным свойством и уникален для терапии рака с точки зрения колонизации тканей, взаимодействия с иммунной системой и простоты применения.
Разработанная платформа на основе дрожжей
Синтетические биологи разрабатывают генетически модифицированные живые дрожжи, которые могут доставлять терапевтические биологические препараты. При пероральном приеме эти живые дрожжи действуют как микрофабрики и производят терапевтические молекулы непосредственно в желудочно-кишечном тракте. Поскольку дрожжи являются эукариотическими, ключевым преимуществом является то, что их можно вводить вместе с антибиотиками. Пробиотические дрожжи, экспрессирующие человеческий пуринергический рецептор P2Y2, подавляли воспаление кишечника в мышиных моделях воспалительного заболевания кишечника. [162] Были разработаны живые дрожжи S. boulardii, доставляющие тетраспецифический антитоксин, который эффективно нейтрализует токсин A и токсин B Clostridioides difficile . Этот терапевтический антитоксин представляет собой слияние четырех однодоменных антител ( нанотел ), которые эффективно и широко нейтрализуют два основных фактора вирулентности C. difficile в месте заражения в доклинических моделях. [163] Первое клиническое испытание на людях живых дрожжей, модифицированных для лечения инфекции Clostridioides difficile, ожидается в 2024 году и будет спонсироваться разработчиком Fzata, Inc.
Иммунная система играет важную роль в раке и может быть использована для атаки раковых клеток. Клеточная терапия фокусируется на иммунотерапии , в основном путем создания Т-клеток .
Рецепторы Т-клеток были спроектированы и «обучены» для обнаружения раковых эпитопов . Химерные антигенные рецепторы (CAR) состоят из фрагмента антитела, слитого с внутриклеточными сигнальными доменами Т-клеток, которые могут активировать и запускать пролиферацию клетки. Несколько методов лечения на основе CAR второго поколения были одобрены FDA. [164]
Генные переключатели были разработаны для повышения безопасности лечения. Были разработаны выключатели-убийцы для прекращения терапии, если у пациента проявляются серьезные побочные эффекты. [165] Механизмы могут более тонко контролировать систему, останавливать и реактивировать ее. [166] [167] Поскольку количество Т-клеток важно для постоянства и тяжести терапии, рост Т-клеток также контролируется для повышения эффективности и безопасности терапии. [168]
Хотя ряд механизмов может повысить безопасность и контроль, ограничения включают сложность индукции больших цепей ДНК в клетках и риски, связанные с введением в клетки чужеродных компонентов, особенно белков.
Самым популярным биотопливом является этанол, произведенный из кукурузы или сахарного тростника, но этот метод производства биотоплива является проблематичным и ограниченным из-за высокой стоимости сельского хозяйства и неадекватных топливных характеристик этанола. Заменителем и потенциальным источником возобновляемой энергии являются микробы, метаболические пути которых были изменены для более эффективного преобразования биомассы в биотопливо. Только если их производственные затраты могут быть сделаны равными или даже превысить затраты на текущее производство топлива, можно ожидать, что эти методы будут успешными. В связи с этим существует несколько лекарств, дорогостоящие производственные процедуры которых не позволяют им иметь более широкий терапевтический диапазон. Создание новых материалов и микробиологическое производство биоматериалов существенно выиграют от новых инструментов искусственной биологии. [155]
Система кластеризованных часто интерспейсированных коротких палиндромных повторов (CRISPR)/CRISPR-ассоциированных (Cas) является мощным методом генной инженерии в ряде организмов благодаря своей простоте, модульности и масштабируемости. В этой технике направляющая РНК (гРНК) привлекает нуклеазу CRISPR Cas9 к определенному месту в геноме, вызывая двойной разрыв цепи. Несколько процессов репарации ДНК, включая гомологически направленную рекомбинацию и негомологичное соединение концов, могут быть использованы для достижения желаемого изменения генома (т. е. удаления или вставки гена). Кроме того, dCas9 (мертвый Cas9 или Cas9 с дефицитом нуклеазы), двойной мутант Cas9 (H840A, D10A), использовался для контроля экспрессии генов у бактерий или при связывании со стимуляцией сайта подавления у дрожжей. [169]
Для создания и разработки биологических систем регулирующие компоненты, включая регуляторы, сайты связывания рибосом (RBS) и терминаторы, имеют решающее значение. Несмотря на годы исследований, существует множество различных разновидностей и число промоутеров и терминаторов для Escherichia coli, но также и для хорошо изученного модельного организма Saccharomyces cerevisiae, а также для других интересующих организмов, эти инструменты довольно редки. Было изобретено множество методов для поиска и идентификации промоутеров и терминаторов, чтобы преодолеть это ограничение, включая добычу генома, случайный мутагенез, гибридную инженерию, биофизическое моделирование, комбинаторный дизайн и рациональный дизайн. [169]
Синтетическая биология использовалась для органоидов , которые представляют собой выращенные в лабораторных условиях органы, применяемые в медицинских исследованиях и трансплантации. [170]
3D-биопечать может использоваться для реконструкции тканей из различных областей тела. Предшественником внедрения 3D-печати в здравоохранение стала серия испытаний, проведенных исследователями из Бостонской детской больницы. Команда вручную изготовила сменные мочевые пузыри для семи пациентов, построив каркасы, а затем наслаивая на каркасы клетки пациентов и позволяя им расти. Испытания прошли успешно, поскольку пациенты оставались в добром здравии в течение 7 лет после имплантации, что побудило научного сотрудника по имени Энтони Атала, доктора медицины, искать способы автоматизации процесса. [171] Пациентов с терминальной стадией заболевания мочевого пузыря теперь можно лечить с помощью биоинженерных тканей мочевого пузыря для восстановления поврежденного органа. [172] Эту технологию также потенциально можно применять к костям, коже, хрящам и мышечной ткани. [173] Хотя одной из долгосрочных целей технологии 3D-биопечать является реконструкция целого органа, а также минимизация проблемы нехватки органов для трансплантации. [174] Было достигнуто мало успехов в биопечати полностью функциональных органов, таких как печень, кожа, мениск или поджелудочная железа. [175] [176] [177] В отличие от имплантируемых стентов, органы имеют сложную форму и их значительно сложнее биопечатать. Биопечатное сердце, например, должно не только соответствовать структурным требованиям, но и требованиям васкуляризации, механической нагрузки и распространения электрического сигнала. [178] В 2022 году был зарегистрирован первый успех клинического испытания 3D-биопечатного трансплантата, изготовленного из собственных клеток пациента, внешнего уха для лечения микротии [179] . [ 180]
3D-биопечать вносит значительный вклад в развитие медицинской области тканевой инженерии , позволяя проводить исследования инновационных материалов, называемых биоматериалами . Некоторые из наиболее известных биоинженерных веществ обычно прочнее обычных телесных материалов, включая мягкие ткани и кости. Эти компоненты могут выступать в качестве будущих заменителей, даже улучшений, исходных материалов тела. Кроме того, Агентство по снижению угроз обороны США стремится печатать мини-органы, такие как сердце, печень и легкие, в качестве потенциала для более точного тестирования новых лекарств и, возможно, устранения необходимости тестирования на животных. [181]
Продолжаются исследования и разработки методов, основанных на синтетической биологии, для индукции регенерации у людей [ актуально? ], а также создания трансплантируемых искусственных органов .
Синтетическая биология может быть использована для создания наночастиц, которые могут быть использованы для доставки лекарств, а также для других целей. [182] Дополнительные исследования и разработки стремятся и создали синтетические клетки , которые имитируют функции биологических клеток. Приложения включают медицину, такую как дизайнерские наночастицы , которые заставляют клетки крови разъедать — изнутри наружу — части атеросклеротических бляшек , которые вызывают сердечные приступы. [183] [184] [185] Синтетические микрокапли для водорослевых клеток или синергетические водорослево-бактериальные многоклеточные сфероидные микробные реакторы , например, могут быть использованы для производства водорода в качестве биотехнологии водородной экономики . [186] [187]
Клетки-дизайнеры млекопитающих конструируются людьми для определённого поведения, например, иммунная клетка, которая экспрессирует синтетический рецептор, предназначенный для борьбы с определённым заболеванием. [188] [189] Электрогенетика — это приложение синтетической биологии, которое включает использование электрических полей для стимуляции реакции в конструированных клетках. [190] Управление клетками-дизайнерами может осуществляться относительно легко с помощью обычных электронных устройств, таких как смартфоны. Кроме того, электрогенетика позволяет создавать устройства, которые намного меньше и компактнее, чем устройства, использующие другие стимулы, с помощью микроскопических электродов. [190] Одним из примеров того, как электрогенетика используется на благо общественного здравоохранения, является стимуляция клеток-дизайнеров, которые способны производить/доставлять терапевтические средства. [191] Это было реализовано в клетках Electro HEK, клетках, которые содержат потенциалзависимые кальциевые каналы, которые являются электрочувствительными, что означает, что ионный канал можно контролировать с помощью электрической проводимости между электродами и клетками Electro HEK. [190] Было показано, что уровни экспрессии искусственного гена, которые содержались в этих клетках Electro HEK, можно контролировать, изменяя напряжение или длину электрического импульса. Дальнейшие исследования расширили эту надежную систему, одной из которых является система бета-клеточной линии, разработанная для управления высвобождением инсулина на основе электрических сигналов. [192]
Создание новой жизни и вмешательство в существующую жизнь вызвало этические проблемы в области синтетической биологии и активно обсуждается. [193] [194]
К распространенным этическим вопросам относятся:
Этические аспекты синтетической биологии имеют три основные характеристики: биобезопасность , биозащита и создание новых форм жизни. [196] Другие упомянутые этические вопросы включают регулирование новых творений, управление патентами на новые творения, распределение выгод и целостность исследований. [197] [193]
Этические проблемы всплыли в связи с технологиями рекомбинантной ДНК и генетически модифицированных организмов (ГМО), а во многих юрисдикциях были введены обширные правила генной инженерии и исследования патогенов. Эми Гутман , бывший глава Президентской комиссии по биоэтике, утверждала, что нам следует избегать соблазна чрезмерно регулировать синтетическую биологию в целом и генную инженерию в частности. По словам Гутман, «Регулятивная экономия особенно важна в новых технологиях... где соблазн подавить инновации на основе неопределенности и страха перед неизвестным особенно велик. Грубые инструменты законодательных и нормативных ограничений могут не только препятствовать распространению новых выгод, но и могут быть контрпродуктивными для безопасности, не давая исследователям разрабатывать эффективные меры предосторожности». [198]
Один этический вопрос заключается в том, приемлемо ли создавать новые формы жизни, что иногда называют «игрой в Бога». В настоящее время создание новых форм жизни, не существующих в природе, происходит в небольших масштабах, потенциальные выгоды и опасности остаются неизвестными, а для большинства исследований обеспечивается тщательное рассмотрение и надзор. [193] Многие сторонники говорят о большой потенциальной ценности — для сельского хозяйства, медицины и академических знаний, среди прочих областей — создания искусственных форм жизни. Создание новых сущностей может расширить научные знания далеко за пределы того, что в настоящее время известно из изучения природных явлений. Тем не менее, существует опасение, что искусственные формы жизни могут снизить «чистоту» природы (т. е. природа может быть каким-то образом испорчена вмешательством и манипуляцией человека) и потенциально повлиять на принятие более инженерных принципов вместо идеалов, ориентированных на биоразнообразие и природу. Некоторые также обеспокоены тем, что если искусственная форма жизни будет выпущена в природу, она может помешать биоразнообразию, вытесняя естественные виды из-за ресурсов (подобно тому, как цветение водорослей убивает морские виды). Другая проблема касается этического отношения к вновь созданным сущностям, если они чувствуют боль , чувствительность и самовосприятие. Продолжаются дебаты о том, следует ли предоставлять таким формам жизни моральные или юридические права, хотя не существует консенсуса относительно того, как эти права будут администрироваться или обеспечиваться.
Этические и моральные обоснования, которые поддерживают определенные приложения синтетической биологии, включают их потенциальное смягчение существенных глобальных проблем пагубного воздействия на окружающую среду традиционного сельского хозяйства (включая производство мяса ), благополучия животных , продовольственной безопасности и здоровья человека , [199] [200] [201] [202], а также потенциальное сокращение потребностей человека в рабочей силе и, посредством терапии болезней, уменьшение человеческих страданий и продление жизни.
Что наиболее этически целесообразно при рассмотрении мер биобезопасности? Как можно избежать случайного внедрения синтетической жизни в естественную среду? Этим вопросам было уделено много этических и критических размышлений. Биобезопасность относится не только к биологическому сдерживанию; она также относится к шагам, предпринимаемым для защиты населения от потенциально опасных биологических агентов. Несмотря на то, что такие опасения важны и остаются без ответа, не все продукты синтетической биологии представляют собой проблему биологической безопасности или негативных последствий для окружающей среды. Утверждается, что большинство синтетических технологий безвредны и не способны процветать во внешнем мире из-за своих «неестественных» характеристик, поскольку пока еще не было примера трансгенного микроба, наделенного преимуществом в плане приспособленности в дикой природе.
В целом, существующие методы контроля опасности , методологии оценки риска и правила, разработанные для традиционных генетически модифицированных организмов (ГМО), считаются достаточными для синтетических организмов. «Внешние» методы биосдерживания в лабораторном контексте включают физическое сдерживание с помощью шкафов биобезопасности и перчаточных боксов , а также средств индивидуальной защиты . В сельскохозяйственном контексте они включают изоляционные расстояния и барьеры от пыльцы , аналогичные методам биосдерживания ГМО . Синтетические организмы могут обеспечивать повышенный контроль опасности, поскольку они могут быть спроектированы с помощью «внутренних» методов биосдерживания, которые ограничивают их рост в неизолированной среде или предотвращают горизонтальный перенос генов в природные организмы. Примерами внутреннего биосдерживания являются ауксотрофия , биологические выключатели уничтожения , неспособность организма реплицироваться или передавать модифицированные или синтетические гены потомству и использование ксенобиологических организмов с использованием альтернативной биохимии, например, с использованием искусственных ксенонуклеиновых кислот (XNA) вместо ДНК. [203] [204] Что касается ауксотрофии, бактерии и дрожжи можно сконструировать так, чтобы они не могли производить гистидин , важную аминокислоту для всей жизни. Такие организмы, таким образом, можно выращивать только на богатых гистидином средах в лабораторных условиях, что сводит на нет опасения, что они могут распространиться в нежелательные области.
Некоторые этические вопросы связаны с биобезопасностью, где биосинтетические технологии могут быть преднамеренно использованы для причинения вреда обществу и/или окружающей среде. Поскольку синтетическая биология поднимает этические вопросы и вопросы биобезопасности, человечество должно рассмотреть и спланировать, как обращаться с потенциально опасными созданиями, и какие этические меры могут быть потенциально использованы для сдерживания гнусных биосинтетических технологий. За исключением регулирования компаний синтетической биологии и биотехнологий, [205] [206] однако, эти вопросы не рассматриваются как новые, поскольку они были подняты во время более ранних дебатов о рекомбинантной ДНК и генетически модифицированных организмах (ГМО), а обширные правила генной инженерии и исследования патогенов уже действуют во многих юрисдикциях. [207]
Кроме того, разработка инструментов синтетической биологии облегчила людям с меньшим образованием, подготовкой и доступом к оборудованию возможность изменять и использовать патогенные организмы в качестве биологического оружия. Это увеличивает угрозу биотерроризма , особенно по мере того, как террористические группы осознают значительные социальные, экономические и политические потрясения, вызванные такими пандемиями, как COVID-19 . По мере разработки новых методов в области синтетической биологии риск биотерроризма, вероятно, продолжит расти. [208] Хуан Сарате, занимавший должность заместителя советника по национальной безопасности по борьбе с терроризмом с 2005 по 2009 год, отметил, что «серьезность и экстремальные разрушения нового коронавируса, вероятно, подстегнут воображение самых креативных и опасных групп и лиц пересмотреть биотеррористические атаки». [209]
Проект SYNBIOSAFE, финансируемый Европейским союзом [210] , опубликовал отчеты о том, как управлять синтетической биологией. В статье 2007 года были определены ключевые вопросы безопасности, защиты, этики и интерфейса между наукой и обществом, которые проект определил как общественное образование и постоянный диалог между учеными, предприятиями, правительством и специалистами по этике. [211] [212] Ключевые вопросы безопасности, выявленные SYNBIOSAFE, включали привлечение компаний, продающих синтетическую ДНК, и сообщества биохакеров -любителей биологии. Ключевые этические вопросы касались создания новых форм жизни.
Последующий отчет был посвящен биобезопасности, особенно так называемой проблеме двойного использования . Например, хотя синтетическая биология может привести к более эффективному производству медицинских препаратов, она также может привести к синтезу или модификации вредных патогенов (например, оспы ). [213] Сообщество биохакеров остается источником особой озабоченности, поскольку распределенная и диффузная природа биотехнологии с открытым исходным кодом затрудняет отслеживание, регулирование или смягчение потенциальных проблем, связанных с биобезопасностью и биозащитой. [214]
COSY, еще одна европейская инициатива, фокусируется на общественном восприятии и коммуникации. [215] [216] [217] Чтобы лучше донести синтетическую биологию и ее социальные последствия до более широкой общественности, COSY и SYNBIOSAFE опубликовали SYNBIOSAFE , 38-минутный документальный фильм, в октябре 2009 года. [210]
Международная ассоциация синтетической биологии предложила саморегулирование. [218] Это предлагает конкретные меры, которые должна реализовать индустрия синтетической биологии, особенно компании по синтезу ДНК. В 2007 году группа под руководством ученых из ведущих компаний по синтезу ДНК опубликовала «практический план разработки эффективной структуры надзора для индустрии синтеза ДНК». [205]
В январе 2009 года Фонд Альфреда П. Слоуна профинансировал Центр Вудро Вильсона , Центр Гастингса и Институт Дж. Крейга Вентера для изучения общественного восприятия, этических и политических последствий синтетической биологии. [219]
9–10 июля 2009 года Комитет Национальной академии наук по науке, технологиям и праву провел симпозиум на тему «Возможности и проблемы в новой области синтетической биологии». [220]
После публикации первого синтетического генома и сопутствующего освещения в СМИ вопроса о создании «жизни» президент Барак Обама учредил Президентскую комиссию по изучению биоэтических вопросов для изучения синтетической биологии. [221] Комиссия провела ряд заседаний и в декабре 2010 года опубликовала отчет под названием «Новые направления: этика синтетической биологии и новые технологии». Комиссия заявила, что «хотя достижение Вентера ознаменовало собой значительный технический прогресс в демонстрации того, что относительно большой геном может быть точно синтезирован и заменен другим, оно не равнозначно «созданию жизни». [222] Она отметила, что синтетическая биология является новой областью, которая создает потенциальные риски и выгоды. Комиссия не рекомендовала изменения политики или надзора и призвала к продолжению финансирования исследований и новому финансированию мониторинга, изучения новых этических вопросов и общественного образования. [207]
Синтетическая биология, как основной инструмент для биологических достижений, приводит к «потенциалу для разработки биологического оружия, возможным непредвиденным негативным последствиям для здоровья человека ... и любым потенциальным последствиям для окружающей среды». [223] Распространение такой технологии также может сделать производство биологического и химического оружия доступным для более широкого круга государственных и негосударственных субъектов . [224] Этих проблем безопасности можно избежать, регулируя промышленное использование биотехнологий с помощью политического законодательства. Федеральные руководящие принципы по генетическим манипуляциям предлагаются «Президентской комиссией по биоэтике ... в ответ на объявленное создание самовоспроизводящейся клетки из химически синтезированного генома, выдвинуто 18 рекомендаций не только для регулирования науки ... для просвещения общественности». [223]
13 марта 2012 года более 100 экологических и общественных групп, включая Friends of the Earth , International Center for Technology Assessment и ETC Group , выпустили манифест «Принципы надзора за синтетической биологией» . Этот манифест призывает к всемирному мораторию на выпуск и коммерческое использование синтетических организмов до тех пор, пока не будут установлены более надежные правила и строгие меры биологической безопасности. Группы, в частности, призывают к прямому запрету использования синтетической биологии на геноме человека или микробиоме человека . [225] [226] Ричард Левонтин написал, что некоторые из принципов безопасности для надзора, обсуждаемых в «Принципах надзора за синтетической биологией», являются разумными, но главная проблема с рекомендациями в манифесте заключается в том, что «широкая общественность не имеет возможности обеспечить какую-либо значимую реализацию этих рекомендаций». [227]
Опасности синтетической биологии включают в себя биобезопасные опасности для работников и населения, биобезопасные опасности, возникающие из-за преднамеренного создания организмов для причинения вреда, и экологические опасности. [228] Биобезопасные опасности аналогичны опасностям для существующих областей биотехнологии, в основном воздействие патогенов и токсичных химикатов, хотя новые синтетические организмы могут иметь новые риски. [203] Что касается биобезопасности, существует опасение, что синтетические или переработанные организмы теоретически могут быть использованы для биотерроризма . Потенциальные риски включают воссоздание известных патогенов с нуля, создание существующих патогенов с целью сделать их более опасными и создание микробов для производства вредных биохимикатов. [229] Наконец, экологические опасности включают неблагоприятное воздействие на биоразнообразие и экосистемные услуги , включая потенциальные изменения в землепользовании в результате сельскохозяйственного использования синтетических организмов. [230] [231] Синтетическая биология является примером технологии двойного назначения с потенциалом использования способами, которые могут преднамеренно или непреднамеренно нанести вред людям и/или нанести ущерб окружающей среде. Часто «ученые, принимающие их учреждения и финансирующие органы» рассматривают возможность ненадлежащего использования запланированного исследования и иногда принимают меры для снижения вероятности ненадлежащего использования. [232]
Существующие системы анализа рисков для ГМО, как правило, считаются достаточными для синтетических организмов, хотя могут возникнуть трудности для организма, созданного «снизу вверх» из отдельных генетических последовательностей. [204] [233] Синтетическая биология, как правило, подпадает под существующие правила для ГМО и биотехнологии в целом, а также любые правила, которые существуют для последующих коммерческих продуктов, хотя, как правило, нет правил ни в одной юрисдикции, которые были бы специфичны для синтетической биологии. [234] [235]
{{cite journal}}: Неизвестный параметр |agency=проигнорирован ( помощь ){{cite news}}: |last2=имеет общее название ( помощь ){{cite web}}: Отсутствует или пусто |title=( помощь ){{cite book}}: |website=проигнорировано ( помощь ){{cite book}}: |website=проигнорировано ( помощь )