Биохимия или биологическая химия — это изучение химических процессов внутри и в отношении живых организмов . [1] Биохимия , являющаяся субдисциплиной как химии, так и биологии , может быть разделена на три области: структурную биологию , энзимологию и метаболизм . За последние десятилетия 20-го века биохимия добилась успеха в объяснении жизненных процессов с помощью этих трех дисциплин. Почти все области наук о жизни раскрываются и развиваются с помощью биохимической методологии и исследований. [2] Биохимия фокусируется на понимании химической основы, которая позволяет биологическим молекулам вызывать процессы, происходящие внутри живых клеток и между клетками, [3] в свою очередь, тесно связанные с пониманием тканей и органов , а также структуры и функции организма. [4] Биохимия тесно связана с молекулярной биологией , изучением молекулярных механизмов биологических явлений. [5]
Большая часть биохимии занимается структурами, функциями и взаимодействиями биологических макромолекул, таких как белки , нуклеиновые кислоты , углеводы и липиды . Они обеспечивают структуру клеток и выполняют многие функции, связанные с жизнью. [6] Химия клетки также зависит от реакций малых молекул и ионов . Они могут быть неорганическими (например, вода и ионы металлов ) или органическими (например, аминокислоты , которые используются для синтеза белков ). [7] Механизмы, используемые клетками для извлечения энергии из окружающей среды посредством химических реакций , известны как метаболизм . Результаты биохимии применяются в основном в медицине , питании и сельском хозяйстве . В медицине биохимики исследуют причины и методы лечения болезней . [8] Питание изучает, как поддерживать здоровье и хорошее самочувствие, а также последствия дефицита питательных веществ . [9] В сельском хозяйстве биохимики исследуют почву и удобрения с целью улучшения выращивания сельскохозяйственных культур, хранения урожая и борьбы с вредителями . В последние десятилетия биохимические принципы и методы были объединены с подходами к решению проблем, применяемыми в инженерии, для манипулирования живыми системами с целью создания полезных инструментов для исследований, промышленных процессов, а также диагностики и контроля заболеваний — дисциплины биотехнологии .
_and_Carl_Ferdinand_Cori_-_restoration1.jpg/440px-Gerty_Theresa_Radnitz_Cori_(1896-1957)_and_Carl_Ferdinand_Cori_-_restoration1.jpg)
В наиболее полном определении биохимию можно рассматривать как изучение компонентов и состава живых существ и того, как они объединяются, чтобы стать жизнью. В этом смысле история биохимии может восходить к древним грекам . [10] Однако биохимия как особая научная дисциплина началась где-то в 19 веке или немного раньше, в зависимости от того, на каком аспекте биохимии сосредоточено внимание. Некоторые утверждали, что началом биохимии, возможно, было открытие первого фермента , диастазы (теперь называемой амилазой ), в 1833 году Ансельмом Пайеном , [11] в то время как другие считали первую демонстрацию Эдуардом Бюхнером сложного биохимического процесса спиртового брожения в бесклеточных экстрактах в 1897 году рождением биохимии. [12] [13] Некоторые также могут указать на ее начало с влиятельной работы 1842 года Юстуса фон Либиха « Химия животных, или Органическая химия в ее приложениях к физиологии и патологии» , в которой была представлена химическая теория метаболизма, [10] или даже ранее с исследований 18-го века по брожению и дыханию Антуана Лавуазье . [14] [15] Многие другие пионеры в этой области, которые помогли раскрыть слои сложности биохимии, были провозглашены основателями современной биохимии. Эмиль Фишер , который изучал химию белков , [16] и Ф. Гоуленд Хопкинс , который изучал ферменты и динамическую природу биохимии, представляют собой два примера ранних биохимиков. [17]
Термин «биохимия» был впервые использован, когда Винценц Клетцинский (1826–1882) напечатал свой «Compendium der Biochemie» в Вене в 1858 году; он произошел от сочетания биологии и химии . В 1877 году Феликс Хоппе-Зейлер использовал термин ( biochemie на немецком языке) как синоним физиологической химии в предисловии к первому выпуску Zeitschrift für Physiologische Chemie (Журнал физиологической химии), где он выступал за создание институтов, посвященных этой области исследований. [18] [19] Однако часто упоминается, что немецкий химик Карл Нойберг придумал это слово в 1903 году, [20] [21] [22] хотя некоторые приписывают его Францу Хофмайстеру . [23]
Когда-то считалось, что жизнь и ее материалы обладают неким существенным свойством или субстанцией (часто называемой « жизненным принципом »), отличной от любой, обнаруженной в неживой материи, и считалось, что только живые существа могут производить молекулы жизни. [25] В 1828 году Фридрих Вёлер опубликовал статью о своем счастливом синтезе мочевины из цианата калия и сульфата аммония ; некоторые считали это прямым ниспровержением витализма и установлением органической химии . [26] [27] Однако синтез Вёлера вызвал споры, поскольку некоторые отрицают смерть витализма от его рук. [28] С тех пор биохимия продвинулась вперед, особенно с середины 20-го века, с развитием новых методов, таких как хроматография , рентгеновская дифракция , двухполяризационная интерферометрия , ЯМР-спектроскопия , радиоизотопная маркировка , электронная микроскопия и моделирование молекулярной динамики . Эти методы позволили открыть и детально проанализировать многие молекулы и метаболические пути клетки , такие как гликолиз и цикл Кребса (цикл лимонной кислоты), и привели к пониманию биохимии на молекулярном уровне. [ необходима цитата ]
Другим важным историческим событием в биохимии является открытие гена и его роли в передаче информации в клетке. В 1950-х годах Джеймс Д. Уотсон , Фрэнсис Крик , Розалинд Франклин и Морис Уилкинс сыграли важную роль в решении структуры ДНК и предположении ее связи с генетической передачей информации. [29] В 1958 году Джордж Бидл и Эдвард Татум получили Нобелевскую премию за работу с грибами, показывающую, что один ген производит один фермент . [30] В 1988 году Колин Питчфорк стал первым человеком, осужденным за убийство с использованием доказательств ДНК , что привело к росту судебной экспертизы . [31] Совсем недавно Эндрю З. Файер и Крейг К. Мелло получили Нобелевскую премию 2006 года за открытие роли РНК-интерференции (РНКi) в подавлении экспрессии генов . [32]
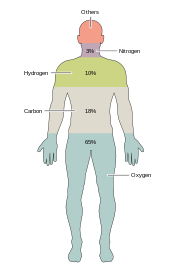
Около двух десятков химических элементов необходимы для различных видов биологической жизни . Большинство редких элементов на Земле не нужны для жизни (исключениями являются селен и йод ), [33] в то время как несколько распространенных ( алюминий и титан ) не используются. Большинство организмов разделяют потребности в элементах, но есть несколько различий между растениями и животными . Например, морские водоросли используют бром , но наземные растения и животные, похоже, не нуждаются в нем. Всем животным требуется натрий , но он не является необходимым элементом для растений. Растениям нужны бор и кремний , но животным они могут не понадобиться (или могут потребоваться в очень малых количествах). [ требуется цитата ]
Всего шесть элементов — углерод , водород , азот , кислород , кальций и фосфор — составляют почти 99% массы живых клеток, включая клетки человеческого тела (см. состав человеческого тела для полного списка). В дополнение к шести основным элементам, которые составляют большую часть человеческого тела, людям требуются меньшие количества, возможно, еще 18. [34]
Четыре основных класса молекул в биохимии (часто называемых биомолекулами ) — это углеводы , липиды , белки и нуклеиновые кислоты . [35] Многие биологические молекулы являются полимерами : в этой терминологии мономеры — это относительно небольшие макромолекулы, которые связаны друг с другом для создания больших макромолекул, известных как полимеры. Когда мономеры связаны вместе для синтеза биологического полимера , они подвергаются процессу, называемому дегидратационным синтезом . Различные макромолекулы могут собираться в более крупные комплексы, часто необходимые для биологической активности .
Две основные функции углеводов — хранение энергии и обеспечение структуры. Один из распространенных сахаров , известный как глюкоза , является углеводом, но не все углеводы являются сахарами. На Земле углеводов больше, чем любого другого известного типа биомолекул; они используются для хранения энергии и генетической информации , а также играют важную роль во взаимодействиях и коммуникациях между клетками . [ требуется цитата ]
Простейшим типом углеводов является моносахарид , который, помимо прочих свойств, содержит углерод , водород и кислород , в основном в соотношении 1:2:1 (обобщенная формула C n H 2 n O n , где n равно не менее 3). Глюкоза (C 6 H 12 O 6 ) является одним из важнейших углеводов; другие включают фруктозу (C 6 H 12 O 6 ), сахар, обычно ассоциируемый со сладким вкусом фруктов , [36] [a] и дезоксирибозу (C 5 H 10 O 4 ), компонент ДНК . Моносахарид может переключаться между ациклической (открытоцепочечной) формой и циклической формой. Открытоцепочечная форма может быть превращена в кольцо атомов углерода, соединенных мостиком с помощью атома кислорода, созданного из карбонильной группы одного конца и гидроксильной группы другого. Циклическая молекула имеет полуацетальную или полукетальную группу, в зависимости от того, была ли линейная форма альдозой или кетозой . [38]
В этих циклических формах кольцо обычно имеет 5 или 6 атомов. Эти формы называются фуранозами и пиранозами , соответственно, — по аналогии с фураном и пираном , простейшими соединениями с тем же углеродно-кислородным кольцом (хотя у них отсутствуют углеродно-углеродные двойные связи этих двух молекул). Например, альдогексозаглюкоза может образовывать полуацетальную связь между гидроксилом на углероде 1 и кислородом на углероде 4, давая молекулу с 5-членным кольцом, называемую глюкофураноза . Та же реакция может происходить между углеродами 1 и 5, образуя молекулу с 6-членным кольцом, называемую глюкопираноза . Циклические формы с 7-атомным кольцом, называемые гептозами, встречаются редко. [ необходима цитата ]
Два моносахарида могут быть соединены гликозидной или эфирной связью в дисахарид посредством реакции дегидратации, в ходе которой высвобождается молекула воды. Обратная реакция, в которой гликозидная связь дисахарида разрывается на два моносахарида, называется гидролизом . Самый известный дисахарид — сахароза или обычный сахар , который состоит из соединенных молекулы глюкозы и молекулы фруктозы . Другим важным дисахаридом является лактоза , содержащаяся в молоке, состоящая из молекулы глюкозы и молекулы галактозы . Лактоза может гидролизоваться лактазой , а недостаток этого фермента приводит к непереносимости лактозы .
Когда несколько (примерно от трех до шести) моносахаридов соединены, это называется олигосахаридом ( oligo- означает «немного»). Эти молекулы, как правило, используются в качестве маркеров и сигналов , а также имеют некоторые другие применения. [39] Многие соединенные моносахариды образуют полисахарид . Они могут быть соединены в одну длинную линейную цепь, или они могут быть разветвленными . Два из наиболее распространенных полисахаридов - целлюлоза и гликоген , оба состоят из повторяющихся мономеров глюкозы . Целлюлоза является важным структурным компонентом клеточных стенок растений , а гликоген используется как форма хранения энергии у животных.
Сахар можно охарактеризовать по наличию восстанавливающих или невосстанавливающих концов. Восстанавливающий конец углевода — это атом углерода, который может находиться в равновесии с альдегидной ( альдозной ) или кетоформой ( кетозой ) с открытой цепью. Если присоединение мономеров происходит у такого атома углерода, свободная гидроксильная группа пиранозной или фуранозной формы обменивается с боковой цепью ОН другого сахара, давая полный ацеталь . Это предотвращает раскрытие цепи в альдегидную или кетоформу и делает модифицированный остаток невосстанавливающим. Лактоза содержит восстанавливающий конец в своей глюкозной части, тогда как галактозная часть образует полный ацеталь с группой C4-OH глюкозы. Сахароза не имеет восстанавливающего конца из-за образования полного ацеталя между альдегидным углеродом глюкозы (C1) и кетоуглеродом фруктозы (C2).

Липиды включают в себя разнообразный спектр молекул и в некоторой степени являются всеобъемлющим понятием для относительно нерастворимых в воде или неполярных соединений биологического происхождения, включая воски , жирные кислоты , фосфолипиды , полученные из жирных кислот, сфинголипиды , гликолипиды и терпеноиды (например, ретиноиды и стероиды ). Некоторые липиды представляют собой линейные алифатические молекулы с открытой цепью, в то время как другие имеют кольцевые структуры. Некоторые являются ароматическими (с циклической [кольцевой] и плоской [плоской] структурой), а другие — нет. Некоторые из них гибкие, а другие — жесткие. [42]
Липиды обычно состоят из одной молекулы глицерина, объединенной с другими молекулами. В триглицеридах , основной группе объемных липидов, есть одна молекула глицерина и три жирные кислоты . Жирные кислоты считаются мономером в этом случае и могут быть насыщенными (нет двойных связей в углеродной цепи) или ненасыщенными (одна или несколько двойных связей в углеродной цепи). [ необходима цитата ]
Большинство липидов имеют некоторый полярный характер и в значительной степени неполярны. В целом, основная часть их структуры неполярна или гидрофобна («боится воды»), что означает, что она плохо взаимодействует с полярными растворителями, такими как вода . Другая часть их структуры полярна или гидрофильна («любит воду») и будет иметь тенденцию ассоциироваться с полярными растворителями, такими как вода. Это делает их амфифильными молекулами (имеющими как гидрофобные, так и гидрофильные части). В случае холестерина полярная группа представляет собой просто –ОН (гидроксил или спирт). [ необходима цитата ]
В случае фосфолипидов полярные группы значительно больше и более полярны, как описано ниже.
Липиды являются неотъемлемой частью нашего ежедневного рациона. Большинство масел и молочных продуктов , которые мы используем для приготовления и употребления пищи, такие как масло , сыр , топленое масло и т. д., состоят из жиров . Растительные масла богаты различными полиненасыщенными жирными кислотами (ПНЖК). Продукты, содержащие липиды, перевариваются в организме и расщепляются на жирные кислоты и глицерин, конечные продукты распада жиров и липидов. Липиды, особенно фосфолипиды , также используются в различных фармацевтических продуктах , либо в качестве со-солюбилизаторов (например, в парентеральных инфузиях), либо в качестве компонентов- носителей лекарств (например, в липосоме или трансферсоме ).

Белки — это очень большие молекулы — макробиополимеры — состоящие из мономеров, называемых аминокислотами . Аминокислота состоит из альфа-атома углерода, присоединенного к аминогруппе , –NH 2 , карбоксильной группы, –COOH (хотя они существуют как –NH 3 + и –COO − в физиологических условиях), простого атома водорода и боковой цепи, обычно обозначаемой как «–R». Боковая цепь «R» различна для каждой аминокислоты, из которых существует 20 стандартных . Именно эта группа «R» делает каждую аминокислоту разной, а свойства боковых цепей в значительной степени влияют на общую трехмерную конформацию белка. Некоторые аминокислоты выполняют функции сами по себе или в измененной форме; например, глутамат выполняет функции важного нейромедиатора . Аминокислоты могут быть соединены с помощью пептидной связи . В этом синтезе дегидратации молекула воды удаляется, и пептидная связь соединяет азот аминогруппы одной аминокислоты с углеродом карбоксильной группы другой. Полученная молекула называется дипептидом , а короткие отрезки аминокислот (обычно менее тридцати) называются пептидами или полипептидами . Более длинные отрезки заслуживают названия белков . Например, важный белок сыворотки крови альбумин содержит 585 аминокислотных остатков . [43]


Белки могут иметь структурные и/или функциональные роли. Например, движения белков актина и миозина в конечном итоге отвечают за сокращение скелетных мышц. Одно свойство многих белков заключается в том, что они специфически связываются с определенной молекулой или классом молекул — они могут быть чрезвычайно избирательны в том, что они связывают. Антитела являются примером белков, которые прикрепляются к одному определенному типу молекул. Антитела состоят из тяжелых и легких цепей. Две тяжелые цепи будут связаны с двумя легкими цепями через дисульфидные связи между их аминокислотами. Антитела специфичны через вариации, основанные на различиях в N-концевом домене. [44]
Иммуноферментный анализ (ИФА), который использует антитела, является одним из самых чувствительных тестов, которые современная медицина использует для обнаружения различных биомолекул. Однако, вероятно, наиболее важными белками являются ферменты . Практически каждая реакция в живой клетке требует фермента для снижения энергии активации реакции. Эти молекулы распознают определенные молекулы реагентов, называемые субстратами ; затем они катализируют реакцию между ними. Снижая энергию активации , фермент ускоряет эту реакцию со скоростью 10 11 или более; реакция, которая обычно занимает более 3000 лет, чтобы завершиться спонтанно, может занять менее секунды с ферментом. Сам фермент не используется в этом процессе и может свободно катализировать ту же самую реакцию с новым набором субстратов. Используя различные модификаторы, можно регулировать активность фермента, что позволяет контролировать биохимию клетки в целом.
Структура белков традиционно описывается в иерархии из четырех уровней. Первичная структура белка состоит из его линейной последовательности аминокислот; например, «аланин-глицин-триптофан-серин-глутамат-аспарагин-глицин-лизин-...». Вторичная структура связана с локальной морфологией (морфология является изучением структуры). Некоторые комбинации аминокислот будут иметь тенденцию сворачиваться в спираль, называемую α-спиралью , или в лист, называемый β-листом ; некоторые α-спирали можно увидеть на схеме гемоглобина выше. Третичная структура представляет собой всю трехмерную форму белка. Эта форма определяется последовательностью аминокислот. Фактически, одно изменение может изменить всю структуру. Альфа-цепь гемоглобина содержит 146 аминокислотных остатков; замена остатка глутамата в положении 6 на остаток валина настолько изменяет поведение гемоглобина, что это приводит к серповидноклеточной анемии . Наконец, четвертичная структура касается структуры белка с несколькими пептидными субъединицами, как гемоглобин с его четырьмя субъединицами. Не все белки имеют более одной субъединицы. [45]


Принятые внутрь белки обычно расщепляются на отдельные аминокислоты или дипептиды в тонком кишечнике , а затем всасываются. Затем они могут быть объединены для образования новых белков. Промежуточные продукты гликолиза, цикла лимонной кислоты и пентозофосфатного пути могут быть использованы для образования всех двадцати аминокислот, и большинство бактерий и растений обладают всеми необходимыми ферментами для их синтеза. Однако люди и другие млекопитающие могут синтезировать только половину из них. Они не могут синтезировать изолейцин , лейцин , лизин , метионин , фенилаланин , треонин , триптофан и валин . Поскольку они должны быть усвоены, это незаменимые аминокислоты . Млекопитающие обладают ферментами для синтеза аланина , аспарагина , аспартата , цистеина , глутамата , глутамина , глицина , пролина , серина и тирозина — заменимых аминокислот. Хотя они могут синтезировать аргинин и гистидин , они не могут производить их в достаточных количествах для молодых растущих животных, поэтому их часто считают незаменимыми аминокислотами.
Если аминогруппа удаляется из аминокислоты, она оставляет углеродный скелет, называемый α - кетокислотой . Ферменты, называемые трансаминазами, могут легко переносить аминогруппу с одной аминокислоты (делая ее α-кетокислотой) на другую α-кетокислоту (делая ее аминокислотой). Это важно в биосинтезе аминокислот, так как для многих путей промежуточные продукты из других биохимических путей преобразуются в скелет α-кетокислоты, а затем добавляется аминогруппа, часто посредством трансаминирования . Затем аминокислоты могут быть связаны вместе, образуя белок.
Похожий процесс используется для расщепления белков. Сначала он гидролизуется до его составляющих аминокислот. Свободный аммиак (NH3), существующий в виде иона аммония (NH4+) в крови, токсичен для форм жизни. Поэтому должен существовать подходящий метод его выведения. У разных животных развились различные тактики в зависимости от потребностей животных. Одноклеточные организмы выделяют аммиак в окружающую среду. Аналогично, костистые рыбы могут выделять аммиак в воду, где он быстро разбавляется. В целом, млекопитающие преобразуют аммиак в мочевину через цикл мочевины .
Чтобы определить, связаны ли два белка, или, другими словами, решить, являются ли они гомологичными или нет, ученые используют методы сравнения последовательностей. Такие методы, как выравнивание последовательностей и структурное выравнивание, являются мощными инструментами, которые помогают ученым выявлять гомологии между родственными молекулами. Значимость поиска гомологии среди белков выходит за рамки формирования эволюционной модели семейств белков . Выявляя, насколько похожи две белковые последовательности, мы получаем знания об их структуре и, следовательно, об их функции.

Нуклеиновые кислоты , так называемые из-за их распространенности в клеточных ядрах , являются общим названием семейства биополимеров . Они представляют собой сложные, высокомолекулярные биохимические макромолекулы, которые могут передавать генетическую информацию во всех живых клетках и вирусах. [2] Мономеры называются нуклеотидами , и каждый состоит из трех компонентов: азотистого гетероциклического основания ( пурина или пиримидина ), пентозного сахара и фосфатной группы. [46]

Наиболее распространенными нуклеиновыми кислотами являются дезоксирибонуклеиновая кислота (ДНК) и рибонуклеиновая кислота (РНК). Фосфатная группа и сахар каждого нуклеотида связываются друг с другом, образуя остов нуклеиновой кислоты, в то время как последовательность азотистых оснований хранит информацию. Наиболее распространенными азотистыми основаниями являются аденин , цитозин , гуанин , тимин и урацил . Азотистые основания каждой цепи нуклеиновой кислоты будут образовывать водородные связи с определенными другими азотистыми основаниями в комплементарной цепи нуклеиновой кислоты. Аденин связывается с тимином и урацилом, тимин связывается только с аденином, а цитозин и гуанин могут связываться только друг с другом. Аденин, тимин и урацил содержат две водородные связи, в то время как водородные связи, образованные между цитозином и гуанином, составляют три.
Помимо генетического материала клетки, нуклеиновые кислоты часто играют роль вторичных мессенджеров , а также формируют базовую молекулу для аденозинтрифосфата (АТФ), первичной молекулы-переносчика энергии, обнаруженной во всех живых организмах. Кроме того, азотистые основания, возможные в двух нуклеиновых кислотах, различны: аденин, цитозин и гуанин встречаются как в РНК, так и в ДНК, тогда как тимин встречается только в ДНК, а урацил встречается в РНК.
Глюкоза является источником энергии в большинстве форм жизни. Например, полисахариды расщепляются на мономеры ферментами ( гликогенфосфорилаза удаляет остатки глюкозы из гликогена, полисахарида). Дисахариды, такие как лактоза или сахароза, расщепляются на два компонента моносахариды. [47]
Глюкоза в основном метаболизируется очень важным десятиступенчатым путем , называемым гликолизом , конечным результатом которого является расщепление одной молекулы глюкозы на две молекулы пирувата . Это также производит чистые две молекулы АТФ , энергетической валюты клеток, вместе с двумя восстановительными эквивалентами преобразования НАД + (никотинамидадениндинуклеотид: окисленная форма) в НАДН (никотинамидадениндинуклеотид: восстановленная форма). Для этого не требуется кислород; если кислород отсутствует (или клетка не может использовать кислород), НАД восстанавливается путем преобразования пирувата в лактат (молочную кислоту) (например, у людей) или в этанол плюс углекислый газ (например, у дрожжей ). Другие моносахариды, такие как галактоза и фруктоза, могут быть преобразованы в промежуточные продукты гликолитического пути. [48]
В аэробных клетках с достаточным количеством кислорода , как и в большинстве клеток человека, пируват далее метаболизируется. Он необратимо преобразуется в ацетил-КоА , выделяя один атом углерода в качестве побочного продукта углекислого газа , генерируя другой восстановительный эквивалент в виде НАДН . Две молекулы ацетил-КоА (из одной молекулы глюкозы) затем входят в цикл лимонной кислоты , производя две молекулы АТФ, еще шесть молекул НАДН и два восстановленных (убихинона) (через ФАДН 2 как связанный с ферментом кофактор), и высвобождая оставшиеся атомы углерода в виде углекислого газа. Произведенные молекулы НАДН и хинола затем поступают в ферментные комплексы дыхательной цепи, системы переноса электронов, в конечном итоге передающей электроны кислороду и сохраняющей высвобождаемую энергию в виде протонного градиента через мембрану ( внутренняя митохондриальная мембрана у эукариот). Таким образом, кислород восстанавливается до воды, а исходные акцепторы электронов НАД + и хинон регенерируются. Вот почему люди вдыхают кислород и выдыхают углекислый газ. Энергия, высвобождаемая при переносе электронов из высокоэнергетических состояний в NADH и хиноле, сначала сохраняется в виде протонного градиента и преобразуется в АТФ через АТФ-синтазу. Это генерирует дополнительные 28 молекул АТФ (24 из 8 NADH + 4 из 2 хинолов), что в общей сложности составляет 32 молекулы АТФ, сохраняемые на каждую деградированную глюкозу (две из гликолиза + две из цитратного цикла). [49] Очевидно, что использование кислорода для полного окисления глюкозы обеспечивает организм гораздо большим количеством энергии, чем любая независимая от кислорода метаболическая функция, и это, как полагают, является причиной того, что сложная жизнь появилась только после того, как атмосфера Земли накопила большое количество кислорода.
У позвоночных энергично сокращающиеся скелетные мышцы (например, во время поднятия тяжестей или бега на короткие дистанции) не получают достаточного количества кислорода для удовлетворения потребности в энергии, и поэтому они переходят на анаэробный метаболизм , преобразуя глюкозу в лактат. Сочетание глюкозы из неуглеводного происхождения, такого как жир и белки. Это происходит только тогда, когда запасы гликогена в печени израсходованы. Путь является критическим обращением гликолиза от пирувата к глюкозе и может использовать многие источники, такие как аминокислоты, глицерин и цикл Кребса . Крупномасштабный катаболизм белков и жиров обычно происходит, когда те страдают от голода или определенных эндокринных расстройств. [50] Печень регенерирует глюкозу, используя процесс, называемый глюконеогенезом . Этот процесс не совсем противоположен гликолизу и на самом деле требует в три раза больше энергии, полученной от гликолиза (используется шесть молекул АТФ по сравнению с двумя, полученными при гликолизе). Аналогично вышеприведенным реакциям, произведенная глюкоза может затем подвергаться гликолизу в тканях, которым нужна энергия, храниться в виде гликогена (или крахмала в растениях) или преобразовываться в другие моносахариды или соединяться в ди- или олигосахариды. Объединенные пути гликолиза во время упражнений, перехода лактата через кровоток в печень, последующего глюконеогенеза и высвобождения глюкозы в кровоток называются циклом Кори . [51]

Исследователи в области биохимии используют специфические методы, присущие биохимии, но все чаще объединяют их с методами и идеями, разработанными в области генетики , молекулярной биологии и биофизики . Между этими дисциплинами нет четкой границы. Биохимия изучает химию, необходимую для биологической активности молекул, молекулярная биология изучает их биологическую активность, генетика изучает их наследственность, которая, как оказалось, передается их геномом . Это показано на следующей схеме, которая изображает один из возможных взглядов на отношения между областями:
{{cite book}}: CS1 maint: multiple names: authors list (link)