_(6982162417).jpg/440px-Inspecting_a_Drug_Manufacturer_(FDA034)_(6982162417).jpg)
Фармацевтическая промышленность — это отрасль, связанная с медициной , которая открывает, разрабатывает, производит и продает фармацевтические товары для использования в качестве лекарств , которые действуют, будучи введенными (или введенными самостоятельно ) пациентами, использующими такие лекарства с целью лечения и/или предотвращения заболеваний (а также, возможно, облегчения симптомов заболевания и/или травмы ). [1] [2] Фармацевтические компании могут иметь дело с « дженериковыми » лекарствами и медицинскими устройствами без участия интеллектуальной собственности , с « брендовыми » материалами, которые специально привязаны к истории данной компании, или с тем и другим в разных контекстах. Отрасль имеет различные подразделения (которые включают в себя отдельные области, такие как производство биопрепаратов ), все они подчиняются различным законам и правилам , которые регулируют целые финансовые процессы, включая патентование , тестирование эффективности, оценку безопасности и маркетинг этих лекарств. В 2020 году на мировом фармацевтическом рынке было произведено лекарств на общую сумму 1 228,45 млрд долларов США, что свидетельствует о среднегодовом темпе роста (CAGR) в 1,8% с учетом результатов недавних событий (включая пандемию COVID-19 ). [3]
В историческом плане фармацевтическая промышленность как интеллектуальная концепция возникла в середине-конце 1800-х годов в некоторых национальных государствах с развитой экономикой, таких как Германия , Швейцария и Соединенные Штаты, поскольку многочисленные предприятия, занимающиеся синтетической органической химией , такие как ряд фирм, производящих красители, полученные из каменноугольной смолы в больших масштабах, искали новые применения своих искусственных материалов с точки зрения здоровья человека . Эта тенденция к увеличению капиталовложений произошла одновременно с научным изучением патологии как области, значительно продвинувшейся вперед, и различные предприятия установили отношения сотрудничества с академическими лабораториями, оценивающими человеческие травмы и заболевания. Примерами промышленных компаний с фармацевтической направленностью, которые сохранились до наших дней после столь отдаленного начала, являются Bayer (базирующаяся в Германии) и Pfizer (базирующаяся в США). [4]
Современная эра фармацевтической промышленности началась с местных аптекарей, которые расширили свою традиционную роль по распространению растительных препаратов, таких как морфин и хинин, до оптового производства в середине 1800-х годов, а также с открытий, полученных в результате прикладных исследований. Преднамеренное открытие лекарств из растений началось с выделения между 1803 и 1805 годами морфина — анальгетика и снотворного — из опиума немецким помощником аптекаря Фридрихом Сертюрнером , который назвал это соединение в честь греческого бога сновидений Морфея . [5] К концу 1880-х годов немецкие производители красителей усовершенствовали очистку отдельных органических соединений из смолы и других минеральных источников, а также создали элементарные методы в органическом химическом синтезе . [4] Развитие методов синтетической химии позволило ученым систематически изменять структуру химических веществ, а развитие зарождающейся науки фармакологии расширило их возможности по оценке биологических эффектов этих структурных изменений. [ требуется ссылка ]
К 1890-м годам было обнаружено глубокое воздействие экстрактов надпочечников на многие различные типы тканей, что положило начало поиску как механизма химической сигнализации, так и попыткам использовать эти наблюдения для разработки новых лекарств. Повышение артериального давления и сосудосуживающее действие экстрактов надпочечников представляли особый интерес для хирургов как кровоостанавливающие средства и как средство лечения шока, и ряд компаний разработали продукты на основе экстрактов надпочечников, содержащих различную чистоту активного вещества. В 1897 году Джон Абель из Университета Джонса Хопкинса идентифицировал активное начало как адреналин , который он выделил в неочищенном состоянии в виде сульфатной соли. Промышленный химик Дзёкичи Такамине позже разработал метод получения адреналина в чистом виде и лицензировал технологию компании Parke-Davis . Parke-Davis продавала адреналин под торговым названием Адреналин . Инъекционный адреналин оказался особенно эффективным для лечения острых приступов астмы , а ингаляционная версия продавалась в Соединенных Штатах до 2011 года ( Primatene Mist ). [6] [7] К 1929 году адреналин был разработан в виде ингалятора для использования при лечении заложенности носа.
Несмотря на высокую эффективность, необходимость инъекций ограничивала использование адреналина [ необходимо разъяснение ], и были найдены перорально активные производные. Структурно похожее соединение, эфедрин , было идентифицировано японскими химиками на заводе Ma Huang и выпущено на рынок Eli Lilly в качестве перорального лечения астмы. После работы Генри Дейла и Джорджа Баргера в Burroughs-Wellcome , академический химик Гордон Аллес синтезировал амфетамин и испытал его на пациентах с астмой в 1929 году. Препарат, как оказалось, имел лишь скромные противоастматические эффекты, но вызывал ощущения возбуждения и сердцебиения. Амфетамин был разработан Смитом, Кляйном и Френчем как назальное сосудосуживающее средство под торговым названием бензедриновый ингалятор. В конечном итоге амфетамин был разработан для лечения нарколепсии , постэнцефалитического паркинсонизма и повышения настроения при депрессии и других психиатрических показаниях. В 1937 году он получил одобрение Американской медицинской ассоциации как новое и неофициальное средство для этих целей [8] и оставался широко распространенным средством лечения депрессии до разработки трициклических антидепрессантов в 1960-х годах [7] .

В 1903 году Герман Эмиль Фишер и Йозеф фон Меринг раскрыли свое открытие, что диэтилбарбитуровая кислота, образующаяся в результате реакции диэтилмалоновой кислоты, оксихлорида фосфора и мочевины, вызывает сон у собак. Открытие было запатентовано и лицензировано Bayer Pharmaceuticals , которая продавала соединение под торговым названием Veronal как снотворное, начиная с 1904 года. Систематические исследования влияния структурных изменений на силу и продолжительность действия привели к открытию фенобарбитала в Bayer в 1911 году и открытию его мощной противоэпилептической активности в 1912 году. Фенобарбитал был одним из наиболее широко используемых препаратов для лечения эпилепсии в 1970-х годах и по состоянию на 2014 год остается в списке основных лекарственных средств Всемирной организации здравоохранения. [9] [10] В 1950-х и 1960-х годах возросла осведомленность о вызывающих привыкание свойствах и потенциале злоупотребления барбитуратами и амфетаминами, что привело к ужесточению ограничений на их использование и усилению государственного надзора за врачами, выписывающими рецепты. Сегодня амфетамин в значительной степени ограничен для использования при лечении синдрома дефицита внимания , а фенобарбитал — при лечении эпилепсии . [11] [12]
В 1958 году Лео Штернбах открыл первый бензодиазепин , хлордиазепоксид (Либриум). Были разработаны и используются десятки других бензодиазепинов, некоторые из наиболее популярных препаратов - диазепам (Валиум), алпразолам (Ксанакс), клоназепам (Клонопин) и лоразепам (Ативан). Благодаря своей гораздо более высокой безопасности и терапевтическим свойствам бензодиазепины в значительной степени заменили использование барбитуратов в медицине, за исключением некоторых особых случаев. Когда позже было обнаружено, что бензодиазепины, как и барбитураты, значительно теряют свою эффективность и могут иметь серьезные побочные эффекты при длительном приеме, Хизер Эштон исследовала зависимость от бензодиазепинов и разработала протокол прекращения их использования. [ необходима цитата ]
Серия экспериментов, проведенных с конца 1800-х до начала 1900-х годов, показала, что диабет вызван отсутствием вещества, обычно вырабатываемого поджелудочной железой. В 1869 году Оскар Минковский и Йозеф фон Меринг обнаружили, что диабет можно вызвать у собак путем хирургического удаления поджелудочной железы. В 1921 году канадский профессор Фредерик Бантинг и его студент Чарльз Бест повторили это исследование и обнаружили, что инъекции экстракта поджелудочной железы устраняют симптомы, вызванные удалением поджелудочной железы. Вскоре было продемонстрировано, что экстракт действует на людей, но развитие инсулинотерапии как обычной медицинской процедуры было отложено из-за трудностей с производством материала в достаточном количестве и с воспроизводимой чистотой. Исследователи обратились за помощью к промышленным партнерам в Eli Lilly and Co., основываясь на опыте компании в области крупномасштабной очистки биологических материалов. Химик Джордж Б. Уолден из Eli Lilly and Company обнаружил, что тщательная регулировка pH экстракта позволяет производить относительно чистый класс инсулина. Под давлением Университета Торонто и потенциального патентного оспаривания со стороны академических ученых, которые независимо разработали аналогичный метод очистки, было достигнуто соглашение о неисключительном производстве инсулина несколькими компаниями. До открытия и широкого распространения инсулиновой терапии продолжительность жизни диабетиков составляла всего несколько месяцев. [13]
Разработка лекарств для лечения инфекционных заболеваний была основным направлением ранних исследований и разработок; в 1900 году пневмония, туберкулез и диарея были тремя основными причинами смерти в Соединенных Штатах, а смертность в первый год жизни превышала 10%. [14] [15] [ проверка не удалась ]
В 1911 году Пауль Эрлих и химик Альфред Бертхайм из Института экспериментальной терапии в Берлине разработали арсфенамин , первый синтетический противоинфекционный препарат. Препарату было дано коммерческое название сальварсан. [16] Эрлих, отметив как общую токсичность мышьяка , так и избирательное поглощение некоторых красителей бактериями, выдвинул гипотезу, что краситель, содержащий мышьяк, с аналогичными свойствами избирательного поглощения может быть использован для лечения бактериальных инфекций. Арсфенамин был получен в рамках кампании по синтезу серии таких соединений и, как было обнаружено, проявляет частично избирательную токсичность. Арсфенамин оказался первым эффективным средством лечения сифилиса , болезни, которая до тех пор была неизлечимой и неизбежно приводила к тяжелым изъязвлениям кожи, неврологическим повреждениям и смерти. [17]
Подход Эрлиха к систематическому изменению химической структуры синтетических соединений и измерению эффектов этих изменений на биологическую активность широко использовался промышленными учеными, включая ученых Bayer Йозефа Кларера, Фрица Митча и Герхарда Домагка . Эта работа, также основанная на тестировании соединений, доступных в немецкой красильной промышленности, привела к разработке Пронтозила , первого представителя класса сульфонамидных антибиотиков . По сравнению с арсфенамином, сульфонамиды имели более широкий спектр действия и были гораздо менее токсичными, что делало их полезными при инфекциях, вызванных такими патогенами, как стрептококки . [18] В 1939 году Домагк получил Нобелевскую премию по медицине за это открытие. [19] [20] Тем не менее, резкое снижение смертности от инфекционных заболеваний, произошедшее до Второй мировой войны, было в первую очередь результатом улучшения мер общественного здравоохранения, таких как чистая вода и менее перенаселенное жилье, а влияние противоинфекционных препаратов и вакцин было значительным, в основном, после Второй мировой войны. [21] [22]
В 1928 году Александр Флеминг открыл антибактериальные эффекты пенициллина , но его использование для лечения человеческих болезней ожидало разработки методов его крупномасштабного производства и очистки. Они были разработаны консорциумом фармацевтических компаний под руководством правительства США и Великобритании во время мировой войны. [23]
В течение этого периода наблюдался ранний прогресс в разработке вакцин, в первую очередь в форме академических и финансируемых правительством фундаментальных исследований, направленных на выявление патогенов, ответственных за распространенные инфекционные заболевания. В 1885 году Луи Пастер и Пьер Поль Эмиль Ру создали первую вакцину против бешенства . Первые вакцины против дифтерии были произведены в 1914 году из смеси дифтерийного токсина и антитоксина (полученного из сыворотки инокулированного животного), но безопасность прививки была незначительной, и она не получила широкого распространения. В 1921 году в Соединенных Штатах было зарегистрировано 206 000 случаев дифтерии, что привело к 15 520 смертельным исходам. В 1923 году параллельные усилия Гастона Рамона из Института Пастера и Александра Гленни из Исследовательских лабораторий Уэллкома (позже часть GlaxoSmithKline ) привели к открытию того, что более безопасную вакцину можно получить, обработав дифтерийный токсин формальдегидом . [ 24] В 1944 году Морис Хиллеман из Squibb Pharmaceuticals разработал первую вакцину против японского энцефалита . [25] Позднее Хиллеман перешел в Merck , где сыграл ключевую роль в разработке вакцин против кори , эпидемического паротита , ветряной оспы , краснухи , гепатита А , гепатита В и менингита .

До 20 века лекарства, как правило, производились мелкими производителями с небольшим регулирующим контролем над производством или заявлениями о безопасности и эффективности. В той степени, в которой такие законы существовали, исполнение было слабым. В Соединенных Штатах усиление регулирования вакцин и других биологических препаратов было вызвано вспышками столбняка и смертями, вызванными распространением зараженной вакцины против оспы и дифтерийного антитоксина. [26] Закон о контроле над биологическими препаратами 1902 года требовал, чтобы федеральное правительство выдавало предварительное одобрение для каждого биологического препарата, а также для процесса и предприятия, производящего такие препараты. За этим в 1906 году последовал Закон о чистых пищевых продуктах и лекарствах , который запрещал межгосударственное распространение фальсифицированных или неправильно маркированных продуктов питания и лекарств. Лекарство считалось неправильно маркированным, если оно содержало алкоголь, морфин, опиум, кокаин или любой из нескольких других потенциально опасных или вызывающих привыкание препаратов, и если на его этикетке не было указано количество или пропорция таких препаратов. Попытки правительства использовать закон для преследования производителей за необоснованные заявления об эффективности были подорваны постановлением Верховного суда, ограничивающим полномочия федерального правительства по обеспечению соблюдения закона случаями неправильной спецификации ингредиентов препарата. [27]
В 1937 году более 100 человек умерли после приема « Эликсира сульфаниламида », произведенного компанией SE Massengill Company из Теннесси. Продукт был разработан на основе диэтиленгликоля , высокотоксичного растворителя, который в настоящее время широко используется в качестве антифриза. [28] Согласно законам, существовавшим в то время, судебное преследование производителя было возможно только на основании того, что продукт был назван «эликсиром», что буквально подразумевало раствор в этаноле. В ответ на этот эпизод Конгресс США принял Федеральный закон о пищевых продуктах, лекарственных средствах и косметике 1938 года , который впервые потребовал предпродажной демонстрации безопасности перед продажей препарата и прямо запретил ложные терапевтические заявления. [29]
После Второй мировой войны произошел взрыв в открытии новых классов антибактериальных препаратов [30], включая цефалоспорины (разработанные Eli Lilly на основе основополагающих работ Джузеппе Бротцу и Эдварда Абрахама ), [31] [32] стрептомицин (открытый в ходе финансируемой Merck исследовательской программы в лаборатории Селмана Ваксмана [33] ), тетрациклины [34] (открытые в Lederle Laboratories, ныне являющейся частью Pfizer ), эритромицин (открытый в Eli Lilly and Co.) [35] и их распространение на все более широкий спектр бактериальных патогенов. Стрептомицин, открытый в ходе финансируемой Merck исследовательской программы в лаборатории Селмана Ваксмана в Ратгерсе в 1943 году, стал первым эффективным средством лечения туберкулеза. На момент его открытия санатории для изоляции больных туберкулезом были повсеместным явлением в городах развитых стран, и 50% из них умирали в течение 5 лет после поступления. [33] [36]
В отчете Федеральной торговой комиссии, выпущенном в 1958 году, была предпринята попытка количественно оценить влияние разработки антибиотиков на американское общественное здравоохранение. В отчете было установлено, что за период с 1946 по 1955 год наблюдалось 42%-ное снижение заболеваемости болезнями, при которых антибиотики были эффективны, и только 20%-ное снижение тех, при которых антибиотики не были эффективны. В отчете сделан вывод, что «похоже, что использование антибиотиков, ранняя диагностика и другие факторы ограничили распространение эпидемии и, таким образом, количество этих заболеваний, которые произошли». Исследование далее изучило показатели смертности от восьми распространенных заболеваний, при которых антибиотики предлагали эффективную терапию (сифилис, туберкулез, дизентерия, скарлатина, коклюш, менингококковые инфекции и пневмония), и обнаружило 56%-ное снижение за тот же период. [37] Среди них следует отметить 75%-ное снижение смертности от туберкулеза. [38]
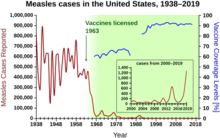

В 1940–1955 годах темпы снижения смертности в США ускорились с 2% в год до 8% в год, а затем вернулись к историческому показателю в 2% в год. Резкое снижение в первые послевоенные годы объясняется быстрым развитием новых методов лечения и вакцин от инфекционных заболеваний, которое произошло в эти годы. [40] [22] Разработка вакцин продолжала ускоряться, и наиболее заметным достижением этого периода стала разработка Джонасом Солком в 1954 году вакцины против полиомиелита при финансировании некоммерческого Национального фонда детского паралича . Процесс вакцинации никогда не был запатентован, а вместо этого был передан фармацевтическим компаниям для производства в качестве недорогого дженерика . В 1960 году Морис Хиллеман из Merck Sharp & Dohme идентифицировал вирус SV40 , который, как позже было показано, вызывает опухоли у многих видов млекопитающих. Позже было установлено, что SV40 присутствовал в качестве загрязнителя в партиях вакцины от полиомиелита, которые были введены 90% детей в Соединенных Штатах. [41] [42] Загрязнение, по-видимому, возникло как в исходном запасе клеток, так и в тканях обезьян, используемых для производства. В 2004 году Национальный институт рака объявил, что он пришел к выводу, что SV40 не связан с раком у людей. [43]
Другие известные новые вакцины того периода включают вакцины от кори (1962, Джон Франклин Эндерс из Детского медицинского центра в Бостоне, позже усовершенствованные Морисом Хиллеманом из Merck), краснухи (1969, Хиллеманом, Merck) и эпидемического паротита (1967, Хиллеман, Merck) [44] Заболеваемость краснухой, синдромом врожденной краснухи, корью и паротитом в Соединенных Штатах снизилась более чем на 95% сразу после широкомасштабной вакцинации. [45] Первые 20 лет лицензированной вакцинации от кори в США предотвратили, по оценкам, 52 миллиона случаев заболевания, 17 400 случаев умственной отсталости и 5200 смертей. [46]
Гипертония является фактором риска атеросклероза, [47] сердечной недостаточности , [48] ишемической болезни сердца , [49] [50] инсульта , [51] заболеваний почек , [52] [53] и заболеваний периферических артерий , [54] [55] и является наиболее важным фактором риска сердечно -сосудистой заболеваемости и смертности в промышленно развитых странах . [56] До 1940 года примерно 23% всех смертей среди людей старше 50 лет были связаны с гипертонией. Тяжелые случаи гипертонии лечились хирургическим путем. [57]
Ранние разработки в области лечения гипертонии включали блокаторы симпатической нервной системы на основе четвертичных аммониевых ионов, но эти соединения никогда не использовались широко из-за их серьезных побочных эффектов, поскольку долгосрочные последствия для здоровья высокого кровяного давления еще не были установлены, а также потому, что их приходилось вводить путем инъекций.
В 1952 году исследователи из Ciba открыли первый перорально доступный вазодилататор, гидралазин . [58] Основным недостатком монотерапии гидралазином было то, что он терял свою эффективность с течением времени ( тахифилаксия ). В середине 1950-х годов Карл Х. Бейер, Джеймс М. Спраг, Джон Э. Баер и Фредерик К. Новелло из Merck and Co. открыли и разработали хлоротиазид , который остается наиболее широко используемым антигипертензивным препаратом сегодня. [59] Это развитие было связано со значительным снижением уровня смертности среди людей с гипертонией. [60] Изобретатели были отмечены премией Ласкера в области общественного здравоохранения в 1975 году за «спасение неисчислимых тысяч жизней и облегчение страданий миллионов жертв гипертонии». [61]
Обзор Cochrane 2009 года пришел к выводу, что тиазидные антигипертензивные препараты снижают риск смерти ( RR 0,89), инсульта (RR 0,63), ишемической болезни сердца (RR 0,84) и сердечно-сосудистых событий (RR 0,70) у людей с высоким кровяным давлением. [62] В последующие годы были разработаны и нашли широкое применение в комбинированной терапии другие классы антигипертензивных препаратов, включая петлевые диуретики (Lasix/ furosemide , Hoechst Pharmaceuticals , 1963), [63] бета-блокаторы ( ICI Pharmaceuticals , 1964) [64] ингибиторы АПФ и блокаторы рецепторов ангиотензина . Ингибиторы АПФ снижают риск возникновения нового заболевания почек [RR 0,71] и смерти [RR 0,84] у пациентов с диабетом, независимо от того, страдают ли они гипертонией. [65]
До Второй мировой войны контроль рождаемости был запрещен во многих странах, а в Соединенных Штатах даже обсуждение методов контрацепции иногда приводило к судебному преследованию по законам Комстока . Таким образом, история разработки оральных контрацептивов тесно связана с движением за контроль рождаемости и усилиями активистов Маргарет Сэнгер , Мэри Деннетт и Эммы Голдман . На основе фундаментальных исследований, проведенных Грегори Пинкуса , и синтетических методов получения прогестерона, разработанных Карлом Джерасси в Syntex и Фрэнком Колтоном в GD Searle & Co. , первый оральный контрацептив, Эновид , был разработан GD Searle & Co. и одобрен FDA в 1960 году. Первоначальная формула включала значительно чрезмерные дозы гормонов и вызывала серьезные побочные эффекты. Тем не менее, к 1962 году 1,2 миллиона американских женщин принимали таблетки, а к 1965 году их число возросло до 6,5 миллионов. [66] [67] [68] [69] Доступность удобной формы временной контрацепции привела к кардинальным изменениям в общественных нравах, включая расширение спектра вариантов образа жизни, доступных женщинам, снижение зависимости женщин от мужчин в вопросах контрацепции, поощрение отсрочки вступления в брак и увеличение количества добрачных сожительств. [70]

В США призыв к пересмотру Закона о FD&C возник в результате слушаний в Конгрессе под руководством сенатора Эстеса Кефовера из Теннесси в 1959 году. Слушания охватывали широкий спектр политических вопросов, включая злоупотребления в рекламе, сомнительную эффективность лекарств и необходимость более строгого регулирования отрасли. В то время как импульс для нового законодательства временно ослабел из-за продолжительных дебатов, возникла новая трагедия, которая подчеркнула необходимость более всеобъемлющего регулирования и стала движущей силой для принятия новых законов.
12 сентября 1960 года американский лицензиат, компания William S. Merrell Company из Цинциннати, подала новую заявку на регистрацию препарата Кевадон ( талидомид ), седативного средства , которое продавалось в Европе с 1956 года. Медицинский сотрудник FDA, отвечающий за рассмотрение соединения, Фрэнсис Келси , считал, что данные, подтверждающие безопасность талидомида, были неполными. Фирма продолжала оказывать давление на Келси и FDA, чтобы они одобрили заявку до ноября 1961 года, когда препарат был снят с немецкого рынка из-за его связи с серьезными врожденными аномалиями. Несколько тысяч новорожденных в Европе и других странах пострадали от тератогенного действия талидомида. Без одобрения FDA фирма распространила Кевадон среди более чем 1000 врачей под видом исследовательского использования. В этом «исследовании» талидомид получили более 20 000 американцев, в том числе 624 беременные пациентки, и около 17 известных новорожденных пострадали от последствий приема препарата. [ необходима цитата ]
Трагедия с талидомидом воскресила законопроект Кефовера об усилении регулирования лекарственных средств, который застопорился в Конгрессе, и поправка Кефовера-Харриса стала законом 10 октября 1962 года. С этого момента производители должны были доказать FDA, что их препараты эффективны и безопасны, прежде чем они могли выйти на рынок США. FDA получила полномочия регулировать рекламу рецептурных препаратов и устанавливать надлежащую производственную практику . Закон требовал, чтобы все препараты, представленные между 1938 и 1962 годами, были эффективными. Совместное исследование FDA и Национальной академии наук показало, что почти 40 процентов этих продуктов были неэффективны. Аналогичное всестороннее исследование безрецептурных продуктов началось десять лет спустя. [71]
В 1971 году Акира Эндо , японский биохимик, работавший в фармацевтической компании Sankyo, идентифицировал мевастатин (ML-236B), молекулу, вырабатываемую грибком Penicillium citrinum , как ингибитор ГМГ-КоА-редуктазы, важнейшего фермента, используемого организмом для выработки холестерина. Испытания на животных показали очень хороший ингибирующий эффект, как и в клинических испытаниях , однако долгосрочное исследование на собаках обнаружило токсические эффекты при более высоких дозах, и в результате мевастатин считался слишком токсичным для использования человеком. Мевастатин никогда не продавался из-за его побочных эффектов в виде опухолей, ухудшения состояния мышц и иногда смерти у лабораторных собак.
P. Roy Vagelos , главный научный сотрудник и позднее генеральный директор Merck & Co , заинтересовался и совершил несколько поездок в Японию, начиная с 1975 года. К 1978 году Merck выделил ловастатин (мевинолин, MK803) из грибка Aspergillus terreus , впервые выпущенный на рынок в 1987 году под названием Mevacor. [72] [73] [74]
В апреле 1994 года были объявлены результаты спонсируемого Merck исследования Scandinavian Simvastatin Survival Study . Исследователи протестировали симвастатин , позже проданный Merck как Zocor, на 4444 пациентах с высоким уровнем холестерина и сердечными заболеваниями. Через пять лет исследование пришло к выводу, что у пациентов наблюдалось снижение уровня холестерина на 35%, а их шансы умереть от сердечного приступа снизились на 42%. [75] В 1995 году Zocor и Mevacor принесли Merck более 1 миллиарда долларов США. Эндо был награжден премией Японии 2006 года и премией Lasker-DeBakey Clinical Medical Research Award в 2008 году. За его «новаторское исследование нового класса молекул» для «снижения уровня холестерина» [ фрагмент предложения ] [76] [77]
В течение нескольких десятилетий биопрепараты приобретали все большую значимость по сравнению с лечением малыми молекулами. Биотехнологический подсектор, ветеринария и китайский фармацевтический сектор также существенно выросли. С организационной точки зрения крупные международные фармацевтические корпорации испытали существенное снижение своей доли стоимости. Кроме того, основной сектор дженериков (заменители непатентованных брендов) был обесценен из-за конкуренции. [78]
По оценкам Торрея, к февралю 2021 года рыночная стоимость фармацевтической промышленности составит 7,03 трлн долларов США, из которых 6,1 трлн долларов США — это стоимость публичных компаний. На долю малых молекул пришлось 58,2% доли оценки по сравнению с 84,6% в 2003 году. Биологические препараты выросли с 14,5% до 30,5%. Доля оценки китайской фармацевтики выросла с 2003 по 2021 год с 1% до 12%, обогнав Швейцарию, которая сейчас занимает 3-е место с 7,7%. У Соединенных Штатов по-прежнему самая дорогая фармацевтическая промышленность с 40% глобальной оценки. [79] 2023 год стал годом увольнений по меньшей мере 10 000 человек в 129 публичных биотехнологических компаниях по всему миру, хотя большинство из них были небольшими; это было значительное увеличение сокращений по сравнению с 2022 годом, что отчасти было обусловлено ухудшением мировых финансовых условий и сокращением инвестиций со стороны «инвесторов общего профиля». [80] Частные фирмы также столкнулись с существенным сокращением венчурных инвестиций в 2023 году, что продолжило тенденцию к снижению, начатую в 2021 году, что также привело к сокращению первичных публичных размещений акций . [80]
В статье 2022 года эта идея была кратко сформулирована следующим образом: «В бизнесе разработки лекарств сделки могут быть столь же важны, как и научные прорывы», обычно называемые фармацевтическими слияниями и поглощениями (M&A). [81] В ней подчеркивается, что некоторые из наиболее эффективных средств правовой защиты начала 21-го века стали возможны только благодаря слияниям и поглощениям, в частности, отмечены Кейтруда и Хумира . [81]
Открытие лекарств — это процесс, посредством которого потенциальные лекарства обнаруживаются или разрабатываются. В прошлом большинство лекарств открывались либо путем выделения активного ингредиента из традиционных средств, либо путем счастливого открытия. Современная биотехнология часто фокусируется на понимании метаболических путей, связанных с болезненным состоянием или патогеном , и манипулировании этими путями с помощью молекулярной биологии или биохимии . Большая часть ранних стадий открытия лекарств традиционно проводилась университетами и научно-исследовательскими институтами.
Разработка лекарств относится к действиям, предпринимаемым после того, как соединение идентифицировано как потенциальное лекарство, чтобы установить его пригодность в качестве лекарства. Цели разработки лекарств - определить соответствующую формулу и дозировку , а также установить безопасность . Исследования в этих областях обычно включают комбинацию исследований in vitro , исследований in vivo и клинических испытаний . Стоимость разработки на поздней стадии означает, что ее обычно выполняют более крупные фармацевтические компании. [82] Фармацевтическая и биотехнологическая промышленность тратит более 15% своих чистых продаж на исследования и разработки, что по сравнению с другими отраслями является самой высокой долей. [83]
Часто крупные многонациональные корпорации демонстрируют вертикальную интеграцию , участвуя в широком спектре исследований и разработок лекарственных препаратов, производства и контроля качества, маркетинга, продаж и дистрибуции. Более мелкие организации, с другой стороны, часто фокусируются на конкретном аспекте, таком как открытие кандидатов на лекарственные препараты или разработка формул. Часто соглашения о сотрудничестве между исследовательскими организациями и крупными фармацевтическими компаниями заключаются для изучения потенциала новых лекарственных веществ. В последнее время многонациональные корпорации все чаще полагаются на контрактные исследовательские организации для управления разработкой лекарственных препаратов. [84]
Открытие и разработка лекарств обходятся очень дорого; из всех соединений, исследованных для использования на людях, только небольшая часть в конечном итоге одобряется в большинстве стран назначенными правительством медицинскими учреждениями или советами, которые должны одобрить новые лекарства, прежде чем они могут быть проданы в этих странах. В 2010 году было одобрено 18 НМЭ (новых молекулярных сущностей) и три биологических препарата FDA, или 21 в общей сложности, что меньше, чем 26 в 2009 году и 24 в 2008 году. С другой стороны, в 2007 году было всего 18 одобрений, а в 2006 году — 22. С 2001 года Центр оценки и исследований лекарств в среднем получал 22,9 одобрений в год. [85] Это одобрение приходит только после крупных инвестиций в доклиническую разработку и клинические испытания , а также приверженности постоянному мониторингу безопасности . Лекарства, которые терпят неудачу на полпути этого процесса, часто влекут за собой большие расходы, не принося при этом никакой прибыли. Если принять во внимание стоимость этих неудачных лекарств, то стоимость разработки успешного нового лекарства ( нового химического вещества , или NCE) оценивается в 1,3 млрд долларов США [86] (не включая расходы на маркетинг ). Однако в 2012 году профессора Лайт и Лексчин сообщили, что уровень одобрения новых лекарств был относительно стабильным и составлял в среднем от 15 до 25 на протяжении десятилетий. [87]
Исследования и инвестиции в отрасль в целом достигли рекордных 65,3 млрд долларов в 2009 году. [88] Хотя стоимость исследований в США в период с 1995 по 2010 год составляла около 34,2 млрд долларов, доходы росли быстрее (за это время доходы выросли на 200,4 млрд долларов). [87]
Исследование консалтинговой фирмы Bain & Company показало, что стоимость открытия, разработки и запуска (включая маркетинговые и другие деловые расходы) нового препарата (вместе с перспективными препаратами, которые не прошли проверку) выросла за пятилетний период почти до 1,7 млрд долларов в 2003 году. [89] По данным Forbes, к 2010 году расходы на разработку составляли от 4 до 11 млрд долларов на препарат. [90]
Некоторые из этих оценок также учитывают альтернативную стоимость инвестирования капитала за много лет до получения доходов (см. Временная стоимость денег ). Из-за очень длительного времени, необходимого для открытия, разработки и одобрения фармацевтических препаратов, эти затраты могут накапливаться до почти половины общих расходов. Прямым следствием в цепочке создания стоимости фармацевтической промышленности является то, что крупные фармацевтические транснациональные корпорации имеют тенденцию все больше передавать на аутсорсинг риски, связанные с фундаментальными исследованиями, что несколько меняет экосистему отрасли, поскольку биотехнологические компании играют все более важную роль, и общие стратегии соответствующим образом пересматриваются. [91] Некоторые одобренные препараты, такие как те, которые основаны на переформулировке существующего активного ингредиента (также называемые расширениями линейки), гораздо менее затратны в разработке.
В Соединенных Штатах новые фармацевтические продукты должны быть одобрены Управлением по контролю за продуктами и лекарствами (FDA) как безопасные и эффективные. Этот процесс обычно включает подачу заявки на исследовательский новый препарат с достаточным количеством доклинических данных для поддержки продолжения испытаний на людях. После одобрения IND могут быть проведены три фазы постепенно увеличивающихся клинических испытаний на людях. Фаза I обычно изучает токсичность с использованием здоровых добровольцев. Фаза II может включать фармакокинетику и дозирование у пациентов, а фаза III представляет собой очень большое исследование эффективности в предполагаемой популяции пациентов. После успешного завершения испытаний фазы III в FDA подается заявка на новый препарат . FDA рассматривает данные, и если продукт рассматривается как имеющий положительную оценку пользы и риска, выдается разрешение на продажу продукта в США. [92]
Четвертая фаза пострегистрационного наблюдения также часто требуется из-за того, что даже самые крупные клинические испытания не могут эффективно предсказать распространенность редких побочных эффектов. Пострегистрационный надзор гарантирует, что после выхода на рынок безопасность препарата тщательно контролируется. В некоторых случаях его показания могут быть ограничены определенными группами пациентов, а в других случаях вещество полностью изымается с рынка.
FDA предоставляет информацию об одобренных препаратах на сайте Orange Book. [93]
В Великобритании Агентство по регулированию лекарственных средств и товаров медицинского назначения одобряет и оценивает препараты для использования. Обычно одобрение в Великобритании и других европейских странах приходит позже, чем в США. Затем Национальный институт здравоохранения и совершенствования медицинской помощи (NICE) для Англии и Уэльса решает, разрешит ли Национальная служба здравоохранения (NHS) (в смысле оплаты) их использование и каким образом. Британский национальный формуляр является основным руководством для фармацевтов и врачей.
Во многих западных странах, не входящих в США, возникло «четвертое препятствие» анализа эффективности затрат , прежде чем новые технологии могут быть предоставлены. Это фокусируется на «цене эффективности» (например, с точки зрения стоимости за QALY ) рассматриваемых технологий. В Англии и Уэльсе NICE решает, будут ли препараты и технологии предоставляться NHS и при каких обстоятельствах, в то время как аналогичные договоренности существуют с Scottish Medicines Consortium в Шотландии и Pharmaceutical Benefits Advisory Committee в Австралии. Продукт должен преодолеть порог эффективности затрат, чтобы быть одобренным. Лечение должно представлять собой «соотношение цены и качества» и чистую выгоду для общества.
Существуют специальные правила для некоторых редких заболеваний («сиротских заболеваний») в нескольких основных территориях регулирования лекарственных средств. Например, заболевания, затрагивающие менее 200 000 пациентов в Соединенных Штатах или более крупные группы населения в определенных обстоятельствах, подпадают под действие Закона об орфанных препаратах. [94] Поскольку медицинские исследования и разработки препаратов для лечения таких заболеваний финансово невыгодны, компании, которые этим занимаются, вознаграждаются налоговыми льготами, освобождением от пошлин и эксклюзивным правом на продажу этого препарата на ограниченное время (семь лет), независимо от того, защищен ли препарат патентами.
В 2011 году мировые расходы на рецептурные препараты превысили 954 млрд долларов, хотя в Европе и Северной Америке рост несколько замедлился. На Соединенные Штаты приходится более трети мирового фармацевтического рынка, с годовым объемом продаж в 340 млрд долларов, за ними следуют ЕС и Япония. [96] Развивающиеся рынки, такие как Китай, Россия, Южная Корея и Мексика, обогнали этот рынок, показав огромный рост в 81 процент. [97] [98]
Десять самых продаваемых препаратов 2013 года принесли в общей сложности 75,6 млрд долларов продаж, при этом противовоспалительный препарат Хумира стал самым продаваемым препаратом в мире с объемом продаж 10,7 млрд долларов. Вторым и третьим по продажам были Энбрел и Ремикейд соответственно. [99] Тремя самыми продаваемыми препаратами в Соединенных Штатах в 2013 году были Абилифай (6,3 млрд долларов), Нексиум (6 млрд долларов) и Хумира (5,4 млрд долларов). [100] Самый продаваемый препарат из когда-либо существовавших, Липитор , в среднем приносил 13 млрд долларов в год и принес в общей сложности 141 млрд долларов за весь период своего существования до истечения срока действия патента Pfizer в ноябре 2011 года.
IMS Health публикует анализ тенденций, ожидаемых в фармацевтической промышленности в 2007 году, включая рост прибыли в большинстве секторов, несмотря на потерю некоторых патентов, и появление новых «блокбастерных» препаратов на горизонте. [101]
В зависимости от ряда соображений компания может подать заявку и получить патент на препарат или процесс производства препарата, предоставляя исключительные права, как правило, на 20 лет. [102] Однако только после тщательного изучения и тестирования, которые в среднем занимают от 10 до 15 лет, государственные органы выдадут разрешение компании на маркетинг и продажу препарата. [103] Патентная защита позволяет владельцу патента возмещать расходы на исследования и разработки за счет высокой прибыли от фирменного препарата. Когда срок действия патентной защиты препарата истекает, конкурирующая компания обычно разрабатывает и продает дженерик . Разработка и одобрение дженериков обходится дешевле, что позволяет продавать их по более низкой цене. Часто владелец фирменного препарата представляет дженерик до истечения срока действия патента, чтобы получить преимущество на рынке дженериков. [104] Таким образом, реструктуризация стала обычным делом, вызванным истечением срока действия патентов на продукты, выпущенные в «золотую эру» отрасли в 1990-х годах, и неспособностью компаний разработать достаточное количество новых бестселлеров, чтобы заменить потерянные доходы. [105]
В США стоимость рецептов увеличилась за период с 1995 по 2005 год на 3,4 миллиарда долларов в год, увеличившись на 61 процент. Розничные продажи рецептурных препаратов подскочили на 250 процентов с 72 миллиардов долларов до 250 миллиардов долларов, в то время как средняя цена рецептов выросла более чем вдвое с 30 до 68 долларов. [106]
Реклама распространена в медицинских журналах, а также через более распространенные каналы СМИ. В некоторых странах, особенно в США, им разрешено рекламировать напрямую для широкой публики. Фармацевтические компании обычно нанимают продавцов (часто называемых «фармацевтическими представителями» или, более старый термин, «специалистами») для прямого и личного маркетинга врачам и другим поставщикам медицинских услуг. В некоторых странах, особенно в США, фармацевтические компании также нанимают лоббистов для влияния на политиков. Маркетинг рецептурных препаратов в США регулируется федеральным Законом о маркетинге рецептурных препаратов 1987 года . План фармацевтического маркетинга включает в себя планы расходов, каналы и идеи, которые выведут ассоциацию по лекарственным препаратам, ее пункты и администрации вперед на текущей сцене.
В книге «Плохая фарма» также обсуждается влияние представителей фармацевтических компаний, то, как фармацевтические компании нанимают авторов-призраков для написания статей для публикации учеными, насколько на самом деле независимы академические журналы, как фармацевтические компании финансируют непрерывное образование врачей и как группы пациентов часто финансируются промышленностью. [107]
Начиная с 1980-х годов, новые методы маркетинга рецептурных препаратов для потребителей стали важными. Прямая реклама в СМИ для потребителей была легализована в Руководстве FDA для промышленности по вещательной рекламе, направленной на потребителей.
Растет полемика вокруг фармацевтического маркетинга и влияния. Были выдвинуты обвинения и получены данные о влиянии на врачей и других медицинских работников через представителей фармацевтических компаний, включая постоянное предоставление маркетинговых «подарков» и предвзятой информации медицинским работникам; [108] широко распространенная реклама в журналах и на конференциях; финансирование независимых организаций здравоохранения и кампаний по пропаганде здорового образа жизни; лоббирование врачей и политиков (больше, чем в любой другой отрасли в США [109] ); спонсорство медицинских школ или обучения медсестер; спонсорство мероприятий непрерывного образования с влиянием на учебную программу; [110] и найм врачей в качестве оплачиваемых консультантов в медицинские консультативные советы.
Некоторые правозащитные организации, такие как No Free Lunch и AllTrials , критиковали влияние маркетинга лекарств на врачей, поскольку, по их словам, это склоняет врачей назначать продаваемые лекарства, даже если другие могут быть дешевле или лучше для пациента. [111]
Были высказаны обвинения в торговле болезнями [112] (чрезмерной медикализации) для расширения рынка лекарств. Первая конференция по этой теме состоялась в Австралии в 2006 году. [113] В 2009 году финансируемая правительством Национальная служба по назначению лекарств запустила программу «Поиск доказательств – распознавание шумихи», направленную на обучение врачей общей практики методам независимого анализа лекарств. [114]
Метаанализы показали, что психиатрические исследования, спонсируемые фармацевтическими компаниями, в несколько раз чаще дают положительные результаты, а если в них участвует сотрудник фармацевтической компании, эффект становится еще больше. [115] [116] [117] Влияние также распространилось на подготовку врачей и медсестер в медицинских школах, с чем ведется борьба.
Утверждалось, что разработка Диагностического и статистического руководства по психическим расстройствам и расширение критериев представляют собой растущую медикализацию человеческой природы или « торговлю болезнями », вызванную влиянием фармацевтических компаний на психиатрию. [118] Потенциал прямого конфликта интересов был повышен, отчасти потому, что примерно половина авторов, которые отбирали и определяли психические расстройства DSM-IV, имели или ранее имели финансовые отношения с фармацевтической промышленностью. [119]
В США, начиная с 2013 года, в соответствии с Отчетами о финансовой прозрачности врачей (часть Закона о солнечном свете), Центры по услугам Medicare и Medicaid должны собирать информацию от соответствующих производителей и организаций групповых закупок, чтобы сообщать информацию об их финансовых отношениях с врачами и больницами. Данные публикуются на веб-сайте Центров по услугам Medicare и Medicaid. Ожидается, что отношения между врачами и фармацевтической промышленностью станут полностью прозрачными. [120]
В отчете, подготовленном OpenSecrets , в 2017 году на фармацевтический бизнес в той или иной степени работало более 1100 лоббистов. В первом квартале 2017 года индустрия товаров для здоровья и фармацевтика потратила 78 миллионов долларов на лоббирование членов Конгресса США. [121]
Ценообразование на фармацевтические препараты становится серьезной проблемой для систем здравоохранения. [122] Исследование, проведенное West Health Policy Center в ноябре 2020 года, показало, что более 1,1 миллиона пожилых граждан, участвующих в программе Medicare в США , как ожидается, преждевременно умрут в течение следующего десятилетия, поскольку они не смогут позволить себе рецептурные препараты, что потребует дополнительных 17,7 миллиардов долларов, которые будут ежегодно тратиться на предотвратимые медицинские расходы из-за осложнений со здоровьем. [123]
Бен Голдакр утверждал, что регулирующие органы, такие как Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA) в Великобритании или Управление по контролю за продуктами питания и лекарственными средствами (FDA) в Соединенных Штатах, отстаивают интересы фармацевтических компаний, а не интересы общественности из-за кругового обмена сотрудниками между регулирующим органом и компаниями и развития дружеских отношений между регулирующим органом и сотрудниками компании. [124] Он утверждает, что регулирующие органы не требуют, чтобы новые препараты предлагали улучшение по сравнению с тем, что уже доступно, или даже чтобы они были особенно эффективными. [124]
Другие утверждают, что чрезмерное регулирование подавляет терапевтические инновации и что текущая стоимость требуемых регулятором клинических испытаний препятствует полному использованию новых генетических и биологических знаний для лечения человеческих заболеваний. В отчете Совета советников президента по науке и технологиям за 2012 год было сделано несколько ключевых рекомендаций по снижению бремени регулирования для разработки новых лекарств, включая 1) расширение использования FDA ускоренных процессов одобрения, 2) создание ускоренного пути одобрения для лекарств, предназначенных для использования в узко определенных группах населения, и 3) проведение пилотных проектов, направленных на оценку осуществимости нового, адаптивного процесса одобрения лекарств. [125]
Фармацевтическое мошенничество подразумевает обман, который приносит финансовую выгоду фармацевтической компании. Оно затрагивает отдельных лиц, а также государственные и частные страховые компании. Существует несколько различных схем [126], используемых для обмана системы здравоохранения , которые характерны для фармацевтической промышленности. К ним относятся: нарушения надлежащей производственной практики (GMP), маркетинг не по назначению, мошенничество с лучшими ценами, мошенничество с CME, отчетность о ценах Medicaid и изготовленные составные лекарства. [127] Из этой суммы 2,5 миллиарда долларов были возвращены в рамках дел о ложных исках в 2010 финансовом году. Примерами дел о мошенничестве являются урегулирование GlaxoSmithKline на 3 миллиарда долларов, урегулирование Pfizer на 2,3 миллиарда долларов и урегулирование Merck & Co на 650 миллионов долларов. Ущерб от мошенничества может быть возмещен с помощью Закона о ложных исках , чаще всего в соответствии с положениями qui tam , которые вознаграждают человека за то, что он является « осведомителем » или relator (закон) . [128]
Каждая крупная компания, продающая атипичные антипсихотики — Bristol-Myers Squibb , Eli Lilly and Company , Pfizer , AstraZeneca и Johnson & Johnson — либо урегулировала недавние правительственные дела в соответствии с Законом о ложных исках на сотни миллионов долларов, либо в настоящее время находится под следствием по поводу возможного мошенничества в сфере здравоохранения. После обвинений в незаконном маркетинге два из урегулирований установили рекорды в 2009 году по самым большим уголовным штрафам, когда-либо налагаемым на корпорации. Одно касалось антипсихотика Zyprexa компании Eli Lilly , а другое касалось Bextra , противовоспалительного препарата, используемого при артрите. В деле Bextra правительство также обвинило Pfizer в незаконном маркетинге другого антипсихотика, Geodon ; Pfizer урегулировала эту часть иска на сумму 301 миллион долларов, не признав никаких нарушений. [129]
2 июля 2012 года GlaxoSmithKline признала себя виновной в совершении уголовных преступлений и согласилась на урегулирование в размере 3 миллиардов долларов по самому крупному делу о мошенничестве в сфере здравоохранения в США и крупнейшему платежу фармацевтической компании. [130] Урегулирование связано с незаконным продвижением компанией рецептурных препаратов, ее непредставлением данных о безопасности, [131] подкупом врачей и продвижением лекарств для целей, на которые они не были лицензированы. Вовлеченными препаратами были Paxil , Wellbutrin , Advair , Lamictal и Zofran для непреднамеренных, не покрытых страховкой применений. Эти препараты, а также препараты Imitrex , Lotronex , Flovent и Valtrex были вовлечены в схему откатов . [132] [133] [134]
Ниже приведен список четырех крупнейших соглашений, достигнутых с фармацевтическими компаниями с 1991 по 2012 год, отсортированный по размеру общего соглашения. Юридические иски против фармацевтической промышленности значительно различались за последние два десятилетия, включая мошенничество с Medicare и Medicaid , несанкционированное продвижение и ненадлежащие производственные практики. [135] [136]
В мае 2015 года New England Journal of Medicine подчеркнул важность взаимодействия фармацевтической промышленности и врачей для разработки новых методов лечения и утверждал, что моральное возмущение по поводу должностных преступлений в отрасли неоправданно заставило многих переоценить проблемы, созданные финансовыми конфликтами интересов. В статье отмечалось, что крупные организации здравоохранения, такие как Национальный центр по развитию трансляционных наук Национальных институтов здравоохранения, Президентский совет консультантов по науке и технологиям, Всемирный экономический форум, Фонд Гейтса, Wellcome Trust и Управление по контролю за продуктами и лекарствами, поощряли более тесное взаимодействие между врачами и промышленностью с целью улучшения преимуществ для пациентов. [141] [142]
В ноябре 2020 года несколько фармацевтических компаний объявили об успешных испытаниях вакцин от COVID-19 с эффективностью профилактики инфекции от 90 до 95%. Согласно заявлениям компаний и данным, рассмотренным внешними аналитиками, эти вакцины стоят от 3 до 37 долларов за дозу. [143] The Wall Street Journal опубликовал редакционную статью, призывающую отметить это достижение Нобелевской премией мира. [144]
Врачи без границ предупредили, что высокие цены и монополии на лекарства, тесты и вакцины продлят пандемию и будут стоить жизней. Они призвали правительства предотвратить спекуляцию, используя при необходимости принудительные лицензии , как это уже сделали Канада, Чили, Эквадор, Германия и Израиль. [145]
20 февраля 46 американских законодателей призвали правительство США не предоставлять монопольные права при распределении денег налогоплательщиков на разработку вакцин и методов лечения коронавируса, чтобы избежать предоставления частным производителям исключительного контроля над ценами и доступностью. [146]
В Соединенных Штатах правительство подписало соглашения, в которых субсидировались исследования и разработки и/или строительство производственных предприятий для потенциальных терапевтических средств от COVID-19. Обычно соглашение предполагало, что правительство брало на себя право собственности на определенное количество доз продукта без дальнейшей оплаты. Например, под эгидой Operation Warp Speed в Соединенных Штатах правительство субсидировало исследования, связанные с вакцинами и терапевтическими средствами от COVID-19 в Regeneron, [147] Johnson and Johnson, Moderna, AstraZeneca, Novavax, Pfizer и GSK. Типичные условия включали исследовательские субсидии в размере от 400 миллионов до 2 миллиардов долларов и включали государственную собственность на первые 100 миллионов доз любой успешно разработанной вакцины от COVID-19. [148]
Американская фармацевтическая компания Gilead запросила и получила статус орфанного препарата для ремдесивира от Управления по контролю за продуктами и лекарствами США (FDA) 23 марта 2020 года. Это положение призвано стимулировать разработку препаратов, затрагивающих менее 200 000 американцев, путем предоставления производителю усиленных и расширенных прав юридической монополии, а также освобождения от налогов и государственных пошлин. [149] [150] Ремдесивир является кандидатом на лечение COVID-19; на момент предоставления статуса менее 200 000 американцев имели COVID-19, но число быстро росло, поскольку пандемия COVID-19 достигла США, и скорое пересечение порога считалось неизбежным. [149] [150] Ремдесивир был разработан компанией Gilead при финансировании правительства США более чем на 79 миллионов долларов. [150] В мае 2020 года компания Gilead объявила, что предоставит первые 940 000 доз ремдесивира федеральному правительству бесплатно. [151] Столкнувшись с бурной реакцией общественности, 25 марта компания Gilead отказалась от статуса «сиротского препарата» для ремдесивира. [152] Компания Gilead сохраняет 20-летние патенты на ремдесивир в более чем 70 странах. [145] В мае 2020 года компания также объявила, что ведет переговоры с несколькими компаниями-производителями дженериков о предоставлении прав на производство ремдесивира для развивающихся стран, а также с Патентным пулом лекарственных средств о предоставлении более широкого доступа к дженерикам. [153]
Патенты подвергались критике в развивающихся странах, поскольку они, как полагают [ кто? ], ограничивают доступ к существующим лекарствам. [154] Примирение патентов и всеобщего доступа к лекарствам потребует эффективной международной политики ценовой дискриминации . Более того, в соответствии с соглашением ТРИПС Всемирной торговой организации страны должны разрешить патентование фармацевтических продуктов. В 2001 году ВТО приняла Дохинскую декларацию , в которой указано, что соглашение ТРИПС следует читать с учетом целей общественного здравоохранения, и разрешаются некоторые методы обхода фармацевтических монополий: посредством обязательного лицензирования или параллельного импорта , даже до истечения срока действия патента. [155]
В марте 2001 года 40 многонациональных фармацевтических компаний подали в суд на ЮАР из-за ее Закона о лекарственных средствах , который разрешал производство дженериков антиретровирусных препаратов (АРВ) для лечения ВИЧ, несмотря на то, что эти препараты были запатентованы. [156] ВИЧ был и остается эпидемией в ЮАР, и АРВ в то время стоили от 10 000 до 15 000 долларов США на пациента в год. Это было не по карману большинству граждан ЮАР, и поэтому правительство ЮАР обязалось предоставлять АРВ по ценам, близким к тем, которые люди могли себе позволить. Для этого им пришлось бы игнорировать патенты на лекарства и производить дженерики внутри страны (используя обязательную лицензию) или импортировать их из-за рубежа. После международных протестов в поддержку прав на общественное здравоохранение (включая сбор 250 000 подписей организацией «Врачи без границ ») правительства нескольких развитых стран (включая Нидерланды, Германию, Францию, а позднее США) поддержали правительство ЮАР, и дело было прекращено в апреле того же года. [157]
В 2016 году GlaxoSmithKline (шестая по величине фармацевтическая компания в мире) объявила, что она отменит свои патенты в бедных странах, чтобы позволить независимым компаниям производить и продавать версии своих препаратов в этих регионах, тем самым расширяя доступ общественности к ним. [158] GlaxoSmithKline опубликовала список из 50 стран, в которых она больше не будет иметь патентов, что затронет один миллиард человек во всем мире.
В 2011 году четыре из 20 крупнейших корпоративных благотворительных пожертвований и восемь из 30 крупнейших корпоративных благотворительных пожертвований поступили от фармацевтических производителей. Основная часть корпоративных благотворительных пожертвований (69% по состоянию на 2012 год) поступает в виде неденежных благотворительных пожертвований, большинство из которых снова были пожертвованиями фармацевтических компаний. [159]
Благотворительные программы и усилия фармацевтических компаний по открытию и разработке лекарственных препаратов включают:
миссия фармацевтической промышленности — производить продукцию для пациентов, чтобы вылечить их, вакцинировать или облегчить симптомы, часто путем производства жидких инъекционных препаратов или пероральных твердых препаратов, а также других методов лечения.
Сотрудники Управления по контролю за продуктами питания и лекарственными средствами, осознавая серьезность проблемы, подсчитали, что примерно половина из 9 000 000 000 капсул и таблеток барбитуратов и амфетамина, ежегодно производимых в этой стране, перенаправляется на незаконное использование. Прибыль, получаемая от незаконной продажи этих наркотиков, оказалась привлекательной для организованной преступности, поскольку амфетамин можно купить оптом менее чем за 1 доллар за 1000 капсул, но при продаже на нелегальном рынке он приносит от 30 до 50 долларов за 1000, а при розничной продаже индивидуальному покупателю таблетка может принести от 10 до 25 центов.
Барбитураты, введенные в медицину Э. Фишером и Дж. фон Мерингом в 1903 году, безусловно, являются одними из наиболее широко используемых и злоупотребляемых лекарств в медицине. Около 400 тонн этих препаратов производится каждый год; этого достаточно, чтобы усыпить около 9 000 000 человек каждую ночь в течение этого периода, если каждому дать дозу 0,1 г.
{{cite journal}}: CS1 maint: неподходящий URL ( ссылка ){{cite web}}: CS1 maint: архивная копия как заголовок ( ссылка )