
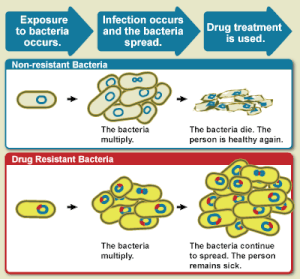
Устойчивость к противомикробным препаратам ( AMR или AR ) возникает, когда микробы вырабатывают механизмы, защищающие их от противомикробных препаратов , которые являются препаратами, используемыми для лечения инфекций. [2] Эта устойчивость затрагивает все классы микробов, включая бактерии ( устойчивость к антибиотикам ), вирусы ( устойчивость к противовирусным препаратам ), простейшие ( устойчивость к антипротозойным препаратам ) и грибки ( устойчивость к противогрибковым препаратам ). Вместе эти адаптации попадают под зонтик AMR, создавая значительные проблемы для здравоохранения во всем мире. [3] Неправильное использование и неправильное управление противомикробными препаратами являются основными факторами этой устойчивости, хотя она также может возникать естественным путем через генетические мутации и распространение резистентных генов. [4]
Микробы, устойчивые к нескольким препаратам, называются мультирезистентными (МЛУ) и иногда их называют супербактериями . [5] Устойчивость к антибиотикам, значительная подгруппа AMR, позволяет бактериям выживать при лечении антибиотиками , что усложняет лечение инфекций и варианты лечения. [3] Устойчивость возникает в результате спонтанной мутации, горизонтального переноса генов и повышенного селективного давления из-за чрезмерного использования антибиотиков как в медицине, так и в сельском хозяйстве, что ускоряет развитие устойчивости. [6]
Бремя AMR огромно: почти 5 миллионов смертей ежегодно связаны с резистентными инфекциями. [7] Инфекции, вызванные микробами AMR, сложнее поддаются лечению и часто требуют дорогостоящих альтернативных методов лечения, которые могут иметь более серьезные побочные эффекты. [8] Профилактические меры, такие как использование антибиотиков узкого спектра действия и улучшение гигиенических практик, направлены на снижение распространения резистентности. [9]
ВОЗ и другие международные организации предупреждают, что к 2050 году AMR может привести к 10 миллионам смертей ежегодно, если не будут приняты меры. [10] Глобальные инициативы, такие как призывы к международным договорам по AMR, подчеркивают скоординированные усилия по ограничению неправильного использования, финансированию исследований и обеспечению доступа к необходимым противомикробным препаратам в развивающихся странах. Однако пандемия COVID-19 перенаправила ресурсы и научное внимание от AMR, что усилило проблему. [11]
ВОЗ определяет устойчивость к противомикробным препаратам как устойчивость микроорганизма к противомикробному препарату , который когда-то был способен лечить инфекцию, вызванную этим микроорганизмом. [3] Человек не может стать устойчивым к антибиотикам. Устойчивость — это свойство микроба, а не человека или другого организма, инфицированного микробом. [13] Все типы микробов могут развить устойчивость к лекарствам. Таким образом, существует устойчивость к антибиотикам, противогрибковым, противовирусным и противопаразитарным препаратам. [4] [8]
Устойчивость к антибиотикам является подмножеством устойчивости к противомикробным препаратам. Эта более специфическая устойчивость связана с бактериями и, таким образом, делится на два дополнительных подмножества: микробиологическая и клиническая. Микробиологическая устойчивость является наиболее распространенной и возникает из генов, мутировавших или унаследованных, которые позволяют бактериям противостоять механизму уничтожения микроба, связанному с определенными антибиотиками. Клиническая устойчивость проявляется в неэффективности многих терапевтических методов, когда бактерии, которые обычно восприимчивы к лечению, становятся устойчивыми после того, как переживают исход лечения. В обоих случаях приобретенной устойчивости бактерии могут передавать генетический катализатор устойчивости посредством горизонтального переноса генов: конъюгации, трансдукции или трансформации. Это позволяет устойчивости распространяться среди тех же видов патогенов или даже похожих бактериальных патогенов. [14]
В докладе ВОЗ, опубликованном в апреле 2014 года, говорится: «Эта серьезная угроза больше не является прогнозом на будущее, она происходит прямо сейчас в каждом регионе мира и может затронуть любого человека, любого возраста, в любой стране. Устойчивость к антибиотикам — когда бактерии изменяются таким образом, что антибиотики больше не действуют на людей, которым они нужны для лечения инфекций, — теперь является серьезной угрозой общественному здравоохранению». [15]
Ежегодно во всем мире с AMR связано около 5 миллионов смертей. [7] В 2019 году число смертей в мире, связанных с AMR, составило 1,27 миллиона. В том же году AMR, возможно, стала причиной 5 миллионов смертей, и каждый пятый человек, умерший из-за AMR, был ребенком в возрасте до пяти лет. [16]
В 2018 году ВОЗ посчитала устойчивость к антибиотикам одной из самых больших угроз для глобального здравоохранения, продовольственной безопасности и развития. [17] Количество смертей, связанных с УПП, различается в зависимости от региона:
Европейский центр профилактики и контроля заболеваний подсчитал, что в 2015 году в ЕС и Европейской экономической зоне было зарегистрировано 671 689 случаев заражения, вызванных бактериями, устойчивыми к антибиотикам, что привело к 33 110 случаям смерти. Большинство из них были приобретены в медицинских учреждениях. [18] [19] В 2019 году было зарегистрировано 133 000 случаев смерти, вызванных AMR. [20]
AMR в значительной степени обусловлена неправильным и чрезмерным использованием противомикробных препаратов. [7] Однако в то же время многие люди во всем мире не имеют доступа к основным противомикробным препаратам. [7] Это приводит к тому, что микробы либо вырабатывают защиту от лекарств, используемых для их лечения, либо определенные штаммы микробов, имеющие естественную устойчивость к противомикробным препаратам, становятся гораздо более распространенными, чем те, которые легко победить с помощью лекарств. [21] Хотя устойчивость к противомикробным препаратам возникает естественным образом с течением времени, использование противомикробных препаратов в различных условиях как в сфере здравоохранения, так и за ее пределами привело к тому, что устойчивость к противомикробным препаратам становится все более распространенной. [22]
Хотя многие микробы со временем развивают устойчивость к антибиотикам посредством естественной мутации, чрезмерное и ненадлежащее назначение антибиотиков ускорило проблему. Возможно, что до 1 из 3 рецептов, выписанных на антибиотики, являются ненужными. [23] Ежегодно выписывается около 154 миллионов рецептов на антибиотики. Из них до 46 миллионов являются ненужными или неподходящими для состояния пациента. [23] Микробы могут естественным образом вырабатывать устойчивость через генетические мутации, которые происходят во время деления клеток, и хотя случайные мутации редки, многие микробы размножаются часто и быстро, увеличивая вероятность того, что члены популяции приобретут мутацию, которая увеличивает устойчивость. [24] Многие люди прекращают принимать антибиотики, когда начинают чувствовать себя лучше. Когда это происходит, возможно, что микробы, которые менее восприимчивы к лечению, все еще остаются в организме. Если эти микробы способны продолжать размножаться, это может привести к инфицированию бактериями, которые менее восприимчивы или даже устойчивы к антибиотику. [24]

AMR — это естественный процесс. [2] Устойчивость к противомикробным препаратам может развиваться естественным образом из-за постоянного воздействия противомикробных препаратов. Естественный отбор означает, что организмы, способные адаптироваться к окружающей среде, выживают и продолжают производить потомство. [25] В результате типы микроорганизмов, способные выживать с течением времени при постоянном воздействии определенных противомикробных препаратов, естественным образом станут более распространенными в окружающей среде, а те, у которых нет этой устойчивости, станут устаревшими. [22]
Некоторые современные виды устойчивости к противомикробным препаратам также развились естественным образом до начала использования противомикробных препаратов в клинических целях у человека. Например, устойчивость к метициллину развилась как патоген ежей, возможно, как коэволюционная адаптация патогена к ежам, инфицированным дерматофитом, который естественным образом вырабатывает антибиотики. [26] Кроме того, многие почвенные грибы и бактерии являются естественными конкурентами, а оригинальный антибиотик пенициллин, открытый Александром Флемингом, быстро утратил клиническую эффективность при лечении людей, и, кроме того, ни один из других природных пенициллинов (F, K, N, X, O, U1 или U6) в настоящее время не используется в клинической практике. [ необходима ссылка ]
Устойчивость к противомикробным препаратам может быть приобретена от других микробов путем обмена генами в процессе, называемом горизонтальным переносом генов . Это означает, что как только ген устойчивости к антибиотику появляется в микробном сообществе, он может затем распространиться на другие микробы в сообществе, потенциально переходя от микроба, не вызывающего заболевания, к микробу, вызывающему заболевание. Этот процесс в значительной степени обусловлен процессами естественного отбора , которые происходят во время использования или неправильного использования антибиотиков. [27]
Со временем большинство штаммов бактерий и инфекций, присутствующих в настоящее время, будут иметь тип, устойчивый к антимикробному агенту, используемому для их лечения, что делает этот агент теперь неэффективным для борьбы с большинством микробов. С увеличением использования антимикробных агентов происходит ускорение этого естественного процесса. [28]
В 89% стран антибиотики могут быть назначены только врачом и предоставлены аптекой. [29] Самолечение потребителями определяется как «прием лекарств по собственной инициативе или по предложению другого человека, который не является сертифицированным медицинским работником», и было определено как одна из основных причин развития устойчивости к противомикробным препаратам. [30] Самолечение антибиотиками является неподходящим способом их использования, но распространенной практикой в странах с ограниченными ресурсами. Такая практика подвергает людей риску заражения бактериями, у которых развилась устойчивость к противомикробным препаратам. [31] Многие люди прибегают к этому по необходимости, когда доступ к врачу невозможен из-за карантинов и закрытия врачебных кабинетов общей практики или когда у пациентов ограничено время или деньги, чтобы посетить врача, выписавшего рецепт. [32] Благодаря такому расширению доступа становится чрезвычайно легко получать противомикробные препараты, и примером является Индия, где в штате Пенджаб 73% населения прибегают к лечению своих незначительных проблем со здоровьем и хронических заболеваний путем самолечения. [30]
Самолечение чаще встречается за пределами больничной среды, и это связано с более высоким использованием антибиотиков, причем большинство антибиотиков используется в обществе, а не в больницах. Распространенность самолечения в странах с низким и средним уровнем дохода (СНСД) колеблется от 8,1% до очень высокого уровня в 93%. Доступность, финансовая доступность и состояние медицинских учреждений, а также поведение, направленное на здоровье, являются факторами, которые влияют на самолечение в странах с низким и средним уровнем дохода (СНСД). [31] Две существенные проблемы с самолечением — это отсутствие знаний у населения, во-первых, об опасных эффектах некоторых противомикробных препаратов (например, ципрофлоксацина , который может вызывать тендинит , разрыв сухожилия и расслоение аорты ) [33] [34] и, во-вторых, широкая микробная резистентность и то, когда следует обращаться за медицинской помощью, если инфекция не проходит. Для того чтобы определить уровень знаний и предвзятые мнения общественности об устойчивости к антибиотикам, был проведен скрининг 3537 статей, опубликованных в Европе, Азии и Северной Америке. Из 55 225 человек, опрошенных в статьях, 70% слышали об устойчивости к антибиотикам ранее, но 88% из них считали, что это относится к какому-то типу физических изменений в организме человека. [30]
Клиническое неправильное использование со стороны медицинских работников является еще одним фактором, способствующим повышению устойчивости к противомикробным препаратам. Исследования, проведенные в США, показывают, что показания к лечению антибиотиками, выбор используемого агента и продолжительность терапии были неправильными в 50% изученных случаев. [35] В 2010 и 2011 годах около трети назначений антибиотиков в амбулаторных условиях в Соединенных Штатах были ненужными. [36] Другое исследование в отделении интенсивной терапии крупной больницы во Франции показало, что от 30% до 60% назначенных антибиотиков были ненужными. [35] Такое ненадлежащее использование противомикробных препаратов способствует развитию устойчивости к противомикробным препаратам, поддерживая развитие генетических изменений у бактерий, которые приводят к устойчивости. [37]
Согласно исследованию, проведенному в США с целью оценки отношения и знаний врачей об устойчивости к противомикробным препаратам в амбулаторных условиях, только 63% опрошенных сообщили об устойчивости к антибиотикам как о проблеме в их местной практике, в то время как 23% сообщили об агрессивном назначении антибиотиков как о необходимости избежать неспособности обеспечить адекватную помощь. [38] Это демонстрирует, как большинство врачей недооценивают влияние, которое их собственные привычки назначения оказывают на устойчивость к противомикробным препаратам в целом. Это также подтверждает, что некоторые врачи могут быть чрезмерно осторожными и назначать антибиотики как по медицинским, так и по юридическим причинам, даже если клинические показания к применению этих лекарств не всегда подтверждаются. Это может привести к ненужному использованию противомикробных препаратов, что могло ухудшиться во время пандемии COVID-19 . [39] [40]
Исследования показали, что распространенные заблуждения относительно эффективности и необходимости антибиотиков для лечения распространенных легких заболеваний способствуют их чрезмерному использованию. [41] [42]
Важную роль в обсуждении использования антибиотиков играет ветеринарная медицинская система. Ветеринарный надзор требуется законом для всех важных с медицинской точки зрения антибиотиков. [43] Ветеринары используют подход фармакокинетической/фармакодинамической модели (ФК/ПД), чтобы гарантировать, что правильная доза препарата будет доставлена в правильное место в правильное время. [44]
Увеличение использования антибиотиков во время ранних волн пандемии COVID-19 может усугубить эту глобальную проблему здравоохранения . [45] [46] Более того, пандемическая нагрузка на некоторые системы здравоохранения может способствовать возникновению инфекций, устойчивых к антибиотикам. [47] С другой стороны, «повышение гигиены рук, сокращение международных поездок и сокращение плановых больничных процедур могли снизить отбор и распространение патогенов AMR в краткосрочной перспективе» во время пандемии COVID-19. [48] Использование дезинфицирующих средств , таких как дезинфицирующие средства для рук на спиртовой основе и антисептическое мытье рук, также может иметь потенциал для повышения устойчивости к противомикробным препаратам. [49] Широкое использование дезинфицирующих средств может привести к мутациям, которые вызывают устойчивость к противомикробным препаратам. [50]
На совещании высокого уровня ООН по AMR в 2024 году было взято обязательство сократить смертность, связанную с бактериальной AMR, на 10% в течение следующих шести лет. [7] [51] В своей первой крупной декларации по этому вопросу с 2016 года мировые лидеры также обязались собрать 100 миллионов долларов для обновления и реализации планов действий по AMR. [52] Однако в окончательном проекте декларации была опущена более ранняя цель по сокращению использования антибиотиков у животных на 30% к 2030 году из-за противодействия стран-производителей мяса и сельскохозяйственной промышленности. Критики утверждают, что это упущение является серьезным недостатком, поскольку на животноводство приходится около 73% мировых продаж противомикробных препаратов, включая антибиотики , противовирусные препараты и противопаразитарные средства .
Учитывая сложные взаимодействия между людьми, животными и окружающей средой, также важно учитывать экологические аспекты и факторы, способствующие устойчивости к противомикробным препаратам. [53] Хотя все еще существуют некоторые пробелы в знаниях в понимании механизмов и путей передачи, [54] загрязнение окружающей среды считается значительным фактором, способствующим устойчивости к противомикробным препаратам. [55] Важными факторами, способствующими этому, являются «остатки антибиотиков», «промышленные стоки», «сельскохозяйственные стоки», «тяжелые металлы», «биоциды и пестициды» и «сточные воды», которые создают резервуары для устойчивых генов и бактерий, что облегчает передачу человеческих патогенов. [54] [55] Неиспользованные или просроченные антибиотики, если их не утилизировать должным образом, могут попадать в водные системы и почву. [55] Сбросы фармацевтических производств и других промышленных компаний также могут привносить антибиотики и другие химикаты в окружающую среду. [55] Эти факторы позволяют создавать селективное давление для устойчивых бактерий. [55] Антибиотики, используемые в животноводстве и аквакультуре, могут загрязнять почву и воду, что способствует развитию резистентности у микробов окружающей среды. [54] Тяжелые металлы, такие как цинк, медь и ртуть, а также биоциды и пестициды, могут совместно выбирать резистентность к антибиотикам, [55] увеличивая ее скорость. [54] Ненадлежащая очистка сточных вод и канализационных вод позволяет резистентным бактериям и генам распространяться через водные системы. [54] [54]

Кризис устойчивости к противомикробным препаратам также распространяется на пищевую промышленность, особенно на животных, производящих продукты питания. С постоянно растущим населением существует постоянное давление, направленное на повышение производительности во многих сельскохозяйственных секторах, включая производство мяса как источника белка. [56] Антибиотики скармливаются скоту в качестве добавок для роста и профилактической меры для снижения вероятности инфекций. [57]
Фермеры обычно используют антибиотики в кормах для животных для улучшения темпов роста и предотвращения инфекций. Однако это нелогично, поскольку антибиотики используются для лечения инфекций, а не для их предотвращения. 80% антибиотиков в США используются в сельскохозяйственных целях, и около 70% из них имеют медицинское значение. [58] Чрезмерное использование антибиотиков дает бактериям время для адаптации, оставляя более высокие дозы или даже более сильные антибиотики, необходимые для борьбы с инфекцией. Хотя антибиотики для стимуляции роста были запрещены во всем ЕС в 2006 году, 40 стран мира по-прежнему используют антибиотики для стимуляции роста. [59]
Это может привести к переносу устойчивых штаммов бактерий в пищу, которую едят люди, что может привести к потенциально фатальному переносу заболеваний. Хотя практика использования антибиотиков в качестве стимуляторов роста действительно приводит к повышению урожайности и мясной продукции, это серьезная проблема, и ее необходимо сократить, чтобы предотвратить возникновение устойчивости к противомикробным препаратам. [60] Хотя доказательства, связывающие использование противомикробных препаратов в животноводстве с устойчивостью к противомикробным препаратам, ограничены, Консультативная группа Всемирной организации здравоохранения по комплексному надзору за устойчивостью к противомикробным препаратам настоятельно рекомендовала сократить использование важных с медицинской точки зрения противомикробных препаратов в животноводстве. Кроме того, Консультативная группа заявила, что такие противомикробные препараты должны быть прямо запрещены как для стимуляции роста, так и для профилактики заболеваний у животных, производящих продукты питания. [61]
Картографируя потребление антибиотиков в животноводстве по всему миру, было предсказано, что в 228 странах к 2030 году потребление антибиотиков в животноводстве увеличится на 67%. В некоторых странах, таких как Бразилия, Россия, Индия, Китай и Южная Африка, прогнозируется увеличение на 99%. [28] Несколько стран ограничили использование антибиотиков в животноводстве, включая Канаду, Китай, Японию и США. Эти ограничения иногда связаны со снижением распространенности устойчивости к противомикробным препаратам у людей. [61]
В Соединенных Штатах Директива о ветеринарных кормах вступила в силу в 2017 году, согласно которой все важные с медицинской точки зрения антибиотики, которые должны использоваться в кормах или воде для пищевых животных, требуют ветеринарной директивы о кормах (VFD) или рецепта. [62]
Большинство пестицидов защищают урожай от насекомых и растений, но в некоторых случаях антимикробные пестициды используются для защиты от различных микроорганизмов, таких как бактерии, вирусы, грибки, водоросли и простейшие. Чрезмерное использование многих пестицидов в попытке получить более высокий урожай сельскохозяйственных культур привело к тому, что многие из этих микробов выработали толерантность к этим антимикробным агентам. В настоящее время в Агентстве по охране окружающей среды США (EPA) зарегистрировано и продается на рынке более 4000 антимикробных пестицидов, что свидетельствует о широком использовании этих агентов. [63] По оценкам, на каждый прием пищи человеком используется 0,3 г пестицидов, поскольку 90% всех пестицидов используется в сельском хозяйстве. Большинство этих продуктов используются для защиты от распространения инфекционных заболеваний и, как мы надеемся, для защиты общественного здоровья. Но из большого количества используемых пестицидов также оценивается, что менее 0,1% этих антимикробных агентов фактически достигают своих целей. Это оставляет более 99% всех используемых пестицидов доступными для заражения других ресурсов. [64] В почве, воздухе и воде эти антимикробные агенты способны распространяться, вступая в контакт с большим количеством микроорганизмов и приводя к тому, что эти микробы развивают механизмы, чтобы переносить и далее сопротивляться пестицидам. Использование противогрибковых азольных пестицидов, которые вызывают экологическую резистентность к азолам, было связано со случаями резистентности к азолам в клинических условиях. [65] Те же проблемы возникают и перед новыми классами противогрибковых препаратов (например, оротомиды ), которые снова используются как в клинике, так и в сельском хозяйстве. [66]

Вечная мерзлота — это термин, используемый для обозначения любой почвы, которая оставалась замороженной в течение двух лет или более, причем самые старые известные примеры непрерывно замерзали в течение около 700 000 лет. [68] В последние десятилетия вечная мерзлота быстро оттаивала из-за изменения климата . [69] : 1237 Холод сохраняет любые органические вещества внутри вечной мерзлоты, и микроорганизмы могут возобновить свои жизненные функции после ее оттаивания. В то время как некоторые распространенные патогены , такие как грипп , оспа или бактерии, связанные с пневмонией, не смогли пережить преднамеренные попытки их возродить, [70] более адаптированные к холоду микроорганизмы, такие как сибирская язва или несколько древних вирусов растений и амеб , успешно пережили длительное оттаивание. [71] [72] [73] [74] [75]
Некоторые ученые утверждают, что неспособность известных возбудителей инфекционных заболеваний выживать при замораживании и оттаивании делает эту угрозу маловероятной. Вместо этого были высказаны предположения, что когда современные патогенные бактерии взаимодействуют с древними, они могут посредством горизонтального переноса генов подхватить генетические последовательности , которые связаны с устойчивостью к противомикробным препаратам, усугубляя и без того сложную проблему. [76] Антибиотики, к которым бактерии вечной мерзлоты проявили по крайней мере некоторую устойчивость, включают хлорамфеникол , стрептомицин , канамицин , гентамицин , тетрациклин , спектиномицин и неомицин . [77] Однако другие исследования показывают, что уровни устойчивости у древних бактерий к современным антибиотикам остаются ниже, чем у современных бактерий из активного слоя талой земли над ними, [67] что может означать, что этот риск «не больше», чем от любой другой почвы. [78]

Все чаще звучат призывы общественности к глобальным коллективным действиям по борьбе с этой угрозой, включая предложение о международном договоре по устойчивости к противомикробным препаратам. Для распознавания и измерения тенденций устойчивости на международном уровне по-прежнему необходимы дополнительные детали и внимание; была предложена идея глобальной системы отслеживания, но ее реализация еще не произошла. Система такого рода обеспечит понимание областей высокой устойчивости, а также информацию, необходимую для оценки программ, внедрения вмешательств и других изменений, направленных на борьбу с устойчивостью к антибиотикам или ее устранение. [79] [80]
Отсрочка или минимизация использования антибиотиков при определенных состояниях может помочь безопасно сократить их использование. [81] Продолжительность лечения противомикробными препаратами должна основываться на инфекции и других проблемах со здоровьем, которые могут быть у человека. [82] Для многих инфекций после того, как человек выздоровел, мало доказательств того, что прекращение лечения вызывает большую резистентность. [82] Поэтому некоторые считают, что раннее прекращение лечения может быть разумным в некоторых случаях. [82] Однако другие инфекции требуют длительных курсов независимо от того, чувствует ли себя человек лучше. [82]
Отсрочка приема антибиотиков при таких заболеваниях, как боль в горле и средний отит, может не отличаться по частоте осложнений по сравнению с немедленным приемом антибиотиков, например. [81] При лечении инфекций дыхательных путей требуется клиническая оценка относительно соответствующего лечения (отсроченное или немедленное применение антибиотиков). [81]
Исследование «Более короткие и более длительные курсы антибиотиков при респираторных инфекциях: борьба с устойчивостью к противомикробным препаратам — ретроспективное поперечное исследование в условиях вторичной медицинской помощи в Великобритании» подчеркивает срочность переоценки продолжительности лечения антибиотиками на фоне глобальной проблемы устойчивости к противомикробным препаратам (УПП). Оно исследует эффективность более коротких и более длительных курсов антибиотиков при инфекциях дыхательных путей (ИДП) в условиях вторичной медицинской помощи в Великобритании, подчеркивая необходимость в основанных на фактических данных методах назначения лекарств для оптимизации результатов лечения пациентов и борьбы с УПП. [83]
Существует множество национальных и международных программ мониторинга угроз, связанных с лекарственной устойчивостью, включая метициллин-резистентный золотистый стафилококк (MRSA), ванкомицин-резистентный золотистый стафилококк (VRSA), Enterobacterales , продуцирующие бета-лактамазу расширенного спектра (ESBL) , ванкомицин-резистентный энтерококк (VRE) и полирезистентный Acinetobacter baumannii (MRAB). [84]
ResistanceOpen — это онлайновая глобальная карта устойчивости к противомикробным препаратам, разработанная HealthMap , которая отображает агрегированные данные об устойчивости к противомикробным препаратам из общедоступных и предоставленных пользователями данных. [85] [86] Веб-сайт может отображать данные в радиусе 25 миль (40 км) от местоположения. Пользователи могут отправлять данные из антибиотикограмм для отдельных больниц или лабораторий. Европейские данные взяты из EARS-Net (Европейская сеть надзора за устойчивостью к противомикробным препаратам), части ECDC . ResistanceMap — это веб-сайт Центра динамики заболеваний, экономики и политики , который предоставляет данные об устойчивости к противомикробным препаратам на глобальном уровне. [87]
Глобальный план действий ВОЗ по борьбе с УПП также рекомендует проводить наблюдение за устойчивостью к противомикробным препаратам у животных. [88] В ЕС были сделаны первые шаги по созданию ветеринарного аналога EARS-Vet (EARS-Net для ветеринарной медицины). [89] Данные об УПП, в частности, у домашних животных, скудны, но необходимы для поддержки управления антибиотиками в ветеринарии. [90]
Для сравнения, наблюдается отсутствие национальных и международных программ мониторинга устойчивости к противогрибковым препаратам. [91]
Программы управления противомикробными препаратами, по-видимому, полезны для снижения показателей устойчивости к противомикробным препаратам. [92] Программа управления противомикробными препаратами также предоставит фармацевтам знания, необходимые для информирования пациентов о том, что антибиотики не будут работать, например, при вирусе. [93]
Чрезмерное использование противомикробных препаратов стало одним из главных факторов, способствующих развитию устойчивости к противомикробным препаратам. С начала эры противомикробных препаратов противомикробные препараты использовались для лечения широкого спектра инфекционных заболеваний. [94] Чрезмерное использование противомикробных препаратов стало основной причиной роста уровня устойчивости к противомикробным препаратам. Основная проблема заключается в том, что врачи готовы назначать противомикробные препараты неинформированным людям, которые считают, что противомикробные препараты могут вылечить почти все болезни, включая вирусные инфекции, такие как простуда. Анализ рецептов на лекарства показал, что 36% людей с простудой или инфекцией верхних дыхательных путей (оба заболевания обычно вирусного происхождения) получали рецепты на антибиотики. [95] Эти рецепты не привели ни к чему, кроме увеличения риска дальнейшей эволюции бактерий, устойчивых к антибиотикам. [96] Использование противомикробных препаратов без рецепта является еще одной движущей силой, ведущей к чрезмерному использованию антибиотиков для самостоятельного лечения таких заболеваний, как простуда, кашель, лихорадка и дизентерия, что приводит к эпидемии устойчивости к антибиотикам в таких странах, как Бангладеш, и рискует распространиться по всему миру. [97] Введение строгого контроля за применением антибиотиков в амбулаторных условиях для сокращения ненадлежащего назначения антибиотиков может снизить возникающую бактериальную устойчивость. [98]
Руководство ВОЗ AWaRe (Access, Watch, Reserve) и книга антибиотиков были введены для руководства по выбору антибиотиков для 30 наиболее распространенных инфекций у взрослых и детей, чтобы сократить ненадлежащее назначение в первичной медицинской помощи и больницах. Узкоспектральные антибиотики предпочтительны из-за их более низкого потенциала резистентности, а антибиотики широкого спектра действия рекомендуются только для людей с более тяжелыми симптомами. Некоторые антибиотики с большей вероятностью вызывают резистентность, поэтому они сохраняются как резервные антибиотики в книге AWaRe. [99]
Для предотвращения чрезмерного использования противогрибковой терапии в клинике использовались различные диагностические стратегии, что является безопасной альтернативой эмпирической противогрибковой терапии и, таким образом, лежит в основе схем управления противогрибковой терапией. [100]
Группы по контролю за противомикробными препаратами в больницах поощряют оптимальное использование противомикробных препаратов. [101] Цели контроля за противомикробными препаратами — помочь практикующим врачам выбрать правильный препарат в правильной дозе и с правильной продолжительностью терапии, предотвращая неправильное использование и сводя к минимуму развитие резистентности. Меры контроля могут сократить продолжительность пребывания в среднем чуть более чем на 1 день, не увеличивая при этом риск смерти. [102] Выдача выписанным пациентам точного количества фармацевтических единиц антибиотиков, необходимых для завершения текущего лечения, может сократить остатки антибиотиков в обществе, поскольку в общественных аптеках может быть неэффективность упаковки антибиотиков. [103]
Учитывая объем помощи, оказываемой в первичной медицинской помощи (общая практика), недавние стратегии были сосредоточены на сокращении ненужного назначения противомикробных препаратов в этой обстановке. Было показано, что простые вмешательства, такие как письменная информация, объясняющая, когда прием антибиотиков не является необходимым, например, при распространенных инфекциях верхних дыхательных путей, сокращают назначение антибиотиков. [104] Также доступны различные инструменты, помогающие специалистам решить, необходимо ли назначение противомикробных препаратов.
Ожидания родителей, обусловленные беспокойством за здоровье своих детей, могут влиять на то, как часто детям назначают антибиотики. Родители часто полагаются на своего врача за советом и заверениями. Однако отсутствие информации на простом языке и недостаточное время для консультации негативно влияет на эти отношения. По сути, родители часто полагаются на прошлый опыт в своих ожиданиях, а не на заверения врача. Достаточное время для консультации и информация на простом языке могут помочь родителям принимать обоснованные решения и избегать ненужного использования антибиотиков. [105]
Врач должен строго придерживаться пяти правил назначения лекарств: правильный пациент, правильный препарат, правильная доза, правильный путь и правильное время. [106] Микробиологические образцы следует брать для посева и тестирования чувствительности до начала лечения, когда это показано, и лечение может быть изменено на основе отчета о восприимчивости. [107] [108]
Работники здравоохранения и фармацевты могут помочь в борьбе с устойчивостью к антибиотикам путем: усиления профилактики и контроля инфекций; назначения и выдачи антибиотиков только тогда, когда они действительно необходимы; назначения и выдачи правильных антибиотиков для лечения заболевания. [15] Система единичных доз, внедренная в общественных аптеках, также может сократить остатки антибиотиков в домохозяйствах. [103]
Люди могут помочь справиться с резистентностью, используя антибиотики только в случае заражения бактериальной инфекцией и назначения врача; выполняя полный курс лечения, даже если пользователь чувствует себя лучше, никогда не делясь антибиотиками с другими или используя оставшиеся рецепты. [15] Прием антибиотиков без необходимости не поможет пользователю, а вместо этого даст бактериям возможность адаптироваться и оставить пользователя с побочными эффектами, которые сопутствуют определенному типу антибиотика. [109] CDC рекомендует вам следовать этим правилам поведения, чтобы избежать этих негативных побочных эффектов и защитить сообщество от распространения устойчивых к лекарствам бактерий. [109] Практика основных курсов профилактики бактериальных инфекций, таких как гигиена, также помогает предотвратить распространение устойчивых к антибиотикам бактерий. [110]
Контроль инфекционных заболеваний посредством улучшения инфраструктуры водоснабжения, санитарии и гигиены (WASH) должен быть включен в повестку дня по устойчивости к противомикробным препаратам (AMR). «Межведомственная координационная группа по устойчивости к противомикробным препаратам» заявила в 2018 году, что «распространение патогенов через небезопасную воду приводит к высокому бремени желудочно-кишечных заболеваний, что еще больше увеличивает потребность в лечении антибиотиками». [113] Это особенно проблема в развивающихся странах , где распространение инфекционных заболеваний, вызванное неадекватными стандартами WASH, является основным фактором спроса на антибиотики. [114] Растущее использование антибиотиков вместе с сохраняющимися уровнями инфекционных заболеваний привели к опасному циклу, в котором зависимость от противомикробных препаратов увеличивается, а эффективность лекарств снижается. [114] Правильное использование инфраструктуры для водоснабжения, санитарии и гигиены (WASH) может привести к снижению случаев диареи, леченных антибиотиками, на 47–72 процента в зависимости от типа вмешательства и его эффективности. [114] Сокращение бремени диареи за счет улучшения инфраструктуры приведет к значительному сокращению числа случаев диареи, леченных антибиотиками. По оценкам, к 2030 году их число составит от 5 миллионов в Бразилии до 590 миллионов в Индии. [114] Тесная связь между возросшим потреблением и резистентностью указывает на то, что это напрямую смягчит ускоряющееся распространение AMR. [114] Санитария и вода для всех к 2030 году — это цель номер 6 Целей устойчивого развития . [115]
Более строгое соблюдение правил мытья рук персоналом больницы приводит к снижению уровня резистентных организмов. [116]
Инфраструктура водоснабжения и санитарии в медицинских учреждениях обеспечивает значительные сопутствующие преимущества для борьбы с УПП, и инвестиции следует увеличить. [113] Существует много возможностей для улучшения: ВОЗ и ЮНИСЕФ подсчитали в 2015 году, что во всем мире 38% медицинских учреждений не имеют источника воды, почти 19% не имеют туалетов и 35% не имеют воды и мыла или спиртосодержащего средства для мытья рук. [117]
Производителям противомикробных препаратов необходимо улучшить очистку своих сточных вод (используя промышленные процессы очистки сточных вод), чтобы сократить выбросы остатков в окружающую среду. [113]
Установлено, что использование антибиотиков в животноводстве может привести к появлению устойчивости к противомикробным препаратам у бактерий, обнаруженных у животных, употребляемых в пищу, к вводимым антибиотикам (через инъекции или лечебные корма). [118] По этой причине в этих практиках используются только противомикробные препараты, которые считаются «не имеющими клинического значения».
В отличие от устойчивости к антибактериальным препаратам, устойчивость к противогрибковым препаратам может быть обусловлена земледелием ; в настоящее время не существует нормативных актов, регулирующих использование аналогичных классов противогрибковых препаратов в сельском хозяйстве и клинике. [91] [66]
Недавние исследования показали, что профилактическое использование «неприоритетных» или «не имеющих клинической значимости» противомикробных препаратов в кормах может потенциально, при определенных условиях, привести к совместному отбору бактерий AMR из окружающей среды с устойчивостью к важным с медицинской точки зрения антибиотикам. [119] Возможность совместного отбора резистентностей AMR в пищевой цепочке может иметь далеко идущие последствия для здоровья человека. [119] [120]
В 1997 году министры здравоохранения Европейского союза проголосовали за запрет авопарцина и еще четырех антибиотиков, используемых для стимуляции роста животных в 1999 году. [121] В 2006 году вступил в силу запрет на использование антибиотиков в европейских кормах, за исключением двух антибиотиков в кормах для птицы. [122] В Скандинавии есть доказательства того, что запрет привел к снижению распространенности устойчивости к антибиотикам в (неопасных) популяциях бактерий животных. [123] По состоянию на 2004 год несколько европейских стран установили снижение устойчивости к противомикробным препаратам у людей путем ограничения использования противомикробных препаратов в сельском хозяйстве и пищевой промышленности без ущерба для здоровья животных или экономических затрат. [124]
Министерство сельского хозяйства США (USDA) и Управление по контролю за продуктами и лекарствами (FDA) собирают данные об использовании антибиотиков у людей и, в более ограниченном объеме, у животных. [125] Около 80% антибиотиков в США используются в сельскохозяйственных целях, и около 70% из них имеют медицинское значение. [58] Это дает основания для беспокойства по поводу кризиса устойчивости к антибиотикам в США и еще больше оснований для его мониторинга. В 1977 году FDA впервые определило, что имеются доказательства появления устойчивых к антибиотикам штаммов бактерий у скота. Тем не менее, давняя практика разрешения безрецептурной продажи антибиотиков (включая пенициллин и другие препараты) владельцам животных для введения их собственным животным продолжалась во всех штатах. В 2000 году FDA объявило о своем намерении отозвать одобрение использования фторхинолонов в птицеводстве из-за существенных доказательств, связывающих его с возникновением устойчивых к фторхинолонам инфекций Campylobacter у людей. Юридические проблемы со стороны производителей продуктов питания для животных и фармацевтической промышленности отложили окончательное решение до 2006 года. [126] Фторхинолоны были запрещены для использования вне инструкции по применению у животных, употребляемых в пищу, в США с 2007 года. [127] Тем не менее, они по-прежнему широко используются для домашних и экзотических животных. [128]
На 79-м заседании высокого уровня Генеральной Ассамблеи Организации Объединенных Наций по УПП 26 сентября 2024 года мировые лидеры одобрили политическую декларацию, в которой взяли на себя обязательство по четкому набору целей и действий, включая сокращение предполагаемых 4,95 миллиона человеческих смертей, связанных с бактериальной УПП, на 10% в год к 2030 году. [7] Растущая взаимосвязанность мира и тот факт, что новые классы антибиотиков не разрабатывались и не одобрялись более 25 лет, подчеркивают, в какой степени устойчивость к противомикробным препаратам является глобальной проблемой здравоохранения. [129] Глобальный план действий по решению растущей проблемы устойчивости к антибиотикам и другим противомикробным препаратам был одобрен на Шестьдесят восьмой Всемирной ассамблее здравоохранения в мае 2015 года. [88] Одной из ключевых целей плана является повышение осведомленности и понимания устойчивости к противомикробным препаратам посредством эффективной коммуникации, образования и обучения. Этот глобальный план действий, разработанный Всемирной организацией здравоохранения, был создан для борьбы с проблемой устойчивости к противомикробным препаратам и руководствовался рекомендациями стран и основных заинтересованных сторон. Глобальный план действий ВОЗ состоит из пяти ключевых целей, которые могут быть достигнуты с помощью различных средств, и представляет страны, объединяющиеся для решения крупной проблемы, которая может иметь будущие последствия для здоровья. [28] Эти цели следующие:
Шаги к прогрессу
Всемирная организация здравоохранения организовала первую Всемирную неделю осведомленности об антибиотиках, которая пройдет с 16 по 22 ноября 2015 года. Целью недели является повышение глобальной осведомленности об устойчивости к антибиотикам. Она также хочет способствовать правильному использованию антибиотиков во всех областях, чтобы предотвратить дальнейшие случаи устойчивости к антибиотикам. [140]
Всемирная неделя знаний об антибиотиках проводится ежегодно в ноябре с 2015 года. В 2017 году Продовольственная и сельскохозяйственная организация Объединенных Наций (ФАО), Всемирная организация здравоохранения (ВОЗ) и Всемирная организация по охране здоровья животных (МЭБ) совместно призывают к ответственному использованию антибиотиков у людей и животных для снижения возникновения устойчивости к антибиотикам. [141]
Объединенные Нации
В 2016 году Генеральный секретарь Организации Объединенных Наций созвал Межведомственную координационную группу (IACG) по устойчивости к противомикробным препаратам. [142] IACG работала с международными организациями и экспертами в области здоровья человека, животных и растений, чтобы создать план по борьбе с устойчивостью к противомикробным препаратам. [142] Их отчет, опубликованный в апреле 2019 года, подчеркивает серьезность устойчивости к противомикробным препаратам и угрозу, которую она представляет для мирового здравоохранения. В нем предлагается пять рекомендаций, которым государствам-членам следует следовать, чтобы справиться с этой растущей угрозой. Рекомендации IACG следующие: [143]

Пять основных механизмов, посредством которых бактерии проявляют устойчивость к антибиотикам:

Существует несколько различных типов микробов, у которых со временем выработалась устойчивость.
Шесть патогенов, вызывающих большинство смертей, связанных с резистентностью, — это Escherichia coli , Staphylococcus aureus, Klebsiella pneumoniae, Streptococcus pneumoniae, Acinetobacter baumannii и Pseudomonas aeruginosa . Они были ответственны за 929 000 смертей, связанных с резистентностью, и 3,57 миллиона смертей, связанных с резистентностью, в 2019 году. [16]
Neisseria gonorrhoeae , продуцирующая пенициллиназу, развила устойчивость к пенициллину в 1976 году. Другим примером является Neisseria gonorrhoeae , устойчивая к азитромицину , которая развила устойчивость к азитромицину в 2011 году. [152]
В грамотрицательных бактериях плазмидно-опосредованные гены устойчивости производят белки, которые могут связываться с ДНК-гиразой , защищая ее от действия хинолонов. Наконец, мутации в ключевых участках ДНК-гиразы или топоизомеразы IV могут снизить их связывающую способность с хинолонами, снижая эффективность препарата. [153]
Некоторые бактерии от природы устойчивы к определенным антибиотикам; например, грамотрицательные бактерии устойчивы к большинству β-лактамных антибиотиков из-за наличия β-лактамазы . Устойчивость к антибиотикам также может быть приобретена в результате генетической мутации или горизонтального переноса генов . [154] Хотя мутации редки, спонтанные мутации в геноме патогена происходят со скоростью примерно от 1 из 10 5 до 1 из 10 8 на хромосомную репликацию, [155] тот факт, что бактерии размножаются с высокой скоростью, позволяет эффекту быть значительным. Учитывая, что продолжительность жизни и производство новых поколений могут находиться на временной шкале всего лишь часов, новая (de novo) мутация в родительской клетке может быстро стать унаследованной мутацией с широким распространением, что приведет к микроэволюции полностью устойчивой колонии. Однако хромосомные мутации также накладывают издержки на приспособленность. Например, рибосомная мутация может защитить бактериальную клетку, изменив сайт связывания антибиотика, но может привести к более медленной скорости роста. [156] Более того, некоторые адаптивные мутации могут распространяться не только через наследование, но и через горизонтальный перенос генов . Наиболее распространенным механизмом горизонтального переноса генов является перенос плазмид, несущих гены устойчивости к антибиотикам, между бактериями одного и того же или разных видов посредством конъюгации . Однако бактерии также могут приобретать устойчивость через трансформацию , как в случае поглощения Streptococcus pneumoniae голых фрагментов внеклеточной ДНК, содержащих гены устойчивости к антибиотикам стрептомицину, [157] через трансдукцию , как в случае опосредованного бактериофагом переноса генов устойчивости к тетрациклину между штаммами S. pyogenes , [158] или через агентов переноса генов , которые представляют собой частицы, продуцируемые клеткой-хозяином, которые напоминают структуры бактериофагов и способны переносить ДНК. [159]
Устойчивость к антибиотикам может быть искусственно введена в микроорганизм с помощью лабораторных протоколов, иногда используемых в качестве селективного маркера для изучения механизмов переноса генов или для идентификации особей, которые поглотили фрагмент ДНК, включающий ген устойчивости и другой интересующий ген. [160]
Недавние открытия не показывают необходимости больших популяций бактерий для появления устойчивости к антибиотикам. Небольшие популяции Escherichia coli в градиенте антибиотиков могут стать устойчивыми. Любая гетерогенная среда в отношении градиентов питательных веществ и антибиотиков может способствовать устойчивости к антибиотикам в небольших популяциях бактерий. Исследователи предполагают, что механизм эволюции устойчивости основан на четырех мутациях SNP в геноме E. coli, вызванных градиентом антибиотиков. [161]
В одном исследовании, имеющем значение для космической микробиологии, непатогенный штамм E. coli MG1655 подвергался воздействию следовых количеств антибиотика широкого спектра действия хлорамфеникола в условиях имитируемой микрогравитации (LSMMG, или микрогравитация с низким сдвигом) в течение более 1000 поколений. Адаптированный штамм приобрел устойчивость не только к хлорамфениколу, но и перекрестную устойчивость к другим антибиотикам; [162] это контрастировало с наблюдением за тем же штаммом, который был адаптирован к более чем 1000 поколений в условиях LSMMG, но без какого-либо воздействия антибиотиков; в этом случае штамм не приобрел никакой такой устойчивости. [163] Таким образом, независимо от того, где они используются, использование антибиотика, вероятно, приведет к стойкой устойчивости к этому антибиотику, а также перекрестной устойчивости к другим противомикробным препаратам.
В последние годы появление и распространение β-лактамаз , называемых карбапенемазами, стало серьезным кризисом здравоохранения. [164] [165] Одной из таких карбапенемаз является металло-бета-лактамаза 1 Нью-Дели (NDM-1), [166] фермент , который делает бактерии устойчивыми к широкому спектру бета-лактамных антибиотиков . Наиболее распространенными бактериями, которые вырабатывают этот фермент, являются грамотрицательные, такие как E. coli и Klebsiella pneumoniae , но ген NDM-1 может распространяться от одного штамма бактерий к другому путем горизонтального переноса генов . [167]
Для лечения некоторых вирусных инфекций используются специальные противовирусные препараты . Эти препараты предотвращают размножение вирусов, подавляя основные стадии цикла репликации вируса в инфицированных клетках. Противовирусные препараты используются для лечения ВИЧ , гепатита В , гепатита С , гриппа , вирусов герпеса , включая вирус ветряной оспы , цитомегаловирус и вирус Эпштейна-Барр . У каждого вируса некоторые штаммы стали устойчивыми к вводимым препаратам. [168]
Противовирусные препараты обычно нацелены на ключевые компоненты вирусной репродукции; например, осельтамивир нацелен на нейраминидазу гриппа , тогда как аналоги гуанозина ингибируют вирусную ДНК-полимеразу. Таким образом, устойчивость к противовирусным препаратам приобретается через мутации в генах, которые кодируют белковые мишени препаратов.
Устойчивость к противовирусным препаратам ВИЧ является проблематичной, и даже появились штаммы с множественной лекарственной устойчивостью. [169] Одним из источников устойчивости является то, что многие современные препараты для лечения ВИЧ, включая НИОТ и ННИОТ, нацелены на обратную транскриптазу ; однако обратная транскриптаза ВИЧ-1 очень подвержена ошибкам, и поэтому мутации, вызывающие устойчивость, возникают быстро. [170] Устойчивые штаммы вируса ВИЧ появляются быстро, если используется только один противовирусный препарат. [171] Использование трех или более препаратов вместе, называемое комбинированной терапией , помогло контролировать эту проблему, но необходимы новые препараты из-за продолжающегося появления штаммов ВИЧ, устойчивых к лекарствам. [172]
Инфекции, вызванные грибами, являются причиной высокой заболеваемости и смертности у лиц с ослабленным иммунитетом , таких как больные ВИЧ/СПИДом, туберкулезом или получающие химиотерапию . [173] Грибы Candida , Cryptococcus neoformans и Aspergillus fumigatus вызывают большинство этих инфекций, и у всех из них наблюдается устойчивость к противогрибковым препаратам. [174] Множественная лекарственная устойчивость у грибов растет из-за широкого использования противогрибковых препаратов для лечения инфекций у лиц с ослабленным иммунитетом и использования некоторых сельскохозяйственных противогрибковых препаратов. [91] [175] Устойчивость к противогрибковым препаратам связана с повышенной смертностью.
Некоторые грибы (например, Candida krusei и флуконазол ) проявляют внутреннюю устойчивость к определенным противогрибковым препаратам или классам, тогда как некоторые виды развивают противогрибковую устойчивость к внешнему давлению. Противогрибковая устойчивость является проблемой One Health , вызванной множеством внешних факторов, включая широкое использование фунгицидов, чрезмерное использование клинических противогрибковых препаратов, изменение окружающей среды и факторы хозяина. [91]
В США резистентные к флуконазолу виды Candida и резистентность к азолам у Aspergillus fumigatus были выделены как растущая угроза. [84]
Более 20 видов Candida могут вызывать инфекцию кандидоза , наиболее распространенным из которых является Candida albicans . Дрожжи Candida обычно обитают на коже и слизистых оболочках, не вызывая инфекции. Однако чрезмерный рост Candida может привести к кандидозу. Некоторые виды Candida (например, Candida glabrata ) становятся устойчивыми к противогрибковым препаратам первой и второй линии, таким как эхинокандины и азолы . [84]
Появление Candida auris как потенциального человеческого патогена, который иногда проявляет устойчивость к противогрибковым препаратам нескольких классов, вызывает беспокойство и было связано с несколькими вспышками во всем мире. ВОЗ опубликовала список приоритетных грибковых патогенов, включая патогены с устойчивостью к противогрибковым препаратам. [176]
Выявление резистентности к противогрибковым препаратам подрывается ограниченной классической диагностикой инфекции, когда культура отсутствует, что препятствует тестированию восприимчивости. [91] Национальные и международные схемы надзора за грибковыми заболеваниями и резистентностью к противогрибковым препаратам ограничены, что затрудняет понимание бремени заболевания и связанной с ним резистентности. [91] Применение молекулярного тестирования для выявления генетических маркеров, связанных с резистентностью, может улучшить выявление резистентности к противогрибковым препаратам, но разнообразие мутаций, связанных с резистентностью, увеличивается среди видов грибков, вызывающих инфекцию. Кроме того, ряд механизмов резистентности зависят от повышения регуляции выбранных генов (например, рефлюксных насосов), а не от определенных мутаций, которые поддаются молекулярному обнаружению.
Из-за ограниченного числа противогрибковых препаратов в клиническом использовании и растущей глобальной заболеваемости противогрибковой резистентностью, использование существующих противогрибковых препаратов в комбинации может быть полезным в некоторых случаях, но необходимы дальнейшие исследования. Аналогичным образом, другие подходы, которые могут помочь бороться с возникновением противогрибковой резистентности, могут полагаться на разработку направленных на хозяина терапий, таких как иммунотерапия или вакцины. [91]
Простейшие паразиты, вызывающие такие заболевания, как малярия , трипаносомоз , токсоплазмоз , криптоспоридиоз и лейшманиоз , являются важными патогенами человека. [177]
Малярийные паразиты, устойчивые к препаратам, которые в настоящее время доступны для инфекций, распространены, и это привело к увеличению усилий по разработке новых лекарств. [178] Также сообщалось о резистентности к недавно разработанным препаратам, таким как артемизинин . Проблема лекарственной резистентности при малярии подтолкнула усилия по разработке вакцин. [179]
Трипаносомы — паразитические простейшие, вызывающие африканский трипаносомоз и болезнь Шагаса (американский трипаносомоз). [180] [181] Вакцин для профилактики этих инфекций не существует, поэтому для лечения инфекций используются такие препараты, как пентамидин и сурамин , бензнидазол и нифуртимокс . Эти препараты эффективны, но были зарегистрированы случаи инфекций, вызванных резистентными паразитами. [177]
Лейшманиоз вызывается простейшими и является важной проблемой общественного здравоохранения во всем мире, особенно в субтропических и тропических странах. Лекарственная устойчивость «стала серьезной проблемой». [182]


В 2022 году геномные эпидемиологи сообщили о результатах глобального исследования устойчивости к противомикробным препаратам с помощью геномной эпидемиологии на основе сточных вод , обнаружив большие региональные различия, предоставив карты и предположив, что гены устойчивости также передаются между видами микроорганизмов, которые не являются близкородственными. [184] [183] ВОЗ предоставляет отчеты Глобальной системы надзора за устойчивостью к противомикробным препаратам и их применением (GLASS), в которых обобщаются годовые (например, за 2020 год) данные по международной УПП, а также интерактивная панель управления. [185] [186]
По данным Министерства здравоохранения Англии , общее число инфекций, устойчивых к антибиотикам, в Англии выросло на 9 % — с 55 812 в 2017 году до 60 788 в 2018 году, однако потребление антибиотиков снизилось на 9 % — с 20,0 до 18,2 установленных суточных доз на 1000 жителей в день в период с 2014 по 2018 год. [187]
Центры по контролю и профилактике заболеваний сообщили, что было зарегистрировано более 2,8 миллионов случаев устойчивости к антибиотикам. Однако в 2019 году общее количество смертей от инфекций, устойчивых к антибиотикам, снизилось на 18%, а количество смертей в больницах снизилось на 30%. [188]
Пандемия COVID свела на нет большую часть прогресса, достигнутого в деле смягчения последствий устойчивости к антибиотикам, что привело к более широкому использованию антибиотиков, более резистентным инфекциям и меньшему количеству данных о профилактических мерах. [189] Количество госпитализированных инфекций и смертей увеличилось на 15% в 2020 году, и значительно более высокие показатели инфекций были зарегистрированы для 4 из 6 типов инфекций, связанных с оказанием медицинской помощи. [190]
1950–1970-е годы стали золотым веком открытия антибиотиков, когда было открыто бесчисленное множество новых классов антибиотиков для лечения ранее неизлечимых заболеваний, таких как туберкулез и сифилис. [191] Однако с тех пор открытие новых классов антибиотиков практически прекратилось, и ситуация становится особенно проблематичной, учитывая устойчивость бактерий [192], продемонстрированную с течением времени, а также продолжающееся неправильное и чрезмерное использование антибиотиков при лечении. [193]
Феномен устойчивости к противомикробным препаратам, вызванный чрезмерным использованием антибиотиков, был предсказан еще в 1945 году Александром Флемингом , который сказал: «Может наступить время, когда пенициллин сможет купить любой в магазине. Тогда есть опасность, что невежественный человек может легко недодозать себя и, подвергая свои микробы нелетальному количеству препарата, сделать их устойчивыми». [194] [195] Без создания новых и более сильных антибиотиков эпоха, когда обычные инфекции и незначительные травмы могут убить, и когда сложные процедуры, такие как хирургия и химиотерапия, станут слишком рискованными, является вполне реальной возможностью. [196] Устойчивость к противомикробным препаратам может привести к эпидемиям огромных масштабов, если не будут приняты превентивные меры. В наши дни текущая устойчивость к противомикробным препаратам приводит к более длительному пребыванию в больнице, более высоким медицинским расходам и повышенной смертности. [193]
С середины 1980-х годов фармацевтические компании инвестировали в лекарства от рака или хронических заболеваний, которые имеют больший потенциал для зарабатывания денег, и «снижали акцент или отказывались от разработки антибиотиков». [197] 20 января 2016 года на Всемирном экономическом форуме в Давосе , Швейцария , более «80 фармацевтических и диагностических компаний» со всего мира призвали к «трансформационным коммерческим моделям» на глобальном уровне для стимулирования исследований и разработок антибиотиков и «расширенного использования диагностических тестов, которые могут быстро идентифицировать инфекционный организм». [197] Ряд стран рассматривают или внедряют модели несвязанной оплаты для новых противомикробных препаратов, при которых оплата основана на стоимости, а не на объеме продаж лекарств. Это дает возможность платить за ценные новые лекарства, даже если они зарезервированы для использования при относительно редких инфекциях, устойчивых к лекарствам. [198]
Некоторые ученые, занимающиеся глобальным здравоохранением, утверждают, что для предотвращения и контроля устойчивости к противомикробным препаратам необходима глобальная правовая база. [199] [200] [201] [202] Например, обязательная глобальная политика может быть использована для создания стандартов использования противомикробных препаратов, регулирования маркетинга антибиотиков и укрепления глобальных систем надзора. [201] [199] Обеспечение соответствия участвующих сторон является сложной задачей. [201] Глобальная политика в отношении устойчивости к противомикробным препаратам может извлечь уроки из экологического сектора, приняв стратегии, которые сделали международные экологические соглашения успешными в прошлом, такие как: санкции за несоблюдение, помощь в реализации, правила принятия решений большинством голосов, независимая научная группа и конкретные обязательства. [203]
В бюджете Соединенных Штатов на 2016 год президент США Барак Обама предложил почти удвоить объем федерального финансирования для «борьбы с устойчивостью к антибиотикам и ее предотвращения» до более чем 1,2 млрд долларов. [204] Многие международные финансовые агентства, такие как USAID, DFID, SIDA и Фонд Билла и Мелинды Гейтс, пообещали выделить деньги на разработку стратегий по борьбе с устойчивостью к противомикробным препаратам. [ требуется ссылка ]
27 марта 2015 года Белый дом опубликовал всеобъемлющий план по решению растущей потребности агентств в борьбе с ростом устойчивых к антибиотикам бактерий. Целевая группа по борьбе с устойчивыми к антибиотикам бактериями разработала Национальный план действий по борьбе с устойчивыми к антибиотикам бактериями с целью предоставления дорожной карты для руководства США в борьбе с устойчивостью к антибиотикам и с надеждой на спасение многих жизней. В этом плане изложены шаги, которые предпримет федеральное правительство в течение следующих пяти лет, необходимые для предотвращения и сдерживания вспышек устойчивых к антибиотикам инфекций; поддержания эффективности антибиотиков, уже имеющихся на рынке; и содействия разработке будущих диагностических средств, антибиотиков и вакцин. [205]
План действий был разработан вокруг пяти целей с фокусом на укрепление здравоохранения, общественного здравоохранения, ветеринарии, сельского хозяйства, безопасности пищевых продуктов и исследований, а также производства. Эти цели, перечисленные Белым домом, следующие:
Ниже приведены цели, которые необходимо достичь к 2020 году: [205]
Текущее состояние AMR в США
По состоянию на 2023 год устойчивость к противомикробным препаратам (УПП) остается значительной угрозой общественному здравоохранению в Соединенных Штатах. Согласно отчету Центров по контролю и профилактике заболеваний за 2023 год об угрозах устойчивости к антибиотикам, в США ежегодно регистрируется более 2,8 миллиона инфекций, устойчивых к антибиотикам, что ежегодно приводит к не менее чем 35 000 смертей. [206] Среди наиболее опасных резистентных патогенов — устойчивые к карбапенемам энтеробактерии (CRE), устойчивый к метициллину золотистый стафилококк (MRSA) и Clostridioides difficile (C. diff), все из которых продолжают вызывать тяжелые внутрибольничные инфекции (ИСМП).
Пандемия COVID-19 привела к значительному нарушению в здравоохранении, с увеличением использования антибиотиков при лечении вирусных инфекций. Этот рост назначения антибиотиков в сочетании с перегруженностью систем здравоохранения способствовали возобновлению AMR в годы пандемии. Отчет CDC за 2021 год выявил резкое увеличение числа случаев ИСМП, вызванных резистентными патогенами у пациентов с COVID-19, и эта тенденция сохранилась и в 2023 году. [207] Последние данные свидетельствуют о том, что, хотя использование антибиотиков снизилось после пандемии, некоторые резистентные патогены по-прежнему распространены в медицинских учреждениях. [206]
CDC также расширил свою кампанию Get Ahead of Sepsis в 2023 году, сосредоточившись на повышении осведомленности о роли AMR в сепсисе и содействии разумному использованию антибиотиков как в медицинских учреждениях, так и в общественных местах. [208] Эта инициатива охватила миллионы людей через социальные сети, медицинские учреждения и пропаганду общественного здравоохранения, направленную на информирование общественности о важности профилактики инфекций и сокращения неправильного использования антибиотиков.
По данным Всемирной организации здравоохранения , политики могут помочь в борьбе с резистентностью путем укрепления возможностей отслеживания резистентности и лабораторных исследований, а также путем регулирования и поощрения надлежащего использования лекарственных средств. [15] Политики и промышленность могут помочь в борьбе с резистентностью путем: содействия инновациям, исследованиям и разработке новых инструментов; и содействия сотрудничеству и обмену информацией между всеми заинтересованными сторонами. [15]
Правительство США продолжает уделять первоочередное внимание смягчению последствий AMR посредством политики и законодательства. В 2023 году был опубликован Национальный план действий по борьбе с бактериями, устойчивыми к антибиотикам (CARB) на 2023–2028 годы, в котором изложены стратегические цели по сокращению инфекций, устойчивых к антибиотикам, продвижению профилактики инфекций и ускорению исследований новых антибиотиков. [209] В плане также подчеркивается важность улучшения управления антибиотиками в здравоохранении, сельском хозяйстве и ветеринарии. Кроме того, Закон ПАСТЕРА (Пионерские подписки на антимикробные препараты для прекращения роста устойчивости) набирает обороты в Конгрессе. В случае принятия законопроект создаст модель оплаты на основе подписки для стимулирования разработки новых противомикробных препаратов, одновременно поддерживая программы управления противомикробными препаратами для сокращения неправильного использования существующих антибиотиков. [210] Это законодательство считается критически важным шагом на пути к устранению экономических барьеров для разработки новых противомикробных препаратов.
Измерение затрат и выгод стратегий по борьбе с AMR является сложным, и политика может иметь эффект только в отдаленном будущем. В других инфекционных заболеваниях эта проблема решалась с помощью математических моделей. Необходимы дополнительные исследования, чтобы понять, как развивается и распространяется AMR, чтобы математическое моделирование можно было использовать для прогнозирования вероятных эффектов различных политик. [211]

Различение инфекций, требующих антибиотиков, от самоограничивающихся инфекций является клинически сложной задачей. Для того чтобы направлять надлежащее использование антибиотиков и предотвращать развитие и распространение устойчивости к противомикробным препаратам, необходимы диагностические тесты, которые предоставляют врачам своевременные и действенные результаты.
Острое лихорадочное заболевание является распространенной причиной обращения за медицинской помощью во всем мире и основной причиной заболеваемости и смертности. В районах со снижающейся заболеваемостью малярией многие лихорадящие пациенты неправильно лечатся от малярии, и при отсутствии простого диагностического теста для выявления альтернативных причин лихорадки врачи предполагают, что немалярийное лихорадочное заболевание, скорее всего, является бактериальной инфекцией, что приводит к ненадлежащему использованию антибиотиков. Многочисленные исследования показали, что использование экспресс-тестов на малярию без надежных инструментов для различения других причин лихорадки привело к увеличению использования антибиотиков. [212]
Тестирование чувствительности к антимикробным препаратам (AST) может способствовать подходу точной медицины к лечению, помогая врачам назначать более эффективную и целенаправленную антимикробную терапию. [213] В то же время при традиционном фенотипическом AST может потребоваться от 12 до 48 часов для получения результата из-за времени, необходимого для роста организмов на/в культуральной среде. [214] Быстрое тестирование, возможное благодаря инновациям в области молекулярной диагностики , определяется как «выполнимое в течение 8-часовой рабочей смены». [214] Существует несколько коммерческих анализов, одобренных Управлением по контролю за продуктами питания и лекарственными средствами, которые могут обнаруживать гены AMR из различных типов образцов. Прогресс был медленным из-за ряда причин, включая стоимость и регулирование. [215] Однако методы генотипической характеристики AMR все чаще используются в сочетании с алгоритмами машинного обучения в исследованиях, чтобы помочь лучше предсказать фенотипическую AMR из генотипа организма. [216] [217]
Оптические методы, такие как фазово-контрастная микроскопия в сочетании с анализом отдельных клеток, являются еще одним мощным методом мониторинга роста бактерий. В 2017 году ученые из Уппсальского университета в Швеции опубликовали метод [218] , который применяет принципы микрофлюидики и отслеживания клеток, чтобы контролировать реакцию бактерий на антибиотики менее чем за 30 минут общего времени манипуляции. Это изобретение было удостоено премии Longitude Prize в размере 8 млн фунтов стерлингов по AMR в 2024 году. Недавно эта платформа была усовершенствована путем соединения микрофлюидного чипа с оптическим пинцетом [219] для того, чтобы изолировать бактерии с измененным фенотипом непосредственно из аналитической матрицы.
Быстрые методы диагностики также были опробованы в качестве антимикробных вмешательств для влияния на факторы здравоохранения, способствующие AMR. Было показано, что измерение сывороточного прокальцитонина снижает уровень смертности, потребление антимикробных препаратов и побочные эффекты, связанные с антимикробными препаратами, у пациентов с респираторными инфекциями, но влияние на AMR пока не было продемонстрировано. [220] Аналогичным образом, было показано, что тестирование сыворотки на воспалительный биомаркер C-реактивный белок в месте оказания помощи влияет на показатели назначения антимикробных препаратов в этой когорте пациентов, но необходимы дальнейшие исследования, чтобы продемонстрировать влияние на показатели AMR. [221] Клинические исследования для исключения бактериальных инфекций часто проводятся для пациентов с острыми респираторными инфекциями у детей. В настоящее время неясно, влияет ли быстрое вирусное тестирование на применение антибиотиков у детей. [222]
Вакцины являются неотъемлемой частью мер по снижению AMR, поскольку они предотвращают инфекции, сокращают использование и чрезмерное использование противомикробных препаратов и замедляют появление и распространение патогенов, устойчивых к лекарственным препаратам. [7] Микроорганизмы обычно не развивают устойчивость к вакцинам , поскольку вакцины уменьшают распространение инфекции и воздействуют на патоген несколькими способами у одного и того же хозяина и, возможно, по-разному у разных хозяев. Кроме того, если использование вакцин увеличится, есть доказательства того, что устойчивые к антибиотикам штаммы патогенов уменьшатся; потребность в антибиотиках естественным образом снизится, поскольку вакцины предотвращают инфекцию до ее возникновения. [223] В отчете ВОЗ за 2024 год говорится, что вакцины против 24 патогенов могут сократить количество необходимых антибиотиков на 22% или на 2,5 миллиарда определенных суточных доз во всем мире каждый год. [7] Если бы вакцины можно было развернуть против всех оцененных патогенов, они могли бы сэкономить треть расходов больниц, связанных с AMR. [7] Вакцинированные люди реже болеют инфекциями и защищены от возможных осложнений от вторичных инфекций, которые могут потребовать приема противомикробных препаратов или госпитализации. [7] Однако существуют хорошо документированные случаи резистентности к вакцинам, хотя они обычно представляют собой гораздо меньшую проблему, чем резистентность к противомикробным препаратам. [224] [225]
Хотя теоретически многообещающие, антистафилококковые вакцины показали ограниченную эффективность из-за иммунологических различий между видами стафилококков и ограниченной продолжительности эффективности вырабатываемых антител. Ведутся разработка и тестирование более эффективных вакцин. [226]
Два регистрационных испытания оценивали вакцины-кандидаты в стратегиях активной иммунизации против инфекции S. aureus . В испытании фазы II бивалентная вакцина капсульных белков 5 и 8 была испытана на 1804 пациентах, находящихся на гемодиализе, с первичной фистулой или синтетическим сосудистым доступом. Через 40 недель после вакцинации защитный эффект был замечен против бактериемии S. aureus , но не через 54 недели после вакцинации. [227] На основании этих результатов было проведено второе испытание, которое не показало эффективности. [228]
Merck протестировала вакцину V710, нацеленную на IsdB, в слепом рандомизированном исследовании на пациентах, перенесших срединную стернотомию. Исследование было прекращено после того, как у реципиентов V710 был обнаружен более высокий уровень смертности, связанной с недостаточностью полиорганной системы. Реципиенты вакцины, у которых развилась инфекция S. aureus, имели в пять раз большую вероятность умереть, чем контрольные реципиенты, у которых развилась инфекция S. aureus . [229]
Многочисленные исследователи предполагали, что вакцина с несколькими антигенами была бы более эффективной, однако отсутствие биомаркеров, определяющих защитный иммунитет человека, оставляет эти предложения на логическом, но строго гипотетическом уровне. [228]
Антитела являются многообещающими против устойчивости к противомикробным препаратам. Моноклональные антитела (mAbs) нацелены на факторы бактериальной вирулентности, способствуя уничтожению бактерий посредством различных механизмов. Три одобренных FDA антитела нацелены на токсины B. anthracis и C. difficile . [230] [231] Инновационные стратегии включают DSTA4637S, конъюгат антитела-антибиотика, и MEDI13902, биспецифическое антитело, нацеленное на компоненты Pseudomonas aeruginosa. [231]
Альтернативная терапия — это предлагаемый метод, при котором два или три антибиотика принимаются поочередно вместо приема только одного антибиотика, так что бактерии, устойчивые к одному антибиотику, погибают при приеме следующего антибиотика. Исследования показали, что этот метод снижает скорость появления устойчивых к антибиотикам бактерий in vitro по сравнению с одним препаратом в течение всего периода. [232]
Исследования показали, что бактерии, которые развивают устойчивость к антибиотикам по отношению к одной группе антибиотиков, могут стать более чувствительными к другим. [233] Это явление можно использовать для отбора против резистентных бактерий с использованием подхода, называемого цикличностью побочной чувствительности, который недавно оказался актуальным при разработке стратегий лечения хронических инфекций, вызванных Pseudomonas aeruginosa . [234] Несмотря на свои обещания, крупномасштабные клинические и экспериментальные исследования выявили ограниченные доказательства восприимчивости к цикличности антибиотиков среди различных патогенов. [235] [236]
С момента открытия антибиотиков усилия по научным исследованиям и разработкам (НИОКР) своевременно предоставляли новые препараты для лечения бактерий, которые стали устойчивыми к старым антибиотикам, но в 2000-х годах возникла обеспокоенность тем, что разработка замедлилась настолько, что у тяжелобольных людей могут закончиться варианты лечения. [237] [238] Другая проблема заключается в том, что врачи могут неохотно проводить рутинные операции из-за повышенного риска опасной инфекции. [239] Резервное лечение может иметь серьезные побочные эффекты; например, антибиотики, такие как аминогликозиды (такие как амикацин , гентамицин , канамицин , стрептомицин и т. д.), используемые для лечения лекарственно-устойчивого туберкулеза и муковисцидоза, могут вызывать респираторные расстройства, глухоту и почечную недостаточность. [240] [241]
Потенциальный кризис налицо является результатом заметного сокращения отраслевых исследований и разработок. [242] [243] Недостаточные финансовые инвестиции в исследования антибиотиков усугубили ситуацию. [244] [242] Фармацевтическая промышленность имеет мало стимулов инвестировать в антибиотики из-за высокого риска и потому, что потенциальная финансовая прибыль с меньшей вероятностью покроет стоимость разработки , чем для других фармацевтических препаратов. [245] В 2011 году Pfizer , одна из последних крупных фармацевтических компаний, разрабатывающих новые антибиотики, закрыла свои основные исследовательские усилия, сославшись на низкую доходность акционеров по сравнению с препаратами для лечения хронических заболеваний. [246] Однако малые и средние фармацевтические компании по-прежнему активно занимаются исследованиями антибиотиков. В частности, помимо классических методологий синтетической химии, исследователи разработали комбинаторную платформу синтетической биологии на уровне отдельных клеток в высокопроизводительном скрининговом режиме для диверсификации новых лантхипептидов . [247]
За 5–10 лет с 2010 года произошли значительные изменения в способах открытия и разработки новых антимикробных препаратов — в основном за счет формирования государственно-частных инициатив финансирования. К ним относятся CARB-X [ 248] , который фокусируется на неклинической и ранней фазе разработки новых антибиотиков, вакцин, быстрой диагностики; Novel Gram Negative Antibiotic (GNA-NOW) [249] , который является частью Инициативы ЕС по инновационным лекарственным средствам ; и Replenishing and Enabling the Pipeline for Anti-infective Resistance Impact Fund (REPAIR). [250] Более поздняя стадия клинической разработки поддерживается Фондом действий по борьбе с АМР, который, в свою очередь, поддерживается несколькими инвесторами с целью разработки 2–4 новых противомикробных препаратов к 2030 году. Проведение этих испытаний облегчается национальными и международными сетями, поддерживаемыми Сетью клинических исследований Национального института исследований в области здравоохранения и ухода (NIHR), Европейским альянсом клинических исследований по инфекционным заболеваниям (ECRAID) и недавно сформированной ADVANCE-ID, которая является сетью клинических исследований, базирующейся в Азии. [251] Глобальное партнерство по исследованиям и разработкам противомикробных препаратов (GARDP) генерирует новые доказательства глобальных угроз АМР, таких как неонатальный сепсис, лечение серьезных бактериальных инфекций и инфекций, передающихся половым путем, а также решает проблему глобального доступа к новым и стратегически важным антибактериальным препаратам. [252]
Открытие и разработка новых противомикробных препаратов были облегчены нормативными достижениями, которые в основном возглавлялись Европейским агентством по лекарственным средствам (EMA) и Управлением по контролю за продуктами и лекарствами (FDA). Эти процессы все больше согласуются, хотя остаются важные различия, и разработчикам лекарств приходится готовить отдельные документы. Были разработаны новые пути разработки, чтобы помочь с одобрением новых противомикробных препаратов, которые удовлетворяют неудовлетворенные потребности, такие как Ограниченный популяционный путь для антибактериальных и противогрибковых препаратов (LPAD). Эти новые пути необходимы из-за трудностей в проведении крупных окончательных клинических испытаний фазы III своевременно.
Некоторые экономические препятствия для разработки новых противомикробных препаратов были устранены с помощью инновационных схем возмещения, которые отделяют оплату противомикробных препаратов от продаж на основе объема. В Великобритании схема вознаграждения за выход на рынок была впервые предложена Национальным институтом клинического совершенства (NICE), в рамках которой ежегодная абонентская плата выплачивается за использование стратегически ценных противомикробных препаратов — цефидерокол и цефтазидим-авиабактам являются первыми препаратами, которые будут использоваться таким образом, и эта схема является потенциальным образцом для сопоставимых программ в других странах.
Доступные классы противогрибковых препаратов по-прежнему ограничены, но по состоянию на 2021 год разрабатываются новые классы противогрибковых препаратов, которые проходят различные стадии клинических испытаний для оценки эффективности. [253]
Ученые начали использовать передовые вычислительные подходы с суперкомпьютерами для разработки новых производных антибиотиков для борьбы с устойчивостью к противомикробным препаратам. [243] [254] [255]
Использование альтернатив без антибиотиков при лечении костных инфекций может помочь снизить использование антибиотиков и, таким образом, устойчивость к противомикробным препаратам. [35] Материал для регенерации костей биоактивное стекло S53P4 показало эффективность подавления роста до 50 клинически значимых бактерий, включая MRSA и MRSE. [256] [257] [258]
В течение последних десятилетий медные и серебряные наноматериалы продемонстрировали привлекательные особенности для разработки нового семейства противомикробных агентов. [259] Наночастицы (1-100 нм) демонстрируют уникальные свойства и обещают быть противомикробными агентами против резистентных бактерий. Серебро (AgNP) и наночастицы золота (AuNP) широко изучаются, разрушая бактериальные клеточные мембраны и мешая синтезу белка. Наночастицы оксида цинка (ZnO NP), меди (CuNP) и кремния (SiNP) также проявляют противомикробные свойства. Однако высокие затраты на синтез, потенциальная токсичность и нестабильность создают проблемы. Чтобы преодолеть их, изучаются методы биологического синтеза и комбинированная терапия с другими противомикробными препаратами. Также изучаются улучшенная биосовместимость и нацеливание для повышения эффективности. [231]
Подобно ситуации с терапией малярии, где были найдены успешные методы лечения, основанные на древних рецептах [260], уже достигнуты определенные успехи в поиске и тестировании древних лекарств и других методов лечения, которые эффективны против бактерий AMR. [261]
Одним из ключевых инструментов, определенных ВОЗ и другими для борьбы с ростом устойчивости к противомикробным препаратам, является улучшенный надзор за распространением и перемещением генов AMR в различных сообществах и регионах. Недавние достижения в высокопроизводительном секвенировании ДНК в результате проекта «Геном человека» привели к возможности определять отдельные микробные гены в образце. [262] Наряду с наличием баз данных известных генов устойчивости к противомикробным препаратам, таких как Comprehensive Antimicrobial Resistance Database (CARD) [263] [264] и ResFinder , [265] [266] это позволяет идентифицировать все гены устойчивости к противомикробным препаратам в образце – так называемый « резистом ». При этом можно определить профиль этих генов в сообществе или среде, что дает представление о том, как устойчивость к противомикробным препаратам распространяется в популяции, и позволяет идентифицировать устойчивость, которая вызывает беспокойство. [262]
Фаготерапия — это терапевтическое использование бактериофагов для лечения патогенных бактериальных инфекций . [267] Фаготерапия имеет множество потенциальных применений в медицине, а также в стоматологии, ветеринарии и сельском хозяйстве. [268]
Фаготерапия основана на использовании природных бактериофагов для заражения и лизиса бактерий в месте заражения хозяина. Благодаря современным достижениям в области генетики и биотехнологии эти бактериофаги, возможно, могут быть изготовлены для лечения определенных инфекций. [269] Фаги могут быть биоинженерными для борьбы с бактериальными инфекциями с множественной лекарственной устойчивостью, и их использование включает дополнительное преимущество предотвращения уничтожения полезных бактерий в организме человека. [30] Фаги разрушают стенки и мембраны бактериальных клеток с помощью литических белков, которые убивают бактерии, проделывая множество отверстий изнутри наружу. [270] Бактериофаги могут даже обладать способностью переваривать биопленку , которую образуют многие бактерии, защищающую их от антибиотиков, чтобы эффективно заражать и убивать бактерии. Биоинженерия может сыграть свою роль в создании успешных бактериофагов. [270]
Понимание взаимодействий и эволюции популяций бактерий и фагов в среде организма человека или животного имеет важное значение для рациональной фаговой терапии. [271]
Бактериофаги используются против бактерий, устойчивых к антибиотикам, в Грузии ( Институт Джорджа Элиавы ) и в одном институте во Вроцлаве , Польша. [272] [273] Коктейли с бактериофагами являются распространенными препаратами, продающимися без рецепта в аптеках восточных стран. [274] [275] В Бельгии четыре пациента с тяжелыми инфекциями опорно-двигательного аппарата получили терапию бактериофагами с сопутствующими антибиотиками. После одного курса терапии фагами рецидива инфекции не произошло, и не было обнаружено никаких серьезных побочных эффектов, связанных с терапией. [276]