Органическая химия — раздел химии , занимающийся научным изучением структуры, свойств и реакций органических соединений и органических материалов , т. е. вещества в его различных формах, содержащих атомы углерода . [1] Изучение строения определяет их структурную формулу . Изучение свойств включает физические и химические свойства , а также оценку химической реактивности для понимания их поведения. Изучение органических реакций включает химический синтез природных продуктов , лекарств и полимеров , а также изучение отдельных органических молекул в лаборатории и посредством теоретического ( in silico ) исследования.
В круг химических веществ, изучаемых в органической химии, входят углеводороды (соединения, содержащие только углерод и водород ), а также соединения на основе углерода, но содержащие и другие элементы, [1] [2] [3] особенно кислород , азот , серу , фосфор ( входит во многие биохимические вещества ) и галогены . Металлоорганическая химия – это изучение соединений, содержащих связи углерод– металл .
Кроме того, современные исследования сосредоточены на органической химии с участием других металлоорганических соединений , включая лантаноиды , но особенно переходных металлов цинка, меди, палладия, никеля, кобальта, титана и хрома.
Органические соединения составляют основу всей земной жизни и составляют большинство известных химических веществ. Структура связей углерода с его четырехвалентной валентностью (формальные одинарные, двойные и тройные связи, а также структуры с делокализованными электронами) делает множество органических соединений структурно разнообразными, а диапазон их применения огромным. Они составляют основу или являются составными частями многих коммерческих продуктов, включая фармацевтические препараты ; нефтехимия и агрохимия , а также продукция из них, включая смазочные материалы , растворители ; пластмассы ; топливо и взрывчатые вещества . Изучение органической химии пересекается с металлоорганической химией и биохимией , а также с медицинской химией , химией полимеров и материаловедением . [1]

До XVIII века химики вообще считали, что соединения, полученные из живых организмов, наделены жизненной силой, отличающей их от неорганических соединений . Согласно концепции витализма (теории жизненной силы), органическое вещество было наделено «жизненной силой». [4] В первой половине девятнадцатого века были опубликованы некоторые из первых систематических исследований органических соединений. Около 1816 года Мишель Шеврёль начал исследование мыла , изготовленного из различных жиров и щелочей . Он выделил кислоты, которые в сочетании со щелочью дали мыло. Поскольку все это были отдельные соединения, он продемонстрировал, что можно производить химические изменения в различных жирах (которые традиционно происходят из органических источников), производя новые соединения без «жизненной силы». В 1828 году Фридрих Вёлер получил органическую химическую мочевину (карбамид), составляющую мочу , из неорганических исходных материалов (солей цианата калия и сульфата аммония ) в ходе процесса, который сейчас называется синтезом Велера . Хотя сам Велер с осторожностью относился к заявлениям о том, что он опроверг витализм, это был первый случай, когда вещество, считавшееся органическим, было синтезировано в лаборатории без биологических (органических) исходных материалов. Сейчас это событие общепризнано как действительно опровергающее доктрину витализма. [5]
В 1856 году Уильям Генри Перкин , пытаясь произвести хинин , случайно получил органический краситель , ныне известный как лиловый Перкин . Его открытие, ставшее широко известным благодаря финансовому успеху, значительно повысило интерес к органической химии. [6]
Решающим прорывом в органической химии стала концепция химической структуры, независимо разработанная в 1858 году Фридрихом Августом Кекуле и Арчибальдом Скоттом Купером . [7] Оба исследователя предположили, что атомы четырехвалентного углерода могут связываться друг с другом, образуя углеродную решетку, и что подробные закономерности атомных связей можно различить путем умелой интерпретации соответствующих химических реакций. [8]
Эра фармацевтической промышленности началась в последнем десятилетии XIX века, когда немецкая компания Bayer впервые произвела ацетилсалициловую кислоту, более известную как аспирин . [9] К 1910 году Пауль Эрлих и его лабораторная группа начали разрабатывать основанный на мышьяке арсфенамин ( Сальварсан) как первое эффективное лекарственное средство от сифилиса и тем самым положили начало медицинской практике химиотерапии . Эрлих популяризировал концепцию «волшебных лекарств» и систематического улучшения лекарственной терапии. [10] [11] Его лаборатория внесла решающий вклад в разработку антисыворотки против дифтерии и стандартизацию терапевтических сывороток. [12]

Ранние примеры органических реакций и их применения часто находили благодаря удаче и подготовке к неожиданным наблюдениям. Однако вторая половина XIX века стала свидетелем систематических исследований органических соединений. Показательно появление синтетического индиго. Производство индиго из растительных источников упало с 19 000 тонн в 1897 году до 1 000 тонн к 1914 году благодаря синтетическим методам, разработанным Адольфом фон Байером . В 2002 году из нефтехимических продуктов было произведено 17 000 тонн синтетического индиго . [14]
В начале 20 века было показано, что полимеры и ферменты представляют собой крупные органические молекулы, а нефть имеет биологическое происхождение.
Многостадийный синтез сложных органических соединений называется полным синтезом. Общий синтез сложных природных соединений усложнился до глюкозы и терпинеола . Например, соединения, связанные с холестерином , открыли пути синтеза сложных гормонов человека и их модифицированных производных. С начала 20 века сложность общего синтеза возросла и теперь включает молекулы высокой сложности, такие как лизергиновая кислота и витамин B 12 . [15]

Открытие нефти и развитие нефтехимической промышленности стимулировали развитие органической химии. Преобразование отдельных нефтяных соединений в типы соединений с помощью различных химических процессов привело к органическим реакциям , позволяющим создавать широкий спектр промышленных и коммерческих продуктов, включая, среди (многих) других: пластмассы , синтетический каучук , органические клеи и различные нефтяные присадки и катализаторы , модифицирующие свойства. .
Большинство химических соединений, встречающихся в биологических организмах, представляют собой соединения углерода, поэтому связь между органической химией и биохимией настолько тесна, что биохимию можно рассматривать, по существу, как раздел органической химии. Хотя история биохимии может охватывать около четырех столетий, фундаментальное понимание этой области начало развиваться только в конце 19 века, а сам термин «биохимия» был придуман примерно в начале 20 века. Исследования в этой области росли на протяжении всего двадцатого века, без каких-либо признаков замедления темпов роста, что можно подтвердить путем проверки служб абстрагирования и индексирования, таких как BIOSIS Previews и Biological Abstracts , которые начались в 1920-х годах как единый ежегодный том. , но разрослась настолько резко, что к концу 20-го века она была доступна обычному пользователю только как электронная онлайн- база данных . [16]
Поскольку органические соединения часто существуют в виде смесей , для оценки чистоты также были разработаны различные методы; Методы хроматографии особенно важны для этого применения и включают ВЭЖХ и газовую хроматографию . Традиционные методы разделения включают дистилляцию , кристаллизацию , выпаривание , магнитную сепарацию и экстракцию растворителем .
Органические соединения традиционно характеризовались с помощью различных химических тестов, называемых «мокрыми методами», но такие тесты в значительной степени были вытеснены спектроскопическими или другими компьютерными методами анализа. [17] Основные аналитические методы перечислены в приблизительном порядке полезности:
Традиционные спектроскопические методы, такие как инфракрасная спектроскопия , оптическое вращение и спектроскопия UV/VIS , предоставляют относительно неспецифическую структурную информацию, но продолжают использоваться для конкретных приложений. Показатель преломления и плотность также могут быть важны для идентификации веществ.
Физические свойства органических соединений, обычно представляющие интерес, включают как количественные, так и качественные характеристики. Количественная информация включает температуру плавления, температуру кипения, растворимость и показатель преломления. К качественным свойствам относятся запах, консистенция и цвет.
Органические соединения обычно плавятся, а многие из них кипят. Напротив, хотя неорганические материалы обычно можно плавить, многие из них не кипятят, а вместо этого имеют тенденцию разлагаться. Раньше температура плавления (т. пл.) и температура кипения (т. пл.) предоставляли важную информацию о чистоте и идентичности органических соединений. Точки плавления и кипения коррелируют с полярностью молекул и их молекулярной массой. Некоторые органические соединения, особенно симметричные, возвышенны . Хорошо известным примером сублимируемого органического соединения является пара-дихлорбензол , пахучий компонент современных нафталиновых шариков. Органические соединения обычно не очень стабильны при температуре выше 300 °C, хотя существуют некоторые исключения.
Нейтральные органические соединения имеют тенденцию быть гидрофобными ; то есть они менее растворимы в воде, чем неорганические растворители. Исключением являются органические соединения, содержащие ионизируемые группы, а также низкомолекулярные спирты , амины и карбоновые кислоты , в которых возникает водородная связь . В противном случае органические соединения имеют тенденцию растворяться в органических растворителях . Растворимость широко варьируется в зависимости от органического растворителя и органического растворителя.
В зависимости от применения представляют интерес различные специализированные свойства молекулярных кристаллов и органических полимеров с сопряженными системами , например, термомеханические и электромеханические, такие как пьезоэлектричество , электропроводность (см. проводящие полимеры и органические полупроводники ) и электрооптические (например, неэлектрические) . линейная оптика ) свойства. По историческим причинам подобные свойства являются в основном предметом изучения наук о полимерах и материаловедения .

Названия органических соединений бывают либо систематическими, логически вытекающими из свода правил, либо несистематическими, подчиняющимися различным традициям. Систематическая номенклатура предусмотрена спецификациями IUPAC (Международного союза теоретической и прикладной химии). Систематическая номенклатура начинается с названия родительской структуры внутри интересующей молекулы. Это родительское имя затем модифицируется префиксами, суффиксами и числами, чтобы однозначно передать структуру. Учитывая, что известны миллионы органических соединений, строгое использование систематических названий может быть затруднительным. Таким образом, рекомендации ИЮПАК более тщательно соблюдаются для простых соединений, но не для сложных молекул. Чтобы использовать систематическое именование, необходимо знать структуры и имена родительских структур. Родительские структуры включают незамещенные углеводороды, гетероциклы и их монофункционализированные производные.
Несистематическая номенклатура проще и однозначнее, по крайней мере, для химиков-органиков. Несистематические названия не указывают на структуру соединения. Они свойственны сложным молекулам, к которым относится большинство натуральных продуктов. Таким образом, неофициально названный диэтиламид лизергиновой кислоты систематически именуется (6a R ,9 R )-N , N - диэтил-7-метил-4,6,6a,7,8,9-гексагидроиндоло-[4,3- fg ] хинолин-9-карбоксамид.
С ростом использования вычислительной техники появились и другие методы именования, предназначенные для интерпретации машинами. Два популярных формата — SMILES и InChI .
Органические молекулы чаще всего описываются рисунками или структурными формулами , комбинациями рисунков и химических символов. Формула линейного угла проста и однозначна. В этой системе концы и пересечения каждой линии представляют один углерод, а атомы водорода можно либо обозначить явно, либо предположить, что они присутствуют, как это подразумевается под четырехвалентным углеродом.

К 1880 году произошел взрыв числа открываемых химических соединений, чему способствовали новые синтетические и аналитические методы. Гриньяр описал ситуацию как «chaos le plus complet» (полный хаос). Из-за отсутствия условностей одно и то же соединение могло иметь несколько названий. Это привело к созданию Женевских правил в 1892 году. [18]
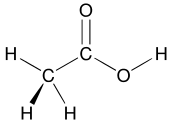
Концепция функциональных групп занимает центральное место в органической химии как средство классификации структур и предсказания свойств. Функциональная группа представляет собой молекулярный модуль, и предполагается, что реакционная способность этой функциональной группы в определенных пределах одинакова во множестве молекул. Функциональные группы могут оказывать решающее влияние на химические и физические свойства органических соединений. Молекулы классифицируются в зависимости от их функциональных групп. Например, все спирты имеют субъединицу COH. Все спирты имеют тенденцию быть в некоторой степени гидрофильными , обычно образуют сложные эфиры и обычно могут превращаться в соответствующие галогениды . Большинство функциональных групп содержат гетероатомы (атомы, отличные от C и H). Органические соединения классифицируются по функциональным группам: спирты, карбоновые кислоты, амины и т. д. [19] Функциональные группы делают молекулу более кислой или основной из-за их электронного влияния на окружающие части молекулы.
По мере того, как p K a (так называемая основность ) молекулярной присоединения/функциональной группы увеличивается, при измерении увеличивается сила соответствующего диполя . Диполь, направленный в сторону функциональной группы (более высокое p K a, следовательно, основная природа группы), указывает на нее и уменьшается по силе с увеличением расстояния. Дипольное расстояние (измеряется в ангстремах ) и стерические препятствия функциональной группе оказывают межмолекулярное и внутримолекулярное влияние на окружающую среду и уровень pH .
Различные функциональные группы имеют разные значения p K a и силу связи (одинарную, двойную, тройную), что приводит к повышенной электрофильности при более низком p K a и увеличению силы нуклеофила при более высоком p K a . Более основные/нуклеофильные функциональные группы стремятся атаковать электрофильную функциональную группу с более низким p K a на другой молекуле (межмолекулярная) или внутри той же молекулы (внутримолекулярная). Любая группа с чистым кислотным значением p K a , находящимся в пределах диапазона, например ацильная или карбонильная группа, является честной добычей. Поскольку вероятность воздействия снижается с увеличением p K a , наиболее вероятно, что атаке подвергаются ацилхлоридные компоненты с наименьшими измеренными значениями p K a , за которыми следуют карбоновые кислоты (p K a =4), тиолы (13), малонаты (13), спирты (17), альдегиды (20), нитрилы (25), сложные эфиры (25), затем амины (35). [20] Амины являются очень основными и являются отличными нуклеофилами/атакаторами.
Алифатические углеводороды подразделяются на три группы гомологического ряда по степени их насыщенности :
Остальная часть группы классифицируется в соответствии с присутствующими функциональными группами. Такие соединения могут быть «прямыми», разветвленными или циклическими. Степень разветвления влияет на такие характеристики, как октановое или цетановое число в химии нефти.
Как насыщенные ( алициклические ) соединения, так и ненасыщенные соединения существуют в виде циклических производных. Наиболее стабильные кольца содержат пять или шесть атомов углерода, но распространены большие кольца (макроциклы) и кольца меньшего размера. Самым маленьким семейством циклоалканов является трехчленный циклопропан ((CH 2 ) 3 ). Насыщенные циклические соединения содержат только одинарные связи, тогда как ароматические кольца имеют чередующуюся (или сопряженную) двойную связь. Циклоалканы не содержат кратных связей, в отличие от циклоалкенов и циклоалкинов.
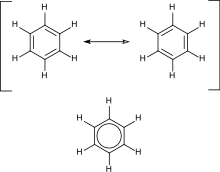
Ароматические углеводороды содержат сопряженные двойные связи. Это означает, что каждый атом углерода в кольце находится в состоянии sp2-гибридизации, что обеспечивает дополнительную стабильность. Наиболее важным примером является бензол , структура которого была сформулирована Кекуле , который первым предложил принцип делокализации или резонанса для объяснения его структуры. Для «обычных» циклических соединений ароматичность обеспечивается наличием 4n + 2 делокализованных пи-электронов, где n — целое число. Особую нестабильность ( антиароматичность ) придает присутствие 4n-сопряженных пи-электронов.
Характеристики циклических углеводородов снова изменяются, если присутствуют гетероатомы, которые могут существовать либо как заместители, присоединенные снаружи к кольцу (экзоциклические), либо как члены самого кольца (эндоциклические). В последнем случае кольцо называется гетероциклом . Пиридин и фуран являются примерами ароматических гетероциклов, тогда как пиперидин и тетрагидрофуран являются соответствующими алициклическими гетероциклами. Гетероатомом гетероциклических молекул обычно является кислород, сера или азот, причем последний особенно распространен в биохимических системах.
Гетероциклы обычно встречаются в широком спектре продуктов, включая анилиновые красители и лекарства. Кроме того, они распространены в широком спектре биохимических соединений, таких как алкалоиды , витамины, стероиды и нуклеиновые кислоты (например, ДНК, РНК).
Кольца могут сливаться с другими кольцами по краю, образуя полициклические соединения . Пуриновые нуклеозидные основания представляют собой известные полициклические ароматические гетероциклы. Кольца также могут сливаться в «уголке», так что один атом (почти всегда углерода) имеет две связи, идущие к одному кольцу, и две — к другому. Такие соединения называются спиро и играют важную роль в некоторых натуральных продуктах .

Одним из важных свойств углерода является то, что он легко образует цепи или сети, связанные связями углерод-углерод (углерод-углерод). Процесс связывания называется полимеризацией , а цепи или сети называются полимерами . Исходное соединение называется мономером .
Существуют две основные группы полимеров: синтетические полимеры и биополимеры . Синтетические полимеры производятся искусственно и обычно называются промышленными полимерами . [21] Биополимеры возникают в естественной среде или без вмешательства человека.
Биомолекулярная химия — основная категория органической химии, которую часто изучают биохимики . Многие сложные многофункциональные групповые молекулы играют важную роль в живых организмах. Некоторые из них представляют собой длинноцепочечные биополимеры , к ним относятся пептиды , ДНК , РНК и полисахариды , такие как крахмалы у животных и целлюлозы у растений. Другими основными классами являются аминокислоты (мономерные строительные блоки пептидов и белков), углеводы (включая полисахариды), нуклеиновые кислоты (которые включают ДНК и РНК в качестве полимеров) и липиды . Кроме того, биохимия животных содержит множество низкомолекулярных промежуточных продуктов, которые помогают в производстве энергии в рамках цикла Кребса и производят изопрен , наиболее распространенный углеводород у животных. Изопрены у животных образуют важные структурные соединения стероидов ( холестерол ) и стероидных гормонов; а в растениях образуют терпены , терпеноиды , некоторые алкалоиды и класс углеводородов, называемый биополимерными полиизопреноидами, присутствующими в латексе различных видов растений, который является основой для изготовления каучука .
См. также: синтез пептидов , синтез олигонуклеотидов и синтез углеводов .

В фармакологии важной группой органических соединений являются малые молекулы , также называемые «малыми органическими соединениями». В этом контексте малая молекула — это небольшое органическое соединение, которое биологически активно, но не является полимером . На практике небольшие молекулы имеют молярную массу менее примерно 1000 г/моль.
Фуллерены и углеродные нанотрубки , углеродные соединения сфероидальной и трубчатой структуры, стимулировали множество исследований в смежной области материаловедения . Первый фуллерен был открыт в 1985 году сэром Гарольдом В. Крото из Соединенного Королевства, а также Ричардом Э. Смолли и Робертом Ф. Керлом-младшим из США. Используя лазер для испарения графитовых стержней в атмосфере гелия, эти химики и их помощники получили клеточные молекулы, состоящие из 60 атомов углерода (C60), соединенных одинарными и двойными связями, образующих полую сферу с 12 пятиугольными и 20 шестиугольными гранями — конструкция, напоминающая футбольный мяч или футбольный мяч. В 1996 году трио было удостоено Нобелевской премии за новаторские усилия. Молекула С60 получила название бакминстерфуллерен (или, проще говоря, бакибол) в честь американского архитектора Р. Бакминстера Фуллера, чей геодезический купол построен по тем же структурным принципам.
Органические соединения, содержащие связи углерода с азотом, кислородом и галогенами, обычно не группируются отдельно. Другие иногда относят к основным группам органической химии и обсуждают под такими названиями, как сероорганическая химия , металлоорганическая химия , фосфорорганическая химия и кремнийорганическая химия .
Органические реакции – это химические реакции с участием органических соединений . Многие из этих реакций связаны с функциональными группами. Общая теория этих реакций предполагает тщательный анализ таких свойств, как сродство к электрону ключевых атомов, прочность связей и стерические затруднения . Эти факторы могут определять относительную стабильность короткоживущих реакционноспособных промежуточных продуктов , которые обычно напрямую определяют путь реакции.
К основным типам реакций относятся: реакции присоединения , реакции отщепления , реакции замещения , перициклические реакции , реакции перегруппировки и окислительно-восстановительные реакции . Примером распространенной реакции является реакция замещения, записываемая как:
где X — некоторая функциональная группа , а Nu — нуклеофил .
Число возможных органических реакций бесконечно. Однако наблюдаются некоторые общие закономерности, которые можно использовать для описания многих распространенных или полезных реакций. Каждая реакция имеет пошаговый механизм реакции, который объясняет, как она происходит последовательно, хотя подробное описание стадий не всегда ясно из одного только списка реагентов.
Пошаговый ход любого данного механизма реакции можно представить с помощью методов перемещения стрелок , в которых изогнутые стрелки используются для отслеживания движения электронов при переходе исходных материалов через промежуточные продукты к конечным продуктам.

Синтетическая органическая химия - это прикладная наука , граничащая с инженерией , «проектированием, анализом и / или созданием произведений для практических целей». Органический синтез нового соединения — это задача решения проблем, при которой синтез целевой молекулы разрабатывается путем выбора оптимальных реакций из оптимальных исходных материалов. Сложные соединения могут иметь десятки стадий реакции, которые последовательно создают нужную молекулу. Синтез протекает за счет использования реакционной способности функциональных групп молекулы. Например, карбонильное соединение можно использовать в качестве нуклеофила , превратив его в енолят , или в качестве электрофила ; их сочетание называется альдольной реакцией . Разработка практически полезных синтезов всегда требует проведения реального синтеза в лаборатории. Научная практика создания новых путей синтеза сложных молекул называется полным синтезом .
Стратегии синтеза включают ретросинтез , популяризированный Э. Дж. Кори , который начинается с целевой молекулы и разделяет ее на части в соответствии с известными реакциями. Части или предлагаемые предшественники подвергаются одинаковой обработке до тех пор, пока не будут получены доступные и в идеале недорогие исходные материалы. Затем ретросинтез записывается в противоположном направлении, чтобы дать синтез. Можно построить «синтетическое дерево», поскольку каждое соединение, а также каждый предшественник имеет несколько синтезов.