Рецепторы, сопряженные с G-белком ( GPCR ), также известные как рецепторы с семью трансмембранными доменами , рецепторы 7TM , гептаспиральные рецепторы , серпантинные рецепторы и рецепторы, сопряженные с G-белком ( GPLR ), образуют большую группу эволюционно связанных белков , которые являются рецепторами клеточной поверхности , которые обнаруживают молекулы вне клетки и активируют клеточные ответы. Они сопряжены с G-белками . Они проходят через клеточную мембрану семь раз в форме шести петель [2] (три внеклеточные петли, взаимодействующие с молекулами лиганда , три внутриклеточные петли, взаимодействующие с G-белками, N-концевая внеклеточная область и C-концевая внутриклеточная область [2] ) аминокислотных остатков , поэтому их иногда называют семитрансмембранными рецепторами. [3] Лиганды могут связываться либо с внеклеточным N-концом и петлями (например, рецепторы глутамата), либо с сайтом связывания внутри трансмембранных спиралей ( семейство родопсиноподобных ). Все они активируются агонистами , хотя также наблюдалась спонтанная автоактивация пустого рецептора. [3]
Рецепторы, сопряженные с G-белком, встречаются только у эукариот , включая дрожжи и хоанофлагелляты . [4] Лиганды , которые связывают и активируют эти рецепторы, включают светочувствительные соединения, запахи , феромоны , гормоны и нейротрансмиттеры и различаются по размеру от небольших молекул до пептидов и крупных белков . Рецепторы, сопряженные с G-белком, участвуют во многих заболеваниях.
Существует два основных пути передачи сигнала с участием рецепторов, сопряженных с G-белком:
Когда лиганд связывается с GPCR, он вызывает конформационное изменение в GPCR, что позволяет ему действовать как фактор обмена гуаниновых нуклеотидов (GEF). Затем GPCR может активировать связанный с ним белок G , обменивая GDP, связанный с белком G, на GTP . Субъединица α белка G вместе со связанным GTP затем может диссоциировать от субъединиц β и γ для дальнейшего воздействия на внутриклеточные сигнальные белки или целевые функциональные белки напрямую в зависимости от типа субъединицы α ( G αs , G αi/o , G αq/11 , G α12/13 ). [6] : 1160
GPCR являются важной мишенью для лекарств, и примерно 34% [7] всех одобренных Управлением по контролю за продуктами и лекарствами (FDA) лекарств нацелены на 108 членов этого семейства. По оценкам, глобальный объем продаж этих лекарств составляет 180 миллиардов долларов США по состоянию на 2018 год [обновлять]. [7] Предполагается, что GPCR являются мишенями примерно для 50% лекарств, которые в настоящее время находятся на рынке, в основном из-за их участия в сигнальных путях, связанных со многими заболеваниями, т. е. психическими, метаболическими, включая эндокринологические расстройства, иммунологическими, включая вирусные инфекции, сердечно-сосудистыми, воспалительными, расстройствами чувств и раком. Давно обнаруженная связь между GPCR и многими эндогенными и экзогенными веществами, приводящая, например, к анальгезии, является еще одной динамично развивающейся областью фармацевтических исследований. [3]
С определением первой структуры комплекса между рецептором, сопряженным с G-белком (GPCR), и тримером G-белка (Gαβγ) в 2011 году была открыта новая глава исследований GPCR для структурных исследований глобальных переключателей с более чем одним исследуемым белком. Предыдущие прорывы включали определение кристаллической структуры первого GPCR, родопсина, в 2000 году и кристаллической структуры первого GPCR с диффундирующим лигандом (β 2 AR) в 2007 году. Способ, которым семь трансмембранных спиралей GPCR организованы в пучок, предполагался на основе модели низкого разрешения родопсина лягушки из исследований двумерных кристаллов с помощью криогенной электронной микроскопии . Кристаллическая структура родопсина, которая появилась три года спустя, не была сюрпризом, за исключением наличия дополнительной цитоплазматической спирали H8 и точного местоположения петли, покрывающей сайт связывания ретиналя. Однако он предоставил основу, которая, как надеялись, станет универсальным шаблоном для моделирования гомологии и разработки лекарств для других GPCR, однако эта идея оказалась слишком оптимистичной.
Семь лет спустя кристаллизация β 2 -адренергического рецептора (β 2 AR) с диффундирующим лигандом принесла удивительные результаты, поскольку она выявила совершенно иную форму внеклеточной стороны рецептора, чем у родопсина. Эта область важна, поскольку она отвечает за связывание лиганда и является мишенью многих лекарств. Более того, сайт связывания лиганда был гораздо более просторным, чем в структуре родопсина, и был открыт наружу. В других рецепторах, кристаллизованных вскоре после этого, связывающая сторона была еще более легкодоступна для лиганда. Новые структуры, дополненные биохимическими исследованиями, раскрыли механизмы действия молекулярных переключателей, которые модулируют структуру рецептора, приводя к состояниям активации для агонистов или к состояниям полной или частичной инактивации для обратных агонистов. [3]
Нобелевская премия по химии 2012 года была присуждена Брайану Кобилке и Роберту Лефковицу за их работу, которая была «решающей для понимания того, как функционируют рецепторы, сопряженные с G-белком». [8] Было по крайней мере семь других Нобелевских премий, присужденных за некоторые аспекты сигнализации, опосредованной G-белком. По состоянию на 2012 год, два из десяти самых продаваемых в мире препаратов ( Advair Diskus и Abilify ) действуют, воздействуя на рецепторы, сопряженные с G-белком. [9]

Точный размер суперсемейства GPCR неизвестен, но по данным анализа последовательности генома было предсказано, что по крайней мере 831 различных человеческих генов (или около 4% всего генома , кодирующего белок ) кодируют их . [10] [11] Хотя было предложено множество схем классификации, суперсемейство классически делится на три основных класса (A, B и C) без обнаруживаемой общей гомологии последовательностей между классами.
Самый большой класс на сегодняшний день — это класс A, на который приходится почти 85% генов GPCR. Из GPCR класса A более половины, как предполагается, кодируют обонятельные рецепторы , в то время как остальные рецепторы лигандируются известными эндогенными соединениями или классифицируются как сиротские рецепторы . Несмотря на отсутствие гомологии последовательностей между классами, все GPCR имеют общую структуру и механизм передачи сигнала . Очень большая группа родопсина A была далее разделена на 19 подгрупп ( A1-A19 ). [12]
Согласно классической системе AF, GPCR можно сгруппировать в шесть классов на основе гомологии последовательностей и функционального сходства: [13] [14] [15] [16]
Совсем недавно была предложена альтернативная система классификации GPCR позвоночных под названием GRAFS ( Glutamate , Rhodopsin , Adhesion , Frizzled / Taste2 , Secretin ). [10] Они соответствуют классическим классам C, A, B2, F и B. [17]
Раннее исследование, основанное на доступной последовательности ДНК, предположило, что геном человека кодирует около 750 рецепторов, связанных с G-белком, [18] около 350 из которых обнаруживают гормоны, факторы роста и другие эндогенные лиганды. Примерно 150 GPCR, обнаруженных в геноме человека, имеют неизвестные функции.
Некоторые веб-серверы [19] и методы прогнозирования биоинформатики [20] [21] использовались для прогнозирования классификации GPCR только на основе их аминокислотной последовательности с помощью подхода псевдоаминокислотного состава .
GPCR участвуют в самых разных физиологических процессах. Вот некоторые примеры их физиологических ролей:
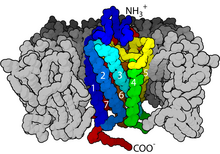
GPCR являются интегральными мембранными белками , которые обладают семью доменами, охватывающими мембрану, или трансмембранными спиралями . [26] [27] Внеклеточные части рецептора могут быть гликозилированы . Эти внеклеточные петли также содержат два высококонсервативных остатка цистеина , которые образуют дисульфидные связи для стабилизации структуры рецептора. Некоторые белки с семью трансмембранными спиралями ( каналродопсин ), которые напоминают GPCR, могут содержать ионные каналы внутри своего белка.
В 2000 году была решена первая кристаллическая структура млекопитающего GPCR, бычьего родопсина ( 1F88 ). [28] В 2007 году была решена первая структура человеческого GPCR [29] [1] [30] Эта структура человеческого β 2 -адренергического рецептора GPCR оказалась очень похожей на бычий родопсин. Также были определены структуры активированных или связанных с агонистом GPCR. [31] [32] [33] [34] Эти структуры показывают, как связывание лиганда на внеклеточной стороне рецептора приводит к конформационным изменениям на цитоплазматической стороне рецептора. Самым большим изменением является внешнее перемещение цитоплазматической части 5-й и 6-й трансмембранной спирали (TM5 и TM6). Структура активированного бета-2-адренергического рецептора в комплексе с Gs подтвердила , что Gα связывается с полостью, созданной этим движением. [35]
GPCR демонстрируют структуру, похожую на структуру некоторых других белков с семью трансмембранными доменами , таких как микробные родопсины и рецепторы адипонектина 1 и 2 ( ADIPOR1 и ADIPOR2 ). Однако эти рецепторы и каналы 7TMH (7-трансмембранные спирали) не ассоциируются с G-белками . Кроме того, ADIPOR1 и ADIPOR2 ориентированы противоположно GPCR в мембране (т. е. GPCR обычно имеют внеклеточный N-конец , цитоплазматический C-конец , тогда как ADIPOR инвертированы). [36]

С точки зрения структуры, GPCR характеризуются внеклеточным N-концом , за которым следуют семь трансмембранных (7-TM) α-спиралей (TM-1 к TM-7), соединенных тремя внутриклеточными (IL-1 к IL-3) и тремя внеклеточными петлями (EL-1 к EL-3), и, наконец, внутриклеточным C-концом . GPCR организуется в третичную структуру, напоминающую бочку, с семью трансмембранными спиралями, образующими полость внутри плазматической мембраны, которая служит доменом связывания лиганда , который часто покрыт EL-2. Однако лиганды могут также связываться в другом месте, как в случае более объемных лигандов (например, белков или крупных пептидов ), которые вместо этого взаимодействуют с внеклеточными петлями или, как показано на примере метаботропных глутаматных рецепторов класса C (mGluR), с N-концевым хвостом. Класс C GPCR отличается своим большим N-концевым хвостом, который также содержит домен связывания лиганда. При связывании глутамата с mGluR N-концевой хвост претерпевает конформационное изменение, которое приводит к его взаимодействию с остатками внеклеточных петель и доменов TM. Конечным эффектом всех трех типов активации, вызванной агонистом, является изменение относительной ориентации спиралей TM (подобное скручивающему движению), что приводит к более широкой внутриклеточной поверхности и «раскрытию» остатков внутриклеточных спиралей и доменов TM, имеющих решающее значение для функции передачи сигнала (т. е. сопряжения G-белка). Обратные агонисты и антагонисты также могут связываться с рядом различных участков, но конечным эффектом должно быть предотвращение этой переориентации спирали TM. [3]
Структура N- и C-концевых хвостов GPCR может также выполнять важные функции помимо связывания лиганда. Например, C-конец мускариновых рецепторов M3 достаточен , а шестиаминокислотный полиосновный домен (KKKRRK) в C-конце необходим для его предварительной сборки с белками Gq . [ 37] В частности, C-конец часто содержит остатки серина (Ser) или треонина (Thr), которые при фосфорилировании увеличивают сродство внутриклеточной поверхности к связыванию белков-скаффолдеров, называемых β- аррестинами (β-arr). [38] После связывания β-аррестины как стерически предотвращают связывание G-белка, так и могут привлекать другие белки, что приводит к созданию сигнальных комплексов, участвующих в активации пути киназы, регулируемой внеклеточным сигналом ( ERK ), или эндоцитозе рецептора (интернализации). Поскольку фосфорилирование этих остатков Ser и Thr часто происходит в результате активации GPCR, опосредованное β-arr разделение G-белка и интернализация GPCR являются важными механизмами десенсибилизации . [ 39] Кроме того, существуют интернализованные «мегакомплексы», состоящие из одного GPCR, β-arr (в конформации хвоста), [40] [41] и гетеротримерного G-белка, которые могут отвечать за передачу белковых сигналов от эндосом. [42] [43]
Последняя общая структурная тема среди GPCR — пальмитоилирование одного или нескольких участков C-концевого хвоста или внутриклеточных петель. Пальмитоилирование — это ковалентная модификация остатков цистеина (Cys) посредством добавления гидрофобных ацильных групп , и имеет эффект нацеливания рецептора на богатые холестерином и сфинголипидами микродомены плазматической мембраны, называемые липидными плотами . Поскольку многие из нижестоящих трансдукторных и эффекторных молекул GPCR (включая те, которые участвуют в путях отрицательной обратной связи ) также нацелены на липидные плоты, это имеет эффект облегчения быстрой рецепторной сигнализации.
GPCR реагируют на внеклеточные сигналы, опосредованные огромным разнообразием агонистов, от белков до биогенных аминов и протонов , но все они передают этот сигнал через механизм сопряжения G-белка. Это становится возможным благодаря домену фактора обмена гуанин -нуклеотидов ( GEF ), в первую очередь образованному комбинацией IL-2 и IL-3 вместе с соседними остатками связанных с ними спиралей TM.

Рецептор, связанный с G-белком, активируется внешним сигналом в форме лиганда или другого сигнального посредника. Это создает конформационное изменение в рецепторе, вызывая активацию G-белка . Дальнейший эффект зависит от типа G-белка. G-белки впоследствии инактивируются активирующими GTPase белками, известными как RGS-белки .
GPCR включают один или несколько рецепторов для следующих лигандов: медиаторы сенсорных сигналов (например, световые и обонятельные стимулирующие молекулы); аденозин , бомбезин , брадикинин , эндотелин , γ-аминомасляная кислота ( ГАМК ), фактор роста гепатоцитов ( HGF ), меланокортины , нейропептид Y , опиоидные пептиды, опсины , соматостатин , GH , тахикинины , члены семейства вазоактивных кишечных пептидов и вазопрессин ; биогенные амины (например, дофамин , адреналин , норадреналин , гистамин , серотонин и мелатонин ); глутамат ( метаботропный эффект); глюкагон ; ацетилхолин ( мускариновый эффект); хемокины ; липидные медиаторы воспаления (например, простагландины , простаноиды , фактор активации тромбоцитов и лейкотриены ); пептидные гормоны (например, кальцитонин , анафилатоксин C5a , фолликулостимулирующий гормон [ФСГ], гонадотропин-рилизинг-гормон [ГнРГ], нейрокинин , тиреотропин-рилизинг-гормон [ТРГ] и окситоцин ); и эндоканнабиноиды .
GPCR, действующие как рецепторы для стимулов, которые еще не идентифицированы, известны как сиротские рецепторы .
Однако, в отличие от других типов рецепторов, которые были изучены, где лиганды связываются снаружи с мембраной, лиганды GPCR обычно связываются внутри трансмембранного домена. Однако, активируемые протеазой рецепторы активируются путем расщепления части их внеклеточного домена. [45]

Передача сигнала через мембрану рецептором не полностью изучена. Известно, что в неактивном состоянии GPCR связан с гетеротримерным комплексом G-белка. Связывание агониста с GPCR приводит к конформационному изменению рецептора, которое передается связанной субъединице G α гетеротримерного белка G через динамику белкового домена . Активированная субъединица G α обменивает GTP вместо GDP , что, в свою очередь, запускает диссоциацию субъединицы G α от димера G βγ и от рецептора. Диссоциированные субъединицы G α и G βγ взаимодействуют с другими внутриклеточными белками, продолжая каскад передачи сигнала, в то время как освобожденный GPCR способен повторно связываться с другим гетеротримерным белком G, образуя новый комплекс, который готов инициировать еще один раунд передачи сигнала. [46]
Считается, что молекула рецептора существует в конформационном равновесии между активным и неактивным биофизическими состояниями. [47] Связывание лигандов с рецептором может смещать равновесие в сторону активных состояний рецептора. Существует три типа лигандов: агонисты — это лиганды, которые смещают равновесие в пользу активных состояний; обратные агонисты — это лиганды, которые смещают равновесие в пользу неактивных состояний; и нейтральные антагонисты — это лиганды, которые не влияют на равновесие. Пока неизвестно, чем именно отличаются друг от друга активные и неактивные состояния.

Когда рецептор неактивен, домен GEF может быть связан с также неактивной α-субъединицей гетеротримерного G-белка . Эти «G-белки» представляют собой тример субъединиц α, β и γ (известных как Gα, Gβ и Gγ соответственно), который становится неактивным при обратимом связывании с гуанозиндифосфатом (GDP) (или, альтернативно, без гуаниннуклеотида), но активным при связывании с гуанозинтрифосфатом (GTP). После активации рецептора домен GEF, в свою очередь, аллостерически активирует G-белок, способствуя обмену молекулы GDP на GTP в α-субъединице G-белка. Клетка поддерживает соотношение цитозольного GTP:GDP 10:1, поэтому обмен на GTP обеспечивается. В этот момент субъединицы G-белка диссоциируют от рецептора, а также друг от друга, образуя мономер Gα-GTP и тесно взаимодействующий димер Gβγ , которые теперь могут свободно модулировать активность других внутриклеточных белков. Однако степень, в которой они могут диффундировать , ограничена из-за пальмитоилирования Gα и наличия изопреноидной части, ковалентно добавленной к C-концам Gγ.
Поскольку Gα также обладает способностью к медленному гидролизу GTP→GDP , неактивная форма α-субъединицы (Gα-GDP) в конечном итоге регенерируется, что позволяет реассоциироваться с димером Gβγ для образования «отдыхающего» G-белка, который может снова связываться с GPCR и ожидать активации. Скорость гидролиза GTP часто ускоряется из-за действий другого семейства аллостерических модулирующих белков, называемых регуляторами сигнализации G-белка , или белками RGS, которые являются типом белка, активирующего GTPase , или GAP. Фактически, многие из первичных эффекторных белков (например, аденилатциклазы ), которые активируются/инактивируются при взаимодействии с Gα-GTP, также обладают активностью GAP. Таким образом, даже на этой ранней стадии процесса сигнализация, инициированная GPCR, имеет способность к самопрекращению.

Было показано, что нисходящие сигналы GPCR, возможно, взаимодействуют с сигналами интегрина , такими как FAK . [48] Сигналы интегрина будут фосфорилировать FAK, что затем может снизить активность GPCR G αs .

Если рецептор в активном состоянии сталкивается с G-белком , он может активировать его. Некоторые данные свидетельствуют о том, что рецепторы и G-белки на самом деле предварительно связаны. [37] Например, связывание G-белков с рецепторами влияет на сродство рецептора к лигандам. Активированные G-белки связаны с GTP .
Дальнейшая передача сигнала зависит от типа G-белка. Фермент аденилатциклаза является примером клеточного белка, который может регулироваться G-белком, в данном случае G-белком G s . Активность аденилатциклазы активируется, когда она связывается с субъединицей активированного G-белка. Активация аденилатциклазы заканчивается, когда G-белок возвращается в GDP -связанное состояние.
Аденилатциклазы (из которых у человека известны 9 мембраносвязанных и одна цитозольная формы) могут также активироваться или ингибироваться другими способами (например, связыванием Ca2+/ кальмодулина ), что может изменять активность этих ферментов аддитивным или синергическим образом вместе с G-белками.
Сигнальные пути, активируемые через GPCR, ограничены первичной последовательностью и третичной структурой самого GPCR, но в конечном итоге определяются конкретной конформацией, стабилизированной конкретным лигандом , а также доступностью молекул -трансдьюсеров . В настоящее время считается, что GPCR используют два основных типа трансдьюсеров: G-белки и β-аррестины . Поскольку β-аррестины имеют высокое сродство только к фосфорилированной форме большинства GPCR (см. выше или ниже), большая часть сигнализации в конечном итоге зависит от активации G-белка. Однако возможность взаимодействия позволяет осуществлять сигнализацию, независимую от G-белка.
Существует три основных сигнальных пути, опосредованных G-белком, опосредованных четырьмя подклассами G-белков, отличающихся друг от друга гомологией последовательностей ( G αs , G αi/o , G αq/11 и G α12/13 ). Каждый подкласс G-белка состоит из нескольких белков, каждый из которых является продуктом нескольких генов или вариаций сплайсинга , которые могут придавать им различия от едва заметных до отчетливых в отношении сигнальных свойств, но в целом они, по-видимому, разумно сгруппированы в четыре класса. Поскольку свойства передачи сигнала различных возможных комбинаций βγ, по-видимому, не отличаются радикально друг от друга, эти классы определяются в соответствии с изоформой их α-субъединицы. [6] : 1163
Хотя большинство GPCR способны активировать более одного подтипа Gα, они также демонстрируют предпочтение одного подтипа перед другим. Когда активированный подтип зависит от лиганда, связанного с GPCR, это называется функциональной селективностью (также известной как агонист-направленный трафик или конформационно-специфический агонизм). Однако связывание любого отдельного конкретного агониста может также инициировать активацию нескольких различных G-белков, поскольку он может быть способен стабилизировать более одной конформации домена GEF GPCR , даже в течение одного взаимодействия. Кроме того, конформация, которая предпочтительно активирует одну изоформу Gα, может активировать другую, если предпочтительная менее доступна. Кроме того, пути обратной связи могут приводить к модификациям рецептора (например, фосфорилированию), которые изменяют предпочтение G-белка. Независимо от этих различных нюансов, предпочтительный партнер по связыванию GPCR обычно определяется в соответствии с G-белком, наиболее очевидно активированным эндогенным лигандом в большинстве физиологических или экспериментальных условий.
Приведенные выше описания игнорируют эффекты Gβγ -сигнализации, которые также могут быть важны, в частности, в случае активированных G αi/o -сопряженных GPCR. Первичными эффекторами Gβγ являются различные ионные каналы, такие как регулируемые G-белком внутренние выпрямляющие каналы K + (GIRK), P / Q - и N-типа потенциалзависимые каналы Ca 2+ , а также некоторые изоформы AC и PLC, наряду с некоторыми изоформами фосфоинозитид-3-киназы (PI3K).
Хотя они классически считаются работающими только вместе, GPCR могут передавать сигналы через независимые от G-белка механизмы, а гетеротримерные G-белки могут играть функциональные роли независимо от GPCR. GPCR могут передавать сигналы независимо через многие белки, уже упомянутые для их ролей в зависимой от G-белка сигнализации, такие как β-arrs , GRK и Srcs . Было показано, что такая сигнализация физиологически значима, например, сигнализация β-аррестина, опосредованная хемокиновым рецептором CXCR3, была необходима для полной эффективности хемотаксиса активированных Т-клеток. [49] Кроме того, дополнительные белки-каркасы, участвующие в субклеточной локализации GPCR (например, белки, содержащие домен PDZ ), также могут действовать как передатчики сигнала. Чаще всего эффектор является членом семейства MAPK .
В конце 1990-х годов начали накапливаться доказательства, позволяющие предположить, что некоторые GPCR способны передавать сигналы без G-белков. Было показано, что митоген-активируемая протеинкиназа ERK2 , ключевой медиатор передачи сигнала ниже по течению от активации рецептора во многих путях, активируется в ответ на опосредованную цАМФ активацию рецептора в слизистой плесени D. discoideum, несмотря на отсутствие связанных α- и β-субъединиц G-белка. [50]
В клетках млекопитающих было продемонстрировано, что хорошо изученный β2 - адренорецептор активирует путь ERK2 после опосредованного аррестином разъединения сигнализации, опосредованной G-белком. Поэтому кажется вероятным, что некоторые механизмы, которые ранее считались связанными исключительно с десенсибилизацией рецепторов, на самом деле являются примерами переключения рецепторами своего сигнального пути, а не просто выключения.
В клетках почек было показано, что рецептор брадикинина B2 напрямую взаимодействует с протеиновой тирозиновой фосфатазой. Наличие тирозин-фосфорилированной последовательности ITIM (иммунорецепторный тирозин-основанный ингибирующий мотив) в рецепторе B2 необходимо для опосредования этого взаимодействия и, следовательно, антипролиферативного эффекта брадикинина. [51]
Хотя это относительно незрелая область исследований, похоже, что гетеротримерные G-белки также могут принимать участие в передаче сигналов, не связанной с GPCR. Имеются данные о ролях в качестве передатчиков сигналов почти во всех других типах рецептор-опосредованной передачи сигналов, включая интегрины , рецепторные тирозинкиназы (RTK), рецепторы цитокинов ( JAK/STAT ), а также модуляцию различных других «вспомогательных» белков, таких как GEF , ингибиторы диссоциации гуанин-нуклеотидов (GDI) и протеинфосфатазы . Могут быть даже специфические белки этих классов, чья основная функция является частью GPCR-независимых путей, называемых активаторами сигнализации G-белка (AGS). Как повсеместность этих взаимодействий, так и важность субъединиц Gα и Gβγ для этих процессов до сих пор неясны.



Существует два основных пути передачи сигнала с участием рецепторов, связанных с G-белком : путь сигнала цАМФ и путь сигнала фосфатидилинозитола . [5]
Передача сигнала цАМФ включает пять основных элементов: рецептор стимулирующего гормона (Rs) или рецептор ингибирующего гормона (Ri); стимулирующий регуляторный G-белок (Gs) или ингибирующий регуляторный G-белок (Gi); аденилатциклаза ; протеинкиназа А (PKA); и фосфодиэстераза цАМФ .
Рецептор стимулирующего гормона (Rs) — это рецептор, который может связываться со стимулирующими сигнальными молекулами, тогда как рецептор ингибирующего гормона (Ri) — это рецептор, который может связываться с ингибирующими сигнальными молекулами.
Стимулирующий регуляторный G-белок — это G-белок, связанный с рецептором стимулирующего гормона (Rs), и его α-субъединица при активации может стимулировать активность фермента или другого внутриклеточного метаболизма. Напротив, ингибирующий регуляторный G-белок связан с рецептором ингибирующего гормона, и его α-субъединица при активации может ингибировать активность фермента или другого внутриклеточного метаболизма.
Аденилатциклаза — это 12-трансмембранный гликопротеин, который катализирует превращение АТФ в цАМФ с помощью кофактора Mg 2+ или Mn 2+ . Образующийся цАМФ является вторичным мессенджером в клеточном метаболизме и аллостерическим активатором протеинкиназы А.
Протеинкиназа А является важным ферментом в клеточном метаболизме из-за своей способности регулировать клеточный метаболизм путем фосфорилирования определенных комитированных ферментов в метаболическом пути. Она также может регулировать экспрессию определенных генов, клеточную секрецию и проницаемость мембран. Белковый фермент содержит две каталитические субъединицы и две регуляторные субъединицы. Когда нет цАМФ, комплекс неактивен. Когда цАМФ связывается с регуляторными субъединицами, их конформация изменяется, вызывая диссоциацию регуляторных субъединиц, что активирует протеинкиназу А и допускает дальнейшие биологические эффекты.
Затем эти сигналы могут быть прекращены фосфодиэстеразой цАМФ, которая представляет собой фермент, расщепляющий цАМФ до 5'-АМФ и инактивирующий протеинкиназу А.
В сигнальном пути фосфатидилинозитола внеклеточная сигнальная молекула связывается с рецептором G-белка (Gq ) на поверхности клетки и активирует фосфолипазу C , которая расположена на плазматической мембране . Липаза гидролизует фосфатидилинозитол-4,5-бисфосфат (PIP2) на два вторичных мессенджера: инозитол-1,4,5-трифосфат (IP3) и диацилглицерол (DAG). IP3 связывается с рецептором IP3 в мембране гладкого эндоплазматического ретикулума и митохондрий, открывая каналы Ca2 + . DAG помогает активировать протеинкиназу C (PKC), которая фосфорилирует многие другие белки, изменяя их каталитическую активность, что приводит к клеточным ответам.
Эффекты Ca 2+ также примечательны: он взаимодействует с DAG при активации PKC и может активировать путь киназы CaM , в котором модулируемый кальцием белок кальмодулин (CaM) связывает Ca 2+ , претерпевает изменение конформации и активирует киназу CaM II, которая обладает уникальной способностью увеличивать свою связывающую способность с CaM путем автофосфорилирования, делая CaM недоступным для активации других ферментов. Затем киназа фосфорилирует целевые ферменты, регулируя их активность. Два сигнальных пути связаны вместе Ca 2+ -CaM, который также является регуляторной субъединицей аденилатциклазы и фосфодиэстеразы в сигнальном пути цАМФ.
GPCR становятся десенсибилизированными при воздействии их лиганда в течение длительного периода времени. Существует две признанные формы десенсибилизации: 1) гомологичная десенсибилизация , при которой активированный GPCR подавляется; и 2) гетерологичная десенсибилизация , при которой активированный GPCR вызывает подавление другого GPCR. Ключевой реакцией этого подавления является фосфорилирование внутриклеточного (или цитоплазматического ) домена рецептора протеинкиназами .
Циклические АМФ-зависимые протеинкиназы ( протеинкиназа А ) активируются сигнальной цепью, исходящей от белка G (который был активирован рецептором) через аденилатциклазу и циклический АМФ (цАМФ). В механизме обратной связи эти активированные киназы фосфорилируют рецептор. Чем дольше рецептор остается активным, тем больше киназ активируется и тем больше рецепторов фосфорилируется. В β2 - адренорецепторах это фосфорилирование приводит к переключению связи с класса Gs G -белка на класс Gi . [52] Фосфорилирование , опосредованное цАМФ-зависимым PKA, может вызывать гетерологичную десенсибилизацию в рецепторах, отличных от активированных. [53]
Связанные с G -белком рецепторные киназы (GRK) являются протеинкиназами, которые фосфорилируют только активные GPCR. [54] Связанные с G-белком рецепторные киназы (GRK) являются ключевыми модуляторами сигнализации рецепторов, связанных с G-белком (GPCR). Они составляют семейство из семи серин-треониновых протеинкиназ млекопитающих, которые фосфорилируют рецептор, связанный с агонистом. Фосфорилирование рецепторов, опосредованное GRK, быстро инициирует глубокое нарушение сигнализации рецепторов и десенсибилизацию. Активность GRK и субклеточное нацеливание жестко регулируются взаимодействием с доменами рецепторов, субъединицами G-белка, липидами, якорными белками и кальций-чувствительными белками. [55]
Фосфорилирование рецептора может иметь два последствия:
Как упоминалось выше, G-белки могут прекращать свою собственную активацию из-за их внутренней способности к гидролизу GTP→GDP . Однако эта реакция протекает с низкой скоростью (≈0,02 раза/сек), и, таким образом, для дезактивации любого отдельного G-белка потребовалось бы около 50 секунд, если бы не вступили в игру другие факторы. Действительно, существует около 30 изоформ белков RGS , которые при связывании с Gα через свой домен GAP ускоряют скорость гидролиза до ≈30 раз/сек. Это 1500-кратное увеличение скорости позволяет клетке реагировать на внешние сигналы с высокой скоростью, а также с пространственным разрешением из-за ограниченного количества вторичного мессенджера , который может быть сгенерирован, и ограниченного расстояния, на которое G-белок может диффундировать за 0,03 секунды. По большей части, белки RGS беспорядочны в своей способности дезактивировать G-белки, в то время как RGS, участвующий в данном сигнальном пути, по-видимому, больше определяется тканью и вовлеченным GPCR, чем чем-либо еще. Кроме того, белки RGS выполняют дополнительную функцию увеличения скорости обмена ГТФ-ГДФ в GPCR (т.е. действуют как своего рода ко-ГЭФ), что дополнительно способствует временному разрешению сигнализации GPCR.
Кроме того, GPCR может быть десенсибилизирован сам по себе. Это может произойти как:
После того, как β-аррестин связывается с GPCR, он претерпевает конформационное изменение, что позволяет ему служить в качестве белка-каркаса для комплекса адаптеров, называемого AP-2 , который, в свою очередь, рекрутирует другой белок, называемый клатрином . Если достаточное количество рецепторов в локальной области рекрутируют клатрин таким образом, они агрегируют, и мембрана отпочковывается внутрь в результате взаимодействия между молекулами клатрина в процессе, называемом опсонизацией . Как только ямка была отщипнута от плазматической мембраны из-за действия двух других белков, называемых амфифизином и динамином , она теперь является эндоцитарной пузырькой . В этот момент молекулы адаптера и клатрин диссоциируют , и рецептор либо транспортируется обратно к плазматической мембране, либо направляется в лизосомы для деградации .
В любой точке этого процесса β-аррестины могут также привлекать другие белки, такие как нерецепторная тирозинкиназа (nRTK), c-SRC , которая может активировать ERK1/2 или другую сигнальную митоген-активируемую протеинкиназу (MAPK) посредством, например, фосфорилирования малой ГТФазы , Ras , или привлекать белки каскада ERK напрямую (т. е. Raf-1 , MEK , ERK-1/2), в которой инициируется сигнальная функция из-за их близкого расположения друг к другу. Другой целью c-SRC являются молекулы динамина, участвующие в эндоцитозе. Динамины полимеризуются вокруг шейки входящей везикулы, а их фосфорилирование c-SRC обеспечивает энергию, необходимую для конформационного изменения, позволяющего окончательно «отщепить» от мембраны.
Десенсибилизация рецептора опосредуется посредством комбинации фосфорилирования, связывания β-arr и эндоцитоза, как описано выше. Понижающая регуляция происходит, когда эндоцитированный рецептор встраивается в эндосому, которая перемещается для слияния с органеллой, называемой лизосомой. Поскольку лизосомальные мембраны богаты протонными насосами, их внутренняя часть имеет низкий pH (≈4,8 по сравнению с pH≈7,2 цитозоля), что действует на денатурацию GPCR. Кроме того, лизосомы содержат много деградирующих ферментов , включая протеазы, которые могут функционировать только при таком низком pH, и поэтому пептидные связи, соединяющие остатки GPCR вместе, могут быть расщеплены. Будет ли данный рецептор перемещен в лизосому, задержан в эндосомах или перемещен обратно в плазматическую мембрану, зависит от множества факторов, включая тип рецептора и величину сигнала. Регуляция GPCR дополнительно опосредована факторами транскрипции генов. Эти факторы могут увеличивать или уменьшать транскрипцию генов и, таким образом, увеличивать или уменьшать генерацию новых рецепторов (up- или down-regulation), которые перемещаются к клеточной мембране.
Олигомеризация рецепторов, сопряженных с G-белком, является широко распространенным явлением. Одним из наиболее изученных примеров является метаботропный рецептор GABA B. Этот так называемый конститутивный рецептор образуется путем гетеродимеризации субъединиц GABA B R1 и GABA B R2 . Экспрессия GABA B R1 без GABA B R2 в гетерологичных системах приводит к удержанию субъединицы в эндоплазматическом ретикулуме . Экспрессия только субъединицы GABA B R2, тем временем, приводит к поверхностной экспрессии субъединицы, хотя и без функциональной активности (т. е. рецептор не связывает агонист и не может инициировать ответ после воздействия агониста). Экспрессия двух субъединиц вместе приводит к экспрессии функционального рецептора на плазматической мембране. Было показано, что связывание GABA B R2 с GABA B R1 вызывает маскировку сигнала удержания [60] функциональных рецепторов. [61]
Передача сигнала , опосредованная суперсемейством GPCR, восходит к истокам многоклеточности . GPCR, подобные млекопитающим, обнаружены у грибов и были классифицированы в соответствии с системой классификации GRAFS, основанной на отпечатках GPCR. [17] Идентификация членов суперсемейства в эукариотическом домене и сравнение мотивов, специфичных для семейства, показали, что суперсемейство GPCR имеет общее происхождение. [62] Характерные мотивы указывают на то, что три из пяти семейств GRAFS, Rhodopsin , Adhesion и Frizzled , произошли от рецепторов цАМФ Dictyostelium discoideum до разделения опистоконтов . Позже семейство Secretin произошло от семейства рецепторов Adhesion GPCR до разделения нематод . [17] GPCR насекомых, по-видимому, находятся в своей собственной группе, а Taste2 идентифицирован как происходящий от родопсина . [62] Обратите внимание, что разделение секретин / адгезия основано на предполагаемой функции, а не на сигнатуре, поскольку классический класс B (7tm_2, Pfam PF00002) используется для идентификации обоих в исследованиях.
на молекулярные и математические модели для первоначального ответа рецептора
Данные, диаграммы и веб-инструменты для рецепторов, сопряженных с G-белком (GPCR).; Мунк С., Исберг В., Мордальски С., Харпсё К., Ратаж К., Хаузер А.С. и др. (июль 2016 г.). «GPCRdb: база данных рецепторов, связанных с G-белком - введение». Британский журнал фармакологии . 173 (14): 2195–207. дои : 10.1111/bph.13509. ПМЦ 4919580 . ПМИД 27155948.
GPCR
Инициатива по структуре белка: Центр биологической сети, направленный на определение трехмерных структур репрезентативных белков семейства GPCR