Бром — химический элемент ; имеет символ Br и атомный номер 35. Это летучая красно-коричневая жидкость при комнатной температуре, которая легко испаряется, образуя пар аналогичного цвета. Его свойства занимают промежуточное положение между свойствами хлора и йода . Выделенный независимо двумя химиками, Карлом Якобом Лёвигом (в 1825 году) и Антуаном Жеромом Баларом (в 1826 году), его название произошло от древнегреческого βρῶμος (bromos) «зловоние», что указывает на его резкий и едкий запах.
Элементарный бром очень реактивен и, таким образом, не встречается в природе как свободный элемент . Вместо этого его можно выделить из бесцветных растворимых кристаллических минеральных галогенидных солей, аналогичных поваренной соли , свойство, которое он разделяет с другими галогенами . Хотя он довольно редок в земной коре, высокая растворимость иона брома (Br− ) привела к его накоплению в океанах. В коммерческих целях элемент легко извлекается из прудов-испарителей рассола , в основном в Соединенных Штатах и Израиле . Масса брома в океанах составляет около одной трехсотой массы хлора.
При стандартных условиях температуры и давления это жидкость; единственный другой элемент, который является жидким при этих условиях, — это ртуть . При высоких температурах броморганические соединения легко диссоциируют, выделяя свободные атомы брома, процесс, который останавливает цепные реакции свободных радикалов . Этот эффект делает броморганические соединения полезными в качестве антипиренов , и более половины брома, производимого во всем мире каждый год, используется для этой цели. Это же свойство заставляет ультрафиолетовый солнечный свет диссоциировать летучие броморганические соединения в атмосфере, выделяя свободные атомы брома, вызывая истощение озонового слоя . В результате многие броморганические соединения, такие как пестицид бромистый метил , больше не используются. Соединения брома по-прежнему используются в буровых растворах для скважин , в фотопленке и в качестве промежуточного продукта в производстве органических химикатов.
Большие количества бромидных солей токсичны из-за действия растворимых бромидных ионов, вызывая бромизм . Однако бром полезен для человеческих эозинофилов , [10] и является важным микроэлементом для развития коллагена у всех животных. [11] Сотни известных броморганических соединений производятся наземными и морскими растениями и животными, и некоторые из них выполняют важные биологические функции. [12] В качестве фармацевтического средства простой бромидный ион (Br− ) оказывает ингибирующее действие на центральную нервную систему, и бромидные соли когда-то были основным медицинским седативным средством, прежде чем были заменены препаратами более короткого действия. Они сохраняют нишу использования в качестве противоэпилептических средств .

Бром был открыт независимо двумя химиками, Карлом Якобом Лёвигом [13] и Антуаном Баларом [14] [ 15] в 1825 и 1826 годах соответственно. [16]
Лёвиг выделил бром из минерального источника воды из своего родного города Бад-Кройцнах в 1825 году. Лёвиг использовал раствор минеральной соли, насыщенный хлором, и извлек бром диэтиловым эфиром . После испарения эфира осталась коричневая жидкость. С этой жидкостью в качестве образца своей работы он подал заявку на должность в лаборатории Леопольда Гмелина в Гейдельберге . Публикация результатов была отложена, и Балард опубликовал свои результаты первым. [17]
Балар обнаружил бромсодержащие химикаты в золе морских водорослей из солончаков Монпелье . Морские водоросли использовались для получения йода, но также содержали бром. Балар перегнал бром из раствора золы морских водорослей, насыщенного хлором. Свойства полученного вещества были промежуточными между свойствами хлора и йода; таким образом, он пытался доказать, что вещество представляет собой монохлорид йода (ICl), но после неудачной попытки он был уверен, что нашел новый элемент, и назвал его мюридом, происходящим от латинского слова muria («рассол»). [15] [18] [19]
После того, как французские химики Луи Николя Воклен , Луи Жак Тенар и Жозеф-Луи Гей-Люссак одобрили эксперименты молодого фармацевта Балара, результаты были представлены на лекции в Академии наук и опубликованы в Annales de Chimie et Physique . [14] В своей публикации Балар заявил, что изменил название с muride на brôme по предложению М. Англада. Название brôme (бром) происходит от греческого βρῶμος ( brômos , «зловоние»). [14] [20] [18] [21] Другие источники утверждают, что французский химик и физик Жозеф-Луи Гей-Люссак предложил название brôme из-за характерного запаха паров. [22] [23] Бром не производился в больших количествах до 1858 года, когда открытие соляных залежей в Штассфурте позволило производить его как побочный продукт поташа . [24]
Помимо некоторых второстепенных медицинских применений, первым коммерческим применением был дагерротип . В 1840 году было обнаружено, что бром имеет некоторые преимущества по сравнению с ранее используемыми парами йода для создания светочувствительного слоя галогенида серебра в дагерротипии. [25]
К 1864 году 25% раствор жидкого брома в 0,75 молярном водном бромистом калии [26] широко использовался [27] для лечения гангрены во время Гражданской войны в США, до публикаций Джозефа Листера и Пастера . [28]
Бромид калия и бромид натрия использовались в качестве противосудорожных и седативных средств в конце 19-го и начале 20-го веков, но постепенно были вытеснены хлоралгидратом , а затем барбитуратами . [ 29] В первые годы Первой мировой войны соединения брома, такие как ксилилбромид, использовались в качестве отравляющего газа . [30]
Бром является третьим галогеном , будучи неметаллом в группе 17 периодической таблицы. Таким образом, его свойства аналогичны свойствам фтора , хлора и йода , и , как правило, являются промежуточными между свойствами двух соседних галогенов, хлора и йода. Бром имеет электронную конфигурацию [Ar]4s23d104p5 , причем семь электронов в четвертой и самой внешней оболочке действуют как его валентные электроны . Как и все галогены, ему не хватает одного электрона до полного октета, и, следовательно, он является сильным окислителем, реагирующим со многими элементами, чтобы завершить свою внешнюю оболочку. [ 31 ] В соответствии с периодическими тенденциями , он является промежуточным по электроотрицательности между хлором и йодом (F: 3,98, Cl: 3,16, Br: 2,96, I: 2,66), и менее реакционноспособен, чем хлор, и более реакционноспособен, чем йод. Он также является более слабым окислителем, чем хлор, но более сильным, чем йод. Наоборот, ион брома является более слабым восстановителем, чем йодид, но более сильным, чем хлорид. [31] Эти сходства привели к тому, что хлор, бром и йод вместе были классифицированы как одна из исходных триад Иоганна Вольфганга Дёберейнера , чья работа предвосхитила периодический закон для химических элементов. [32] [33] Он является промежуточным по атомному радиусу между хлором и йодом, и это приводит к тому, что многие из его атомных свойств также являются промежуточными по значению между хлором и йодом, такими как первая энергия ионизации , сродство к электрону , энтальпия диссоциации молекулы X2 ( X = Cl, Br, I), ионный радиус и длина связи X–X. [31] Летучесть брома подчеркивает его очень пронзительный, удушающий и неприятный запах. [34]
Все четыре стабильных галогена испытывают межмолекулярные силы притяжения Ван-дер-Ваальса , и их сила увеличивается вместе с числом электронов среди всех гомоядерных двухатомных молекул галогенов. Таким образом, температуры плавления и кипения брома являются промежуточными между температурами плавления и кипения хлора и йода. В результате увеличения молекулярной массы галогенов вниз по группе плотность и теплоты плавления и испарения брома снова являются промежуточными между температурами хлора и йода, хотя все их теплоты испарения довольно низкие (что приводит к высокой летучести) благодаря их двухатомной молекулярной структуре. [31] Галогены темнеют по мере спуска по группе: фтор — очень бледно-желтый газ, хлор — зеленовато-желтый, а бром — красновато-коричневая летучая жидкость, которая плавится при температуре -7,2 °C и кипит при температуре 58,8 °C. (Йод — это блестящее черное твердое вещество.) Эта тенденция возникает из-за того, что длины волн видимого света, поглощаемого галогенами, увеличиваются вниз по группе. [31] В частности, цвет галогена, такого как бром, является результатом электронного перехода между самой высокой занятой антисвязывающей молекулярной орбиталью π g и самой низкой вакантной антисвязывающей молекулярной орбиталью σ u . [35] Цвет исчезает при низких температурах, так что твердый бром при −195 °C становится бледно-желтым. [31]
Подобно твёрдым хлору и йоду, твёрдый бром кристаллизуется в орторомбической кристаллической системе , в слоистом расположении молекул Br2 . Расстояние Br–Br составляет 227 пм (близко к газообразному расстоянию Br–Br, равному 228 пм), а расстояние Br···Br между молекулами составляет 331 пм внутри слоя и 399 пм между слоями (сравните радиус Ван-дер-Ваальса брома, равный 195 пм). Такая структура означает, что бром является очень плохим проводником электричества, с проводимостью около 5 × 10−13 Ом − 1 см −1 чуть ниже точки плавления, хотя это выше, чем по существу необнаружимая проводимость хлора. [31]
При давлении 55 ГПа (примерно в 540 000 раз больше атмосферного давления) бром претерпевает переход изолятор-металл. При 75 ГПа он переходит в гранецентрированную орторомбическую структуру. При 100 ГПа он переходит в объемноцентрированную орторомбическую одноатомную форму. [36]
Бром имеет два стабильных изотопа , 79 Br и 81 Br. Это его единственные два природных изотопа, причем 79 Br составляет 51% природного брома, а 81 Br составляет оставшиеся 49%. Оба имеют ядерный спин 3/2− и, таким образом, могут использоваться для ядерного магнитного резонанса , хотя 81 Br более предпочтителен. Относительно 1:1 распределение двух изотопов в природе полезно для идентификации соединений, содержащих бром, с помощью масс-спектроскопии. Все другие изотопы брома радиоактивны, с периодами полураспада, слишком короткими, чтобы встречаться в природе. Из них наиболее важными являются 80 Br ( t 1/2 = 17,7 мин), 80m Br ( t 1/2 = 4,421 ч) и 82 Br ( t 1/2 = 35,28 ч), которые могут быть получены в результате нейтронной активации природного брома. [31] Наиболее стабильным радиоизотопом брома является 77 Br ( t 1/2 = 57,04 ч). Основной режим распада изотопов легче 79 Br — захват электронов в изотопы селена ; изотопов тяжелее 81 Br — бета-распад в изотопы криптона ; и 80 Br может распадаться любым из этих режимов до стабильных 80 Se или 80 Kr. Изотопы Br от 87 Br и тяжелее подвергаются бета-распаду с испусканием нейтронов и имеют практическое значение, поскольку являются продуктами деления. [37]
Бром занимает промежуточное положение по реакционной способности между хлором и йодом и является одним из самых реакционноспособных элементов. Энергии связи с бромом, как правило, ниже, чем с хлором, но выше, чем с йодом, и бром является более слабым окислителем, чем хлор, но более сильным, чем йод. Это можно увидеть из стандартных электродных потенциалов пар X 2 /X − (F, +2,866 В; Cl, +1,395 В; Br, +1,087 В; I, +0,615 В; At, приблизительно +0,3 В). Бромирование часто приводит к более высоким степеням окисления, чем йодирование, но более низким или равным степеням окисления хлорированию. Бром имеет тенденцию реагировать с соединениями, включающими связи M–M, M–H или M–C, образуя связи M–Br. [35]
Простейшим соединением брома является бромистый водород , HBr. Он в основном используется в производстве неорганических бромидов и алкилбромидов , а также в качестве катализатора для многих реакций в органической химии. В промышленности его в основном получают путем реакции газообразного водорода с газообразным бромом при 200–400 °C с платиновым катализатором. Однако восстановление брома красным фосфором является более практичным способом получения бромистого водорода в лаборатории: [38]
При комнатной температуре бромистый водород представляет собой бесцветный газ, как и все галогениды водорода, за исключением фтористого водорода , поскольку водород не может образовывать прочные водородные связи с большим и лишь слегка электроотрицательным атомом брома; однако слабые водородные связи присутствуют в твердом кристаллическом бромистом водороде при низких температурах, подобно структуре фтористого водорода, прежде чем беспорядок начнет преобладать по мере повышения температуры. [38] Водный бромистый водород известен как бромистоводородная кислота , которая является сильной кислотой (p K a = −9), поскольку водородные связи с бромом слишком слабы, чтобы ингибировать диссоциацию. Система HBr/H 2 O также включает множество гидратов HBr· n H 2 O для n = 1, 2, 3, 4 и 6, которые по сути являются солями анионов брома и катионов гидроксония . Бромистоводородная кислота образует азеотроп с температурой кипения 124,3 °C при 47,63 г HBr на 100 г раствора; таким образом, бромистоводородная кислота не может быть сконцентрирована выше этой точки путем перегонки. [39]
В отличие от фтористого водорода , с безводным жидким бромистым водородом трудно работать в качестве растворителя, поскольку его температура кипения низкая, он имеет небольшой интервал жидкого состояния, его диэлектрическая проницаемость низкая и он не диссоциирует в значительной степени на H2Br + и HBr .−
2ионы – последние, в любом случае, гораздо менее стабильны, чем ионы бифторида ( HF−
2) из-за очень слабой водородной связи между водородом и бромом, хотя его соли с очень большими и слабо поляризующими катионами, такими как Cs + и NR+
4(R = Me , Et , Bu n ) все еще может быть выделен. Безводный бромистый водород является плохим растворителем, способным растворять только низкомолекулярные соединения, такие как нитрозилхлорид и фенол , или соли с очень низкой энергией решетки, такие как галогениды тетраалкиламмония. [39]
Почти все элементы в периодической таблице образуют бинарные бромиды. Исключения решительно находятся в меньшинстве и в каждом случае происходят по одной из трех причин: чрезвычайная инертность и нежелание участвовать в химических реакциях ( благородные газы , за исключением ксенона в очень нестабильном XeBr2 ); чрезвычайная ядерная нестабильность, затрудняющая химические исследования до распада и трансмутации (многие из самых тяжелых элементов после висмута ); и наличие электроотрицательности выше, чем у брома ( кислород , азот , фтор и хлор ), так что полученные бинарные соединения формально не являются бромидами, а скорее оксидами, нитридами, фторидами или хлоридами брома. (Тем не менее, трибромид азота назван бромидом, поскольку он аналогичен другим тригалогенидам азота.) [40]
Бромирование металлов с помощью Br 2 имеет тенденцию давать более низкие степени окисления, чем хлорирование с помощью Cl 2 , когда доступно множество степеней окисления. Бромиды могут быть получены путем реакции элемента или его оксида, гидроксида или карбоната с бромистоводородной кислотой, а затем дегидратированы умеренно высокими температурами в сочетании с низким давлением или безводным газом бромистого водорода. Эти методы работают лучше всего, когда бромистый продукт стабилен к гидролизу; в противном случае возможности включают высокотемпературное окислительное бромирование элемента бромом или бромистым водородом, высокотемпературное бромирование оксида металла или другого галогенида бромом, летучим бромидом металла, тетрабромидом углерода или органическим бромидом. Например, оксид ниобия (V) реагирует с тетрабромидом углерода при 370 °C с образованием бромида ниобия (V) . [40] Другим методом является галогенный обмен в присутствии избытка «галогенирующего реагента», например: [40]
Когда требуется низший бромид, можно либо восстановить высший галогенид, используя водород или металл в качестве восстановителя, либо можно использовать термическое разложение или диспропорционирование следующим образом: [40]
Большинство бромидов металлов с металлом в низких степенях окисления (от +1 до +3) являются ионными. Неметаллы, как правило, образуют ковалентные молекулярные бромиды, как и металлы в высоких степенях окисления от +3 и выше. Как ионные, так и ковалентные бромиды известны для металлов в степени окисления +3 (например, бромид скандия в основном ионный, а бромид алюминия — нет). Бромид серебра очень нерастворим в воде и поэтому часто используется в качестве качественного теста на бром. [40]
Галогены образуют множество бинарных, диамагнитных интергалогеновых соединений со стехиометрией XY, XY 3 , XY 5 и XY 7 (где X тяжелее Y), и бром не является исключением. Бром образует монофторид и монохлорид, а также трифторид и пентафторид. Также охарактеризованы некоторые катионные и анионные производные, такие как BrF−
2, BrCl−
2, БрФ+
2, БрФ+
4, и БрФ+
6. Помимо них, известны также некоторые псевдогалогениды , такие как бромциан (BrCN), тиоцианат брома (BrSCN) и азид брома (BrN 3 ). [41]
Бледно-коричневый монофторид брома (BrF) нестабилен при комнатной температуре, быстро и необратимо диспропорционируя на бром, трифторид брома и пентафторид брома. Таким образом, его нельзя получить в чистом виде. Его можно синтезировать прямой реакцией элементов или путем сопропорционирования брома и трифторида брома при высоких температурах. [41] Монохлорид брома (BrCl), красно-коричневый газ, довольно легко обратимо диссоциирует на бром и хлор при комнатной температуре и, таким образом, также не может быть получен в чистом виде, хотя его можно получить обратимой прямой реакцией его элементов в газовой фазе или в четыреххлористом углероде . [40] Монофторид брома в этаноле легко приводит к монобромированию ароматических соединений PhX ( пара -бромирование происходит для X = Me, Bu t , OMe, Br; мета -бромирование происходит для дезактивирующего X = –CO 2 Et, –CHO, –NO 2 ); это происходит из-за гетеролитического расщепления связи Br–F, что приводит к быстрому электрофильному бромированию Br + . [40]
При комнатной температуре трифторид брома (BrF 3 ) представляет собой жидкость соломенного цвета. Он может быть образован путем прямого фторирования брома при комнатной температуре и очищается путем перегонки. Он бурно реагирует с водой и взрывается при контакте с горючими материалами, но является менее мощным фторирующим реагентом, чем трифторид хлора . Он бурно реагирует с бором , углеродом , кремнием , мышьяком , сурьмой , йодом и серой , образуя фториды, а также преобразует большинство металлов и многие металлические соединения во фториды; как таковой, он используется для окисления урана до гексафторида урана в ядерной энергетике. Тугоплавкие оксиды, как правило, фторируются лишь частично, но здесь производные KBrF 4 и BrF 2 SbF 6 остаются реакционноспособными. Трифторид брома является полезным неводным ионизирующим растворителем, поскольку он легко диссоциирует с образованием BrF+
2и БрФ−
4и таким образом проводит электричество. [42]
Пентафторид брома (BrF 5 ) был впервые синтезирован в 1930 году. Он производится в больших масштабах путем прямой реакции брома с избытком фтора при температурах выше 150 °C, а в малых масштабах — путем фторирования бромида калия при 25 °C. Он также бурно реагирует с водой и является очень сильным фторирующим агентом, хотя трифторид хлора еще сильнее. [43]
Хотя дибром является сильным окислителем с высокой первой энергией ионизации, очень сильные окислители, такие как пероксидисульфурилфторид (S 2 O 6 F 2 ), могут окислять его с образованием вишнево-красного Br+
2катион. Известно еще несколько катионов брома, а именно коричневый Br+
3и темно-коричневый Br+
5[44] Трибромидный анион, Br−
3, также был охарактеризован; он аналогичен трииодиду . [41]
Оксиды брома не так хорошо охарактеризованы, как оксиды хлора или оксиды йода , поскольку все они довольно нестабильны: когда-то считалось, что они вообще не могут существовать. Монооксид диброма — это темно-коричневое твердое вещество, которое, будучи достаточно стабильным при -60 °C, разлагается при температуре плавления -17,5 °C; он полезен в реакциях бромирования [46] и может быть получен путем низкотемпературного разложения диоксида брома в вакууме. Он окисляет йод до пентоксида йода и бензол до 1,4-бензохинона ; в щелочных растворах он дает анион гипобромита . [47]
Так называемый « диоксид брома », бледно-желтое кристаллическое вещество, может быть лучше сформулирован как пербромат брома , BrOBrO 3 . Он термически нестабилен выше −40 °C, бурно разлагается на свои элементы при 0 °C. Также известен триоксид диброма , syn -BrOBrO 2 ; это ангидрид бромноватистой кислоты и бромноватистой кислоты . Это оранжевое кристаллическое вещество, которое разлагается выше −40 °C; при слишком быстром нагревании оно взрывается около 0 °C. Также известны несколько других нестабильных радикальных оксидов, как и некоторые плохо охарактеризованные оксиды, такие как пентаоксид диброма , октаоксид триброма и триоксид брома. [47]
Четыре оксокислоты , бромноватистая кислота (HOBr), бромистая кислота (HOBrO), бромистая кислота (HOBrO 2 ) и пербромная кислота (HOBrO 3 ), изучены лучше из-за их большей стабильности, хотя они таковы только в водном растворе. Когда бром растворяется в водном растворе, происходят следующие реакции: [45]
Гипобромистая кислота нестабильна к диспропорционированию. Образующиеся таким образом ионы гипобромита легко диспропорционируют, давая бромид и бромат: [45]
Бромистые кислоты и бромиты очень нестабильны, хотя известны бромиты стронция и бария . [48] Более важными являются броматы , которые готовятся в небольших масштабах путем окисления бромида водным гипохлоритом и являются сильными окислителями. В отличие от хлоратов, которые очень медленно диспропорционируют до хлорида и перхлората, анион бромата устойчив к диспропорционированию как в кислых, так и в водных растворах. Бромистая кислота является сильной кислотой. Бромиды и броматы могут пропорционировать брому следующим образом: [48]
Было много неудачных попыток получить перброматы и пербромную кислоту, что привело к некоторым обоснованиям того, почему они не должны существовать, пока в 1968 году анион не был впервые синтезирован из радиоактивного бета-распада нестабильного83
SeO2−
4. Сегодня перброматы производятся путем окисления щелочных растворов бромата фтористым газом. Избыток бромата и фторида осаждается в виде бромата серебра и фторида кальция , а раствор пербромной кислоты может быть очищен. Ион пербромата довольно инертен при комнатной температуре, но термодинамически является чрезвычайно окисляющим, и для его получения необходимы чрезвычайно сильные окислители, такие как фтор или дифторид ксенона . Связь Br–O в BrO−
4довольно слаб, что соответствует общему нежеланию 4p-элементов мышьяка , селена и брома достигать своей групповой степени окисления, поскольку они следуют за скандидным сокращением, характеризующимся слабой защитой, обеспечиваемой радиально-безузловыми 3d-орбиталями. [49]

Как и другие связи углерод-галоген, связь C–Br является общей функциональной группой, которая является частью основной органической химии . Формально соединения с этой функциональной группой можно считать органическими производными бромид-аниона. Из-за разницы в электроотрицательности между бромом (2,96) и углеродом (2,55) атом углерода в связи C–Br является электронодефицитным и, следовательно, электрофильным . Реакционная способность броморганических соединений напоминает, но является промежуточной между реакционной способностью хлорорганических и иодорганических соединений . Для многих применений органобромиды представляют собой компромисс между реакционной способностью и стоимостью. [50]
Органобромиды обычно производятся путем аддитивного или заместительного бромирования других органических предшественников. Сам бром может быть использован, но из-за его токсичности и летучести обычно используются более безопасные бромирующие реагенты, такие как N -бромсукцинимид . Основные реакции для органобромидов включают дегидробромирование , реакции Гриньяра , восстановительное сочетание и нуклеофильное замещение . [50]
Органобромиды являются наиболее распространенными органогалогенидами в природе, хотя концентрация бромида составляет всего 0,3% от концентрации хлорида в морской воде из-за легкого окисления бромида до эквивалента Br + , сильного электрофила. Фермент бромопероксидаза катализирует эту реакцию. [51] По оценкам, океаны ежегодно выбрасывают 1–2 миллиона тонн бромоформа и 56 000 тонн бромметана . [12]
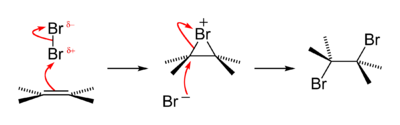
Старый качественный тест на наличие функциональной группы алкена заключается в том, что алкены превращают коричневые водные растворы брома в бесцветные, образуя бромгидрин с некоторым количеством дибромалкана, также полученного. Реакция проходит через короткоживущий сильно электрофильный промежуточный бромониевый продукт . Это пример реакции присоединения галогена . [52]

Бром значительно менее распространен в земной коре, чем фтор или хлор, составляя всего 2,5 части на миллион пород земной коры, и то только в виде солей брома. Это 46-й по распространенности элемент в земной коре. Он значительно более распространен в океанах в результате длительного выщелачивания . Там он составляет 65 частей на миллион, что соответствует соотношению примерно один атом брома на каждые 660 атомов хлора. Соляные озера и скважины с рассолом могут иметь более высокие концентрации брома: например, Мертвое море содержит 0,4% ионов брома. [53] Именно из этих источников добыча брома в основном экономически целесообразна. [54] [55] [56] Бром является десятым по распространенности элементом в морской воде. [57]
Основными источниками производства брома являются Израиль и Иордания . [58] Элемент выделяется путем галогенного обмена, при котором хлорный газ окисляется Br − до Br 2 . Затем он удаляется струей пара или воздуха, а затем конденсируется и очищается. [59] Сегодня бром перевозится в металлических бочках большой емкости или свинцовых цистернах, которые могут вмещать сотни килограммов или даже тонны брома. Бромная промышленность составляет примерно одну сотую от хлорной промышленности. Лабораторное производство не нужно, поскольку бром доступен в продаже и имеет длительный срок хранения. [60]
В промышленности используется широкий спектр броморганических соединений . Некоторые из них готовятся из брома, а другие — из бромистого водорода , который получается путем сжигания водорода в броме. [61]
Бромированные антипирены представляют собой товар все большей важности и составляют крупнейшее коммерческое использование брома. Когда бромированный материал горит, антипирен производит бромистоводородную кислоту , которая вмешивается в радикальную цепную реакцию окисления огня. Механизм заключается в том, что высокореактивные водородные радикалы, кислородные радикалы и гидроксильные радикалы реагируют с бромистоводородной кислотой, образуя менее реактивные радикалы брома (т. е. свободные атомы брома). Атомы брома также могут напрямую реагировать с другими радикалами, помогая прекратить свободнорадикальные цепные реакции, которые характеризуют горение. [62] [63]
Для изготовления бромированных полимеров и пластиков бромсодержащие соединения могут быть включены в полимер во время полимеризации . Один из методов заключается во включении относительно небольшого количества бромированного мономера во время процесса полимеризации. Например, винилбромид может быть использован в производстве полиэтилена , поливинилхлорида или полипропилена . Также могут быть добавлены определенные высокобромированные молекулы, которые участвуют в процессе полимеризации. Например, тетрабромбисфенол А может быть добавлен к полиэфирам или эпоксидным смолам, где он становится частью полимера. Эпоксидные смолы, используемые в печатных платах, обычно изготавливаются из таких огнестойких смол , обозначенных FR в аббревиатуре продуктов ( FR-4 и FR-2 ). В некоторых случаях бромсодержащее соединение может быть добавлено после полимеризации. Например, декабромдифениловый эфир может быть добавлен к конечным полимерам. [64]
Ряд газообразных или высоколетучих бромированных галометановых соединений нетоксичны и являются превосходными средствами пожаротушения по тому же механизму и особенно эффективны в закрытых помещениях, таких как подводные лодки, самолеты и космические корабли. Однако они дороги, а их производство и использование значительно сокращены из-за их воздействия как озоноразрушающих агентов. Они больше не используются в обычных огнетушителях, но сохраняют нишевое применение в аэрокосмических и военных автоматических системах пожаротушения. К ним относятся бромхлорметан (Галон 1011, CH2BrCl ) , бромхлордифторметан (Галон 1211, CBrClF2 ) и бромтрифторметан (Галон 1301, CBrF3 ) . [65]

Бромид серебра используется как отдельно, так и в сочетании с хлоридом серебра и иодидом серебра в качестве светочувствительного компонента фотографических эмульсий . [60]
Бромистый этилен был добавкой в бензинах, содержащих свинцовые антидетонационные агенты . Он очищает свинец, образуя летучий бромистый свинец, который выбрасывается из двигателя. Это применение составило 77% от использования брома в 1966 году в США. Это применение сократилось с 1970-х годов из-за экологических норм (см. ниже). [66]
Бромированное растительное масло (БВО) — сложная смесь триглицеридов растительного происхождения, которые в результате реакции содержат атомы брома, связанные с молекулами, — используется в основном для эмульгирования безалкогольных напитков со вкусом цитрусовых, предотвращая их расслоение во время дистрибуции.
Ядовитый бромметан широко использовался в качестве пестицида для фумигации почвы и жилья методом палаток. Аналогичным образом использовался бромистый этилен. [67] Все эти летучие броморганические соединения теперь регулируются как озоноразрушающие агенты. Монреальский протокол по веществам, разрушающим озоновый слой, запланировал поэтапный отказ от озоноразрушающего химиката к 2005 году, и органобромидные пестициды больше не используются (при фумигации жилья они были заменены такими соединениями, как сульфурилфторид , которые не содержат ни хлора, ни брома, которые вредят озону). До Монреальского протокола в 1991 году (например) примерно 35 000 тонн химиката использовались для борьбы с нематодами , грибками , сорняками и другими почвенными болезнями. [68] [69]
В фармакологии неорганические бромистые соединения, особенно бромистый калий , часто использовались в качестве общих седативных средств в 19-м и начале 20-го века. Бромиды в форме простых солей до сих пор используются в качестве противосудорожных средств как в ветеринарии, так и в медицине, хотя последнее применение варьируется от страны к стране. Например, Управление по контролю за продуктами и лекарствами США (FDA) не одобряет бромид для лечения каких-либо заболеваний, а бромистый натрий был удален из безрецептурных седативных продуктов, таких как Bromo-Seltzer , в 1975 году. [70] Коммерчески доступные броморганические фармацевтические препараты включают вазодилататор ницерголин , седативное средство бротизолам , противораковое средство пипоброман и антисептик мербромин . В противном случае броморганические соединения редко бывают фармацевтически полезными, в отличие от ситуации с фторорганическими соединениями . Некоторые препараты производятся в виде бромидных (или эквивалентных им гидробромидных) солей, но в таких случаях бромид служит безвредным противоионом, не имеющим биологического значения. [50]
Другие применения броморганических соединений включают буровые растворы высокой плотности, красители (такие как тирский пурпур и индикатор бромтимоловый синий ) и фармацевтические препараты. Сам бром, а также некоторые его соединения используются при очистке воды и являются предшественниками различных неорганических соединений с огромным количеством применений (например, бромистое серебро для фотографии). [60] Цинк-бромные батареи представляют собой гибридные проточные батареи, используемые для стационарного резервного электропитания и хранения; от бытовых до промышленных масштабов.
Бром используется в градирнях (вместо хлора) для борьбы с бактериями, водорослями, грибками и зебровыми дрейссенами . [71]
Поскольку он обладает схожими антисептическими свойствами с хлором, бром может использоваться таким же образом, как хлор, в качестве дезинфицирующего или противомикробного средства в таких областях, как плавательные бассейны. Бром начал использоваться в Соединенных Штатах во время Второй мировой войны из-за прогнозируемого дефицита хлора. [72] Однако бром обычно не используется снаружи для этих целей из-за того, что он относительно дороже хлора и отсутствует стабилизатор для защиты от солнца. Для крытых бассейнов он может быть хорошим вариантом, поскольку он эффективен в более широком диапазоне pH. Он также более стабилен в подогреваемом бассейне или джакузи. [73]
Исследование 2014 года предполагает, что бром (в форме бромид-иона) является необходимым кофактором в биосинтезе коллагена IV , что делает элемент необходимым для архитектуры базальной мембраны и развития тканей у животных. [11] Тем не менее, никаких четких симптомов или синдромов депривации у млекопитающих не было задокументировано. [74] В других биологических функциях бром может быть несущественным, но все же полезным, когда он заменяет хлор. Например, в присутствии перекиси водорода, H 2 O 2 , образованной эозинофилом , и ионов хлорида, йодида, тиоцианата или бромида, эозинофильная пероксидаза обеспечивает мощный механизм, с помощью которого эозинофилы убивают многоклеточных паразитов (таких как нематоды, участвующие в филяриатозе ) и некоторые бактерии (такие как бактерии туберкулеза ). Эозинофильная пероксидаза — это галопероксидаза , которая для этой цели преимущественно использует бромид, а не хлорид, образуя гипобромит ( бромноватистая кислота ), хотя использование хлорида возможно. [10]

α-Галоэфиры обычно считаются высокореактивными и, следовательно, токсичными промежуточными продуктами в органическом синтезе. Тем не менее, млекопитающие, включая людей, кошек и крыс, по-видимому, биосинтезируют следы α-бромэфира, 2-октил 4-бром-3-оксобутаноата, который обнаруживается в их спинномозговой жидкости и, по-видимому, играет пока невыясненную роль в индуцировании быстрого сна. [12] Миелопероксидаза нейтрофилов может использовать H 2 O 2 и Br − для бромирования дезоксицитидина, что может привести к мутациям ДНК. [75] Морские организмы являются основным источником броморганических соединений, и именно в этих организмах бром более убедительно показан как необходимый. К 1999 году было идентифицировано более 1600 таких броморганических соединений. Наиболее распространенным является бромистый метил ( CH3Br ), около 56 000 тонн которого ежегодно производят морские водоросли. [12] Эфирное масло гавайской водоросли Asparagopsis taxiformis на 80% состоит из бромоформа . [76] Большинство таких броморганических соединений в море производятся под действием уникального фермента водорослей, ванадиевой бромпероксидазы . [77]
Бромид-анион не очень токсичен: нормальная суточная доза составляет от 2 до 8 миллиграммов. [74] Однако высокие уровни бромида хронически повреждают мембрану нейронов, что постепенно ухудшает нейронную передачу, что приводит к токсичности, известной как бромизм . Бромид имеет период полувыведения от 9 до 12 дней, что может привести к чрезмерному накоплению. Дозы от 0,5 до 1 грамма бромида в день могут привести к бромизму. Исторически терапевтическая доза бромида составляет около 3-5 граммов бромида, что объясняет, почему хроническая токсичность (бромизм) когда-то была так распространена. Хотя значительные и иногда серьезные нарушения происходят в неврологических, психиатрических, дерматологических и желудочно-кишечных функциях, смерть от бромизма редка. [78] Бромизм вызван нейротоксическим воздействием на мозг, что приводит к сонливости , психозу , судорогам и делирию . [79]
Элементарный бром (Br2 ) токсичен и вызывает химические ожоги на коже человека. Вдыхание бромного газа приводит к аналогичному раздражению дыхательных путей, вызывая кашель, удушье, одышку и смерть при вдыхании в достаточно больших количествах. Хроническое воздействие может привести к частым бронхиальным инфекциям и общему ухудшению здоровья. Как сильный окислитель, бром несовместим с большинством органических и неорганических соединений. [82] При транспортировке брома требуется осторожность; его обычно перевозят в стальных цистернах, облицованных свинцом, с прочными металлическими рамами. [60] Управление по охране труда и технике безопасности (OSHA) США установило допустимый предел воздействия (PEL) для брома в виде средневзвешенного по времени значения (TWA) 0,1 ppm. Национальный институт охраны труда и техники безопасности (NIOSH) установил рекомендуемый предел воздействия (REL) в размере TWA 0,1 ppm и краткосрочный предел в размере 0,3 ppm. Воздействие брома, непосредственно опасное для жизни и здоровья (IDLH), составляет 3 ppm. [83] Бром классифицируется как чрезвычайно опасное вещество в Соединенных Штатах, как определено в разделе 302 Закона США о планировании действий в чрезвычайных ситуациях и праве общества на информацию (42 USC 11002), и подлежит строгим требованиям отчетности со стороны предприятий, которые производят, хранят или используют его в значительных количествах. [84]