Атомы являются основными частицами химических элементов . Атом состоит из ядра протонов и, как правило, нейтронов , окруженного электромагнитно связанным роем электронов . Химические элементы отличаются друг от друга числом протонов, которые находятся в их атомах. Например, любой атом, содержащий 11 протонов, является натрием , а любой атом, содержащий 29 протонов, является медью . Атомы с одинаковым числом протонов, но разным числом нейтронов называются изотопами одного и того же элемента.
Атомы чрезвычайно малы, обычно около 100 пикометров в поперечнике. Человеческий волос состоит примерно из миллиона атомов углерода в ширину. Атомы меньше самой короткой длины волны видимого света, что означает, что люди не могут видеть атомы с помощью обычных микроскопов. Они настолько малы, что точное предсказание их поведения с помощью классической физики невозможно из-за квантовых эффектов .
Более 99,9994% [1] массы атома находится в ядре. Протоны имеют положительный электрический заряд , а нейтроны не имеют заряда, поэтому ядро заряжено положительно. Электроны заряжены отрицательно, и этот противоположный заряд связывает их с ядром. Если число протонов и электронов равно, как это обычно и бывает, то атом в целом электрически нейтрален. Если у атома больше электронов, чем протонов, то он имеет общий отрицательный заряд и называется отрицательным ионом (или анионом). И наоборот, если у него больше протонов, чем электронов, он имеет положительный заряд и называется положительным ионом (или катионом).
Электроны атома притягиваются к протонам в атомном ядре электромагнитной силой . Протоны и нейтроны в ядре притягиваются друг к другу ядерной силой . Эта сила обычно сильнее электромагнитной силы, которая отталкивает положительно заряженные протоны друг от друга. При определенных обстоятельствах отталкивающая электромагнитная сила становится сильнее ядерной силы. В этом случае ядро расщепляется и оставляет после себя различные элементы . Это форма ядерного распада .
Атомы могут присоединяться к одному или нескольким другим атомам посредством химических связей , образуя химические соединения, такие как молекулы или кристаллы . Способность атомов присоединяться и отсоединяться друг от друга отвечает за большинство физических изменений, наблюдаемых в природе. Химия — это наука, которая изучает эти изменения.
Основная идея о том, что материя состоит из крошечных неделимых частиц, является старой идеей, которая появилась во многих древних культурах. Слово атом происходит от древнегреческого слова atomos , [a], что означает «неразрезаемый». Но эта древняя идея была основана на философских рассуждениях, а не на научных рассуждениях. Современная атомная теория не основана на этих старых концепциях. [2] [3] В начале 19 века ученый Джон Дальтон нашел доказательства того, что материя действительно состоит из дискретных единиц, и поэтому применил слово атом к этим единицам. [4]

В начале 1800-х годов Джон Дальтон собрал экспериментальные данные, собранные им и другими учеными, и открыл закономерность, которая сейчас известна как « закон кратных пропорций ». Он заметил, что в любой группе химических соединений, которые все содержат два определенных химических элемента, количество элемента A на меру элемента B будет отличаться в этих соединениях на соотношение малых целых чисел. Эта закономерность предполагала, что каждый элемент объединяется с другими элементами в кратных основной единице веса, причем каждый элемент имеет единицу уникального веса. Дальтон решил назвать эти единицы «атомами». [5]
Например, существует два типа оксида олова : один представляет собой серый порошок, который состоит из 88,1% олова и 11,9% кислорода, а другой представляет собой белый порошок, который состоит из 78,7% олова и 21,3% кислорода. Корректируя эти цифры, в сером порошке содержится около 13,5 г кислорода на каждые 100 г олова, а в белом порошке содержится около 27 г кислорода на каждые 100 г олова. 13,5 и 27 образуют соотношение 1:2. Дальтон пришел к выводу, что в сером оксиде содержится один атом кислорода на каждый атом олова, а в белом оксиде содержится два атома кислорода на каждый атом олова ( SnO и SnO 2 ). [6] [7]
Дальтон также проанализировал оксиды железа . Существует один тип оксида железа, который представляет собой черный порошок, который состоит из 78,1% железа и 21,9% кислорода; и есть другой оксид железа, который представляет собой красный порошок, который состоит из 70,4% железа и 29,6% кислорода. Корректируя эти цифры, в черном порошке содержится около 28 г кислорода на каждые 100 г железа, а в красном порошке содержится около 42 г кислорода на каждые 100 г железа. 28 и 42 образуют соотношение 2:3. Дальтон пришел к выводу, что в этих оксидах на каждые два атома железа приходится два или три атома кислорода соответственно ( Fe 2 O 2 и Fe 2 O 3 ). [b] [8] [9]
В качестве последнего примера: закись азота состоит на 63,3% из азота и на 36,7% из кислорода, оксид азота состоит на 44,05% из азота и на 55,95% из кислорода, а диоксид азота состоит на 29,5% из азота и на 70,5% из кислорода. Корректируя эти цифры, получаем, что в закиси азота на каждые 140 г азота приходится 80 г кислорода, в оксиде азота на каждые 140 г азота приходится около 160 г кислорода, а в диоксиде азота на каждые 140 г азота приходится 320 г кислорода. 80, 160 и 320 образуют соотношение 1:2:4. Соответствующие формулы для этих оксидов — N 2 O , NO и NO 2 . [10] [11]
В 1897 году Дж. Дж. Томсон открыл, что катодные лучи не являются формой света, а состоят из отрицательно заряженных частиц, поскольку они могут отклоняться электрическими и магнитными полями. [12] Он измерил, что эти частицы по крайней мере в тысячу раз легче водорода (самого легкого атома). [13] Он назвал эти новые частицы корпускулами , но позже они были переименованы в электроны, поскольку это частицы, которые переносят электричество. [14] Томсон также показал, что электроны идентичны частицам, испускаемым фотоэлектрическими и радиоактивными материалами. [15] Томсон объяснил, что электрический ток — это передача электронов от одного атома к другому, и когда тока нет, электроны внедряются в атомы. Это, в свою очередь, означает, что атомы не являются неделимыми, как думали ученые. Атом состоит из электронов, отрицательный заряд которых уравновешивается некоторым источником положительного заряда, создавая электрически нейтральный атом. Ионы, объяснил Томсон, должны быть атомами, которые имеют избыток или недостаток электронов. [16]
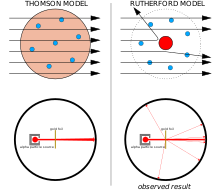
Электроны в атоме логически должны были быть уравновешены соразмерным количеством положительного заряда, но Томсон понятия не имел, откуда взялся этот положительный заряд, поэтому он предположил, что он был повсюду в атоме, поскольку атом имел форму сферы. Это была математически самая простая гипотеза, соответствовавшая имеющимся доказательствам или их отсутствию. Исходя из этого, Томсон предположил, что баланс электростатических сил распределит электроны по всей сфере более или менее равномерно. [17] Модель Томсона широко известна как модель сливового пудинга , хотя ни Томсон, ни его коллеги не использовали эту аналогию. [18] Модель Томсона была неполной, она не могла предсказать никаких других свойств элементов, таких как спектры испускания и валентности . Она вскоре устарела с открытием атомного ядра .
Между 1908 и 1913 годами Эрнест Резерфорд и его коллеги Ганс Гейгер и Эрнест Марсден провели ряд экспериментов, в которых они бомбардировали тонкие металлические фольги пучком альфа-частиц . Они сделали это, чтобы измерить картины рассеяния альфа-частиц. Они заметили небольшое количество альфа-частиц, отклоняющихся на углы больше 90°. Это не должно было быть возможным согласно модели атома Томсона, чьи заряды были слишком рассеяны, чтобы создать достаточно сильное электрическое поле. Все отклонения должны были быть пренебрежимо малыми. Резерфорд предположил, что положительный заряд атома сосредоточен в крошечном объеме в центре атома и что электроны окружают это ядро диффузным облаком. Это ядро несло почти всю массу атома, электроны были очень легкими. Только такая интенсивная концентрация заряда, закрепленная его большой массой, могла создать электрическое поле, которое могло бы так сильно отклонить альфа-частицы. [19]

Проблема классической механики заключается в том, что ускоряющаяся заряженная частица испускает электромагнитное излучение, в результате чего частица теряет кинетическую энергию. Круговое движение считается ускорением, что означает, что электрон, вращающийся вокруг центрального заряда, должен по спирали опускаться в это ядро по мере потери скорости. В 1913 году физик Нильс Бор предложил новую модель, в которой предполагалось, что электроны атома вращаются вокруг ядра, но могут делать это только по конечному набору орбит и могут перескакивать между этими орбитами только в дискретных изменениях энергии, соответствующих поглощению или излучению фотона. [20] Это квантование использовалось для объяснения того, почему орбиты электронов стабильны и почему элементы поглощают и испускают электромагнитное излучение в дискретных спектрах. [21] Модель Бора могла предсказать только спектры излучения водорода, но не атомов с более чем одним электроном.
Еще в 1815 году Уильям Праут заметил, что атомные веса многих элементов были кратны атомному весу водорода, что на самом деле верно для всех них, если принять во внимание изотопы . В 1898 году Дж. Дж. Томсон обнаружил, что положительный заряд иона водорода равен отрицательному заряду электрона, и это были самые маленькие известные заряженные частицы. [22] Позже Томсон обнаружил, что положительный заряд в атоме является положительным кратным отрицательного заряда электрона. [23] В 1913 году Генри Мозли обнаружил, что частоты рентгеновского излучения возбужденного атома являются математической функцией его атомного номера и заряда ядра водорода. В 1919 году Резерфорд бомбардировал азот альфа -частицами и обнаружил ионы водорода , испускаемые газом, и пришел к выводу, что они были получены альфа-частицами, ударяющими и расщепляющими ядра атомов азота. [24]
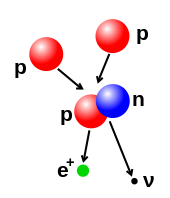
Эти наблюдения привели Резерфорда к выводу, что ядро водорода является особой частицей с положительным зарядом, равным отрицательному заряду электрона. [25] Он назвал эту частицу « протоном » в 1920 году. [26] Атомный номер элемента , который был определен как положение элемента в периодической таблице , также является числом протонов в его ядре. Атомный вес каждого элемента больше, чем его число протонов, поэтому Резерфорд выдвинул гипотезу, что избыточный вес переносится неизвестными частицами без электрического заряда и с массой, равной массе протона.
В 1928 году Уолтер Боте заметил, что бериллий испускает высокопроникающее, электрически нейтральное излучение при бомбардировке альфа-частицами. Позже было обнаружено, что это излучение может выбивать атомы водорода из парафинового воска . Первоначально считалось, что это было высокоэнергетическое гамма-излучение , поскольку гамма-излучение оказывало аналогичное воздействие на электроны в металлах, но Джеймс Чедвик обнаружил, что эффект ионизации был слишком сильным, чтобы быть следствием электромагнитного излучения, при условии сохранения энергии и импульса во взаимодействии. В 1932 году Чедвик подверг различные элементы, такие как водород и азот, воздействию таинственного «бериллиевого излучения», и, измеряя энергии отскакивающих заряженных частиц, он пришел к выводу, что излучение на самом деле состояло из электрически нейтральных частиц, которые не могли быть безмассовыми, как гамма-лучи, но вместо этого должны были иметь массу, близкую к массе протона. Теперь Чедвик утверждал, что эти частицы были нейтронами Резерфорда. [27]

В 1925 году Вернер Гейзенберг опубликовал первую последовательную математическую формулировку квантовой механики ( матричная механика ). [28] Годом ранее Луи де Бройль предположил, что все частицы ведут себя как волны в некоторой степени, [29] и в 1926 году Эрвин Шредингер использовал эту идею для разработки уравнения Шредингера , которое описывает электроны как трехмерные волновые формы, а не как точки в пространстве. [30] Следствием использования волновых форм для описания частиц является то, что математически невозможно получить точные значения как для положения , так и для импульса частицы в заданный момент времени. Это стало известно как принцип неопределенности , сформулированный Вернером Гейзенбергом в 1927 году. [28] В этой концепции для заданной точности измерения положения можно получить только диапазон вероятных значений для импульса, и наоборот. [31] Таким образом, планетарная модель атома была отвергнута в пользу модели, описывающей атомные орбитальные зоны вокруг ядра, где данный электрон с наибольшей вероятностью может находиться. [32] [33] Эта модель смогла объяснить наблюдения за поведением атомов, которые не могли объяснить предыдущие модели, такие как определенные структурные и спектральные закономерности атомов, более крупных, чем водород.
Хотя слово атом изначально обозначало частицу, которую нельзя разрезать на более мелкие частицы, в современном научном использовании атом состоит из различных субатомных частиц . Составными частицами атома являются электрон , протон и нейтрон .
Электрон является наименее массивной из этих частиц на четыре порядка по массе.9,11 × 10 −31 кг , с отрицательным электрическим зарядом и размером, который слишком мал для измерения с помощью имеющихся методов. [34] Это была самая легкая частица с положительной измеренной массой покоя, до открытия массы нейтрино . В обычных условиях электроны связаны с положительно заряженным ядром притяжением, создаваемым противоположными электрическими зарядами. Если атом имеет больше или меньше электронов, чем его атомный номер, то он становится соответственно отрицательно или положительно заряженным как целое; заряженный атом называется ионом . Электроны были известны с конца 19 века, в основном благодаря Дж. Дж. Томсону ; подробности см. в истории субатомной физики .
Протоны имеют положительный заряд и массу1,6726 × 10 −27 кг . Число протонов в атоме называется его атомным числом . Эрнест Резерфорд (1919) заметил, что азот при бомбардировке альфа-частицами выбрасывает то, что, по-видимому, является ядрами водорода. К 1920 году он признал, что ядро водорода является отдельной частицей в атоме, и назвал его протоном .
Нейтроны не имеют электрического заряда и имеют массу1,6749 × 10 −27 кг . [35] [36] Нейтроны являются самыми тяжелыми из трех составляющих частиц, но их масса может быть уменьшена за счет ядерной энергии связи . Нейтроны и протоны (совместно известные как нуклоны ) имеют сопоставимые размеры — порядка2,5 × 10−15 м — хотя «поверхность» этих частиц не имеет четких границ. [37] Нейтрон был открыт в 1932 году английским физиком Джеймсом Чедвиком .
В Стандартной модели физики электроны являются действительно элементарными частицами без внутренней структуры, тогда как протоны и нейтроны являются составными частицами, состоящими из элементарных частиц, называемых кварками . В атомах есть два типа кварков, каждый из которых имеет дробный электрический заряд. Протоны состоят из двух верхних кварков (каждый с зарядом + 2/3 ) и один нижний кварк (с зарядом − 1/3 ). Нейтроны состоят из одного верхнего кварка и двух нижних кварков. Это различие объясняет разницу в массе и заряде между двумя частицами. [38] [39]
Кварки удерживаются вместе сильным взаимодействием (или сильной силой), которое передается глюонами . Протоны и нейтроны, в свою очередь, удерживаются друг с другом в ядре ядерной силой , которая является остатком сильной силы, имеющей несколько иные свойства диапазона (см. статью о ядерной силе для получения дополнительной информации). Глюон является членом семейства калибровочных бозонов , которые являются элементарными частицами, которые являются посредниками физических сил. [38] [39]

Все связанные протоны и нейтроны в атоме составляют крошечное атомное ядро и вместе называются нуклонами . Радиус ядра приблизительно равен фемтометрам , где — общее число нуклонов. [40] Это намного меньше радиуса атома, который составляет порядка 10 5 фм. Нуклоны связаны друг с другом короткодействующим притягивающим потенциалом, называемым остаточной сильной силой . На расстояниях менее 2,5 фм эта сила намного мощнее электростатической силы , которая заставляет положительно заряженные протоны отталкиваться друг от друга. [41]
Атомы одного и того же элемента имеют одинаковое число протонов, называемое атомным номером . В пределах одного элемента число нейтронов может варьироваться, определяя изотоп этого элемента. Общее число протонов и нейтронов определяет нуклид . Число нейтронов относительно протонов определяет стабильность ядра, при этом некоторые изотопы подвергаются радиоактивному распаду . [42]
Протон, электрон и нейтрон классифицируются как фермионы . Фермионы подчиняются принципу исключения Паули , который запрещает идентичным фермионам, таким как несколько протонов, занимать одно и то же квантовое состояние в одно и то же время. Таким образом, каждый протон в ядре должен занимать квантовое состояние, отличное от всех других протонов, и то же самое относится ко всем нейтронам ядра и всем электронам электронного облака. [43]
Ядро, имеющее разное число протонов и нейтронов, может потенциально перейти в состояние с более низкой энергией посредством радиоактивного распада, который приводит к более близкому соответствию числа протонов и нейтронов. В результате атомы с совпадающим числом протонов и нейтронов более устойчивы к распаду, но с увеличением атомного числа взаимное отталкивание протонов требует все большей доли нейтронов для поддержания стабильности ядра. [43]
Число протонов и нейтронов в атомном ядре может быть изменено, хотя это может потребовать очень высоких энергий из-за сильного взаимодействия. Ядерный синтез происходит, когда несколько атомных частиц объединяются, образуя более тяжелое ядро, например, посредством энергетического столкновения двух ядер. Например, в ядре Солнца протонам требуется энергия от 3 до 10 кэВ, чтобы преодолеть их взаимное отталкивание — кулоновский барьер — и слиться в одно ядро. [44] Ядерное деление — это противоположный процесс, заставляющий ядро разделяться на два меньших ядра — обычно посредством радиоактивного распада. Ядро также может быть изменено посредством бомбардировки субатомными частицами высокой энергии или фотонами. Если это изменяет число протонов в ядре, атом превращается в другой химический элемент. [45] [46]
Если масса ядра после реакции синтеза меньше суммы масс отдельных частиц, то разница между этими двумя значениями может быть испущена как тип полезной энергии (такой как гамма-луч или кинетическая энергия бета -частицы ), как описано в формуле эквивалентности массы и энергии Альберта Эйнштейна , E =mc2 , где m — потеря массы, а c — скорость света . Этот дефицит является частью энергии связи нового ядра, и именно невосстановимая потеря энергии заставляет слитые частицы оставаться вместе в состоянии, требующем этой энергии для разделения. [47]
Слияние двух ядер, создающее более крупные ядра с меньшими атомными числами, чем у железа и никеля — общее число нуклонов около 60 — обычно является экзотермическим процессом , который высвобождает больше энергии, чем требуется для их соединения. [48] Именно этот процесс высвобождения энергии делает ядерный синтез в звездах самоподдерживающейся реакцией. Для более тяжелых ядер энергия связи на нуклон начинает уменьшаться. Это означает, что процесс слияния, производящий ядро с атомным числом выше примерно 26 и массовым числом выше примерно 60, является эндотермическим процессом . Таким образом, более массивные ядра не могут подвергнуться реакции слияния с выделением энергии, которая может поддерживать гидростатическое равновесие звезды. [43]

Электроны в атоме притягиваются к протонам в ядре электромагнитной силой . Эта сила связывает электроны внутри электростатической потенциальной ямы, окружающей меньшее ядро, что означает, что для того, чтобы электрон вырвался, необходим внешний источник энергии. Чем ближе электрон к ядру, тем больше сила притяжения. Следовательно, электронам, связанным вблизи центра потенциальной ямы, требуется больше энергии для вылета, чем тем, которые находятся на большем расстоянии.
Электроны, как и другие частицы, обладают свойствами как частицы, так и волны . Электронное облако — это область внутри потенциальной ямы, где каждый электрон образует тип трехмерной стоячей волны — волновой формы, которая не движется относительно ядра. Это поведение определяется атомной орбиталью , математической функцией, которая характеризует вероятность того, что электрон окажется в определенном месте при измерении его положения. [49] Вокруг ядра существует только дискретный (или квантованный) набор этих орбиталей, поскольку другие возможные волновые паттерны быстро распадаются на более стабильную форму. [50] Орбитали могут иметь одну или несколько кольцевых или узловых структур и отличаться друг от друга по размеру, форме и ориентации. [51]

Каждая атомная орбиталь соответствует определенному энергетическому уровню электрона. Электрон может изменить свое состояние на более высокий энергетический уровень, поглощая фотон с достаточной энергией, чтобы перейти в новое квантовое состояние. Аналогично, посредством спонтанного излучения , электрон в более высоком энергетическом состоянии может опуститься в более низкое энергетическое состояние, излучая избыточную энергию в виде фотона. Эти характерные значения энергии, определяемые разницей в энергиях квантовых состояний, отвечают за атомные спектральные линии . [50]
Количество энергии, необходимое для удаления или добавления электрона — энергия связи электрона — намного меньше энергии связи нуклонов . Например, требуется всего 13,6 эВ, чтобы оторвать электрон в основном состоянии от атома водорода [52] , по сравнению с 2,23 миллионами эВ для расщепления ядра дейтерия [53] . Атомы электрически нейтральны, если у них равное количество протонов и электронов. Атомы, которые имеют либо дефицит, либо избыток электронов, называются ионами . Электроны, которые находятся дальше всего от ядра, могут быть переданы другим близлежащим атомам или разделены между атомами. Благодаря этому механизму атомы способны связываться в молекулы и другие типы химических соединений, такие как ионные и ковалентные сетчатые кристаллы [54] .
По определению, любые два атома с одинаковым числом протонов в их ядрах принадлежат к одному и тому же химическому элементу . Атомы с равным числом протонов, но разным числом нейтронов являются различными изотопами одного и того же элемента. Например, все атомы водорода допускают ровно один протон, но существуют изотопы без нейтронов ( водород-1 , безусловно, самая распространенная форма, [55] также называемая протием), с одним нейтроном ( дейтерий ), двумя нейтронами ( тритий ) и более чем с двумя нейтронами . Известные элементы образуют набор атомных номеров, от однопротонного элемента водорода до 118-протонного элемента оганесона . [56] Все известные изотопы элементов с атомными номерами больше 82 являются радиоактивными, хотя радиоактивность элемента 83 ( висмута ) настолько мала, что ею практически можно пренебречь. [57] [58]
Около 339 нуклидов встречаются в природе на Земле , [59] из которых 251 (около 74%) не распались, и их называют « стабильными изотопами ». Только 90 нуклидов являются стабильными теоретически , в то время как еще 161 (что в сумме составляет 251) не распались, хотя теоретически это энергетически возможно. Они также формально классифицируются как «стабильные». Еще 35 радиоактивных нуклидов имеют период полураспада более 100 миллионов лет и достаточно долгоживущие, чтобы присутствовать с момента рождения Солнечной системы . Этот набор из 286 нуклидов известен как первичные нуклиды . Наконец, известно, что еще 53 короткоживущих нуклида встречаются в природе как дочерние продукты распада первичных нуклидов (например, радий из урана ) или как продукты естественных энергетических процессов на Земле, таких как бомбардировка космическими лучами (например, углерод-14). [60] [примечание 1]
Для 80 химических элементов существует по крайней мере один стабильный изотоп . Как правило, для каждого из этих элементов существует лишь несколько стабильных изотопов, в среднем 3,1 стабильных изотопа на элемент. Двадцать шесть « моноизотопных элементов » имеют только один стабильный изотоп, в то время как наибольшее количество стабильных изотопов, наблюдаемых для любого элемента, равно десяти, для элемента олова . Элементы 43 , 61 и все элементы с номером 83 или выше не имеют стабильных изотопов. [61] : 1–12
Стабильность изотопов зависит от соотношения протонов и нейтронов, а также от наличия определенных «магических чисел» нейтронов или протонов, которые представляют собой закрытые и заполненные квантовые оболочки. Эти квантовые оболочки соответствуют набору энергетических уровней в оболочечной модели ядра; заполненные оболочки, такие как заполненная оболочка из 50 протонов для олова, придают нуклиду необычную стабильность. Из 251 известного стабильного нуклида только четыре имеют как нечетное число протонов , так и нечетное число нейтронов: водород-2 ( дейтерий ), литий-6 , бор-10 и азот-14 . ( Тантал-180m является нечетно-нечетным и наблюдаемо стабильным, но, как предсказывают, распадается с очень длительным периодом полураспада.) Кроме того, только четыре естественных радиоактивных нечетно-нечетных нуклида имеют период полураспада более миллиарда лет: калий-40 , ванадий-50 , лантан-138 и лютеций-176 . Большинство нечетно-нечетных ядер крайне нестабильны по отношению к бета-распаду , поскольку продукты распада являются четно-четными и, следовательно, более прочно связаны из-за эффектов ядерного спаривания . [62]
Большая часть массы атома приходится на протоны и нейтроны, из которых он состоит. Общее число этих частиц (называемых «нуклонами») в данном атоме называется массовым числом . Это положительное целое число и безразмерность (вместо того, чтобы иметь размерность массы), поскольку оно выражает количество. Примером использования массового числа является «углерод-12», который имеет 12 нуклонов (шесть протонов и шесть нейтронов).
Фактическая масса атома в состоянии покоя часто выражается в дальтонах (Да), также называемых единой атомной единицей массы (е.м.). Эта единица определяется как двенадцатая часть массы свободного нейтрального атома углерода-12 , что приблизительно равно1,66 × 10 −27 кг . [63] Водород-1 (самый легкий изотоп водорода, который также является нуклидом с наименьшей массой) имеет атомный вес 1,007825 Да. [64] Значение этого числа называется атомной массой . Данный атом имеет атомную массу, приблизительно равную (в пределах 1%) его массовому числу, умноженному на атомную единицу массы (например, масса азота-14 составляет примерно 14 Да), но это число не будет точно целым числом, за исключением (по определению) случая углерода-12. [65] Самый тяжелый стабильный атом - свинец-208, [57] с массой207,976 6521 Да . [66]
Поскольку даже самые массивные атомы слишком легки, чтобы работать с ними напрямую, химики используют вместо этого единицу моль . Один моль атомов любого элемента всегда имеет одинаковое число атомов (около6,022 × 10 23 ). Это число было выбрано таким образом, что если элемент имеет атомную массу 1 а.е.м., моль атомов этого элемента имеет массу, близкую к одному грамму. Из-за определения единой атомной единицы массы , каждый атом углерода-12 имеет атомную массу ровно 12 Да, и поэтому моль атомов углерода-12 весит ровно 0,012 кг. [63]
Атомы не имеют четко определенной внешней границы, поэтому их размеры обычно описываются в терминах атомного радиуса . Это мера расстояния, на которое электронное облако простирается от ядра. [67] Это предполагает, что атом имеет сферическую форму, которая соблюдается только для атомов в вакууме или свободном пространстве. Атомные радиусы могут быть получены из расстояний между двумя ядрами, когда два атома соединены химической связью . Радиус меняется в зависимости от местоположения атома на атомной диаграмме, типа химической связи, количества соседних атомов ( координационного числа ) и квантово-механического свойства, известного как спин . [68] В периодической таблице элементов размер атома имеет тенденцию увеличиваться при перемещении вниз по столбцам, но уменьшаться при перемещении по строкам (слева направо). [69] Следовательно, самый маленький атом — гелий с радиусом 32 пм , в то время как один из самых больших — цезий с радиусом 225 пм. [70]
Под воздействием внешних сил, таких как электрические поля , форма атома может отклоняться от сферической симметрии . Деформация зависит от величины поля и типа орбитали электронов внешней оболочки, как показывают групповые теоретические соображения. Асферические отклонения могут быть вызваны, например, в кристаллах , где большие кристаллоэлектрические поля могут возникать в узлах решетки с низкой симметрией . [71] [72] Было показано, что значительные эллипсоидальные деформации происходят для ионов серы [73] и ионов халькогена [74] в соединениях типа пирита .
Размеры атомов в тысячи раз меньше длины волны света (400–700 нм ), поэтому их нельзя увидеть с помощью оптического микроскопа , хотя отдельные атомы можно наблюдать с помощью сканирующего туннельного микроскопа . Чтобы наглядно представить себе крошечность атома, предположим, что типичный человеческий волос имеет ширину около 1 миллиона атомов углерода. [75] Одна капля воды содержит около 2 секстиллионов (2 × 10 21 ) атомов кислорода и в два раза больше атомов водорода. [76] Алмаз весом в один карат с массой2 × 10 −4 кг содержит около 10 секстиллионов (10 22 ) атомов углерода . [примечание 2] Если бы яблоко было увеличено до размеров Земли, то атомы в яблоке были бы примерно такого же размера, как и исходное яблоко. [77]

Каждый элемент имеет один или несколько изотопов, которые имеют нестабильные ядра, подверженные радиоактивному распаду, заставляя ядро испускать частицы или электромагнитное излучение. Радиоактивность может возникнуть, когда радиус ядра велик по сравнению с радиусом сильного взаимодействия, которое действует только на расстояниях порядка 1 фм. [78]
Наиболее распространенными формами радиоактивного распада являются: [79] [80]
Другие более редкие типы радиоактивного распада включают выброс нейтронов или протонов или кластеров нуклонов из ядра, или более одной бета-частицы . Аналогом гамма-излучения, который позволяет возбужденным ядрам терять энергию другим способом, является внутренняя конверсия — процесс, который производит высокоскоростные электроны, которые не являются бета-лучами, за которыми следует производство высокоэнергетических фотонов, которые не являются гамма-лучами. Несколько крупных ядер взрываются на два или более заряженных фрагмента различной массы плюс несколько нейтронов в распаде, называемом спонтанным ядерным делением .
Каждый радиоактивный изотоп имеет характерный период распада — период полураспада — который определяется количеством времени, необходимым для распада половины образца. Это экспоненциальный процесс распада , который неуклонно уменьшает долю оставшегося изотопа на 50% за каждый период полураспада. Следовательно, после того, как пройдут два периода полураспада, остается только 25% изотопа и т. д. [78]
Элементарные частицы обладают внутренним квантово-механическим свойством, известным как спин . Это аналогично моменту импульса объекта, который вращается вокруг своего центра масс , хотя, строго говоря, эти частицы считаются точечными и не могут быть названы вращающимися. Спин измеряется в единицах приведенной постоянной Планка (ħ), причем электроны, протоны и нейтроны все имеют спин 1 ⁄ 2 ħ, или «спин- 1 ⁄ 2 ». В атоме электроны, движущиеся вокруг ядра, обладают орбитальным моментом импульса в дополнение к своему спину, в то время как само ядро обладает моментом импульса из-за своего ядерного спина. [81]
Магнитное поле, создаваемое атомом — его магнитный момент — определяется этими различными формами углового момента, так же как вращающийся заряженный объект классически создает магнитное поле, но наиболее доминирующий вклад исходит от электронного спина. Из-за природы электронов, подчиняющихся принципу исключения Паули , в котором никакие два электрона не могут находиться в одном и том же квантовом состоянии , связанные электроны объединяются в пары друг с другом, причем один член каждой пары находится в состоянии со спином вверх, а другой — в противоположном состоянии со спином вниз. Таким образом, эти спины компенсируют друг друга, уменьшая общий магнитный дипольный момент до нуля в некоторых атомах с четным числом электронов. [82]
В ферромагнитных элементах, таких как железо, кобальт и никель, нечетное число электронов приводит к неспаренному электрону и чистому общему магнитному моменту. Орбитали соседних атомов перекрываются, и достигается более низкое энергетическое состояние, когда спины неспаренных электронов выстраиваются друг с другом, спонтанный процесс, известный как обменное взаимодействие . Когда магнитные моменты ферромагнитных атомов выстраиваются в линию, материал может создавать измеримое макроскопическое поле. Парамагнитные материалы имеют атомы с магнитными моментами, которые выстраиваются в случайных направлениях, когда магнитное поле отсутствует, но магнитные моменты отдельных атомов выстраиваются в линию в присутствии поля. [82] [83]
Ядро атома не будет иметь спина, если у него четное число нейтронов и протонов, но для других случаев нечетного числа ядро может иметь спин. Обычно ядра со спином выстраиваются в случайных направлениях из-за теплового равновесия , но для некоторых элементов (таких как ксенон-129 ) можно поляризовать значительную часть ядерных спиновых состояний так, чтобы они выстраивались в одном направлении — состояние, называемое гиперполяризацией . Это имеет важные приложения в магнитно-резонансной томографии . [84] [85]
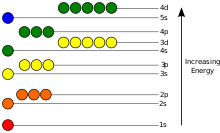
Потенциальная энергия электрона в атоме отрицательна относительно , когда расстояние от ядра стремится к бесконечности ; ее зависимость от положения электрона достигает минимума внутри ядра, примерно обратно пропорционально расстоянию. В квантово-механической модели связанный электрон может занимать только набор состояний, центрированных на ядре, и каждое состояние соответствует определенному уровню энергии ; см. независимое от времени уравнение Шредингера для теоретического объяснения. Уровень энергии можно измерить количеством энергии, необходимой для отсоединения электрона от атома, и обычно указывается в единицах электронвольт (эВ). Самое низкое энергетическое состояние связанного электрона называется основным состоянием, т. е. стационарным состоянием , в то время как переход электрона на более высокий уровень приводит к возбужденному состоянию. [86] Энергия электрона увеличивается вместе с n , поскольку (среднее) расстояние до ядра увеличивается. Зависимость энергии от ℓ вызвана не электростатическим потенциалом ядра, а взаимодействием между электронами.
Для перехода электрона между двумя различными состояниями , например, из основного состояния в первое возбужденное состояние , он должен поглотить или испустить фотон с энергией, соответствующей разнице потенциальной энергии этих уровней, согласно модели Нильса Бора , что можно точно рассчитать с помощью уравнения Шредингера . Электроны перескакивают между орбиталями подобно частицам. Например, если один фотон ударяет по электронам, только один электрон меняет состояние в ответ на фотон; см. Свойства электрона .
Энергия испускаемого фотона пропорциональна его частоте , поэтому эти конкретные уровни энергии проявляются как отдельные полосы в электромагнитном спектре . [87] Каждый элемент имеет характерный спектр, который может зависеть от заряда ядра, подоболочек, заполненных электронами, электромагнитных взаимодействий между электронами и других факторов. [88]

Когда непрерывный спектр энергии проходит через газ или плазму, некоторые из фотонов поглощаются атомами, заставляя электроны менять свой энергетический уровень. Те возбужденные электроны, которые остаются связанными со своим атомом, спонтанно испускают эту энергию в виде фотона, перемещаясь в случайном направлении, и таким образом возвращаются на более низкие энергетические уровни. Таким образом, атомы ведут себя как фильтр, который образует ряд темных полос поглощения в выходной энергии. (Наблюдатель, рассматривающий атомы с точки зрения, которая не включает непрерывный спектр на заднем плане, вместо этого видит ряд линий излучения от фотонов, испускаемых атомами.) Спектроскопические измерения силы и ширины атомных спектральных линий позволяют определить состав и физические свойства вещества. [89]
Тщательное изучение спектральных линий показывает, что некоторые демонстрируют тонкое структурное расщепление. Это происходит из-за спин-орбитальной связи , которая является взаимодействием между спином и движением самого внешнего электрона. [90] Когда атом находится во внешнем магнитном поле, спектральные линии расщепляются на три или более компонентов; явление, называемое эффектом Зеемана . Это вызвано взаимодействием магнитного поля с магнитным моментом атома и его электронов. Некоторые атомы могут иметь несколько электронных конфигураций с одинаковым уровнем энергии, которые, таким образом, появляются как одна спектральная линия. Взаимодействие магнитного поля с атомом сдвигает эти электронные конфигурации на несколько разных энергетических уровней, что приводит к появлению нескольких спектральных линий. [91] Наличие внешнего электрического поля может вызвать сопоставимое расщепление и смещение спектральных линий путем изменения уровней энергии электронов, явление, называемое эффектом Штарка . [92]
Если связанный электрон находится в возбужденном состоянии, взаимодействующий фотон с соответствующей энергией может вызвать вынужденное излучение фотона с соответствующим уровнем энергии. Чтобы это произошло, электрон должен перейти в более низкое энергетическое состояние, которое имеет разницу энергий, соответствующую энергии взаимодействующего фотона. Затем испущенный фотон и взаимодействующий фотон движутся параллельно и с соответствующими фазами. То есть волновые паттерны двух фотонов синхронизированы. Это физическое свойство используется для создания лазеров , которые могут излучать когерентный луч световой энергии в узкой полосе частот. [93]
Валентность — это объединяющая способность элемента. Она определяется числом связей, которые он может образовать с другими атомами или группами. [94] Самая внешняя электронная оболочка атома в его необъединенном состоянии известна как валентная оболочка , а электроны в этой оболочке называются валентными электронами . Число валентных электронов определяет поведение связи с другими атомами. Атомы имеют тенденцию химически реагировать друг с другом таким образом, что заполняет (или опустошает) их внешние валентные оболочки. [95] Например, передача одного электрона между атомами является полезным приближением для связей, которые образуются между атомами с одним электроном больше, чем заполненная оболочка, и другими, которым на один электрон меньше полной оболочки, как это происходит в соединении хлорида натрия и других химических ионных солях. Многие элементы демонстрируют множественную валентность или тенденцию делиться различным количеством электронов в разных соединениях. Таким образом, химическая связь между этими элементами принимает множество форм обмена электронами, которые являются чем-то большим, чем простые переносы электронов. Примерами служат элемент углерод и органические соединения . [96]
Химические элементы часто отображаются в периодической таблице , которая составлена так, чтобы отображать повторяющиеся химические свойства, а элементы с одинаковым числом валентных электронов образуют группу, которая выровнена в одном столбце таблицы. (Горизонтальные ряды соответствуют заполнению квантовой оболочки электронами.) Элементы в крайней правой части таблицы имеют свою внешнюю оболочку, полностью заполненную электронами, что приводит к химически инертным элементам, известным как благородные газы . [97] [98]

Количества атомов находятся в различных состояниях материи, которые зависят от физических условий, таких как температура и давление . Изменяя условия, материалы могут переходить из твердого состояния в жидкое , газообразное и плазменное . [99] В пределах одного состояния материал также может существовать в различных аллотропах . Примером этого является твердый углерод, который может существовать в виде графита или алмаза . [100] Существуют также газообразные аллотропы, такие как дикислород и озон .
При температурах, близких к абсолютному нулю , атомы могут образовывать конденсат Бозе-Эйнштейна , в этот момент квантово-механические эффекты, которые обычно наблюдаются только в атомном масштабе, становятся очевидными в макроскопическом масштабе. [101] [102] Этот переохлажденный набор атомов затем ведет себя как один суператом , что может позволить фундаментальные проверки квантово-механического поведения. [103]

Хотя атомы слишком малы, чтобы их можно было увидеть, такие устройства, как сканирующий туннельный микроскоп (СТМ), позволяют визуализировать их на поверхности твердых тел. Микроскоп использует явление квантового туннелирования , которое позволяет частицам проходить через барьер, который был бы непреодолимым в классической перспективе. Электроны туннелируют через вакуум между двумя смещенными электродами, обеспечивая туннельный ток, который экспоненциально зависит от их разделения. Один электрод представляет собой острый наконечник, в идеале заканчивающийся одним атомом. В каждой точке сканирования поверхности высота наконечника регулируется таким образом, чтобы поддерживать туннельный ток на заданном значении. То, насколько наконечник перемещается к поверхности и от нее, интерпретируется как профиль высоты. При низком смещении микроскоп отображает усредненные электронные орбитали по плотно упакованным энергетическим уровням — локальную плотность электронных состояний вблизи уровня Ферми . [104] [105] Из-за задействованных расстояний оба электрода должны быть чрезвычайно стабильными; только тогда можно наблюдать периодичности, соответствующие отдельным атомам. Сам по себе этот метод не является химически специфичным и не позволяет определить виды атомов, присутствующих на поверхности.
Атомы можно легко идентифицировать по их массе. Если атом ионизирован путем удаления одного из его электронов, его траектория при прохождении через магнитное поле будет изгибаться. Радиус, на который траектория движущегося иона поворачивается магнитным полем, определяется массой атома. Масс -спектрометр использует этот принцип для измерения отношения массы к заряду ионов. Если образец содержит несколько изотопов, масс-спектрометр может определить долю каждого изотопа в образце, измеряя интенсивность различных пучков ионов. Методы испарения атомов включают атомно-эмиссионную спектроскопию с индуктивно связанной плазмой и масс-спектрометрию с индуктивно связанной плазмой , оба из которых используют плазму для испарения образцов для анализа. [106]
Атомно -зондовый томограф имеет субнанометровое разрешение в 3D и может химически идентифицировать отдельные атомы с помощью времяпролетной масс-спектрометрии . [107]
Методы электронной эмиссии, такие как рентгеновская фотоэлектронная спектроскопия (XPS) и электронная оже-спектроскопия (AES), которые измеряют энергию связи основных электронов , используются для идентификации атомных видов, присутствующих в образце, неразрушающим способом. При правильной фокусировке оба метода могут быть сделаны специфичными для области. Другим таким методом является спектроскопия потери энергии электронов (EELS), которая измеряет потерю энергии электронного пучка в просвечивающем электронном микроскопе при его взаимодействии с частью образца.
Спектры возбужденных состояний могут быть использованы для анализа атомного состава далеких звезд . Определенные длины волн света , содержащиеся в наблюдаемом свете от звезд, могут быть выделены и связаны с квантованными переходами в атомах свободного газа. Эти цвета могут быть воспроизведены с помощью газоразрядной лампы, содержащей тот же элемент. [108] Гелий был открыт таким образом в спектре Солнца за 23 года до того, как он был обнаружен на Земле. [109]
Барионная материя составляет около 4% от общей плотности энергии наблюдаемой Вселенной , со средней плотностью около 0,25 частиц/м 3 (в основном протоны и электроны). [110] Внутри галактики, такой как Млечный Путь , частицы имеют гораздо более высокую концентрацию, при этом плотность материи в межзвездной среде (ISM) составляет от 10 5 до 10 9 атомов/м 3 . [111] Считается, что Солнце находится внутри Местного пузыря , поэтому плотность в окрестностях Солнца составляет всего около 10 3 атомов/м 3 . [112] Звезды образуются из плотных облаков в ISM, и эволюционные процессы звезд приводят к постоянному обогащению ISM элементами, более массивными, чем водород и гелий.
До 95% барионной материи Млечного Пути сосредоточено внутри звезд, где условия неблагоприятны для атомной материи. Общая барионная масса составляет около 10% массы галактики; [113] остальная часть массы — это неизвестная темная материя . [114] Высокая температура внутри звезд делает большинство «атомов» полностью ионизированными, то есть отделяет все электроны от ядер. В звездных остатках — за исключением их поверхностных слоев — огромное давление делает электронные оболочки невозможными.
Электроны, как полагают, существуют во Вселенной с ранних стадий Большого взрыва . Атомные ядра образуются в реакциях нуклеосинтеза . Примерно за три минуты нуклеосинтез Большого взрыва произвел большую часть гелия , лития и дейтерия во Вселенной, а также, возможно, часть бериллия и бора . [115] [116] [117]
Вездесущность и стабильность атомов зависят от их энергии связи , что означает, что атом имеет более низкую энергию, чем несвязанная система ядра и электронов. Там, где температура намного выше потенциала ионизации , материя существует в форме плазмы — газа положительно заряженных ионов (возможно, голых ядер) и электронов. Когда температура падает ниже потенциала ионизации, атомы становятся статистически благоприятными. Атомы (вместе со связанными электронами) стали доминировать над заряженными частицами через 380 000 лет после Большого взрыва — эпоха, называемая рекомбинацией , когда расширяющаяся Вселенная остыла достаточно, чтобы позволить электронам присоединиться к ядрам. [118]
После Большого взрыва, в результате которого не образовалось ни углерода , ни более тяжелых элементов , атомные ядра объединялись в звездах посредством процесса ядерного синтеза, в результате чего образовалось больше элемента гелия и (посредством тройного альфа-процесса ) последовательность элементов от углерода до железа ; [119] подробности см . в статье о звездном нуклеосинтезе .
Такие изотопы, как литий-6, а также некоторые бериллий и бор, образуются в космосе в результате расщепления космических лучей . [120] Это происходит, когда высокоэнергетический протон сталкивается с атомным ядром, вызывая выброс большого количества нуклонов.
Элементы тяжелее железа образовались в сверхновых и сталкивающихся нейтронных звездах посредством r-процесса , а в звездах AGB посредством s-процесса , оба из которых включают захват нейтронов атомными ядрами. [121] Такие элементы, как свинец, образовались в основном посредством радиоактивного распада более тяжелых элементов. [122]
Большинство атомов, из которых состоит Земля и ее обитатели, присутствовали в их нынешнем виде в туманности , которая коллапсировала из молекулярного облака, чтобы сформировать Солнечную систему . Остальные являются результатом радиоактивного распада, и их относительная пропорция может быть использована для определения возраста Земли с помощью радиометрического датирования . [123] [124] Большая часть гелия в коре Земли (около 99% гелия из газовых скважин, как показывает его более низкое содержание гелия-3 ) является продуктом альфа-распада . [125]
На Земле есть несколько следовых атомов, которых не было в начале (т. е. не «изначальных»), и которые не являются результатом радиоактивного распада. Углерод-14 непрерывно генерируется космическими лучами в атмосфере. [126] Некоторые атомы на Земле были искусственно созданы либо преднамеренно, либо как побочные продукты ядерных реакторов или взрывов. [127] [128] Из трансурановых элементов — тех, у которых атомные числа больше 92 — только плутоний и нептуний встречаются на Земле в природе. [129] [130] Трансурановые элементы имеют радиоактивное время жизни короче, чем текущий возраст Земли [131], и, таким образом, идентифицируемые количества этих элементов давно распались, за исключением следов плутония-244 , возможно, отложившихся вместе с космической пылью. [123] Природные месторождения плутония и нептуния образуются путем захвата нейтронов в урановой руде. [132]
На Земле содержится около1,33 × 10 50 атомов. [133] Хотя существует небольшое количество независимых атомов благородных газов , таких как аргон , неон и гелий , 99% атмосферы связано в форме молекул, включая углекислый газ и двухатомный кислород и азот . На поверхности Земли подавляющее большинство атомов объединяются, образуя различные соединения, включая воду , соль , силикаты и оксиды . Атомы также могут объединяться, создавая материалы, которые не состоят из дискретных молекул, включая кристаллы и жидкие или твердые металлы . [134] [135] Эта атомная материя образует сетевые структуры, в которых отсутствует определенный тип мелкомасштабного прерывистого порядка, связанного с молекулярной материей. [136]
Все нуклиды с атомным числом выше 82 ( свинец ), как известно, радиоактивны. Ни один нуклид с атомным числом выше 92 ( уран ) не существует на Земле в качестве первичного нуклида , а более тяжелые элементы, как правило, имеют более короткие периоды полураспада. Тем не менее, « остров стабильности », охватывающий относительно долгоживущие изотопы сверхтяжелых элементов [137] с атомными числами от 110 до 114 , может существовать. [138] Прогнозы для периода полураспада самого стабильного нуклида на острове варьируются от нескольких минут до миллионов лет. [139] В любом случае сверхтяжелые элементы (с Z > 104) не будут существовать из-за увеличения кулоновского отталкивания (что приводит к спонтанному делению со все более короткими периодами полураспада) при отсутствии каких-либо стабилизирующих эффектов. [140]
Каждая частица материи имеет соответствующую частицу антиматерии с противоположным электрическим зарядом. Таким образом, позитрон является положительно заряженным антиэлектроном , а антипротон является отрицательно заряженным эквивалентом протона . Когда встречаются материя и соответствующая частица антиматерии, они аннигилируют друг с другом. Из-за этого, наряду с дисбалансом между количеством частиц материи и антиматерии, последние редки во Вселенной. Первые причины этого дисбаланса еще не полностью поняты, хотя теории бариогенезиса могут предложить объяснение. В результате в природе не было обнаружено ни одного атома антиматерии. [141] [142] В 1996 году в лаборатории ЦЕРНа в Женеве был синтезирован антиматерийский аналог атома водорода ( антиводород ) . [143] [144]
Другие экзотические атомы были созданы путем замены одного из протонов, нейтронов или электронов другими частицами, имеющими тот же заряд. Например, электрон может быть заменен более массивным мюоном , образуя мюонный атом . Эти типы атомов могут быть использованы для проверки фундаментальных предсказаний физики. [145] [146] [147]
В одной капле воды содержится 2 000 000 000 000 000 000 000 (это 2 секстиллиона) атомов кислорода и в два раза больше атомов водорода.