Химия — это научное изучение свойств и поведения материи . [1] Это физическая наука в рамках естественных наук , которая изучает химические элементы , из которых состоит материя, и соединения, состоящие из атомов , молекул и ионов : их состав, структуру, свойства, поведение и изменения, которые они претерпевают во время реакций с другими веществами . [2] [3] [4] [5] Химия также изучает природу химических связей в химических соединениях .
По своему предмету химия занимает промежуточное положение между физикой и биологией . [6] Иногда ее называют центральной наукой , поскольку она обеспечивает основу для понимания как базовых , так и прикладных научных дисциплин на фундаментальном уровне. [7] Например, химия объясняет аспекты роста растений ( ботаника ), образование магматических пород ( геология ), как образуется атмосферный озон и как разлагаются загрязнители окружающей среды ( экология ), свойства почвы на Луне ( космохимия ), как действуют лекарства ( фармакология ) и как собирать улики ДНК на месте преступления ( криминалистика ).
Химия существовала под разными названиями с древних времен. [8] Она развивалась, и теперь химия охватывает различные области специализации или субдисциплины, которые продолжают увеличиваться в числе и взаимодействуют, создавая дальнейшие междисциплинарные области изучения. Приложения различных областей химии часто используются в экономических целях в химической промышленности .
Слово химия происходит от модификации в эпоху Возрождения слова алхимия , которое относилось к более раннему набору практик, охватывающих элементы химии, металлургии , философии , астрологии , астрономии , мистицизма и медицины . Алхимия часто ассоциируется с поиском способа превратить свинец или другие неблагородные металлы в золото, хотя алхимики также интересовались многими вопросами современной химии. [9] [10]
Современное слово алхимия, в свою очередь, происходит от арабского слова al-kīmīā ( الكیمیاء ). Оно может иметь египетское происхождение, поскольку al-kīmīā происходит от древнегреческого χημία , которое в свою очередь происходит от слова Kemet , которое является древним названием Египта на египетском языке. [11] С другой стороны, al-kīmīā может происходить от χημεία 'слитый вместе'. [12]

Текущая модель атомной структуры — это квантово-механическая модель . [13] Традиционная химия начинается с изучения элементарных частиц , атомов , молекул , [14] веществ , металлов , кристаллов и других агрегатов материи . Материю можно изучать в твердом, жидком, газообразном и плазменном состояниях , изолированно или в сочетании. Взаимодействия, реакции и превращения, которые изучаются в химии, обычно являются результатом взаимодействий между атомами, приводящих к перестройкам химических связей , которые удерживают атомы вместе. Такое поведение изучается в химической лаборатории .
Химическая лаборатория стереотипно использует различные формы лабораторной стеклянной посуды . Однако стеклянная посуда не является центральной в химии, и большая часть экспериментальной (а также прикладной/промышленной) химии выполняется без нее.

Химическая реакция — это превращение некоторых веществ в одно или несколько других веществ. [15] Основой такого химического превращения является перераспределение электронов в химических связях между атомами. Его можно символически изобразить с помощью химического уравнения , которое обычно включает атомы в качестве субъектов. Число атомов слева и справа в уравнении для химического превращения равно. (Когда число атомов с обеих сторон неравно, превращение называется ядерной реакцией или радиоактивным распадом .) Тип химических реакций, которым может подвергаться вещество, и изменения энергии, которые могут его сопровождать, ограничиваются определенными основными правилами, известными как химические законы .
Энергетические и энтропийные соображения неизменно важны почти во всех химических исследованиях. Химические вещества классифицируются по их структуре , фазе, а также по их химическому составу . Их можно анализировать с помощью инструментов химического анализа , например, спектроскопии и хроматографии . Ученые, занимающиеся химическими исследованиями, известны как химики . [16] Большинство химиков специализируются в одной или нескольких субдисциплинах. Несколько концепций имеют важное значение для изучения химии; некоторые из них: [17]
В химии материя определяется как все, что имеет массу покоя и объем (занимает пространство) и состоит из частиц . Частицы, из которых состоит материя, также имеют массу покоя — не все частицы имеют массу покоя, например фотон . Материя может быть чистым химическим веществом или смесью веществ. [18]

Атом является основной единицей химии. Он состоит из плотного ядра, называемого атомным ядром, окруженного пространством, занятым электронным облаком . Ядро состоит из положительно заряженных протонов и незаряженных нейтронов (вместе называемых нуклонами ), в то время как электронное облако состоит из отрицательно заряженных электронов, которые вращаются вокруг ядра. В нейтральном атоме отрицательно заряженные электроны уравновешивают положительный заряд протонов. Ядро плотное; масса нуклона приблизительно в 1836 раз больше массы электрона, однако радиус атома примерно в 10 000 раз больше его ядра. [19] [20]
Атом также является наименьшей сущностью, которая, как можно предположить, сохраняет химические свойства элемента, такие как электроотрицательность , потенциал ионизации , предпочтительная степень окисления , координационное число и предпочтительные типы образуемых связей (например, металлическая , ионная , ковалентная ).
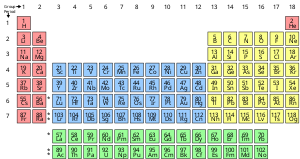
Химический элемент — это чистое вещество, которое состоит из одного типа атома, характеризующегося определенным числом протонов в ядрах его атомов, известным как атомный номер и представленным символом Z. Массовое число — это сумма числа протонов и нейтронов в ядре. Хотя все ядра всех атомов, принадлежащих одному элементу, будут иметь один и тот же атомный номер, они не обязательно могут иметь одно и то же массовое число; атомы элемента, которые имеют разные массовые числа, известны как изотопы . Например, все атомы с 6 протонами в своих ядрах являются атомами химического элемента углерода , но атомы углерода могут иметь массовые числа 12 или 13. [20]
Стандартное представление химических элементов находится в периодической таблице , которая упорядочивает элементы по атомному номеру. Периодическая таблица организована в группы , или столбцы, и периоды , или строки. Периодическая таблица полезна для определения периодических тенденций . [21]

Соединение — это чистое химическое вещество, состоящее из более чем одного элемента. Свойства соединения мало похожи на свойства его элементов. [22] Стандартная номенклатура соединений установлена Международным союзом теоретической и прикладной химии (ИЮПАК). Органические соединения именуются в соответствии с системой органической номенклатуры . [23] Названия неорганических соединений создаются в соответствии с системой неорганической номенклатуры . Когда соединение состоит из более чем одного компонента, они делятся на два класса: электроположительные и электроотрицательные компоненты. [24] Кроме того, Служба химических рефератов разработала метод индексации химических веществ. В этой схеме каждое химическое вещество идентифицируется по номеру, известному как его регистрационный номер CAS .

Молекула — это наименьшая неделимая часть чистого химического вещества , которая имеет свой уникальный набор химических свойств, то есть свой потенциал для прохождения определенного набора химических реакций с другими веществами. Однако это определение хорошо работает только для веществ, которые состоят из молекул, что не относится ко многим веществам (см. ниже). Молекулы, как правило, представляют собой набор атомов, связанных вместе ковалентными связями , так что структура электрически нейтральна, и все валентные электроны спарены с другими электронами либо в связях, либо в неподеленных парах .
Таким образом, молекулы существуют как электрически нейтральные единицы, в отличие от ионов. Когда это правило нарушается, давая «молекуле» заряд, результат иногда называют молекулярным ионом или многоатомным ионом. Однако дискретная и отдельная природа молекулярной концепции обычно требует, чтобы молекулярные ионы присутствовали только в хорошо разделенной форме, например, направленный луч в вакууме в масс-спектрометре . Заряженные многоатомные коллекции, находящиеся в твердых телах (например, обычные сульфатные или нитратные ионы), обычно не считаются «молекулами» в химии. Некоторые молекулы содержат один или несколько неспаренных электронов, создавая радикалы . Большинство радикалов сравнительно реактивны, но некоторые, такие как оксид азота (NO), могут быть стабильными.

«Инертные» или благородные газовые элементы ( гелий , неон , аргон , криптон , ксенон и радон ) состоят из отдельных атомов как их наименьшей дискретной единицы, но другие изолированные химические элементы состоят либо из молекул, либо из сетей атомов, связанных друг с другом каким-либо образом. Идентифицируемые молекулы составляют знакомые вещества, такие как вода, воздух и многие органические соединения, такие как спирт, сахар, бензин и различные фармацевтические препараты .
Однако не все вещества или химические соединения состоят из дискретных молекул, и действительно, большинство твердых веществ, которые составляют твердую кору, мантию и ядро Земли, являются химическими соединениями без молекул. Эти другие типы веществ, такие как ионные соединения и сетчатые твердые тела , организованы таким образом, что не имеют существования идентифицируемых молекул как таковых . Вместо этого эти вещества обсуждаются в терминах формульных единиц или элементарных ячеек как наименьшей повторяющейся структуры внутри вещества. Примерами таких веществ являются минеральные соли (например, поваренная соль ), твердые вещества, такие как углерод и алмаз, металлы и известные кремниевые и силикатные минералы, такие как кварц и гранит.
Одной из основных характеристик молекулы является ее геометрия, часто называемая ее структурой . В то время как структура двухатомных, трехатомных или четырехатомных молекул может быть тривиальной (линейной, угловой пирамидальной и т. д.), структура многоатомных молекул, которые состоят из более чем шести атомов (нескольких элементов), может иметь решающее значение для ее химической природы.
Химическое вещество — это вид материи с определенным составом и набором свойств . [25] Совокупность веществ называется смесью. Примерами смесей являются воздух и сплавы . [26]
Моль — это единица измерения, которая обозначает количество вещества (также называемое химическим количеством). Один моль определяется как содержащий ровно6,022 140 76 × 10 23 частиц ( атомов , молекул , ионов или электронов ), где число частиц на моль известно как постоянная Авогадро . [27] Молярная концентрация — это количество определенного вещества на объем раствора , и обычно выражается в моль/ дм 3 . [28]

В дополнение к специфическим химическим свойствам, которые отличают различные химические классификации, химические вещества могут существовать в нескольких фазах. По большей части химические классификации независимы от этих классификаций объемных фаз; однако некоторые более экзотические фазы несовместимы с определенными химическими свойствами. Фаза представляет собой набор состояний химической системы, которые имеют схожие объемные структурные свойства в диапазоне условий, таких как давление или температура .
Физические свойства, такие как плотность и показатель преломления, как правило, попадают в пределы значений, характерных для фазы. Фаза вещества определяется фазовым переходом , который происходит, когда энергия, введенная в систему или извлеченная из нее, идет на перестройку структуры системы, а не на изменение объемных условий.
Иногда различие между фазами может быть непрерывным, а не иметь дискретную границу, в этом случае считается, что вещество находится в сверхкритическом состоянии. Когда три состояния встречаются на основе условий, это известно как тройная точка , и поскольку это инвариантно, это удобный способ определить набор условий.
Наиболее известными примерами фаз являются твердые тела , жидкости и газы . Многие вещества демонстрируют несколько твердых фаз. Например, существуют три фазы твердого железа (альфа, гамма и дельта), которые различаются в зависимости от температуры и давления. Принципиальным отличием между твердыми фазами является кристаллическая структура или расположение атомов. Другая фаза, часто встречающаяся при изучении химии, — это водная фаза, которая представляет собой состояние веществ, растворенных в водном растворе (то есть в воде).
Менее известные фазы включают плазму , конденсаты Бозе-Эйнштейна и фермионные конденсаты , а также парамагнитные и ферромагнитные фазы магнитных материалов. Хотя большинство известных фаз имеют дело с трехмерными системами, также возможно определить аналоги в двумерных системах, что привлекло внимание из-за своей значимости для систем в биологии .

Атомы, слипающиеся в молекулы или кристаллы, называются связанными друг с другом. Химическую связь можно визуализировать как мультипольный баланс между положительными зарядами в ядрах и отрицательными зарядами, колеблющимися вокруг них. [29] Энергии и распределения характеризуют не просто притяжение и отталкивание, а доступность электрона для связи с другим атомом.
Химическая связь может быть ковалентной связью , ионной связью , водородной связью или просто из-за силы Ван-дер-Ваальса . Каждый из этих видов связей приписывается некоторому потенциалу. Эти потенциалы создают взаимодействия, которые удерживают атомы вместе в молекулах или кристаллах . Во многих простых соединениях теория валентных связей , модель отталкивания электронных пар валентной оболочки ( VSEPR ) и концепция степени окисления могут использоваться для объяснения молекулярной структуры и состава.
Ионная связь образуется, когда металл теряет один или несколько своих электронов, становясь положительно заряженным катионом, а затем электроны приобретаются атомом неметалла, становясь отрицательно заряженным анионом. Два противоположно заряженных иона притягиваются друг к другу, и ионная связь представляет собой электростатическую силу притяжения между ними. Например, натрий (Na), металл, теряет один электрон, становясь катионом Na +, в то время как хлор (Cl), неметалл, приобретает этот электрон, становясь катионом Cl − . Ионы удерживаются вместе благодаря электростатическому притяжению, и образуется это соединение — хлорид натрия (NaCl) или обычная поваренная соль.

В ковалентной связи одна или несколько пар валентных электронов совместно используются двумя атомами: результирующая электрически нейтральная группа связанных атомов называется молекулой . Атомы будут совместно использовать валентные электроны таким образом, чтобы создать электронную конфигурацию благородного газа (восемь электронов на их внешней оболочке) для каждого атома. Атомы, которые имеют тенденцию объединяться таким образом, что каждый из них имеет восемь электронов на своей валентной оболочке, как говорят, следуют правилу октета . Однако некоторым элементам, таким как водород и литий, нужно всего два электрона на их внешней оболочке, чтобы достичь этой стабильной конфигурации; говорят, что эти атомы следуют правилу дуэта , и таким образом они достигают электронной конфигурации благородного газа гелия , который имеет два электрона на своей внешней оболочке.
Аналогично, теории классической физики могут быть использованы для предсказания многих ионных структур. В случае более сложных соединений, таких как комплексы металлов , теория валентных связей менее применима, и обычно используются альтернативные подходы, такие как теория молекулярных орбиталей . См. диаграмму электронных орбиталей.
В контексте химии энергия является атрибутом вещества как следствие его атомной , молекулярной или агрегатной структуры . Поскольку химическое превращение сопровождается изменением одного или нескольких из этих видов структур, оно неизменно сопровождается увеличением или уменьшением энергии вовлеченных веществ. Некоторая энергия передается между окружающей средой и реагентами реакции в форме тепла или света ; таким образом, продукты реакции могут иметь больше или меньше энергии , чем реагенты.
Реакция называется экзергонической, если конечное состояние находится ниже по шкале энергии, чем начальное состояние; в случае эндергонических реакций ситуация обратная. Реакция называется экзотермической , если реакция выделяет тепло в окружающую среду; в случае эндотермических реакций реакция поглощает тепло из окружающей среды.
Химические реакции всегда невозможны, если реагенты не преодолевают энергетический барьер, известный как энергия активации . Скорость химической реакции (при данной температуре T) связана с энергией активации E, с помощью фактора заселенности Больцмана – то есть вероятности того, что молекула будет иметь энергию, большую или равную E при данной температуре T. Эта экспоненциальная зависимость скорости реакции от температуры известна как уравнение Аррениуса . Энергия активации, необходимая для протекания химической реакции, может быть в форме тепла, света, электричества или механической силы в форме ультразвука . [30]
Связанное понятие свободной энергии , которое также включает в себя соображения энтропии, является очень полезным средством для прогнозирования возможности реакции и определения состояния равновесия химической реакции в химической термодинамике . Реакция возможна только в том случае, если общее изменение свободной энергии Гиббса отрицательно ; если оно равно нулю, то говорят, что химическая реакция находится в равновесии .
Существуют только ограниченные возможные состояния энергии для электронов, атомов и молекул. Они определяются правилами квантовой механики , которые требуют квантования энергии связанной системы. Атомы/молекулы в более высоком энергетическом состоянии называются возбужденными. Молекулы/атомы вещества в возбужденном энергетическом состоянии часто гораздо более реактивны; то есть более поддаются химическим реакциям.
Фаза вещества неизменно определяется его энергией и энергией его окружения. Когда межмолекулярные силы вещества таковы, что энергии окружения недостаточно для их преодоления, оно находится в более упорядоченной фазе, например, жидкой или твердой, как в случае с водой (H 2 O); жидкость при комнатной температуре, поскольку ее молекулы связаны водородными связями . [31] В то время как сероводород (H 2 S) является газом при комнатной температуре и стандартном давлении, поскольку его молекулы связаны более слабыми диполь-дипольными взаимодействиями .
Передача энергии от одного химического вещества к другому зависит от размера квантов энергии, испускаемых одним веществом. Однако тепловая энергия часто передается легче от практически любого вещества к другому, поскольку фононы, ответственные за колебательные и вращательные уровни энергии в веществе, имеют гораздо меньше энергии, чем фотоны , задействованные для передачи электронной энергии. Таким образом, поскольку колебательные и вращательные уровни энергии расположены ближе, чем электронные уровни энергии, тепло легче передается между веществами по сравнению со светом или другими формами электронной энергии. Например, ультрафиолетовое электромагнитное излучение не передается с такой же эффективностью от одного вещества к другому, как тепловая или электрическая энергия.
Существование характерных уровней энергии для различных химических веществ полезно для их идентификации путем анализа спектральных линий . Различные виды спектров часто используются в химической спектроскопии , например , ИК , микроволновый , ЯМР , ЭПР и т. д. Спектроскопия также используется для определения состава удаленных объектов, таких как звезды и далекие галактики, путем анализа спектров их излучения.

Термин «химическая энергия» часто используется для обозначения способности химического вещества претерпевать превращения посредством химической реакции или преобразовывать другие химические вещества.

Когда химическое вещество преобразуется в результате его взаимодействия с другим веществом или с энергией, говорят, что произошла химическая реакция. Химическая реакция , таким образом, является понятием, связанным с «реакцией» вещества, когда оно вступает в тесный контакт с другим, будь то смесь или раствор ; воздействие некоторой формы энергии или и то, и другое. Это приводит к некоторому обмену энергией между компонентами реакции, а также с системной средой, которая может быть спроектированными сосудами — часто лабораторной стеклянной посудой .
Химические реакции могут приводить к образованию или диссоциации молекул, то есть к распаду молекул с образованием двух или более молекул или к перегруппировке атомов внутри или между молекулами. Химические реакции обычно включают создание или разрыв химических связей. Окисление, восстановление , диссоциация , кислотно-щелочная нейтрализация и молекулярная перегруппировка — вот некоторые примеры распространенных химических реакций.
Химическую реакцию можно символически изобразить с помощью химического уравнения . В то время как в неядерной химической реакции число и вид атомов по обе стороны уравнения равны, для ядерной реакции это справедливо только для ядерных частиц, а именно протонов и нейтронов. [32]
Последовательность шагов, в которых может происходить реорганизация химических связей в ходе химической реакции, называется ее механизмом . Можно представить себе, что химическая реакция происходит в несколько шагов, каждый из которых может иметь разную скорость. Таким образом, в ходе реакции можно предусмотреть множество промежуточных продуктов реакции с переменной стабильностью. Механизмы реакции предлагаются для объяснения кинетики и относительного состава продуктов реакции. Многие физические химики специализируются на исследовании и предложении механизмов различных химических реакций. Несколько эмпирических правил, таких как правила Вудворда-Хоффмана, часто оказываются полезными при предложении механизма химической реакции.
Согласно золотой книге ИЮПАК , химическая реакция — это «процесс, который приводит к взаимопревращению химических видов». [33] Соответственно, химическая реакция может быть элементарной реакцией или ступенчатой реакцией . Дополнительная оговорка сделана в том, что это определение включает случаи, когда взаимопревращение конформеров экспериментально наблюдается. Такие обнаруживаемые химические реакции обычно включают наборы молекулярных сущностей, как указано в этом определении, но часто концептуально удобно использовать этот термин также для изменений, включающих отдельные молекулярные сущности (т. е. «микроскопические химические события»).

Ион — это заряженный вид, атом или молекула, которые потеряли или приобрели один или несколько электронов. Когда атом теряет электрон и, таким образом, имеет больше протонов, чем электронов, атом является положительно заряженным ионом или катионом . Когда атом получает электрон и, таким образом, имеет больше электронов, чем протонов, атом является отрицательно заряженным ионом или анионом . Катионы и анионы могут образовывать кристаллическую решетку нейтральных солей , таких как ионы Na + и Cl −, образующие хлорид натрия , или NaCl. Примерами многоатомных ионов , которые не расщепляются во время кислотно-основных реакций, являются гидроксид (OH − ) и фосфат (PO 4 3− ).
Плазма состоит из газообразного вещества, которое полностью ионизировано, как правило, под воздействием высокой температуры.

Вещество часто можно классифицировать как кислоту или основание . Существует несколько различных теорий, объясняющих кислотно-основное поведение. Простейшей из них является теория Аррениуса , которая гласит, что кислота — это вещество, которое при растворении в воде образует ионы гидроксония , а основание — это вещество, которое при растворении в воде образует ионы гидроксида . Согласно кислотно-основной теории Бренстеда-Лоури , кислоты — это вещества, которые отдают положительный ион водорода другому веществу в химической реакции; в более широком смысле, основание — это вещество, которое получает этот ион водорода.
Третья распространенная теория — это теория кислотно-основных связей Льюиса , которая основана на образовании новых химических связей. Теория Льюиса объясняет, что кислота — это вещество, способное принимать пару электронов от другого вещества в процессе образования связи, в то время как основание — это вещество, которое может предоставить пару электронов для образования новой связи. Существует несколько других способов, с помощью которых вещество может быть классифицировано как кислота или основание, как это очевидно из истории этой концепции. [34]
Сила кислоты обычно измеряется двумя методами. Одним из измерений, основанным на определении кислотности Аррениуса, является pH , который является измерением концентрации ионов гидроксония в растворе, выраженной в отрицательной логарифмической шкале. Таким образом, растворы с низким pH имеют высокую концентрацию ионов гидроксония и могут быть названы более кислыми. Другим измерением, основанным на определении Бренстеда–Лоури, является константа диссоциации кислоты (K a ), которая измеряет относительную способность вещества действовать как кислота в соответствии с определением кислоты Бренстеда–Лоури. То есть вещества с более высоким K a с большей вероятностью будут отдавать ионы водорода в химических реакциях, чем вещества с более низкими значениями K a .
Окислительно-восстановительные реакции ( редукции - окисления ) включают все химические реакции , в которых атомы изменяют свое состояние окисления либо путем получения электронов (восстановление), либо путем потери электронов (окисление). Вещества, которые обладают способностью окислять другие вещества, называются окислительными и известны как окислители , окислители или окислители. Окислитель удаляет электроны из другого вещества. Аналогично, вещества, которые обладают способностью восстанавливать другие вещества, называются восстановительными и известны как восстановители , восстановители или восстановители.
Восстановитель переносит электроны в другое вещество и таким образом сам окисляется. И поскольку он «отдает» электроны, его также называют донором электронов. Окисление и восстановление по сути относятся к изменению степени окисления — фактическая передача электронов может никогда не произойти. Таким образом, окисление лучше определить как увеличение степени окисления , а восстановление — как уменьшение степени окисления.
Хотя концепция равновесия широко используется в различных науках, в контексте химии она возникает всякий раз, когда возможны различные состояния химического состава, например, в смеси нескольких химических соединений, которые могут реагировать друг с другом, или когда вещество может присутствовать в более чем одном виде фаз.
Система химических веществ в равновесии, даже имея неизменный состав, чаще всего не статична ; молекулы веществ продолжают реагировать друг с другом, тем самым порождая динамическое равновесие . Таким образом, это понятие описывает состояние, в котором такие параметры, как химический состав, остаются неизменными с течением времени.
Химические реакции подчиняются определенным законам, которые стали фундаментальными понятиями в химии. Вот некоторые из них:
История химии охватывает период от древнего прошлого до настоящего времени. Начиная с нескольких тысячелетий до нашей эры цивилизации использовали технологии, которые в конечном итоге легли в основу различных отраслей химии. Примерами служат извлечение металлов из руд , изготовление керамики и глазури, ферментация пива и вина, извлечение химикатов из растений для медицины и парфюмерии, переработка жира в мыло , изготовление стекла и изготовление сплавов , таких как бронза .
Химии предшествовала ее протонаука, алхимия , которая использовала ненаучный подход к пониманию составляющих материи и их взаимодействий. Несмотря на неудачи в объяснении природы материи и ее превращений, алхимики подготовили почву для современной химии, проводя эксперименты и записывая результаты. Роберт Бойль , хотя и скептически относился к элементам и был убежден в алхимии, сыграл ключевую роль в возвышении «священного искусства» как независимой, фундаментальной и философской дисциплины в своей работе «Скептический химик» (1661). [35]
Хотя и алхимия, и химия занимаются материей и ее преобразованиями, решающее различие было дано научным методом , который химики использовали в своей работе. Химия, как совокупность знаний, отличная от алхимии, стала устоявшейся наукой с работой Антуана Лавуазье , который разработал закон сохранения массы , который требовал тщательного измерения и количественных наблюдений химических явлений. История химии впоследствии переплетается с историей термодинамики , особенно благодаря работе Уилларда Гиббса . [36]
Определение химии со временем изменилось, поскольку новые открытия и теории добавили функциональности науке. Термин «химия», по мнению известного ученого Роберта Бойля в 1661 году, означал предмет материальных принципов смешанных тел. [37] В 1663 году химик Кристофер Глейзер описал «химию» как научное искусство, с помощью которого человек учится растворять тела и извлекать из них различные вещества по их составу, а также тому, как снова их объединять и возвышать до более высокого совершенства. [38]
Определение слова «химия» 1730 года, использованное Георгом Эрнстом Шталем , означало искусство разложения смешанных, составных или агрегатных тел на их принципы; и составления таких тел из этих принципов. [39] В 1837 году Жан-Батист Дюма считал, что слово «химия» относится к науке, занимающейся законами и эффектами молекулярных сил. [40] Это определение далее развивалось, пока в 1947 году оно не стало означать науку о веществах: их структуре, их свойствах и реакциях, которые превращают их в другие вещества — характеристика, принятая Лайнусом Полингом . [41] Совсем недавно, в 1998 году, профессор Рэймонд Чанг расширил определение «химии», означающее изучение материи и изменений, которым она подвергается. [42]

Ранние цивилизации, такие как египтяне [43], вавилоняне и индийцы [44], накопили практические знания, касающиеся искусства металлургии, гончарного дела и красителей, но не разработали систематическую теорию.
Основная химическая гипотеза впервые появилась в классической Греции с теорией четырех элементов , окончательно сформулированной Аристотелем, который утверждал, что огонь , воздух , земля и вода являются основными элементами, из которых все образуется как комбинация. Греческий атомизм восходит к 440 г. до н. э., возникнув в трудах таких философов, как Демокрит и Эпикур . В 50 г. до н. э. римский философ Лукреций расширил теорию в своей поэме De rerum natura (О природе вещей). [45] [46] В отличие от современных концепций науки, греческий атомизм был чисто философским по своей природе, мало заботясь об эмпирических наблюдениях и не заботясь о химических экспериментах. [47]
Ранней формой идеи сохранения массы является представление о том, что « Ничто не возникает из ничего » в древнегреческой философии , которое можно найти у Эмпедокла (ок. 4 в. до н. э.): «Ибо невозможно, чтобы что-либо произошло из того, чего нет, и невозможно, чтобы то, что есть, было полностью уничтожено». [48] и Эпикура (3 в. до н. э.), который, описывая природу Вселенной, писал, что «совокупность вещей всегда была такой, какова она сейчас, и всегда будет такой». [49]

В эллинистическом мире искусство алхимии впервые распространилось, смешав магию и оккультизм с изучением природных веществ с конечной целью превращения элементов в золото и открытия эликсира вечной жизни. [50] Работа, в частности, развитие дистилляции , продолжалась в ранний византийский период, и самым известным практиком был греко-египтянин 4-го века Зосима из Панополиса . [51] Алхимия продолжала развиваться и практиковаться по всему арабскому миру после мусульманских завоеваний , [52] а оттуда, и из византийских остатков, [53] распространилась в средневековую и ренессансную Европу через латинские переводы.
Арабские работы, приписываемые Джабиру ибн Хайяну , ввели систематическую классификацию химических веществ и предоставили инструкции по получению неорганического соединения ( нашатырного спирта или хлорида аммония ) из органических веществ (таких как растения, кровь и волосы) химическим путем. [54] Некоторые арабские работы Джабира (например, «Книга милосердия» и «Книга семидесяти») были позже переведены на латынь под латинизированным названием «Гебер» [55] , а в Европе в XIII веке анонимный писатель, обычно называемый псевдо-Гебером , начал создавать алхимические и металлургические сочинения под этим названием. [56] Позднее влиятельные мусульманские философы, такие как Абу ар-Райхан аль-Бируни [57] и Авиценна [58] оспаривали теории алхимии, в частности теорию превращения металлов .

Улучшения в очистке руд и их извлечении для выплавки металлов были широко используемым источником информации для ранних химиков в 16 веке, среди которых был Георг Агрикола (1494–1555), который опубликовал свой главный труд De re metallica в 1556 году. Его работа, описывающая высокоразвитые и сложные процессы добычи металлических руд и извлечения металлов, была вершиной металлургии того времени. Его подход устранил весь мистицизм, связанный с предметом, создав практическую базу, на которой другие могли и будут строить. Работа описывает множество видов печей, используемых для выплавки руды, и стимулирует интерес к минералам и их составу. Агриколу называют «отцом металлургии» и основателем геологии как научной дисциплины. [62] [60] [61]
Под влиянием новых эмпирических методов, предложенных сэром Фрэнсисом Бэконом и другими, группа химиков в Оксфорде , Роберт Бойль , Роберт Гук и Джон Мейоу начали перестраивать старые алхимические традиции в научную дисциплину. Бойль, в частности, подверг сомнению некоторые общепринятые химические теории и утверждал, что химики-практики должны быть более «философскими» и менее коммерчески сосредоточенными в «Скептическом химике» . [35] Он сформулировал закон Бойля , отверг классические «четыре элемента» и предложил механистическую альтернативу атомам и химическим реакциям , которые могли бы быть предметом строгого эксперимента. [63]
.jpg/440px-David_-_Portrait_of_Monsieur_Lavoisier_(cropped).jpg)
В последующие десятилетия было сделано много важных открытий, таких как природа «воздуха», который, как было обнаружено, состоит из множества различных газов. Шотландский химик Джозеф Блэк и фламандец Ян Баптист ван Гельмонт открыли диоксид углерода , или то, что Блэк называл «фиксированным воздухом» в 1754 году; Генри Кавендиш открыл водород и выяснил его свойства, а Джозеф Пристли и, независимо, Карл Вильгельм Шееле выделили чистый кислород . Теория флогистона (вещества, лежащего в основе всего горения) была предложена немцем Георгом Эрнстом Шталем в начале 18 века и была опровергнута только к концу века французским химиком Антуаном Лавуазье , химическим аналогом Ньютона в физике. Лавуазье сделал больше, чем кто-либо другой, для установления новой науки на надлежащей теоретической основе, выяснив принцип сохранения массы и разработав новую систему химической номенклатуры, используемую по сей день. [65]
Английский ученый Джон Дальтон предложил современную теорию атомов : все вещества состоят из неделимых «атомов» материи и что разные атомы имеют разный атомный вес.
Развитие электрохимической теории химических соединений произошло в начале 19 века в результате работы двух ученых, в частности Йенса Якоба Берцелиуса и Гемфри Дэви , что стало возможным благодаря предшествующему изобретению вольтова столба Алессандро Вольта . Дэви открыл девять новых элементов, включая щелочные металлы, путем извлечения их из их оксидов с помощью электрического тока. [66]

Британец Уильям Праут первым предложил упорядочить все элементы по их атомному весу, поскольку все атомы имели вес, который был точным кратным атомному весу водорода. Дж. А. Р. Ньюлендс разработал раннюю таблицу элементов, которая затем была развита в современную периодическую таблицу элементов [69] в 1860-х годах Дмитрием Менделеевым и независимо несколькими другими учеными, включая Юлиуса Лотара Мейера . [70] [71] Инертные газы, позже названные благородными газами, были открыты Уильямом Рамзаем в сотрудничестве с лордом Рэлеем в конце века, тем самым заполнив основную структуру таблицы.

На рубеже двадцатого века теоретические основы химии были наконец поняты благодаря серии замечательных открытий, которые преуспели в исследовании и раскрытии самой природы внутренней структуры атомов. В 1897 году Дж. Дж. Томсон из Кембриджского университета открыл электрон , а вскоре после этого французский ученый Беккерель, а также супруги Пьер и Мария Кюри исследовали явление радиоактивности . В серии пионерских экспериментов по рассеянию Эрнест Резерфорд из Манчестерского университета открыл внутреннюю структуру атома и существование протона, классифицировал и объяснил различные типы радиоактивности и успешно преобразовал первый элемент, бомбардируя азот альфа -частицами .
Его работа по атомной структуре была улучшена его учениками, датским физиком Нильсом Бором , англичанином Генри Мозли и немцем Отто Ганом , который впоследствии стал отцом зарождающейся ядерной химии и открыл деление ядра . Электронная теория химических связей и молекулярных орбиталей была разработана американскими учеными Лайнусом Полингом и Гилбертом Н. Льюисом .
2011 год был объявлен Организацией Объединенных Наций Международным годом химии. [72] Это была инициатива Международного союза теоретической и прикладной химии и Организации Объединенных Наций по вопросам образования, науки и культуры, в которой приняли участие химические общества, ученые и учреждения по всему миру, а также отдельные инициативы по организации местных и региональных мероприятий.
Органическая химия была разработана Юстусом фон Либихом и другими после синтеза мочевины Фридрихом Вёлером . [73] Другими важными достижениями 19-го века были: понимание валентных связей ( Эдвард Франкланд в 1852 году) и применение термодинамики в химии ( Дж. У. Гиббс и Сванте Аррениус в 1870-х годах).
В практической химии чистая химия изучает фундаментальные принципы химии, тогда как прикладная химия применяет эти знания для разработки технологий и решения реальных проблем.
Химия обычно делится на несколько основных субдисциплин. Также есть несколько основных междисциплинарных и более специализированных областей химии. [74]





Другие подразделения включают электрохимию , фемтохимию , химию ароматизаторов , химию потоков , иммуногистохимию , химию гидрогенизации , математическую химию , молекулярную механику , химию природных продуктов , металлоорганическую химию , нефтехимию , фотохимию , физическую органическую химию , химию полимеров , радиохимию , сонохимию , супрамолекулярную химию , синтетическую химию и многие другие.
Междисциплинарные области включают агрохимию , астрохимию (и космохимию ), химию атмосферы , химическую инженерию , химическую биологию , хемоинформатику , химию окружающей среды , геохимию , зеленую химию , иммунохимию , химию моря , материаловедение , механохимию , медицинскую химию , молекулярную биологию , нанотехнологии , энологию, фармакологию , фитохимию , химию твердого тела , науку о поверхности , термохимию и многие другие.
Химическая промышленность представляет собой важную экономическую деятельность во всем мире. 50 крупнейших мировых производителей химической продукции в 2013 году имели продажи в размере 980,5 млрд долларов США с рентабельностью 10,3%. [86]
Популярное чтение
Вводные учебники для бакалавриата
Учебники для продвинутого уровня бакалавриата или магистратуры