
Адсорбция — это адгезия [1] атомов , ионов или молекул из газа, жидкости или растворенного твердого вещества к поверхности . [ 2] Этот процесс создает пленку адсорбата на поверхности адсорбента . Этот процесс отличается от абсорбции , при которой жидкость ( абсорбат ) растворяется или проникает в жидкость или твердое вещество ( абсорбент ). [3] Хотя адсорбция часто предшествует абсорбции, которая подразумевает перенос абсорбата в объем абсорбирующего материала, в качестве альтернативы адсорбция — это отчетливо поверхностное явление, при котором адсорбат не проникает через поверхность материала в объем адсорбента. [4] Термин сорбция охватывает как адсорбцию, так и абсорбцию, а десорбция — это обратный сорбции процесс.
адсорбция : увеличение концентрации растворенного вещества на границе конденсированной и жидкой фаз из-за действия поверхностных сил. Адсорбция может также происходить на границе конденсированной и газообразной фаз. [5]
Как и поверхностное натяжение , адсорбция является следствием поверхностной энергии . В объемном материале все требования к связыванию (будь то ионные , ковалентные или металлические ) составляющих атомов материала выполняются другими атомами в материале. Однако атомы на поверхности адсорбента не полностью окружены другими атомами адсорбента и, следовательно, могут притягивать адсорбаты. Точная природа связывания зависит от деталей вовлеченных видов, но процесс адсорбции обычно классифицируется как физическая адсорбция (характерная для слабых сил Ван-дер-Ваальса ) или хемосорбция (характерная для ковалентной связи). Он также может происходить из-за электростатического притяжения. [6] [7] Природа адсорбции может влиять на структуру адсорбированных видов. Например, физическая адсорбция полимера из раствора может привести к образованию раздавленных структур на поверхности. [8]
Адсорбция присутствует во многих природных, физических, биологических и химических системах и широко используется в промышленных приложениях, таких как гетерогенные катализаторы , [9] [10] активированный уголь , улавливание и использование отходящего тепла для обеспечения холодной водой для кондиционирования воздуха и других технологических требований (адсорбционные охладители), синтетические смолы , увеличение емкости хранения карбидных углей и очистка воды . [11] Адсорбция, ионный обмен и хроматография являются сорбционными процессами, в которых определенные адсорбаты селективно переносятся из жидкой фазы на поверхность нерастворимых жестких частиц, взвешенных в сосуде или упакованных в колонку. Приложения в фармацевтической промышленности, которые используют адсорбцию как средство для продления неврологического воздействия определенных препаратов или их частей, [ необходима ссылка ] менее известны.
Слово «адсорбция» было придумано в 1881 году немецким физиком Генрихом Кайзером (1853–1940). [12]
Адсорбция газов и растворенных веществ обычно описывается с помощью изотерм, то есть количества адсорбата на адсорбенте как функции его давления (если газ) или концентрации (для растворенных веществ в жидкой фазе) при постоянной температуре. Количество адсорбированного вещества почти всегда нормализуется по массе адсорбента, чтобы можно было сравнивать различные материалы. На сегодняшний день разработано 15 различных моделей изотерм. [13]
Первая математическая подгонка изотермы была опубликована Фрейндлихом и Кюстером (1906) и представляет собой чисто эмпирическую формулу для газообразных адсорбатов:
где — масса адсорбированного адсорбата, — масса адсорбента, — давление адсорбата (это можно изменить на концентрацию, если исследовать раствор, а не газ), а и — эмпирические константы для каждой пары адсорбент–адсорбат при заданной температуре. Функция неадекватна при очень высоком давлении, поскольку в действительности имеет асимптотический максимум при неограниченном увеличении давления. По мере увеличения температуры константы и изменяются, отражая эмпирическое наблюдение, что адсорбированное количество увеличивается медленнее и для насыщения поверхности требуются более высокие давления.
Ирвинг Ленгмюр был первым, кто вывел научно обоснованную изотерму адсорбции в 1918 году. [14] Модель применима к газам, адсорбированным на твердых поверхностях. Это полуэмпирическая изотерма с кинетической основой, выведенная на основе статистической термодинамики. Это наиболее распространенное уравнение изотермы для использования из-за его простоты и способности соответствовать различным данным по адсорбции. Оно основано на четырех предположениях:
Эти четыре предположения редко бывают верными: на поверхности всегда есть дефекты, адсорбированные молекулы не обязательно инертны, и механизм явно не тот же самый для первых молекул, которые адсорбируются на поверхности, как для последних. Четвертое условие является самым проблемным, так как часто больше молекул будет адсорбироваться на монослое; эта проблема решается изотермой БЭТ для относительно плоских (не микропористых ) поверхностей. Изотерма Ленгмюра, тем не менее, является первым выбором для большинства моделей адсорбции и имеет множество приложений в поверхностной кинетике (обычно называемой кинетикой Ленгмюра-Хиншельвуда ) и термодинамике .
Ленгмюр предположил, что адсорбция происходит посредством этого механизма: , где A — молекула газа, а S — место адсорбции. Прямые и обратные константы скорости равны k и k −1 . Если мы определим покрытие поверхности, , как долю занятых мест адсорбции, в равновесии мы имеем:
или
где - парциальное давление газа или молярная концентрация раствора. Для очень низких давлений и для высоких давлений .
Значение трудно измерить экспериментально; обычно адсорбат представляет собой газ, а адсорбированное количество указывается в молях, граммах или объемах газа при стандартной температуре и давлении (СТД) на грамм адсорбента. Если обозначить v mon как СТД-объем адсорбата, необходимый для образования монослоя на адсорбенте (на грамм адсорбента), то , и мы получим выражение для прямой линии:
Через его наклон и точку пересечения с осью y мы можем получить v mon и K , которые являются константами для каждой пары адсорбент–адсорбат при данной температуре. v mon связана с числом мест адсорбции через закон идеального газа . Если предположить, что число мест — это просто вся площадь твердого тела, деленная на поперечное сечение молекул адсорбата, мы можем легко вычислить площадь поверхности адсорбента. Площадь поверхности адсорбента зависит от его структуры: чем больше пор, тем больше площадь, что оказывает большое влияние на реакции на поверхности .
Если на поверхности адсорбируется более одного газа, мы определяем как долю пустых мест, и имеем:
Также мы можем определить как долю мест, занятых j -ым газом:
где i — каждый из адсорбируемых газов.
Примечание:
1) Чтобы сделать выбор между уравнениями Ленгмюра и Фрейндлиха, необходимо исследовать энтальпии адсорбции. [15] В то время как модель Ленгмюра предполагает, что энергия адсорбции остается постоянной при заполнении поверхности, уравнение Фрейндлиха выводится с предположением, что теплота адсорбции непрерывно уменьшается по мере того, как заполняются места связывания. [16] Выбор модели, основанный на наилучшем соответствии данным, является распространенным заблуждением. [15]
2) Использование линеаризованной формы модели Ленгмюра больше не является общепринятой практикой. Достижения в области вычислительной мощности позволили выполнять нелинейную регрессию быстро и с большей уверенностью, поскольку не требуется преобразования данных.
Часто молекулы образуют многослойные структуры, то есть некоторые из них адсорбируются на уже адсорбированных молекулах, и изотерма Ленгмюра недействительна. В 1938 году Стивен Брунауэр , Пол Эмметт и Эдвард Теллер разработали модельную изотерму, которая учитывает эту возможность. Их теория называется теорией БЭТ , по первым буквам их фамилий. Они модифицировали механизм Ленгмюра следующим образом:

Вывод формулы сложнее, чем у Ленгмюра (см. ссылки для полного вывода). Получаем:
где x — давление, деленное на давление паров адсорбата при этой температуре (обычно обозначается ), v — объем адсорбированного адсорбата в СТП, v mon — объем адсорбата в СТП, необходимый для образования монослоя, а c — константа равновесия K, которую мы использовали в изотерме Ленгмюра, умноженная на давление паров адсорбата. Ключевое предположение, использованное при выводе уравнения БЭТ, заключается в том, что последовательные теплоты адсорбции для всех слоев, кроме первого, равны теплоте конденсации адсорбата.
Изотерма Ленгмюра обычно лучше подходит для хемосорбции, а изотерма БЭТ лучше подходит для физадсорбции на немикропористых поверхностях.

В других случаях молекулярные взаимодействия между молекулами газа, ранее адсорбированными на твердой поверхности, формируют значительные взаимодействия с молекулами газа в газообразных фазах. Следовательно, адсорбция молекул газа на поверхности с большей вероятностью будет происходить вокруг молекул газа, которые уже присутствуют на твердой поверхности, что делает изотерму адсорбции Ленгмюра неэффективной для целей моделирования. Этот эффект был изучен в системе, где азот был адсорбатом, а вольфрам был адсорбентом Полом Кислюком (1922–2008) в 1957 году. [17] Чтобы компенсировать повышенную вероятность адсорбции, происходящей вокруг молекул, присутствующих на поверхности подложки, Кислюк разработал теорию состояния предшественника, согласно которой молекулы будут входить в состояние предшественника на границе между твердым адсорбентом и адсорбатом в газообразной фазе. Отсюда молекулы адсорбата будут либо адсорбироваться на адсорбенте, либо десорбироваться в газообразную фазу. Вероятность адсорбции из состояния предшественника зависит от близости адсорбата к другим молекулам адсорбата, которые уже были адсорбированы. Если молекула адсорбата в состоянии предшественника находится в непосредственной близости от молекулы адсорбата, которая уже образовалась на поверхности, она имеет вероятность прилипания, отраженную размером константы S E , и либо будет адсорбирована из состояния предшественника со скоростью k EC , либо будет десорбирована в газообразную фазу со скоростью k ES . Если молекула адсорбата входит в состояние предшественника в месте, удаленном от любых других ранее адсорбированных молекул адсорбата, вероятность прилипания отражается размером константы S D .
Эти факторы были включены как часть единой константы, называемой «коэффициентом прилипания», k E , описанной ниже:
Поскольку S D диктуется факторами, которые учитываются моделью Ленгмюра, можно предположить, что S D является константой скорости адсорбции. Однако константа скорости для модели Кислюка ( R ') отличается от константы скорости для модели Ленгмюра, поскольку R ' используется для представления влияния диффузии на образование монослоя и пропорциональна квадратному корню из коэффициента диффузии системы. Изотерма адсорбции Кислюка записывается следующим образом, где θ ( t ) - фракционное покрытие адсорбента адсорбатом, а t - время погружения:
Решение относительно θ ( t ) дает:
Константы адсорбции являются константами равновесия , поэтому они подчиняются уравнению Вант-Гоффа :
Как видно из формулы, изменение K должно быть изостерическим, то есть при постоянном покрытии. Если мы начнем с изотермы БЭТ и предположим, что изменение энтропии одинаково для сжижения и адсорбции, то получим
то есть адсорбция более экзотермична, чем сжижение.
Адсорбцию ансамбля молекул на поверхности или интерфейсе можно разделить на два процесса: адсорбцию и десорбцию. Если скорость адсорбции побеждает скорость десорбции, молекулы будут накапливаться с течением времени, давая кривую адсорбции с течением времени. Если скорость десорбции больше, количество молекул на поверхности будет уменьшаться с течением времени. Скорость адсорбции зависит от температуры, скорости диффузии растворенного вещества (связанной со средней длиной свободного пробега для чистого газа) и энергетического барьера между молекулой и поверхностью. Диффузию и ключевые элементы скорости адсорбции можно рассчитать с помощью законов диффузии Фика и соотношения Эйнштейна (кинетическая теория) . В идеальных условиях, когда нет энергетического барьера и все молекулы, которые диффундируют и сталкиваются с поверхностью, адсорбируются, количество молекул, адсорбированных на поверхности площадью на бесконечной площади поверхности, можно напрямую проинтегрировать из дифференциального уравнения второго закона Фика , чтобы получить: [18]
где - площадь поверхности (единица м2 ) , - числовая концентрация молекул в объеме раствора (единица #/м3 ) , - константа диффузии (единица м2 / с), и - время (единица с). Дальнейшее моделирование и анализ этого уравнения [19] показывают, что зависимость квадратного корня от времени возникает из-за уменьшения концентраций вблизи поверхности при идеальных условиях адсорбции. Кроме того, это уравнение работает только для начала адсорбции, когда вблизи поверхности образуется хорошо себя ведущий градиент концентрации. Поправка на уменьшение площади адсорбции и замедление эволюции градиента концентрации должна учитываться в течение более длительного времени. [20] В реальных экспериментальных условиях поток и малая площадь адсорбции всегда делают скорость адсорбции выше, чем предсказывает это уравнение, и энергетический барьер либо ускорит эту скорость за счет поверхностного притяжения, либо замедлит ее за счет поверхностного отталкивания. Таким образом, предсказание из этого уравнения часто на несколько порядков отличается от экспериментальных результатов. В особых случаях, таких как очень малая площадь адсорбции на большой поверхности и в условиях химического равновесия , когда нет градиента концентрации вблизи поверхности, это уравнение становится полезным для прогнозирования скорости адсорбции с дискуссионной особой тщательностью для определения конкретного значения в конкретном измерении. [19]
Десорбция молекулы с поверхности зависит от энергии связи молекулы с поверхностью и температуры. Типичная общая скорость адсорбции, таким образом, часто является совокупным результатом адсорбции и десорбции.
С 1980 года разрабатывались две теории для объяснения адсорбции и получения работающих уравнений. Эти две теории называются гипотезой хи, квантово-механическим выводом и избыточной поверхностной работой (ESW). [21] Обе эти теории дают одно и то же уравнение для плоских поверхностей:
где U — единичная ступенчатая функция. Определения других символов следующие:
где "ads" означает "адсорбированный", "m" означает "эквивалентность монослоя", а "vap" относится к давлению паров жидкого адсорбтива при той же температуре, что и твердый образец. Единичная функция создает определение молярной энергии адсорбции для первой адсорбированной молекулы по формуле:
График зависимости адсорбированного от называется графиком хи. Для плоских поверхностей наклон графика хи дает площадь поверхности. Эмпирически этот график был замечен как очень хорошо соответствующий изотерме Майклом Полани [22] [23] [24] , а также Яном Хендриком де Буром и Корнелисом Цвиккером [25], но не был продолжен. Это было связано с критикой в первом случае Альберта Эйнштейна , а во втором случае — Брунауэра. Это уравнение плоской поверхности может использоваться в качестве «стандартной кривой» в обычной традиции кривых сравнения, за исключением того, что ранняя часть графика зависимости от пористого образца действует как самостандарт. С помощью этой техники можно анализировать ультрамикропористые, микропористые и мезопористые состояния. Типичные стандартные отклонения для полных изотермических подгонок, включая пористые образцы, составляют менее 2%.
Обратите внимание, что в этом описании физической адсорбции энтропия адсорбции согласуется с термодинамическим критерием Дубинина, то есть энтропия адсорбции из жидкого состояния в адсорбированное состояние приблизительно равна нулю.

Адсорбенты обычно используются в форме сферических гранул, стержней, формованных изделий или монолитов с гидродинамическим радиусом от 0,25 до 5 мм. Они должны обладать высокой стойкостью к истиранию , высокой термической стабильностью и малым диаметром пор, что приводит к большей площади открытой поверхности и, следовательно, высокой адсорбционной способности. Адсорбенты также должны иметь отчетливую пористую структуру, которая обеспечивает быструю транспортировку газообразных паров. [26] Большинство промышленных адсорбентов попадают в один из трех классов:

Силикагель — это химически инертная, нетоксичная, полярная и размерно стабильная (< 400 °C или 750 °F) аморфная форма SiO 2 . Он изготавливается путем реакции между силикатом натрия и уксусной кислотой, за которой следует ряд процессов последующей обработки, таких как старение, травление и т. д. Эти методы последующей обработки приводят к различным распределениям размеров пор.
Кремний используется для осушки технологического воздуха (например, кислорода, природного газа) и адсорбции тяжелых (полярных) углеводородов из природного газа.
Цеолиты — это природные или синтетические кристаллические алюмосиликаты , которые имеют повторяющуюся пористую сеть и выделяют воду при высокой температуре. Цеолиты полярны по своей природе.
Они производятся путем гидротермального синтеза алюмосиликата натрия или другого источника кремния в автоклаве с последующим ионным обменом с определенными катионами (Na + , Li + , Ca 2+ , K + , NH 4 + ). Диаметр каналов цеолитовых ячеек обычно составляет от 2 до 9 Å . За процессом ионного обмена следует сушка кристаллов, которые могут быть гранулированы со связующим веществом для формирования макропористых гранул.
Цеолиты применяются для осушки технологического воздуха, удаления CO2 из природного газа, удаления CO из риформинг-газа, разделения воздуха, каталитического крекинга , а также каталитического синтеза и риформинга.
Неполярные (кремнистые) цеолиты синтезируются из источников кремния, не содержащих алюминий, или путем деалюминирования содержащих алюминий цеолитов. Процесс деалюминирования осуществляется путем обработки цеолита паром при повышенных температурах, обычно выше 500 °C (930 °F). Эта высокотемпературная термическая обработка разрывает связи алюминий-кислород, и атом алюминия вытесняется из каркаса цеолита.
Сам термин «адсорбция» был введен Генрихом Кайзером в 1881 году в контексте поглощения газов углеродом. [28]
Активированный уголь — это высокопористое, аморфное твердое вещество, состоящее из микрокристаллитов с графитовой решеткой, обычно изготавливаемое в виде небольших гранул или порошка. Он неполярен и дешев. Одним из его главных недостатков является то, что он реагирует с кислородом при умеренных температурах (более 300 °C).

Активированный уголь может быть изготовлен из углеродистого материала, включая уголь (битуминозный, суббитуминозный и лигнит), торф, древесину или ореховую скорлупу (например, кокос). Процесс производства состоит из двух фаз: карбонизации и активации. [29] [30] Процесс карбонизации включает сушку и последующее нагревание для отделения побочных продуктов, включая смолы и другие углеводороды, от сырья, а также для удаления любых образующихся газов. Процесс завершается нагреванием материала свыше 400 °C (750 °F) в бескислородной атмосфере, которая не может поддерживать горение. Затем карбонизированные частицы «активируются» путем воздействия на них окислителя, обычно пара или углекислого газа при высокой температуре. Этот агент сжигает структуры, блокирующие поры, созданные во время фазы карбонизации, и, таким образом, они образуют пористую трехмерную структуру решетки графита. Размер пор, образовавшихся во время активации, зависит от времени, которое они проводят на этой стадии. Более длительное время воздействия приводит к увеличению размера пор. Наиболее популярными углеродными материалами на водной основе являются битумные углероды из-за их твердости, стойкости к истиранию, распределения размеров пор и низкой стоимости, но их эффективность необходимо проверять в каждом конкретном случае применения, чтобы определить оптимальный продукт.
Активированный уголь используется для адсорбции органических веществ [31] и неполярных адсорбатов, а также обычно используется для очистки отходящих газов (и сточных вод). Это наиболее широко используемый адсорбент, поскольку большинство его химических (например, поверхностные группы) и физических свойств (например, распределение размеров пор и площадь поверхности) можно настраивать в соответствии с потребностями. [32] Его полезность также обусловлена большим объемом микропор (а иногда и мезопор) и, как следствие, высокой площадью поверхности. В недавних исследовательских работах сообщалось об активированном угле как об эффективном агенте для адсорбции катионных видов токсичных металлов из систем с несколькими загрязнителями, а также предлагались возможные механизмы адсорбции с подтверждающими доказательствами. [33]
Адсорбция воды на поверхностях имеет большое значение в химической инженерии , материаловедении и катализе . Также называемая поверхностной гидратацией, присутствие физически или химически адсорбированной воды на поверхностях твердых тел играет важную роль в управлении свойствами интерфейса, путями химических реакций и каталитической эффективностью в широком диапазоне систем. В случае физически адсорбированной воды поверхностная гидратация может быть устранена просто путем сушки в условиях температуры и давления, допускающих полное испарение воды. Для химически адсорбированной воды гидратация может быть в форме либо диссоциативной адсорбции , где молекулы H2O диссоциируют на адсорбированные поверхностью -H и -OH, либо молекулярной адсорбции (ассоциативной адсорбции), где отдельные молекулы воды остаются нетронутыми [34]
Низкая стоимость (200 долл. США/тонна) и высокая скорость цикла (2000 ×) синтетических цеолитов, таких как Linde 13X с водным адсорбатом, в последнее время привлекли большой академический и коммерческий интерес для использования в качестве хранилища тепловой энергии (TES), в частности низкосортного солнечного и отработанного тепла. Несколько пилотных проектов были профинансированы в ЕС с 2000 года по настоящее время (2020 год). [ необходима цитата ] Основная концепция заключается в хранении солнечной тепловой энергии в виде химической скрытой энергии в цеолите. Обычно горячий сухой воздух из плоских солнечных коллекторов пропускают через слой цеолита таким образом, что любой присутствующий водный адсорбат отводится. Хранение может быть дневным, еженедельным, ежемесячным или даже сезонным в зависимости от объема цеолита и площади солнечных тепловых панелей. Когда тепло требуется ночью, в бессолнечные часы или зимой, увлажненный воздух проходит через цеолит. Поскольку влажность поглощается цеолитом, тепло выделяется в воздух и затем в пространство здания. Эта форма TES, с особым использованием цеолитов, была впервые представлена Джоном Геррой в 1978 году. [35]
Типичными адсорбентами, предлагаемыми для улавливания и хранения углерода, являются цеолиты и MOF . [36] Индивидуализация адсорбентов делает их потенциально привлекательной альтернативой абсорбции. Поскольку адсорбенты можно регенерировать с помощью перепада температуры или давления, этот шаг может быть менее энергоемким, чем методы регенерации абсорбции . [37] Основные проблемы, связанные со стоимостью адсорбции при улавливании углерода, это: регенерация адсорбента, массовое соотношение, растворитель/MOF, стоимость адсорбента, производство адсорбента, срок службы адсорбента. [38]
В технологии сорбционно-усиленной конверсии водяного газа (SEWGS) процесс улавливания углерода до сжигания, основанный на твердой адсорбции, сочетается с реакцией конверсии водяного газа (WGS) для получения потока водорода под высоким давлением. [39] Полученный поток CO 2 может храниться или использоваться для других промышленных процессов. [40]
Адсорбция белка — это процесс, который играет фундаментальную роль в области биоматериалов . Действительно, поверхности биоматериала, контактирующие с биологическими средами, такими как кровь или сыворотка, немедленно покрываются белками. Поэтому живые клетки взаимодействуют не напрямую с поверхностью биоматериала, а со слоем адсорбированных белков. Этот слой белка опосредует взаимодействие между биоматериалами и клетками, переводя физические и химические свойства биоматериала на «биологический язык». [41] Фактически, рецепторы клеточной мембраны связываются с биоактивными участками слоя белка, и эти события связывания рецептора с белком передаются через клеточную мембрану таким образом, что стимулируют определенные внутриклеточные процессы, которые затем определяют адгезию, форму, рост и дифференциацию клеток. Адсорбция белка зависит от многих свойств поверхности, таких как смачиваемость поверхности , химический состав поверхности [42] и морфология поверхности в нанометровом масштабе. [43] Адсорбция поверхностно-активного вещества — это похожее явление, но использующее молекулы поверхностно-активного вещества вместо белков. [44]
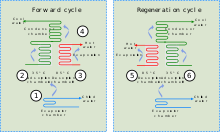
Объединяя адсорбент с хладагентом, адсорбционные охладители используют тепло для обеспечения охлаждающего эффекта. Это тепло в виде горячей воды может поступать из любого количества промышленных источников, включая отходящее тепло от промышленных процессов, основное тепло от солнечных тепловых установок или от тепла выхлопных газов или водяной рубашки поршневого двигателя или турбины.
Хотя между адсорбционными охладителями и абсорбционным охлаждением есть сходство , первое основано на взаимодействии газов и твердых тел. Адсорбционная камера охладителя заполнена твердым материалом (например, цеолитом, силикагелем, оксидом алюминия, активированным углем или некоторыми типами солей металлов), который в своем нейтральном состоянии адсорбировал хладагент. При нагревании твердое тело десорбирует (выделяет) пары хладагента, которые впоследствии охлаждаются и сжижаются. Затем этот жидкий хладагент обеспечивает охлаждающий эффект в испарителе за счет своей энтальпии испарения . На заключительном этапе пары хладагента (ре)адсорбируются в твердом теле. [45] Поскольку адсорбционный охладитель не требует компрессора, он относительно тихий.
Адсорбция, опосредованная портальным сайтом, является моделью для селективной по сайту активированной адсорбции газа в металлических каталитических системах, которые содержат множество различных сайтов адсорбции. В таких системах дефектные сайты с низкой координацией «края и углы» могут демонстрировать значительно более низкие энтальпии адсорбции, чем сайты с высокой координацией ( базальная плоскость ). В результате эти сайты могут служить «порталами» для очень быстрой адсорбции на остальной части поверхности. Явление основано на общем эффекте «перетекания» (описанном ниже), когда определенные адсорбированные виды проявляют высокую подвижность на некоторых поверхностях. Модель объясняет, казалось бы, противоречивые наблюдения термодинамики и кинетики адсорбции газа в каталитических системах, где поверхности могут существовать в диапазоне координационных структур, и она была успешно применена к биметаллическим каталитическим системам, где наблюдается синергическая активность.
В отличие от чистого перетока, адсорбция на портальном участке относится к поверхностной диффузии к соседним участкам адсорбции, а не к неадсорбирующим поверхностям носителя.
Модель, по-видимому, была впервые предложена для оксида углерода на платине, нанесенной на кремний, Брандтом и др. (1993). [46] Похожая, но независимая модель была разработана Кингом и его коллегами [47] [48] [49] для описания адсорбции водорода на рутениевых, серебряно-рутениевых и медно-рутениевых биметаллических катализаторах, нанесенных на кремний, промотированных щелочью. Та же группа применила эту модель к гидрированию CO ( синтез Фишера-Тропша ). [50] Зупанц и др. (2002) впоследствии подтвердили ту же модель для адсорбции водорода на цезий-рутениевых биметаллических катализаторах, нанесенных на магнезию. [51] Тренс и др. (2009) аналогичным образом описали поверхностную диффузию CO на частицах Pt, нанесенных на углерод, различной морфологии. [52]
В случае каталитических или адсорбционных систем, где металлический вид диспергирован на материале подложки (или носителя) (часто квазиинертных оксидах, таких как оксид алюминия или кремний), адсорбционный вид может косвенно адсорбироваться на поверхности подложки в условиях, когда такая адсорбция термодинамически невыгодна. Присутствие металла служит низкоэнергетическим путем для газообразных видов, чтобы сначала адсорбироваться на металле, а затем диффундировать на поверхности подложки. Это возможно, поскольку адсорбированный вид достигает более низкого энергетического состояния после того, как он адсорбируется на металле, тем самым снижая активационный барьер между видами газовой фазы и видами, адсорбированными на подложке.
Наиболее распространенным примером адсорбционного спилловера является водородный спилловер . В случае водорода адсорбция чаще всего сопровождается диссоциацией молекулярного водорода (H 2 ) в атомарный водород (H), за которым следует спилловер присутствующих атомов водорода.
Эффект перелива использовался для объяснения многих наблюдений в гетерогенном катализе и адсорбции. [53]
Адсорбция молекул на полимерных поверхностях является центральной для ряда приложений, включая разработку антипригарных покрытий и в различных биомедицинских устройствах. Полимеры также могут адсорбироваться на поверхностях посредством полиэлектролитной адсорбции .
Адсорбция — первый шаг в жизненном цикле вируса . Следующие шаги — проникновение, снятие оболочки, синтез (транскрипция, если необходимо, и трансляция) и высвобождение. Цикл репликации вируса в этом отношении одинаков для всех типов вирусов. Такие факторы, как транскрипция, могут быть необходимы или не необходимы, если вирус способен интегрировать свою геномную информацию в ядро клетки или если вирус может реплицироваться непосредственно в цитоплазме клетки.
Игра Тетрис — это игра-головоломка, в которой блоки из 4 штук адсорбируются на поверхность во время игры. Ученые использовали блоки Тетриса «как прокси для молекул сложной формы» и их «адсорбцию на плоской поверхности» для изучения термодинамики наночастиц . [ 54 ] [55]
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка )[ нужна страница ]