Азотная кислота — неорганическое соединение с формулой HNO3 . Это очень едкая минеральная кислота . [6] Соединение бесцветно, но образцы имеют тенденцию приобретать желтый оттенок с течением времени из-за разложения на оксиды азота . Большая часть коммерчески доступной азотной кислоты имеет концентрацию 68% в воде. Когда раствор содержит более 86% HNO3 , его называют дымящейся азотной кислотой . В зависимости от количества присутствующего диоксида азота дымящаяся азотная кислота далее характеризуется как красная дымящаяся азотная кислота при концентрации выше 86% или белая дымящаяся азотная кислота при концентрации выше 95%.
Азотная кислота является основным реагентом, используемым для нитрации – присоединения нитрогруппы , как правило, к органической молекуле . В то время как некоторые полученные нитросоединения являются взрывчатыми веществами , чувствительными к ударам и температуре , некоторые из них достаточно стабильны, чтобы использоваться в боеприпасах и при сносе зданий, в то время как другие еще более стабильны и используются в качестве синтетических красителей и лекарств (например, метронидазол ). Азотная кислота также широко используется в качестве сильного окислителя .
Открытие минеральных кислот, таких как азотная кислота, как правило, относят к европейской алхимии XIII века . [7] Общепринятая точка зрения заключается в том, что азотная кислота была впервые описана в труде псевдо-Гебера « De inventione veritatis» («Об открытии истины», около 1300 г. ). [8]
Однако, по словам Эрика Джона Холмьярда и Ахмада Й. аль-Хасана , азотная кислота также встречается в различных более ранних арабских произведениях, таких как « Сундук аль-Хикма» («Сундук мудрости»), приписываемый Джабиру ибн Хайяну (VIII век), или « Тавид аль-Хаким», приписываемый халифу Фатимидов аль-Хакиму би-Амр Аллаху (985–1021). [9]
Рецепт в « Сундук аль-хикма», приписываемый Джабиру, переведен следующим образом: [10] [11]
Возьмите пять частей чистых цветков селитры , три части кипрского купороса и две части йеменских квасцов . Хорошо измельчите их по отдельности, пока они не станут похожи на пыль, а затем поместите их в колбу. Заткните последнюю пальмовым волокном и прикрепите к нему стеклянный приемник. Затем переверните аппарат и нагрейте верхнюю часть (т. е. колбу, содержащую смесь) на слабом огне. Из-за тепла вниз потечет масло, похожее на коровье масло.
Азотная кислота также встречается в работах, написанных после 1300 года и ложно приписываемых Альберту Великому и Рамону Луллию (оба 13-го века). В этих работах описывается перегонка смеси, содержащей селитру и купорос , которую они называют «eau forte» (крепкая водка). [12] [13] [14]
В XVII веке Иоганн Рудольф Глаубер разработал процесс получения азотной кислоты путем перегонки нитрата калия с серной кислотой. В 1776 году Антуан Лавуазье сослался на работу Джозефа Пристли , чтобы указать, что ее можно преобразовать из оксида азота (который он называет «азотистым воздухом»), «соединенного с приблизительно равным объемом чистейшей части обычного воздуха и значительным количеством воды». [15] [a] В 1785 году Генри Кавендиш определил ее точный состав и показал, что ее можно синтезировать, пропуская поток электрических искр через влажный воздух . [12] В 1806 году Хэмфри Дэви сообщил о результатах обширных экспериментов по электролизу дистиллированной воды, заключив, что азотная кислота была получена на аноде из растворенного в атмосфере азотного газа. Он использовал высоковольтную батарею и нереактивные электроды и сосуды, такие как золотые электродные конусы, которые также служили сосудами, соединенными влажным асбестом. [16]
Промышленное производство азотной кислоты из атмосферного воздуха началось в 1905 году с процесса Биркеланда-Эйде , также известного как дуговой процесс. [17] Этот процесс основан на окислении атмосферного азота атмосферным кислородом до оксида азота с помощью очень высокотемпературной электрической дуги. Выходы примерно до 4–5% оксида азота были получены при 3000 °C и меньше при более низких температурах. [17] [18] Оксид азота охлаждался и окислялся оставшимся атмосферным кислородом до диоксида азота, и он впоследствии поглощался водой в серии абсорбционных колонн с насадочными колоннами или тарельчатыми колоннами для получения разбавленной азотной кислоты. Первые башни пропускали диоксид азота через воду и нереакционноспособные кварцевые фрагменты. Около 20% полученных оксидов азота оставались непрореагировавшими, поэтому в последних башнях содержался щелочной раствор для нейтрализации остального. [19] Процесс был очень энергоемким и был быстро вытеснен процессом Оствальда, как только стал доступен дешевый аммиак.
Другой ранний метод производства был изобретен французским инженером Альбертом Нодоном около 1913 года. Его метод производил азотную кислоту путем электролиза нитрата кальция, преобразованного бактериями из азотистого вещества в торфяных болотах. Глиняный горшок, окруженный известняком, был погружен в торф и обложен просмоленной древесиной, чтобы сделать отсек для угольного анода, вокруг которого образуется азотная кислота. Азотная кислота откачивалась из глиняной [20] трубы, которая была погружена на дно горшка. Свежая вода закачивалась в верхнюю часть через другую глиняную трубу, чтобы заменить удаленную жидкость. Внутренняя часть была заполнена коксом . Чугунные катоды были погружены в торф, окружающий их. Сопротивление составляло около 3 Ом на кубический метр, а подаваемая мощность составляла около 10 вольт. Производство с одного месторождения составляло 800 тонн в год. [20] [21]
После внедрения в 1913 году процесса Габера для эффективного производства аммиака производство азотной кислоты из аммиака с использованием процесса Оствальда превзошло производство с использованием процесса Биркеланда–Эйде. Этот метод производства используется и по сей день.
Коммерчески доступная азотная кислота представляет собой азеотроп с водой при концентрации 68% HNO 3 . Этот раствор имеет температуру кипения 120,5 °C (249 °F) при 1 атм. Он известен как «концентрированная азотная кислота». Азеотроп азотной кислоты и воды представляет собой бесцветную жидкость при комнатной температуре.
Известны два твердых гидрата: моногидрат HNO 3 ·H 2 O или нитрат оксония [H 3 O] + [NO 3 ] − и тригидрат HNO 3 ·3H 2 O.
Иногда встречается более старая шкала плотности, в которой концентрированная азотная кислота обозначена как 42 Боме . [22]

Азотная кислота подвержена термическому или световому разложению, поэтому ее часто хранили в бутылках из коричневого стекла:
Эта реакция может привести к некоторым существенным изменениям давления пара над жидкостью, поскольку образующиеся оксиды азота частично или полностью растворяются в кислоте.
Диоксид азота ( NO 2 ) и/или тетраоксид диазота ( N 2 O 4 ) остаются растворенными в азотной кислоте, окрашивая ее в желтый или даже красный цвет при более высоких температурах. В то время как чистая кислота имеет тенденцию выделять белые пары при контакте с воздухом, кислота с растворенным диоксидом азота выделяет красновато-коричневые пары, что приводит к общим названиям «красная дымящаяся азотная кислота» и «белая дымящаяся азотная кислота». Оксиды азота ( NO x ) растворимы в азотной кислоте.
Коммерческая дымящая азотная кислота содержит 98% HNO3 и имеет плотность 1,50 г/см3 . Этот сорт часто используется в промышленности взрывчатых веществ. Он не такой летучий и не такой едкий, как безводная кислота, и имеет приблизительную концентрацию 21,4 М.
Красная дымящаяся азотная кислота , или RFNA, содержит значительные количества растворенного диоксида азота ( NO 2 ), что придает раствору красновато-коричневый цвет. Из-за растворенного диоксида азота плотность красной дымящейся азотной кислоты ниже и составляет 1,490 г/см 3 .
Ингибированная дымящаяся азотная кислота, либо белая ингибированная дымящаяся азотная кислота (IWFNA), либо красная ингибированная дымящаяся азотная кислота (IRFNA), может быть получена путем добавления 0,6–0,7% фтористого водорода (HF). Этот фторид добавляется для коррозионной стойкости в металлические резервуары. Фторид создает слой фторида металла, который защищает металл.
Белая дымящаяся азотная кислота, чистая азотная кислота или WFNA, очень близка к безводной азотной кислоте. Она доступна как 99,9% азотная кислота по анализу, или около 24 молярных . Одной из спецификаций для белой дымящейся азотной кислоты является то, что она имеет максимум 2% воды и максимум 0,5% растворенного NO 2 . Безводная азотная кислота представляет собой бесцветную, маловязкую ( подвижную) жидкость с плотностью 1,512–3 г/см 3 , которая затвердевает при −42 °C (−44 °F) с образованием белых кристаллов. [ необходима цитата ] Ее динамическая вязкость при стандартных условиях составляет 0,76 сП. [23] При разложении на NO 2 и воду она приобретает желтый оттенок. Она кипит при 83 °C (181 °F). Обычно его хранят в стеклянной небьющейся бутылке из янтарного стекла с двойным объемом свободного пространства для обеспечения повышения давления, но даже при соблюдении этих мер предосторожности бутылку необходимо ежемесячно продувать, чтобы сбросить давление.
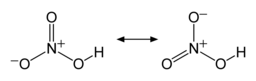
Две конечные связи N–O почти эквивалентны и относительно короткие, на 1,20 и 1,21 Å. [24] Это можно объяснить теориями резонанса ; две основные канонические формы показывают некоторый характер двойной связи в этих двух связях, делая их короче, чем одинарные связи N–O . Третья связь N–O удлинена, поскольку ее атом O связан с атомом H, [25] [26] с длиной связи 1,41 Å в газовой фазе. [24] Молекула слегка апланарна ( плоскости NO 2 и NOH наклонены друг относительно друга на 2°), и существует ограниченное вращение вокруг одинарной связи N–OH. [6] [27]
Азотная кислота обычно считается сильной кислотой при комнатной температуре. Существуют некоторые разногласия относительно значения константы диссоциации кислоты, хотя значение p K a обычно указывается как меньшее −1. Это означает, что азотная кислота в разбавленном растворе полностью диссоциирует, за исключением чрезвычайно кислых растворов. Значение p K a возрастает до 1 при температуре 250 °C. [28]
Азотная кислота может действовать как основание по отношению к такой кислоте, как серная кислота :
Ион нитрония , [NO 2 ] + , является активным реагентом в реакциях ароматического нитрования . Поскольку азотная кислота обладает как кислотными, так и основными свойствами, она может подвергаться реакции автопротолиза, аналогичной самоионизации воды :
Азотная кислота реагирует с большинством металлов, но детали зависят от концентрации кислоты и природы металла. Разбавленная азотная кислота ведет себя как типичная кислота в своей реакции с большинством металлов. Магний , марганец и цинк выделяют H2 :
Азотная кислота может окислять неактивные металлы, такие как медь и серебро . С этими неактивными или менее электроположительными металлами продукты зависят от температуры и концентрации кислоты. Например, медь реагирует с разбавленной азотной кислотой при комнатной температуре со стехиометрией 3:8:
Образующийся оксид азота может реагировать с кислородом воздуха, давая диоксид азота . При более концентрированной азотной кислоте диоксид азота образуется непосредственно в реакции со стехиометрией 1:4:
При реакции с азотной кислотой большинство металлов дают соответствующие нитраты . Некоторые металлоиды и металлы дают оксиды ; например, Sn , As , Sb и Ti окисляются до SnO 2 , As 2 O 5 , Sb 2 O 5 и TiO 2 соответственно. [29]
Некоторые драгоценные металлы , такие как чистое золото и металлы платиновой группы, не реагируют с азотной кислотой, хотя чистое золото реагирует с царской водкой , смесью концентрированной азотной кислоты и соляной кислоты . Однако некоторые менее благородные металлы ( Ag , Cu , ...), присутствующие в некоторых золотых сплавах, относительно бедных золотом, таких как цветное золото, могут легко окисляться и растворяться азотной кислотой, что приводит к изменению цвета поверхности золотого сплава. Азотная кислота используется как дешевое средство в ювелирных магазинах для быстрого обнаружения сплавов с низким содержанием золота (<14 карат ) и быстрой оценки чистоты золота.
Будучи мощным окислителем, азотная кислота реагирует со многими неметаллическими соединениями, иногда взрывообразно. В зависимости от концентрации кислоты, температуры и используемого восстановителя конечные продукты могут быть различными. Реакция происходит со всеми металлами, за исключением ряда благородных металлов и некоторых сплавов . Как правило, окислительные реакции происходят в первую очередь с концентрированной кислотой, способствуя образованию диоксида азота ( NO 2 ). Однако мощные окислительные свойства азотной кислоты имеют термодинамическую природу, но иногда ее реакции окисления довольно кинетически неблагоприятны. Присутствие небольших количеств азотистой кислоты ( HNO 2 ) значительно увеличивает скорость реакции. [29]
Хотя хром (Cr), железо (Fe) и алюминий (Al) легко растворяются в разбавленной азотной кислоте, концентрированная кислота образует слой оксида металла, который защищает большую часть металла от дальнейшего окисления. Образование этого защитного слоя называется пассивацией . [29] Типичные концентрации пассивации составляют от 20% до 50% по объему. [30] [ необходима полная цитата ] Металлы, которые пассивируются концентрированной азотной кислотой, — это железо , кобальт , хром , никель и алюминий . [29]
Будучи сильной окисляющей кислотой , азотная кислота реагирует со многими органическими материалами, и реакции могут быть взрывоопасными. Гидроксильная группа обычно отрывает водород от органической молекулы, образуя воду, а оставшаяся нитрогруппа занимает место водорода. Нитрация органических соединений азотной кислотой является основным методом синтеза многих распространенных взрывчатых веществ, таких как нитроглицерин и тринитротолуол (ТНТ). Поскольку возможно очень много менее стабильных побочных продуктов, эти реакции должны тщательно контролироваться термически, а побочные продукты удаляться для выделения желаемого продукта.
Реакция с неметаллическими элементами, за исключением азота, кислорода, благородных газов , кремния и галогенов , кроме йода, обычно окисляет их до наивысших степеней окисления в виде кислот с образованием диоксида азота для концентрированной кислоты и оксида азота для разбавленной кислоты.
Концентрированная азотная кислота окисляет I 2 , P 4 и S 8 до HIO 3 , H 3 PO 4 и H 2 SO 4 соответственно. [29] Хотя она реагирует с графитом и аморфным углеродом, она не реагирует с алмазом; она может отделить алмаз от графита, который она окисляет. [31]
Азотная кислота реагирует с белками, образуя желтые нитрированные продукты. Эта реакция известна как ксантопротеиновая реакция . Этот тест проводится путем добавления концентрированной азотной кислоты к тестируемому веществу, а затем нагревания смеси. Если присутствуют белки, содержащие аминокислоты с ароматическими кольцами, смесь становится желтой. При добавлении основания, такого как аммиак , цвет становится оранжевым. Эти изменения цвета вызваны нитрированными ароматическими кольцами в белке. [32] [33] Ксантопротеиновая кислота образуется, когда кислота контактирует с эпителиальными клетками . Соответствующие локальные изменения цвета кожи свидетельствуют о ненадлежащих мерах предосторожности при обращении с азотной кислотой.
Промышленное производство азотной кислоты использует процесс Оствальда . Объединенные процессы Оствальда и Габера чрезвычайно эффективны, требуя только воздуха и природного газа в качестве сырья . [34]
Техническое новшество процесса Оствальда заключается в надлежащих условиях, при которых безводный аммиак сгорает до оксида азота (NO) вместо молекулярного азота ( N2 ) . [34] [35] Затем оксид азота окисляется, часто с помощью атмосферного кислорода , до диоксида азота ( NO2 ):
Затем диоксид диспропорционирует в воде на азотную кислоту и исходный оксид азота:
Суммарная реакция представляет собой максимальное окисление аммиака:
Растворенные оксиды азота либо удаляются (в случае белой дымящейся азотной кислоты), либо остаются в растворе, образуя красную дымящуюся азотную кислоту .
Коммерческие растворы азотной кислоты обычно содержат от 52% до 68% азотной кислоты по массе, что является максимальной перегоняемой концентрацией . Дальнейшее обезвоживание до 98% может быть достигнуто с помощью концентрированной H2SO4 . [34] [36] Исторически более высокие концентрации кислоты также производились путем растворения дополнительного диоксида азота в кислоте, но последний завод в Соединенных Штатах прекратил использовать этот процесс в 2012 году. [ 36]
Совсем недавно были разработаны электрохимические методы получения безводной кислоты из концентрированного азотнокислого сырья. [37]
Лабораторные синтезы азотной кислоты изобилуют. Большинство черпают вдохновение из промышленных технологий.
Большое количество нитратных солей вступают в реакцию обмена с серной кислотой ( H2SO4 ) , например, нитрат натрия :
Затем перегонка при температуре кипения азотной кислоты 83 °C отделяет твердый остаток металлической соли. [26] Полученный кислотный раствор представляет собой 68,5% азеотроп и может быть дополнительно сконцентрирован (как в промышленности) либо серной кислотой , либо нитратом магния . [36]
Альтернативно, термическое разложение нитрата меди(II) дает диоксид азота и кислород; затем их пропускают через воду или перекись водорода [38], как в процессе Оствальда:

Основное промышленное применение азотной кислоты — производство удобрений . Азотная кислота нейтрализуется аммиаком для получения нитрата аммония . Это применение потребляет 75–80% из 26 миллионов тонн, производимых ежегодно (1987). Другие основные применения — производство взрывчатых веществ, прекурсоров нейлона и специальных органических соединений. [39]
В органическом синтезе , промышленном и ином, нитрогруппа является универсальной функциональной группой . Смесь азотной и серной кислот вводит нитрозаместитель в различные ароматические соединения путем электрофильного ароматического замещения . Многие взрывчатые вещества, такие как ТНТ , готовятся таким образом:
Избыток воды поглощается либо концентрированной серной кислотой, либо олеумом.
Нитрогруппу можно восстановить до аминогруппы , что позволяет синтезировать анилиновые соединения из различных нитробензолов :
Предшественник нейлона , адипиновая кислота , производится в больших масштабах путем окисления «масла КА» — смеси циклогексанона и циклогексанола — азотной кислотой. [39]
Азотная кислота использовалась в различных формах в качестве окислителя в жидкотопливных ракетах . Эти формы включают красную дымящуюся азотную кислоту, белую дымящуюся азотную кислоту, смеси с серной кислотой и эти формы с ингибитором HF. [40] IRFNA (ингибированная красная дымящаяся азотная кислота ) была одним из трех жидких топливных компонентов для ракеты BOMARC . [41]
Азотную кислоту можно использовать для преобразования металлов в окисленные формы, например, для преобразования металлической меди в нитрат меди . Ее также можно использовать в сочетании с соляной кислотой в качестве царской водки для растворения благородных металлов, таких как золото (как золотохлористоводородная кислота ). Эти соли можно использовать для очистки золота и других металлов свыше 99,9% чистоты с помощью процессов перекристаллизации и селективного осаждения . Ее способность селективно растворять определенные металлы или быть растворителем для многих солей металлов делает ее полезной в процессах разделения золота .
При элементном анализе методами ИСП-МС , ИСП-АЭС , ГФАА и пламенной АА разбавленная азотная кислота (0,5–5,0%) используется в качестве матричного соединения для определения следов металлов в растворах. [42] Для такого определения требуется сверхчистая кислота для определения следов металлов, поскольку небольшие количества ионов металлов могут повлиять на результат анализа.
Он также обычно используется в процессе разложения образцов мутной воды, образцов шлама, твердых образцов, а также других типов уникальных образцов, которые требуют элементного анализа с помощью ICP-MS , ICP-OES , ICP-AES , GFAA и пламенной атомно-абсорбционной спектроскопии . Обычно эти разложения используют 50% раствор купленной HNO3 , смешанной с деионизированной водой типа 1.
В электрохимии азотная кислота используется в качестве химического легирующего агента для органических полупроводников , а также в процессах очистки сырых углеродных нанотрубок .
В низкой концентрации (приблизительно 10%) азотная кислота часто используется для искусственного старения сосны и клена . Получаемый цвет — серо-золотистый, очень похожий на очень старую древесину, обработанную воском или маслом ( отделка древесины ). [43]
Коррозионное воздействие азотной кислоты используется в некоторых специальных приложениях, таких как травление в печатном деле, травление нержавеющей стали или очистка кремниевых пластин в электронике. [44]
Раствор азотной кислоты, воды и спирта, нитал , используется для травления металлов с целью выявления микроструктуры. ISO 14104 является одним из стандартов, подробно описывающих эту хорошо известную процедуру. [45]
Азотная кислота используется либо в сочетании с соляной кислотой, либо отдельно для очистки покровных стекол и предметных стекол для микроскопических приложений высокого класса. [46] Она также используется для очистки стекла перед серебрением при изготовлении серебряных зеркал. [47]
Коммерчески доступные водные смеси 5–30% азотной кислоты и 15–40% фосфорной кислоты обычно используются для очистки пищевого и молочного оборудования, в первую очередь для удаления осажденных соединений кальция и магния (либо осажденных из технологического потока, либо в результате использования жесткой воды во время производства и очистки). Содержание фосфорной кислоты помогает пассивировать ферросплавы от коррозии разбавленной азотной кислотой. [ необходима цитата ]
Азотную кислоту можно использовать в качестве точечного теста на алкалоиды, такие как ЛСД , давая различные цвета в зависимости от алкалоида. [48]
Азотная кислота играет ключевую роль в PUREX и других методах переработки ядерного топлива , где она может растворять множество различных актинидов . Полученные нитраты преобразуются в различные комплексы, которые могут реагировать и извлекаться селективно для отделения металлов друг от друга.
Азотная кислота является едкой кислотой и мощным окислителем . Основная опасность, которую она представляет, — химические ожоги , поскольку она осуществляет кислотный гидролиз с белками ( амид ) и жирами ( эстер ), что впоследствии разлагает живую ткань (например, кожу и плоть ). Концентрированная азотная кислота окрашивает кожу человека в желтый цвет из-за ее реакции с кератином . Эти желтые пятна становятся оранжевыми при нейтрализации. [49] Системные эффекты маловероятны, и это вещество не считается канцерогеном или мутагеном. [50]
Стандартная первая помощь при попадании кислоты на кожу, как и при попадании других едких веществ, заключается в промывании большим количеством воды. Промывание продолжается не менее 10–15 минут, чтобы охладить ткани вокруг ожога кислотой и предотвратить вторичное повреждение. Загрязненную одежду немедленно снимают, а кожу под ней тщательно промывают.
Будучи сильным окислителем, азотная кислота может бурно реагировать со многими соединениями.
Азотная кислота является одним из наиболее распространенных типов кислот, используемых при кислотных атаках . [51]