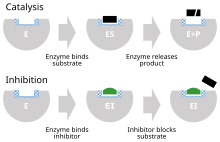
Ингибитор фермента — это молекула , которая связывается с ферментом и блокирует его активность . Ферменты — это белки , которые ускоряют химические реакции, необходимые для жизни , в которых молекулы субстрата превращаются в продукты . [1] Фермент облегчает определенную химическую реакцию, связывая субстрат со своим активным сайтом , специализированной областью на ферменте, которая ускоряет наиболее сложный этап реакции .
Ингибитор фермента останавливает («ингибирует») этот процесс, либо связываясь с активным сайтом фермента (тем самым предотвращая связывание самого субстрата), либо связываясь с другим сайтом на ферменте, так что катализ ферментом реакции блокируется. Ингибиторы фермента могут связываться обратимо или необратимо. Необратимые ингибиторы образуют химическую связь с ферментом таким образом, что фермент ингибируется до тех пор, пока химическая связь не будет разорвана. Напротив, обратимые ингибиторы связываются нековалентно и могут спонтанно покидать фермент, позволяя ферменту возобновить свою функцию. Обратимые ингибиторы производят различные типы ингибирования в зависимости от того, связываются ли они с ферментом, комплексом фермент-субстрат или и тем, и другим.
Ингибиторы ферментов играют важную роль во всех клетках, поскольку они, как правило, специфичны для одного фермента и служат для контроля активности этого фермента. Например, ферменты в метаболическом пути могут быть ингибированы молекулами, произведенными позже в пути, тем самым сокращая производство молекул, которые больше не нужны. Этот тип отрицательной обратной связи является важным способом поддержания баланса в клетке . [2] Ингибиторы ферментов также контролируют основные ферменты, такие как протеазы или нуклеазы, которые, если их не контролировать, могут повредить клетку. Многие яды , вырабатываемые животными или растениями, являются ингибиторами ферментов, которые блокируют активность важнейших ферментов у добычи или хищников .
Многие молекулы лекарственных препаратов являются ингибиторами ферментов, которые подавляют аберрантный человеческий фермент или фермент, критически важный для выживания патогена, такого как вирус , бактерия или паразит . Примерами являются метотрексат (используемый в химиотерапии и при лечении ревматического артрита ) и ингибиторы протеазы, используемые для лечения ВИЧ/СПИДа . Поскольку ингибиторы против патогенов обычно нацелены только на один фермент, такие препараты являются высокоспецифичными и , как правило, вызывают мало побочных эффектов у людей, при условии, что у людей не обнаружено аналогичного фермента. (Это часто так, поскольку такие патогены и люди генетически далеки . ) Лекарственные ингибиторы ферментов часто имеют низкие константы диссоциации , что означает, что для ингибирования фермента требуется лишь незначительное количество ингибитора. Низкая концентрация ингибитора фермента снижает риск повреждения печени и почек и других побочных реакций на лекарства у людей. Следовательно, открытие и совершенствование ингибиторов ферментов является активной областью исследований в области биохимии и фармакологии .
Ингибиторы ферментов представляют собой химически разнообразный набор веществ, размеры которых варьируются от небольших органических молекул до макромолекулярных белков .
Маломолекулярные ингибиторы включают основные первичные метаболиты , которые ингибируют ферменты, вырабатывающие эти метаболиты. Это обеспечивает отрицательную обратную связь, которая предотвращает избыточное производство метаболитов и, таким образом, поддерживает клеточный гомеостаз (устойчивые внутренние условия). [3] [2] Маломолекулярные ингибиторы ферментов также включают вторичные метаболиты , которые не являются необходимыми для организма, который их вырабатывает, но обеспечивают организму эволюционное преимущество, поскольку их можно использовать для отпугивания хищников или конкурирующих организмов или для иммобилизации добычи. [4] Кроме того, многие препараты являются ингибиторами ферментов малых молекул, которые нацелены либо на ферменты, модифицирующие болезнь у пациента [1] : 5 , либо на ферменты у патогенов, которые необходимы для роста и размножения патогена. [5]
Помимо малых молекул, некоторые белки действуют как ингибиторы ферментов. Наиболее ярким примером являются серпины (ингибиторы сериновой протеазы ) , которые вырабатываются животными для защиты от ненадлежащей активации ферментов и растениями для предотвращения хищничества. [6] Другой класс белков-ингибиторов — это ингибиторы рибонуклеазы , которые связываются с рибонуклеазами в одном из самых тесных известных белок-белковых взаимодействий . [7] Особым случаем ингибиторов белковых ферментов являются зимогены , которые содержат аутоингибиторный N-концевой пептид, который связывается с активным сайтом фермента, что внутримолекулярно блокирует его активность в качестве защитного механизма против неконтролируемого катализа. N-концевой пептид отщепляется (расщепляется) от предшественника фермента зимогена другим ферментом, чтобы высвободить активный фермент. [8]
Место связывания ингибиторов на ферментах чаще всего является тем же местом, которое связывает субстрат фермента . Эти ингибиторы активного центра известны как ортостерические («регулярная» ориентация) ингибиторы. [9] Механизм ортостерического ингибирования заключается просто в предотвращении связывания субстрата с ферментом посредством прямой конкуренции, что в свою очередь не позволяет ферменту катализировать превращение субстратов в продукты. В качестве альтернативы ингибитор может связываться с сайтом, удаленным от активного центра фермента. Они известны как аллостерические («альтернативная» ориентация) ингибиторы. [9] Механизмы аллостерического ингибирования разнообразны и включают изменение конформации (формы) фермента таким образом, что он больше не может связывать субстрат ( кинетически неотличимо от конкурентного ортостерического ингибирования) [10] или альтернативно стабилизируют связывание субстрата с ферментом, но фиксируют фермент в конформации, которая больше не является каталитически активной. [11]
Обратимые ингибиторы присоединяются к ферментам с помощью нековалентных взаимодействий, таких как водородные связи , гидрофобные взаимодействия и ионные связи . [12] Множественные слабые связи между ингибитором и активным центром фермента объединяются, образуя прочное и специфическое связывание.
В отличие от необратимых ингибиторов, обратимые ингибиторы обычно не вступают в химические реакции при связывании с ферментом и могут быть легко удалены путем разбавления или диализа . Особый случай — ковалентные обратимые ингибиторы , которые образуют химическую связь с ферментом, но связь может быть расщеплена, поэтому ингибирование полностью обратимо. [13]
Обратимые ингибиторы обычно подразделяются на четыре типа, как это было введено Клеландом в 1963 году. [14] Они классифицируются в соответствии с влиянием ингибитора на V max (максимальную скорость реакции, катализируемой ферментом) и K m (концентрацию субстрата, приводящую к половине максимальной активности фермента), поскольку концентрация субстрата фермента варьируется. [15] [16]
При конкурентном ингибировании субстрат и ингибитор не могут связываться с ферментом одновременно. [17] : 134 Обычно это происходит из-за того, что ингибитор имеет сродство к активному центру фермента, с которым также связывается субстрат; субстрат и ингибитор конкурируют за доступ к активному центру фермента. Этот тип ингибирования можно преодолеть с помощью достаточно высоких концентраций субстрата ( V max остается постоянным), т. е. путем вытеснения ингибитора. [17] : 134–135 Однако кажущаяся K m будет увеличиваться, поскольку для достижения точки K m требуется более высокая концентрация субстрата , или половина V max . Конкурентные ингибиторы часто похожи по структуре на реальный субстрат (см., например, рисунок «метотрексат против фолата» в разделе «Лекарственные препараты»). [17] : 134
При неконкурентном ингибировании ингибитор связывается только с комплексом фермент-субстрат. [17] : 139 Этот тип ингибирования приводит к снижению V max (максимальная скорость снижается в результате удаления активированного комплекса) и снижению K m (из-за лучшей эффективности связывания в результате принципа Ле Шателье и эффективного устранения комплекса ES, что снижает K m , что указывает на более высокую аффинность связывания). [18] Неконкурентное ингибирование встречается редко. [17] : 139 [19]
При неконкурентном ингибировании связывание ингибитора с ферментом снижает его активность , но не влияет на связывание субстрата. [16] Этот тип ингибитора связывается с равным сродством как со свободным ферментом, так и с комплексом фермент-субстрат. Его можно рассматривать как обладающего способностью конкурентного и неконкурентного ингибитора, но без предпочтения к какому-либо типу. В результате степень ингибирования зависит только от концентрации ингибитора. V max уменьшится из-за невозможности реакции протекать столь же эффективно, но K m останется прежним, поскольку фактическое связывание субстрата, по определению, все еще будет функционировать должным образом. [20]
При смешанном ингибировании ингибитор может связываться с ферментом независимо от того, связался ли субстрат уже. Следовательно, смешанное ингибирование представляет собой комбинацию конкурентного и неконкурентного ингибирования. [16] Кроме того, сродство ингибитора к свободному ферменту и комплексу фермент-субстрат может различаться. [17] : 136–139 При увеличении концентрации субстрата [S] этот тип ингибирования может быть уменьшен (из-за конкурентного вклада), но не полностью преодолен (из-за неконкурентного компонента). [21] : 381–382 Хотя ингибиторы смешанного типа могут связываться в активном центре, этот тип ингибирования обычно является результатом аллостерического эффекта, когда ингибитор связывается с другим сайтом на ферменте. Связывание ингибитора с этим аллостерическим сайтом изменяет конформацию (то есть третичную структуру или трехмерную форму) фермента, так что сродство субстрата к активному центру уменьшается. [22]
Эти четыре типа ингибирования также можно различить по влиянию увеличения концентрации субстрата [S] на степень ингибирования, вызванного данным количеством ингибитора. Для конкурентного ингибирования степень ингибирования уменьшается при увеличении [S], для неконкурентного ингибирования степень ингибирования не меняется, а для неконкурентного (также называемого антиконкурентным) ингибирования степень ингибирования увеличивается с [S]. [23]
Обратимое ингибирование можно количественно описать в терминах связывания ингибитора с ферментом и с комплексом фермент-субстрат, а также его влияния на кинетические константы фермента. [24] : 6 В классической схеме Михаэлиса-Ментен (показанной на схеме «механизм ингибирования») фермент (E) связывается со своим субстратом (S) с образованием комплекса фермент-субстрат ES. При катализе этот комплекс распадается с высвобождением продукта P и свободного фермента. [24] : 55 Ингибитор (I) может связываться либо с E, либо с ES с константами диссоциации Ki или Ki ' соответственно. [24] : 87
Когда фермент имеет несколько субстратов, ингибиторы могут демонстрировать различные типы ингибирования в зависимости от того, какой субстрат рассматривается. Это происходит из-за того, что активный сайт содержит два различных сайта связывания в пределах активного сайта, по одному для каждого субстрата. Например, ингибитор может конкурировать с субстратом A за первый сайт связывания, но быть неконкурентным ингибитором по отношению к субстрату B во втором сайте связывания. [26]
Традиционно обратимые ингибиторы ферментов классифицируются как конкурентные, неконкурентные или неконкурентные в соответствии с их влиянием на K m и V max . [14] Эти три типа ингибирования возникают соответственно из-за связывания ингибитора только с ферментом E в отсутствие субстрата S, с комплексом фермент-субстрат ES или с обоими. Разделение этих классов возникает из-за проблемы в их выводе и приводит к необходимости использовать две различные константы связывания для одного события связывания. [27] Далее предполагается, что связывание ингибитора с ферментом приводит к 100% ингибированию и не учитывает возможность частичного ингибирования. [27] Общая форма ингибирующего термина также скрывает связь между связыванием ингибитора с ферментом и его связью с любым другим термином связывания, будь то уравнение Михаэлиса-Ментен или кривая доза-ответ, связанная со связыванием лиганда-рецептора. Чтобы продемонстрировать эту связь, можно сделать следующую перегруппировку: [28]
Эта перегруппировка показывает, что подобно уравнению Михаэлиса–Ментен максимальная скорость реакции зависит от доли популяции фермента, взаимодействующей со своим субстратом.
доля популяции ферментов, связанная с субстратом
часть популяции ферментов, связанная ингибитором
эффект ингибитора является результатом процента популяции фермента, взаимодействующего с ингибитором. Единственная проблема с этим уравнением в его нынешнем виде заключается в том, что оно предполагает абсолютное ингибирование фермента при связывании ингибитора, когда на самом деле может быть широкий диапазон эффектов от 100% ингибирования оборота субстрата до отсутствия ингибирования. Чтобы учесть это, уравнение можно легко модифицировать, чтобы допустить различные степени ингибирования, включив термин delta V max . [29] : 361
или
Этот термин затем может определять остаточную ферментативную активность, присутствующую, когда ингибитор взаимодействует с отдельными ферментами в популяции. Однако включение этого термина имеет дополнительную ценность, позволяя возможность активации, если вторичный термин V max оказывается выше начального термина. Чтобы учесть также возможность активации, обозначение затем можно переписать, заменив ингибитор "I" на модификаторный термин (стимулятор или ингибитор), обозначенный здесь как "X". [28] : eq 13
Хотя эта терминология приводит к упрощенному способу рассмотрения кинетических эффектов, связанных с максимальной скоростью уравнения Михаэлиса-Ментен, она подчеркивает потенциальные проблемы с термином, используемым для описания эффектов, связанных с K m . K m , относящийся к сродству фермента к субстрату, должен в большинстве случаев относиться к потенциальным изменениям в сайте связывания фермента, которые будут напрямую результатом взаимодействий ингибиторов фермента. Как таковой термин, аналогичный термину delta V max , предложенному выше для модуляции V max , должен быть уместен в большинстве ситуаций: [28] : eq 14
![Двумерные графики концентрации 1/[S] (ось x) и 1/V (ось y), демонстрирующие, что при изменении концентрации ингибитора линии конкурентных ингибиторов пересекаются в одной точке на оси y, неконкурентных ингибиторов пересекаются на оси x, а смешанных ингибиторов пересекают точку, которая не находится ни на одной из осей.](http://upload.wikimedia.org/wikipedia/commons/thumb/b/ba/Inhibition_diagrams-1-.png/220px-Inhibition_diagrams-1-.png)
Ингибитор фермента характеризуется константой диссоциации K i , концентрацией, при которой ингибитор занимает половину фермента. При неконкурентном ингибировании ингибитор также может связываться с комплексом фермент-субстрат, а присутствие связанного субстрата может изменить сродство ингибитора к ферменту, что приводит к второй константе диссоциации K i '. Следовательно, K i и K i ' являются константами диссоциации ингибитора для фермента и для комплекса фермент-субстрат соответственно. [30] : Глоссарий Константу фермент-ингибитора K i можно измерить напрямую различными методами; одним из особенно точных методов является изотермическая титрационная калориметрия , при которой ингибитор титруется в раствор фермента и измеряется выделяющееся или поглощаемое тепло. [31] Однако другую константу диссоциации K i ' трудно измерить напрямую, поскольку комплекс фермент-субстрат недолговечен и претерпевает химическую реакцию с образованием продукта. Следовательно, K i ' обычно измеряется косвенно, путем наблюдения за активностью фермента при различных концентрациях субстрата и ингибитора и подгонки данных с помощью нелинейной регрессии [32] к модифицированному уравнению Михаэлиса-Ментен . [21]
где модифицирующие факторы α и α' определяются концентрацией ингибитора и его двумя константами диссоциации
Таким образом, в присутствии ингибитора эффективные K m и V max фермента становятся (α/α') K m и (1/α') V max , соответственно. Однако модифицированное уравнение Михаэлиса-Ментен предполагает, что связывание ингибитора с ферментом достигло равновесия, что может быть очень медленным процессом для ингибиторов с субнаномолярными константами диссоциации. В этих случаях ингибирование становится фактически необратимым, поэтому более практично рассматривать такие прочно связывающиеся ингибиторы как необратимые (см. ниже).
Эффекты различных типов обратимых ингибиторов ферментов на ферментативную активность можно визуализировать с помощью графических представлений уравнения Михаэлиса–Ментена, таких как графики Лайнуивера–Берка , Иди–Хофсти или Хейнса–Вульфа . [17] : 140–144 Иллюстрацией служат три графика Лайнуивера–Берка, изображенные на рисунке диаграмм Лайнуивера–Берка . На верхней диаграмме линии конкурентного ингибирования пересекаются на оси y , что свидетельствует о том, что такие ингибиторы не влияют на V max . На нижней диаграмме линии неконкурентного ингибирования пересекаются на оси x , что свидетельствует о том, что эти ингибиторы не влияют на K m . Однако, поскольку точно оценить K i и K i ' по таким графикам может быть сложно, [33] целесообразно оценивать эти константы с помощью более надежных методов нелинейной регрессии. [33]
Механизм частично конкурентного ингибирования аналогичен механизму неконкурентного, за исключением того, что комплекс EIS имеет каталитическую активность, которая может быть ниже или даже выше (частично конкурентная активация), чем у комплекса фермент-субстрат (ES). Это ингибирование обычно показывает более низкое значение V max , но неизмененное значение K m . [18]
Ингибирование субстрата или продукта происходит, когда субстрат или продукт фермента также действуют как ингибитор. Это ингибирование может следовать конкурентным, неконкурентным или смешанным моделям. При ингибировании субстрата происходит прогрессивное снижение активности при высоких концентрациях субстрата, потенциально из-за фермента, имеющего два конкурирующих участка связывания субстрата. При низком уровне субстрата участок с высоким сродством занят, и следует нормальная кинетика . Однако при более высоких концентрациях второй участок ингибирования становится занятым, ингибируя фермент. [34] Ингибирование продукта (либо собственного продукта фермента, либо продукта фермента ниже по течению в его метаболическом пути) часто является регуляторной функцией метаболизма и может быть формой отрицательной обратной связи . [2]
Медленно-жесткое ингибирование происходит, когда исходный комплекс фермента-ингибитора EI претерпевает конформационную изомерию (изменение формы) во второй более прочно удерживаемый комплекс EI*, но общий процесс ингибирования обратим. Это проявляется в медленном увеличении ингибирования фермента. В этих условиях традиционная кинетика Михаэлиса-Ментен дает ложное значение для K i , которое зависит от времени. Истинное значение K i может быть получено посредством более сложного анализа констант скорости on ( k on ) и off ( k off ) для ассоциации ингибитора с кинетикой, аналогичной необратимому ингибированию . [17] : 168
Мультисубстратные аналоговые ингибиторы являются селективными ингибиторами с высоким сродством, которые могут быть получены для ферментов, катализирующих реакции с более чем одним субстратом, путем захвата энергии связи каждого из этих субстратов в одну молекулу. [35] [36] Например, в реакциях переноса формила биосинтеза пурина мощный мультисубстратный ингибитор аддукта (MAI) к глицинамидрибонуклеотидной (GAR) ТФазе был получен синтетически путем связывания аналогов субстрата GAR и кофактора N-10-формилтетрагидрофолата вместе для получения тиоглицинамидрибонуклеотиддидеазафолата (TGDDF), [37] или ферментативно из природного субстрата GAR для получения GDDF. [38] Здесь субнаномолярная константа диссоциации (KD) TGDDF была больше, чем предполагалось, предположительно из-за полученных энтропийных преимуществ и/или положительных взаимодействий, приобретенных через атомы, связывающие компоненты. Также было замечено, что MAIs продуцируются в клетках в результате реакций пролекарств, таких как изониазид [39] или лигандов ингибиторов ферментов (например, PTC124 ) [40] с клеточными кофакторами, такими как никотинамидадениндинуклеотид (НАДН) и аденозинтрифосфат (АТФ) соответственно. [41]
Поскольку ферменты эволюционировали, чтобы прочно связывать свои субстраты, и большинство обратимых ингибиторов связываются в активном центре ферментов, неудивительно, что некоторые из этих ингибиторов поразительно похожи по структуре на субстраты своих мишеней. Ингибиторы дигидрофолатредуктазы ( DHFR) являются яркими примерами. [42] Другими примерами этих субстратных имитаторов являются ингибиторы протеазы , терапевтически эффективный класс антиретровирусных препаратов, используемых для лечения ВИЧ/СПИДа . [43] [44] Структура ритонавира , пептидомиметического (пептидного имитатора) ингибитора протеазы, содержащего три пептидные связи , как показано на рисунке «конкурентное ингибирование» выше. Поскольку этот препарат напоминает пептид, который является субстратом протеазы ВИЧ, он конкурирует с субстратом в активном центре фермента. [45]
Ингибиторы ферментов часто разрабатываются для имитации переходного состояния или промежуточного продукта реакции, катализируемой ферментом. [46] Это гарантирует, что ингибитор использует эффект стабилизации переходного состояния фермента, что приводит к лучшему сродству связывания (более низкому Ki ) , чем конструкции на основе субстрата. Примером такого ингибитора переходного состояния является противовирусный препарат осельтамивир ; этот препарат имитирует плоскую природу кольцевого иона оксония в реакции вирусного фермента нейраминидазы . [47]
Однако не все ингибиторы основаны на структурах субстратов. Например, структура другого ингибитора протеазы ВИЧ типранавира не основана на пептиде и не имеет очевидного структурного сходства с белковым субстратом. Эти непептидные ингибиторы могут быть более стабильными, чем ингибиторы, содержащие пептидные связи, поскольку они не будут субстратами для пептидаз и с меньшей вероятностью будут деградировать. [48]
При разработке лекарств важно учитывать концентрации субстратов, которым подвергаются целевые ферменты. Например, некоторые ингибиторы протеинкиназы имеют химические структуры, которые похожи на АТФ, один из субстратов этих ферментов. [49] Однако, препараты, которые являются простыми конкурентными ингибиторами, должны будут конкурировать с высокими концентрациями АТФ в клетке. Протеинкиназы также могут быть ингибированы конкуренцией в местах связывания, где киназы взаимодействуют со своими субстратными белками, и большинство белков присутствуют внутри клеток в концентрациях, намного меньших, чем концентрация АТФ. Как следствие, если два ингибитора протеинкиназы оба связываются в активном центре с аналогичной аффинностью, но только один должен конкурировать с АТФ, то конкурентный ингибитор в месте связывания белка будет ингибировать фермент более эффективно. [50]
Необратимые ингибиторы ковалентно связываются с ферментом, и поэтому этот тип ингибирования не может быть легко отменен. [51] Необратимые ингибиторы часто содержат реактивные функциональные группы, такие как азотистые иприты , альдегиды , галогеналканы , алкены , акцепторы Михаэля , фенилсульфонаты или фторфосфонаты . [52] Эти электрофильные группы реагируют с боковыми цепями аминокислот с образованием ковалентных аддуктов . [51] Модифицированными остатками являются те, боковые цепи которых содержат нуклеофилы, такие как гидроксильные или сульфгидрильные группы; к ним относятся аминокислоты серин (который реагирует с DFP , см. схему «Реакция DFP»), а также цистеин , треонин или тирозин . [53]
Необратимое ингибирование отличается от необратимой инактивации фермента. [54] Необратимые ингибиторы, как правило, специфичны для одного класса ферментов и не инактивируют все белки; они действуют не путем разрушения структуры белка , а путем специфического изменения активного центра своей цели. Например, экстремальные значения pH или температуры обычно вызывают денатурацию всей структуры белка, но это неспецифический эффект. Аналогично, некоторые неспецифические химические обработки разрушают структуру белка: например, нагревание в концентрированной соляной кислоте гидролизует пептидные связи, удерживающие белки вместе, высвобождая свободные аминокислоты. [55]
Необратимые ингибиторы демонстрируют зависящее от времени ингибирование, и поэтому их эффективность не может быть охарактеризована значением IC 50. Это связано с тем, что количество активного фермента при данной концентрации необратимого ингибитора будет различным в зависимости от того, как долго ингибитор предварительно инкубировался с ферментом. Вместо этого используются значения k obs /[ I ], [56] где k obs — наблюдаемая скорость инактивации псевдопервого порядка (полученная путем построения графика логарифма % активности в зависимости от времени), а [ I ] — концентрация ингибитора. Параметр k obs /[ I ] действителен до тех пор, пока ингибитор не насыщает связывание с ферментом (в этом случае k obs = k inact ), где k inact — скорость инактивации.
Необратимые ингибиторы сначала образуют обратимый нековалентный комплекс с ферментом (EI или ESI). Затем между ферментом и ингибитором происходит химическая реакция с образованием ковалентно модифицированного «тупикового комплекса» EI* (необратимый ковалентный комплекс). Скорость, с которой образуется EI*, называется скоростью инактивации или k inact . [13] Поскольку образование EI может конкурировать с ES, связывание необратимых ингибиторов может быть предотвращено конкуренцией либо с субстратом, либо со вторым, обратимым ингибитором. Этот защитный эффект является хорошим доказательством специфической реакции необратимого ингибитора с активным сайтом.
Этапы связывания и инактивации этой реакции исследуются путем инкубации фермента с ингибитором и анализа количества активности, остающейся с течением времени. Активность будет уменьшаться в зависимости от времени, обычно после экспоненциального спада . Подгонка этих данных под уравнение скорости дает скорость инактивации при этой концентрации ингибитора. Это делается при нескольких различных концентрациях ингибитора. Если задействован обратимый комплекс EI, скорость инактивации будет насыщаемой, и подгонка этой кривой даст k inact и K i . [57]
Другим методом, который широко используется в этих анализах, является масс-спектрометрия . Здесь точное измерение массы немодифицированного нативного фермента и инактивированного фермента дает увеличение массы, вызванное реакцией с ингибитором, и показывает стехиометрию реакции. [58] Обычно это делается с помощью масс-спектрометра MALDI-TOF . [59] В дополнительной методике пептидный масс-фингерпринтинг включает переваривание нативного и модифицированного белка протеазой, такой как трипсин . Это даст набор пептидов , которые можно проанализировать с помощью масс-спектрометра. Пептид, который изменит массу после реакции с ингибитором, будет тем, который содержит сайт модификации. [60]
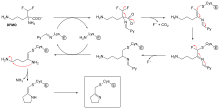
Не все необратимые ингибиторы образуют ковалентные аддукты со своими ферментными мишенями. Некоторые обратимые ингибиторы связываются с ферментом-мишенью настолько прочно, что они по сути необратимы. Эти прочно связывающиеся ингибиторы могут демонстрировать кинетику, похожую на ковалентные необратимые ингибиторы. В этих случаях некоторые из этих ингибиторов быстро связываются с ферментом в комплексе EI с низким сродством, а затем он подвергается более медленной перестройке в очень прочно связанный комплекс EI* (см. схему «механизм необратимого ингибирования»). Такое кинетическое поведение называется медленным связыванием. [62] Эта медленная перестройка после связывания часто включает в себя конформационное изменение , поскольку фермент «зажимает» молекулу ингибитора. Примерами медленно связывающихся ингибиторов являются некоторые важные препараты, такие как метотрексат , [63] аллопуринол , [64] и активированная форма ацикловира . [65]
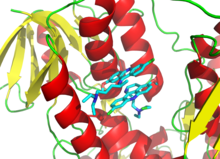
Диизопропилфторфосфат (DFP) является примером необратимого ингибитора протеазы (см. схему «реакция DFP»). Фермент гидролизует связь фосфора и фтора, но остаток фосфата остается связанным с серином в активном центре , дезактивируя его. [67] Аналогично, DFP также реагирует с активным центром ацетилхолинэстеразы в синапсах нейронов и, следовательно, является мощным нейротоксином со смертельной дозой менее 100 мг. [68]
Суицидное торможение — необычный тип необратимого торможения, при котором фермент преобразует ингибитор в реактивную форму в своем активном центре. [69] Примером является ингибитор биосинтеза полиаминов , α-дифторметилорнитин (DFMO), который является аналогом аминокислоты орнитина и используется для лечения африканского трипаносомоза (сонной болезни). Орнитиндекарбоксилаза может катализировать декарбоксилирование DFMO вместо орнитина (см. схему «Механизм ингибитора DFMO»). Однако за этой реакцией декарбоксилирования следует устранение атома фтора, который преобразует этот каталитический промежуточный продукт в сопряженный имин , высокоэлектрофильный вид. Затем эта реактивная форма DFMO реагирует либо с остатком цистеина, либо с остатком лизина в активном центре, необратимо инактивируя фермент. [61]
Поскольку необратимое ингибирование часто включает начальное образование нековалентного комплекса ингибитора фермента (EI), [13] иногда ингибитор может связываться с ферментом более чем одним способом. Например, на рисунке, показывающем трипанотионредуктазу из простейшего паразита человека Trypanosoma cruzi , две молекулы ингибитора, называемого хинакрином ипритом , связаны в его активном центре. Верхняя молекула связана обратимо, но нижняя связана ковалентно, поскольку она прореагировала с аминокислотным остатком через свою азотную ипритную группу. [70]
Ингибиторы ферментов встречаются в природе [71] , а также производятся искусственно в лабораторных условиях. [72] Ингибиторы ферментов естественного происхождения регулируют многие метаболические процессы и необходимы для жизни. [3] [1] Кроме того, естественным образом производимые яды часто являются ингибиторами ферментов, которые эволюционировали для использования в качестве токсичных агентов против хищников, добычи и конкурирующих организмов. [4] Эти природные токсины включают некоторые из самых ядовитых веществ, известных. [73] Искусственные ингибиторы часто используются в качестве лекарств, но также могут быть инсектицидами, такими как малатион , гербицидами, такими как глифосат , [74] или дезинфицирующими средствами , такими как триклозан . Другие искусственные ингибиторы ферментов блокируют ацетилхолинэстеразу , фермент, который расщепляет ацетилхолин , и используются в качестве нервно-паралитических агентов в химической войне . [75]
Ингибирование ферментов является общей чертой контроля метаболических путей в клетках. [3] Метаболический поток через путь часто регулируется метаболитами пути, действующими как ингибиторы и усилители для ферментов в этом же пути. Гликолитический путь является классическим примером. [76] Этот катаболический путь потребляет глюкозу и производит АТФ , НАДН и пируват . Ключевым шагом для регуляции гликолиза является ранняя реакция в пути, катализируемая фосфофруктокиназой-1 (PFK1). Когда уровень АТФ повышается, АТФ связывает аллостерический сайт в PFK1, чтобы снизить скорость ферментативной реакции; гликолиз ингибируется, и продукция АТФ падает. Этот контроль отрицательной обратной связи помогает поддерживать постоянную концентрацию АТФ в клетке. Однако метаболические пути регулируются не только посредством ингибирования, поскольку активация ферментов не менее важна. Что касается PFK1, фруктозо-2,6-бисфосфат и АДФ являются примерами метаболитов, которые являются аллостерическими активаторами. [77]
Физиологическое ингибирование ферментов также может быть вызвано специфическими ингибиторами белков. Этот механизм происходит в поджелудочной железе , которая синтезирует множество пищеварительных ферментов-предшественников, известных как зимогены . Многие из них активируются трипсиновой протеазой, поэтому важно ингибировать активность трипсина в поджелудочной железе, чтобы предотвратить самопереваривание органа. Одним из способов контроля активности трипсина является выработка специфического и мощного белка- ингибитора трипсина в поджелудочной железе. Этот ингибитор прочно связывается с трипсином, предотвращая активность трипсина, которая в противном случае была бы пагубной для органа. [78] Хотя ингибитор трипсина является белком, он избегает гидролиза в качестве субстрата протеазой, исключая воду из активного центра трипсина и дестабилизируя переходное состояние. [79] Другие примеры физиологических белков-ингибиторов ферментов включают ингибитор барстара бактериальной рибонуклеазы барназы . [80]

Животные и растения эволюционировали, чтобы синтезировать широкий спектр ядовитых продуктов, включая вторичные метаболиты , [81] пептиды и белки [82], которые могут действовать как ингибиторы. Природные токсины, как правило, представляют собой небольшие органические молекулы и настолько разнообразны, что, вероятно, существуют естественные ингибиторы для большинства метаболических процессов. [83] Метаболические процессы, на которые направлены природные яды, охватывают не только ферменты в метаболических путях и могут также включать ингибирование функций рецепторов, каналов и структурных белков в клетке. Например, паклитаксел (таксол), органическая молекула, обнаруженная в тихоокеанском тисе , прочно связывается с димерами тубулина и ингибирует их сборку в микротрубочки в цитоскелете . [84]
Многие природные яды действуют как нейротоксины , которые могут вызывать паралич, приводящий к смерти, и функционируют для защиты от хищников или при охоте и захвате добычи. Некоторые из этих природных ингибиторов, [85] несмотря на их токсичные свойства, ценны для терапевтического использования в более низких дозах. [86] Примером нейротоксина являются гликоалкалоиды из видов растений семейства пасленовых (включая картофель , томат и баклажан ), которые являются ингибиторами ацетилхолинэстеразы . Ингибирование этого фермента вызывает неконтролируемое увеличение нейротрансмиттера ацетилхолина, мышечный паралич и затем смерть. Нейротоксичность также может быть результатом ингибирования рецепторов; например, атропин из смертельно опасного паслена ( Atropa belladonna ), который функционирует как конкурентный антагонист мускариновых ацетилхолиновых рецепторов . [87]
Хотя многие природные токсины являются вторичными метаболитами, эти яды также включают пептиды и белки. Примером токсичного пептида является альфа-аманитин , который содержится в родственниках гриба бледной поганки . Это мощный ингибитор фермента, в данном случае предотвращающий транскрипцию ДНК ферментом РНК-полимеразой II . [88] Водорослевый токсин микроцистин также является пептидом и является ингибитором протеинфосфатаз . [89] Этот токсин может загрязнять водные ресурсы после цветения водорослей и является известным канцерогеном, который также может вызывать острое кровоизлияние в печень и смерть при более высоких дозах. [90]
Белки также могут быть естественными ядами или антинутриентами , такими как ингибиторы трипсина (обсуждаемые в разделе «метаболическая регуляция» выше), которые содержатся в некоторых бобовых . [91] Менее распространенный класс токсинов — токсичные ферменты: они действуют как необратимые ингибиторы своих целевых ферментов и работают путем химической модификации своих субстратных ферментов. Примером является рицин , чрезвычайно мощный белковый токсин, содержащийся в бобах касторового масла . [92] Этот фермент представляет собой гликозидазу , которая инактивирует рибосомы. [93] Поскольку рицин является каталитическим необратимым ингибитором, это позволяет всего одной молекуле рицина убить клетку. [94]


Наиболее распространенное применение ингибиторов ферментов — это лекарства для лечения болезней. Многие из этих ингибиторов нацелены на человеческий фермент и направлены на исправление патологического состояния. Например, аспирин — широко используемый препарат, который действует как ингибитор самоубийства фермента циклооксигеназы . [95] Это ингибирование, в свою очередь, подавляет выработку провоспалительных простагландинов , и поэтому аспирин может использоваться для уменьшения боли, лихорадки и воспаления. [95]
По состоянию на 2017 год, [update]по оценкам, 29% одобренных препаратов являются ингибиторами ферментов [96], из которых примерно одна пятая является ингибиторами киназы . [96] Известный класс мишеней киназных препаратов — это рецепторные тирозинкиназы , которые являются важными ферментами, регулирующими рост клеток ; их чрезмерная активация может привести к раку. Поэтому ингибиторы киназ, такие как иматиниб, часто используются для лечения злокачественных новообразований. [97] Янус-киназы — еще один известный пример мишеней лекарственных ферментов. Ингибиторы Янус-киназы блокируют выработку воспалительных цитокинов , и поэтому эти ингибиторы используются для лечения различных воспалительных заболеваний , включая артрит , астму и болезнь Крона . [98]
Пример структурного сходства некоторых ингибиторов с субстратами ферментов, на которые они нацелены, можно увидеть на рисунке, сравнивающем препарат метотрексат с фолиевой кислотой . Фолиевая кислота является окисленной формой субстрата дигидрофолатредуктазы , фермента, который сильно ингибируется метотрексатом. Метотрексат блокирует действие дигидрофолатредуктазы и тем самым останавливает биосинтез тимидина . [42] Этот блок биосинтеза нуклеотидов избирательно токсичен для быстрорастущих клеток, поэтому метотрексат часто используется в химиотерапии рака. [99]
Распространенным средством лечения эректильной дисфункции является силденафил (Виагра). [100] Это соединение является мощным ингибитором цГМФ-специфической фосфодиэстеразы типа 5 , фермента, который разрушает сигнальную молекулу циклического гуанозинмонофосфата . [101] Эта сигнальная молекула вызывает расслабление гладких мышц и обеспечивает приток крови в пещеристое тело , что вызывает эрекцию. Поскольку препарат снижает активность фермента, который останавливает сигнал, он заставляет этот сигнал длиться в течение более длительного периода времени.
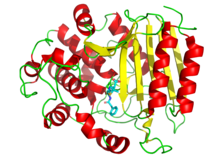
Лекарства также используются для ингибирования ферментов, необходимых для выживания патогенов. Например, бактерии окружены толстой клеточной стенкой, состоящей из сетчатого полимера, называемого пептидогликаном . Многие антибиотики , такие как пенициллин и ванкомицин, ингибируют ферменты, которые производят и затем сшивают нити этого полимера вместе. [102] [103] Это приводит к тому, что клеточная стенка теряет прочность, и бактерии лопаются. На рисунке молекула пенициллина (показана в форме шара и палочки) показана связанной со своей целью, транспептидазой из бактерий Streptomyces R61 (белок показан в виде ленточной диаграммы ).
Разработка антибиотиков облегчается, когда фермент, необходимый для выживания патогена, отсутствует или сильно отличается у людей. [104] Люди не вырабатывают пептидогликан, поэтому антибиотики, которые подавляют этот процесс, избирательно токсичны для бактерий. [105] Избирательная токсичность также возникает у антибиотиков, использующих различия в структуре рибосом у бактерий, [106] или в том, как они вырабатывают жирные кислоты . [107]
Препараты, которые ингибируют ферменты, необходимые для репликации вирусов, эффективны при лечении вирусных инфекций. [108] Противовирусные препараты включают ингибиторы протеазы, используемые для лечения ВИЧ/СПИДа [109] и гепатита С , [110] ингибиторы обратной транскриптазы, нацеленные на ВИЧ/СПИД, [111] ингибиторы нейраминидазы, нацеленные на грипп , [112] и ингибиторы терминазы, нацеленные на цитомегаловирус человека . [113]
Многие пестициды являются ингибиторами ферментов. [114] Ацетилхолинэстераза (АХЭ) — это фермент, обнаруженный у животных, от насекомых до людей. Он необходим для функционирования нервных клеток благодаря своему механизму расщепления нейротрансмиттера ацетилхолина на его составляющие, ацетат и холин . [115] Это несколько необычно для нейротрансмиттеров, поскольку большинство из них, включая серотонин , дофамин и норадреналин , поглощаются из синаптической щели , а не расщепляются. Большое количество ингибиторов АХЭ используется как в медицине, так и в сельском хозяйстве. [116] Обратимые конкурентные ингибиторы, такие как эдрофоний , физостигмин и неостигмин , используются при лечении миастении [117] и при анестезии для устранения мышечной блокады. [118] Карбаматные пестициды также являются примерами обратимых ингибиторов АХЭ. Фосфорорганические пестициды , такие как малатион , паратион и хлорпирифос , необратимо ингибируют ацетилхолинэстеразу. [119]
Гербицид глифосат является ингибитором 3-фосфошикимат 1-карбоксивинилтрансферазы , [120] другие гербициды, такие как сульфонилмочевины , ингибируют фермент ацетолактатсинтазу . [121] Оба фермента необходимы растениям для производства аминокислот с разветвленной цепью . Многие другие ферменты ингибируются гербицидами, включая ферменты, необходимые для биосинтеза липидов и каротиноидов , а также процессов фотосинтеза и окислительного фосфорилирования . [122]

Новые лекарства являются продуктами длительного процесса разработки лекарств , первым шагом которого часто является открытие нового ингибитора фермента. [123] Существует два основных подхода к открытию этих ингибиторов. [124]
Первый общий метод — рациональный дизайн лекарств, основанный на имитации переходного состояния химической реакции, катализируемой ферментом. [125] Спроектированный ингибитор часто очень похож на субстрат, за исключением того, что часть субстрата, которая подвергается химической реакции, заменяется химически стабильной функциональной группой , которая напоминает переходное состояние. Поскольку фермент эволюционировал, чтобы стабилизировать переходное состояние, аналоги переходного состояния обычно обладают более высоким сродством к ферменту по сравнению с субстратом и, следовательно, являются эффективными ингибиторами. [46]
Вторым способом обнаружения новых ингибиторов ферментов является высокопроизводительный скрининг больших библиотек структурно разнообразных соединений для идентификации молекул-хитов, которые связываются с ферментом. Этот метод был расширен, чтобы включить виртуальный скрининг баз данных разнообразных молекул с использованием компьютеров, [126] [127] которые затем сопровождаются экспериментальным подтверждением связывания виртуальных хитов скрининга. [128] Дополнительные подходы, которые могут предоставить новые отправные точки для ингибиторов, включают в себя открытие лидов на основе фрагментов [129] и ДНК-кодированные химические библиотеки (DEL). [130]
Хиты из любого из вышеперечисленных подходов могут быть оптимизированы для связывающих веществ с высоким сродством, которые эффективно ингибируют фермент. [131] Компьютерные методы прогнозирования ориентации связывания и сродства ингибитора к ферменту, такие как молекулярная стыковка [132] и молекулярная механика, могут использоваться для содействия процессу оптимизации. [133] Новые ингибиторы используются для получения кристаллографических структур фермента в комплексе ингибитор/фермент, чтобы показать, как молекула связывается с активным сайтом, что позволяет вносить изменения в ингибитор для оптимизации связывания в процессе, известном как дизайн лекарственного средства на основе структуры . [1] : 66 Этот цикл тестирования и улучшения повторяется до тех пор, пока не будет получен достаточно мощный ингибитор.
В некоторых случаях ингибитор может связываться с отдельным сайтом на ферменте, который находится в аллостерической связи с субстратсвязывающим карманом. Во многих случаях аллостерические, субстратсвязывающие соединения приводят к конформационным изменениям фермента, которые изменяют способность фермента связывать субстрат.
объясняется как химический процесс, включающий несколько явлений, таких как агрегация, диссоциация на субъединицы или денатурация (конформационные изменения), которые происходят одновременно во время инактивации определенного фермента.
Рисунок 1C: Клинический успех привилегированных классов семейств белков (% одобренных препаратов, нацеленных на каждый целевой класс): редуктаза 7,62, киназа 5,94, протеаза 3,35, гидролаза 2,76, NPTаза 2,09, трансфераза 1,92, лиаза 1,59, изомераза 1,51, фосфодиэстераза 1,50, цитохром p450 0,84, эпигенетический ластик 0,33, общее количество ферментных целей одобренных препаратов = 29,45%
Глава 10.2.1: Ингибиторы ацетолактатсинтазы сульфонилмочевины