
В химии амины ( / ə ˈ m iː n , ˈ æ m iː n / , [1] [2] Великобритания также / ˈ eɪ m iː n / [3] ) представляют собой соединения и функциональные группы , которые содержат основной атом азота с неподеленной парой . Формально амины являются производными аммиака ( NH 3 ), в которых один или несколько атомов водорода были заменены заместителем, таким как алкильная или арильная группа [4] (они могут быть соответственно названы алкиламинами и ариламинами; амины, в которых оба типа заместителей присоединены к одному атому азота , могут быть названы алкилариламинами). Важные амины включают аминокислоты , биогенные амины , триметиламин и анилин . Неорганические производные аммиака также называются аминами, такими как монохлорамин ( NClH 2 ). [5]
Заместитель −NH 2 называется аминогруппой. [6]
Химическое обозначение аминов содержит букву «R», где «R» — это не элемент, а «R-группа», что означает «остальная часть молекулы», и в аминах это может быть один атом водорода или углерода, а также углеводородная цепь.
Соединения с атомом азота , присоединенным к карбонильной группе , имеющие таким образом структуру R−C(=O)−NR′R″ , называются амидами и обладают химическими свойствами, отличными от аминов.
Амины можно классифицировать по природе и количеству заместителей на азоте . Алифатические амины содержат только заместители H и алкил. Ароматические амины имеют атом азота, связанный с ароматическим кольцом.
Амины, как алкильные, так и арильные, подразделяются на три подкатегории (см. таблицу) в зависимости от числа атомов углерода, смежных с азотом (сколько атомов водорода молекулы аммиака заменены углеводородными группами): [6] [7]
Четвертая подкатегория определяется связностью заместителей, присоединенных к азоту:
Также возможно наличие четырех органических заместителей на азоте. Эти виды не являются аминами, но являются четвертичными аммониевыми катионами и имеют заряженный азотный центр. Четвертичные аммониевые соли существуют со многими видами анионов .
Амины называют несколькими способами. Обычно соединению присваивают префикс «амино-» или суффикс «-амин». Префикс « N- » показывает замещение на атоме азота. Органическое соединение с несколькими аминогруппами называется диамином , триамином , тетраамином и так далее.
Низшие амины называются суффиксом -амин .

Высшие амины имеют префикс амино в качестве функциональной группы. Однако ИЮПАК не рекомендует эту конвенцию, [8] а предпочитает форму алканамина, например, бутан-2-амин.

Водородные связи существенно влияют на свойства первичных и вторичных аминов. Например, метил- и этиламины при стандартных условиях являются газами, тогда как соответствующие им метиловый и этиловый спирты являются жидкостями. Амины обладают характерным запахом аммиака, жидкие амины имеют характерный «рыбный» и неприятный запах.
Атом азота имеет неподеленную электронную пару , которая может связывать H + с образованием иона аммония R 3 NH + . Неподеленная электронная пара представлена в этой статье двумя точками над или рядом с N. Растворимость в воде простых аминов повышается за счет водородных связей с участием этих неподеленных электронных пар. Обычно соли аммониевых соединений демонстрируют следующий порядок растворимости в воде: первичный аммоний ( RNH+
3) > вторичный аммоний ( R
2Нью-Гэмпшир+
2) > третичный аммоний (R 3 NH + ). Небольшие алифатические амины демонстрируют значительную растворимость во многих растворителях , тогда как амины с большими заместителями являются липофильными. Ароматические амины, такие как анилин , имеют свои неподеленные пары электронов, сопряженные с бензольным кольцом, поэтому их тенденция к образованию водородных связей снижена. Их температуры кипения высоки, а растворимость в воде низкая.
Обычно наличие функциональной аминогруппы выводится с помощью комбинации методов, включая масс-спектрометрию, а также ЯМР и ИК-спектроскопию. Сигналы ЯМР 1 H для аминов исчезают при обработке образца D 2 O. В их инфракрасном спектре первичные амины демонстрируют две полосы NH, тогда как вторичные амины демонстрируют только одну. [6] В их ИК-спектрах первичные и вторичные амины демонстрируют отличительные полосы растяжения NH около 3300 см -1 . Несколько менее отличительными являются полосы, появляющиеся ниже 1600 см -1 , которые слабее и перекрываются с модами CC и CH. В случае пропиламина ножничная мода HNH появляется около 1600 см -1 , растяжение CN около 1000 см -1 , а изгиб R 2 N-H около 810 см -1 . [9]

Алкиламины характеризуются тетраэдрическими азотными центрами. Углы CNC и CNH приближаются к идеализированному углу 109°. Расстояния CN немного короче расстояний CC. Энергетический барьер для инверсии азота стереоцентра составляет около 7 ккал/моль для триалкиламина. Взаимопревращение сравнивают с инверсией раскрытого зонтика в сильный ветер.
Амины типа NHRR' и NRR′R″ являются хиральными : азотный центр несет четыре заместителя, считая неподеленную пару. Из-за низкого барьера инверсии амины типа NHRR' не могут быть получены в оптической чистоте. Для хиральных третичных аминов NRR′R″ может быть разделен только тогда, когда группы R, R' и R″ ограничены в циклических структурах, таких как N -замещенные азиридины ( четвертичные аммониевые соли разделяются).
В ароматических аминах («анилинах») азот часто почти плоский из-за сопряжения неподеленной пары с арильным заместителем. Расстояние CN соответственно короче. В анилине расстояние CN такое же, как и расстояния CC. [10]
Подобно аммиаку, амины являются основаниями . [11] По сравнению с гидроксидами щелочных металлов амины слабее.
Основность аминов зависит от:
Из-за индуктивных эффектов можно ожидать, что основность амина будет увеличиваться с числом алкильных групп в амине. Корреляции усложняются из-за эффектов сольватации, которые противоположны тенденциям для индуктивных эффектов. Эффекты сольватации также доминируют над основностью ароматических аминов (анилинов). Для анилинов неподеленная пара электронов на азоте делокализована в кольцо, что приводит к снижению основности. Заместители в ароматическом кольце и их положения относительно аминогруппы также влияют на основность, как показано в таблице.
Сольватация существенно влияет на основность аминов. Группы NH сильно взаимодействуют с водой, особенно в ионах аммония. Следовательно, основность аммиака увеличивается в 10 11 раз за счет сольватации. Собственная основность аминов, т. е. ситуация, когда сольватация не важна, была оценена в газовой фазе. В газовой фазе амины проявляют основности, предсказанные из эффектов высвобождения электронов органическими заместителями. Таким образом, третичные амины более основные, чем вторичные амины, которые более основные, чем первичные амины, и, наконец, аммиак является наименее основным. Порядок pK b (основности в воде) не следует этому порядку. Аналогично анилин более основной, чем аммиак в газовой фазе, но в десять тысяч раз менее в водном растворе. [14]
В апротонных полярных растворителях, таких как ДМСО , ДМФА и ацетонитрил, энергия сольватации не так высока, как в протонных полярных растворителях, таких как вода и метанол. По этой причине основность аминов в этих апротонных растворителях почти исключительно регулируется электронными эффектами.
Промышленно значимые алкиламины получают из аммиака путем алкилирования спиртами: [5]
В отличие от реакции аминов со спиртами реакция аминов и аммиака с алкилгалогенидами используется для синтеза в лаборатории:
В таких реакциях, которые более полезны для алкилиодидов и бромидов, степень алкилирования трудно контролировать, поэтому получаются смеси первичных, вторичных и третичных аминов, а также четвертичных аммониевых солей. [5]
Селективность может быть улучшена с помощью реакции Делепина , хотя она редко применяется в промышленных масштабах. Селективность также обеспечивается в синтезе Габриэля , который включает реакцию органогалогенида с фталимидом калия .
Арилгалогениды гораздо менее реакционноспособны по отношению к аминам и по этой причине более контролируемы. Популярным способом получения ариламинов является реакция Бухвальда-Хартвига .
Дизамещенные алкены реагируют с HCN в присутствии сильных кислот, образуя формамиды, которые могут быть декарбонилированы. Этот метод, реакция Риттера , используется в промышленности для получения третичных аминов, таких как трет-октиламин. [5]
Широко практикуется также гидроаминирование алкенов. Реакция катализируется твердыми кислотами на основе цеолита . [5]
В процессе гидрирования ненасыщенные N-содержащие функциональные группы восстанавливаются до аминов с использованием водорода в присутствии никелевого катализатора. Подходящие группы включают нитрилы , азиды , имины , включая оксимы , амиды и нитро . В случае нитрилов реакции чувствительны к кислотным или щелочным условиям, которые могут вызвать гидролиз группы −CN . LiAlH 4 чаще используется для восстановления этих же групп в лабораторных масштабах.
Многие амины получают из альдегидов и кетонов путем восстановительного аминирования , которое может протекать как каталитически, так и стехиометрически.
Анилин ( C 6 H 5 NH 2 ) и его производные получают восстановлением нитроароматических соединений. В промышленности водород является предпочтительным восстановителем, тогда как в лаборатории часто используют олово и железо.
Существует множество методов получения аминов, многие из которых довольно специализированы.
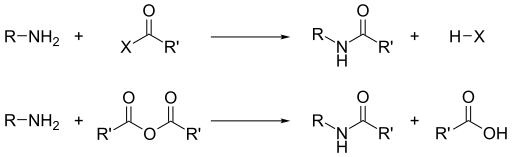
Помимо их основности, доминирующей реакционной способностью аминов является их нуклеофильность . [16] Большинство первичных аминов являются хорошими лигандами для ионов металлов, образуя координационные комплексы . Амины алкилируются алкилгалогенидами. Ацилхлориды и ангидриды кислот реагируют с первичными и вторичными аминами, образуя амиды (« реакция Шоттена-Баумана »).
Аналогично, с сульфонилхлоридами получают сульфонамиды . Это превращение, известное как реакция Хинсберга , является химическим тестом на наличие аминов.
Поскольку амины являются основными, они нейтрализуют кислоты , образуя соответствующие аммониевые соли R 3 NH + . Образуясь из карбоновых кислот и первичных и вторичных аминов, эти соли термически дегидратируются, образуя соответствующие амиды .
Амины подвергаются сульфамированию при обработке триоксидом серы или его источниками:
Амины реагируют с азотистой кислотой , давая соли диазония. Алкилдиазониевые соли не имеют большого значения, поскольку они слишком нестабильны. Наиболее важными членами являются производные ароматических аминов, таких как анилин («фениламин») (A = арил или нафтил):
Анилины и нафтиламины образуют более стабильные соли диазония , которые могут быть выделены в кристаллической форме. [17] Соли диазония подвергаются различным полезным превращениям, включающим замену группы N 2 анионами. Например, цианид меди дает соответствующие нитрилы:
Арилдиазонии соединяются с богатыми электронами ароматическими соединениями, такими как фенол, образуя азосоединения . Такие реакции широко применяются для производства красителей. [18]
Образование имина является важной реакцией. Первичные амины реагируют с кетонами и альдегидами , образуя имины . В случае формальдегида (R' = H) эти продукты обычно существуют в виде циклических тримеров : Восстановление этих иминов дает вторичные амины:
Аналогично вторичные амины реагируют с кетонами и альдегидами с образованием енаминов :
Ионы ртути обратимо окисляют третичные амины с α- водородом до иминиевых ионов: [19]
Обзор реакций аминов приведен ниже:
Амины повсеместно распространены в биологии. Распад аминокислот высвобождает амины, как это было в случае с разлагающейся рыбой, которая пахнет триметиламином . Многие нейротрансмиттеры являются аминами, включая адреналин , норадреналин , дофамин , серотонин и гистамин . Протонированные аминогруппы ( –NH+
3) являются наиболее распространенными положительно заряженными группами в белках , особенно в аминокислоте лизине . [20] Анионная полимерная ДНК обычно связана с различными белками, богатыми аминами. [21] Кроме того, терминальный заряженный первичный аммоний на лизине образует солевые мостики с карбоксилатными группами других аминокислот в полипептидах , что является одним из основных факторов, влияющих на трехмерную структуру белков. [22]
Гормоны, полученные путем модификации аминокислот, называются аминовыми гормонами. Обычно исходная структура аминокислоты изменяется таким образом, что удаляется –COOH, или карбоксильная группа, тогда как –NH+
3, или аминогруппа, остается. Аминовые гормоны синтезируются из аминокислот триптофана или тирозина . [23]
Первичные ароматические амины используются в качестве исходного материала для производства азокрасителей . Он реагирует с азотистой кислотой, образуя соль диазония, которая может вступать в реакцию сочетания с образованием азосоединения. Поскольку азосоединения сильно окрашены, они широко используются в красильной промышленности, такой как:
Большинство лекарственных препаратов и кандидатов на лекарственные препараты содержат функциональные аминогруппы: [24]
Водный моноэтаноламин (MEA), дигликольамин (DGA), диэтаноламин (DEA), диизопропаноламин (DIPA) и метилдиэтаноламин (MDEA) широко используются в промышленности для удаления диоксида углерода (CO2 ) и сероводорода (H2S ) из природного газа и технологических потоков нефтеперерабатывающих заводов. Они также могут использоваться для удаления CO2 из газов сгорания и дымовых газов и могут иметь потенциал для снижения выбросов парниковых газов . Сопутствующие процессы известны как очистка от серы . [26]
Амины часто используются в качестве отвердителей эпоксидных смол. [27] [28] К ним относятся диметилэтиламин , циклогексиламин и различные диамины, такие как 4,4-диаминодициклогексилметан. [5] Многофункциональные амины, такие как тетраэтиленпентамин и триэтилентетрамин , также широко используются в этом качестве. [29] Реакция протекает за счет неподеленной пары электронов азота амина, атакующей самый внешний углерод на оксирановом кольце эпоксидной смолы. Это снимает напряжение кольца на эпоксиде и является движущей силой реакции. [30] Молекулы с функциональностью третичного амина часто используются для ускорения реакции отверждения эпокси-амина и включают такие вещества, как 2,4,6-трис(диметиламинометил)фенол . Было заявлено, что это наиболее широко используемый ускоритель при комнатной температуре для двухкомпонентных систем эпоксидных смол. [31] [32]
Низкомолекулярные простые амины, такие как этиламин , являются лишь слаботоксичными с LD 50 между 100 и 1000 мг/кг. Они являются раздражителями кожи, особенно потому, что некоторые из них легко впитываются через кожу. [5] Амины представляют собой широкий класс соединений, и более сложные члены класса могут быть чрезвычайно биоактивными, например, стрихнин .