В многоклеточных организмах стволовые клетки представляют собой недифференцированные или частично дифференцированные клетки , которые могут изменяться в различные типы клеток и размножаться неограниченно, чтобы производить больше тех же самых стволовых клеток. Они являются самым ранним типом клеток в клеточной линии . [1] Они встречаются как в эмбриональных , так и во взрослых организмах, но в каждом из них они обладают немного разными свойствами. Обычно их отличают от клеток-предшественников , которые не могут делиться неограниченно, и клеток -предшественников или бластных клеток, которые обычно стремятся дифференцироваться в один тип клеток.
У млекопитающих примерно от 50 до 150 клеток составляют внутреннюю клеточную массу на стадии бластоцисты эмбрионального развития , примерно на 5–14 день. Они обладают способностью стволовых клеток. In vivo они в конечном итоге дифференцируются во все типы клеток организма (делая их плюрипотентными ). Этот процесс начинается с дифференциации в три зародышевых слоя — эктодерму , мезодерму и энтодерму — на стадии гаструляции . Однако, когда их выделяют и культивируют in vitro , их можно сохранить на стадии стволовых клеток, и они известны как эмбриональные стволовые клетки (ЭСК).
Взрослые стволовые клетки находятся в нескольких избранных местах в организме, известных как ниши , например, в костном мозге или гонадах . Они существуют для восполнения быстро утраченных типов клеток и являются мультипотентными или унипотентными, то есть они дифференцируются только в несколько типов клеток или один тип клеток. У млекопитающих они включают, среди прочего, гемопоэтические стволовые клетки , которые пополняют клетки крови и иммунные клетки, базальные клетки , которые поддерживают эпителий кожи , и мезенхимальные стволовые клетки , которые поддерживают клетки костей, хрящей , мышц и жира. Взрослые стволовые клетки составляют небольшое меньшинство клеток; их значительно превосходят по численности клетки-предшественники и окончательно дифференцированные клетки, в которые они дифференцируются. [1]
Исследования стволовых клеток выросли из открытий канадских биологов Эрнеста Маккалока , Джеймса Тилла и Эндрю Дж. Беккера из Университета Торонто и Института рака Онтарио в 1960-х годах. [2] [3] По состоянию на 2016 год [обновлять]единственной установленной медицинской терапией с использованием стволовых клеток является трансплантация гемопоэтических стволовых клеток , [4] впервые выполненная в 1958 году французским онкологом Жоржем Мате . Однако с 1998 года стало возможным культивировать и дифференцировать эмбриональные стволовые клетки человека (в линиях стволовых клеток ). Процесс выделения этих клеток был спорным , поскольку он обычно приводит к разрушению эмбриона. Источники для выделения эмбриональных стволовых клеток были ограничены в некоторых европейских странах и Канаде, но другие, такие как Великобритания и Китай, продвигали исследования. [5] Перенос ядра соматической клетки — это метод клонирования , который можно использовать для создания клонированного эмбриона для использования его эмбриональных стволовых клеток в терапии стволовыми клетками. [6] В 2006 году японская группа под руководством Шинья Яманака открыла метод преобразования зрелых клеток тела обратно в стволовые клетки. Они были названы индуцированными плюрипотентными стволовыми клетками (iPSC). [7]
Термин «стволовая клетка» был введен Теодором Бовери и Валентином Геккером в конце 19 века. [8] Пионерские работы в области теории стволовых клеток крови были проведены в начале 20 века Артуром Паппенгеймом , Александром Максимовым , Францем Эрнстом Кристианом Нойманном . [8]
Ключевые свойства стволовой клетки были впервые определены Эрнестом Маккалоком и Джеймсом Тиллом в Университете Торонто и Институте рака Онтарио в начале 1960-х годов. Они открыли кроветворную стволовую клетку, гемопоэтическую стволовую клетку (ГСК), в ходе своей пионерской работы на мышах. Маккалок и Тилл начали серию экспериментов, в которых клетки костного мозга вводились облученным мышам. Они наблюдали уплотнения в селезенке мышей, которые были линейно пропорциональны количеству введенных клеток костного мозга. Они выдвинули гипотезу, что каждое уплотнение (колония) было клоном, возникшим из одной клетки костного мозга (стволовой клетки). В последующей работе Маккалок и Тилл, к которым присоединились аспирант Эндрю Джон Беккер и старший научный сотрудник Луис Симинович , подтвердили, что каждое уплотнение действительно возникло из одной клетки. Их результаты были опубликованы в журнале Nature в 1963 году. В том же году Симинович был ведущим исследователем в исследованиях, которые обнаружили, что колониеобразующие клетки способны к самообновлению, что является ключевым определяющим свойством стволовых клеток, которое теоретизировали Тилл и Маккалок. [9]
Первой терапией с использованием стволовых клеток была пересадка костного мозга, проведенная французским онкологом Жоржем Мате в 1956 году пяти работникам ядерного института Винча в Югославии, пострадавшим от критической аварии . Все работники выжили. [10]
В 1981 году эмбриональные стволовые клетки (ЭС) были впервые выделены и успешно культивированы с использованием мышиных бластоцист британскими биологами Мартином Эвансом и Мэтью Кауфманом . Это позволило сформировать мышиные генетические модели, систему, в которой гены мышей удаляются или изменяются для изучения их функции в патологии. В 1991 году Энн Цукамото запатентовала процесс, который позволил выделить стволовые клетки человека. К 1998 году эмбриональные стволовые клетки человека были впервые выделены американским биологом Джеймсом Томсоном , что сделало возможным появление новых методов трансплантации или различных типов клеток для тестирования новых методов лечения. В 2006 году команда Синьи Яманаки в Киото, Япония, преобразовала фибробласты в плюрипотентные стволовые клетки, изменив экспрессию всего четырех генов. Этот подвиг представляет собой происхождение индуцированных плюрипотентных стволовых клеток, известных как iPS-клетки. [7]
В 2011 году самка гривистого волка , сбитая грузовиком, прошла курс лечения стволовыми клетками в зоопарке Бразилиа. Это первый зарегистрированный случай использования стволовых клеток для лечения травм у дикого животного. [11] [12]
Классическое определение стволовой клетки требует, чтобы она обладала двумя свойствами:
Поддержание популяции стволовых клеток (предотвращение уменьшения ее размеров) обеспечивается двумя механизмами:
1. Асимметричное деление клеток : стволовая клетка делится на одну материнскую клетку, которая идентична исходной стволовой клетке, и другую дочернюю клетку, которая дифференцируется.
Когда стволовая клетка самообновляется, она делится и нарушает недифференцированное состояние. Это самообновление требует контроля клеточного цикла, а также поддержания мультипотентности или плюрипотентности, которые полностью зависят от стволовой клетки. [13]
ЧАС.
Стволовые клетки используют теломеразу , белок, который восстанавливает теломеры , для защиты своей ДНК и продления предела деления клеток ( предел Хейфлика ). [14]
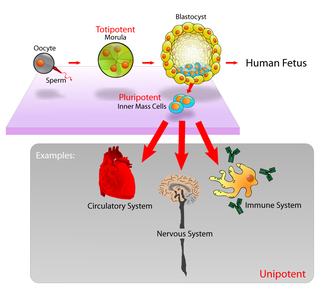

Потентность определяет потенциал дифференциации (потенциал дифференцироваться в различные типы клеток) стволовой клетки. [15]
На практике стволовые клетки идентифицируются по тому, могут ли они регенерировать ткани. Например, определяющим тестом для костного мозга или гемопоэтических стволовых клеток (ГСК) является способность трансплантировать клетки и спасти человека без ГСК. Это показывает, что клетки могут производить новые клетки крови в течение длительного времени. Также должно быть возможно изолировать стволовые клетки от трансплантированного человека, которые сами могут быть трансплантированы другому человеку без ГСК, демонстрируя, что стволовая клетка способна к самообновлению.
Свойства стволовых клеток можно проиллюстрировать in vitro , используя такие методы, как клоногенные анализы , в которых отдельные клетки оцениваются по их способности дифференцироваться и самообновляться. [18] [19] Стволовые клетки также можно выделить по наличию у них отличительного набора маркеров клеточной поверхности. Однако условия культивирования in vitro могут изменить поведение клеток, из-за чего становится неясным, будут ли клетки вести себя аналогичным образом in vivo . Ведутся серьезные споры о том, являются ли некоторые предлагаемые популяции взрослых клеток действительно стволовыми клетками. [20]
Эмбриональные стволовые клетки ( ЭСК ) — это клетки внутренней клеточной массы бластоцисты , образующиеся до имплантации в матку. [21] В эмбриональном развитии человека стадия бластоцисты достигается через 4–5 дней после оплодотворения , и в это время она состоит из 50–150 клеток. ЭСК плюрипотентны и в процессе развития дают начало всем производным трех зародышевых листков : эктодерме , энтодерме и мезодерме . Другими словами, они могут развиться в каждый из более чем 200 типов клеток взрослого организма , если им дать достаточную и необходимую стимуляцию для определенного типа клеток. Они не вносят вклад в экстраэмбриональные оболочки или в плаценту .
В ходе эмбрионального развития клетки внутренней клеточной массы непрерывно делятся и становятся более специализированными. Например, часть эктодермы в дорсальной части эмбриона специализируется как « нейрэктодерма », которая станет будущей центральной нервной системой . [22] Позже в развитии нейруляция заставляет нейроэктодерму формировать нервную трубку . На стадии нервной трубки передняя часть подвергается энцефализации, чтобы сформировать или «образовать» базовую форму мозга. На этой стадии развития основным типом клеток ЦНС считается нейральная стволовая клетка .
Нейральные стволовые клетки самообновляются и в какой-то момент переходят в радиальные глиальные клетки-предшественники (RGP). Рано сформированные RGP самообновляются путем симметричного деления, образуя резервуарную группу клеток-предшественников . Эти клетки переходят в нейрогенное состояние и начинают асимметрично делиться, производя большое разнообразие множества различных типов нейронов, каждый из которых обладает уникальной экспрессией генов, морфологическими и функциональными характеристиками. Процесс образования нейронов из радиальных глиальных клеток называется нейрогенезом . Радиальная глиальная клетка имеет отличительную биполярную морфологию с сильно удлиненными отростками, охватывающими толщину стенки нервной трубки. Она разделяет некоторые глиальные характеристики, в частности экспрессию глиального фибриллярного кислого белка (GFAP). [23] [24] Радиальная глиальная клетка является первичной нервной стволовой клеткой развивающейся ЦНС позвоночных , и ее клеточное тело находится в желудочковой зоне , рядом с развивающейся желудочковой системой . Нейральные стволовые клетки привержены нейрональным линиям ( нейронам , астроцитам и олигодендроцитам ), и поэтому их эффективность ограничена. [22]
Почти все исследования на сегодняшний день использовали мышиные эмбриональные стволовые клетки (mES) или человеческие эмбриональные стволовые клетки (hES), полученные из ранней внутренней клеточной массы. Оба обладают основными характеристиками стволовых клеток, но им требуются совершенно разные среды для поддержания недифференцированного состояния. Мышиные ES-клетки выращиваются на слое желатина в качестве внеклеточного матрикса (для поддержки) и требуют присутствия фактора ингибирования лейкемии (LIF) в сывороточной среде. Также было показано, что лекарственный коктейль, содержащий ингибиторы GSK3B и пути MAPK/ERK , называемый 2i, поддерживает плюрипотентность в культуре стволовых клеток. [25] Человеческие ESC выращиваются на питающем слое мышиных эмбриональных фибробластов и требуют присутствия основного фактора роста фибробластов (bFGF или FGF-2). [26] Без оптимальных условий культивирования или генетических манипуляций [27] эмбриональные стволовые клетки будут быстро дифференцироваться.
Человеческая эмбриональная стволовая клетка также определяется экспрессией нескольких факторов транскрипции и белков клеточной поверхности. Факторы транскрипции Oct-4 , Nanog и Sox2 образуют основную регуляторную сеть, которая обеспечивает подавление генов, которые приводят к дифференциации и поддержанию плюрипотентности. [28] Антигены клеточной поверхности, наиболее часто используемые для идентификации hES-клеток, — это гликолипиды, специфичные для стадии эмбрионального антигена 3 и 4, и кератансульфатные антигены Tra-1-60 и Tra-1-81. Молекулярное определение стволовой клетки включает в себя гораздо больше белков и продолжает оставаться темой исследований. [29]
Используя человеческие эмбриональные стволовые клетки для производства специализированных клеток, таких как нервные клетки или клетки сердца в лабораторных условиях, ученые могут получить доступ к взрослым человеческим клеткам, не беря ткани у пациентов. Затем они могут подробно изучить эти специализированные взрослые клетки, чтобы попытаться распознать осложнения заболеваний или изучить реакции клеток на предлагаемые новые лекарства.
Благодаря своим объединенным способностям неограниченного расширения и плюрипотентности эмбриональные стволовые клетки остаются теоретически потенциальным источником для регенеративной медицины и замены тканей после травм или заболеваний. [30] Однако в настоящее время нет одобренных методов лечения с использованием ЭС-клеток. Первое испытание на людях было одобрено Управлением по контролю за продуктами и лекарствами США в январе 2009 года. [31] Однако испытание на людях было начато только 13 октября 2010 года в Атланте для исследования травм спинного мозга . 14 ноября 2011 года компания, проводящая испытание ( Geron Corporation ), объявила, что прекратит дальнейшую разработку своих программ стволовых клеток. [32] Дифференциация ЭС-клеток в пригодные для использования клетки, избегая при этом отторжения трансплантата, — это лишь некоторые из препятствий, с которыми все еще сталкиваются исследователи эмбриональных стволовых клеток. [33] Эмбриональные стволовые клетки, будучи плюрипотентными, требуют определенных сигналов для правильной дифференциации — при инъекции непосредственно в другой организм ЭС-клетки будут дифференцироваться во множество различных типов клеток, вызывая тератому . Этические соображения относительно использования нерожденных человеческих тканей являются еще одной причиной отсутствия одобренных методов лечения с использованием эмбриональных стволовых клеток. Во многих странах в настоящее время действуют моратории или ограничения либо на исследования человеческих ЭС-клеток, либо на производство новых линий человеческих ЭС-клеток.

Мезенхимальные стволовые клетки (МСК) или мезенхимальные стромальные клетки, также известные как медицинские сигнальные клетки, известны своей мультипотентностью, которая может быть обнаружена во взрослых тканях, например, в мышцах, печени, костном мозге и жировой ткани. Мезенхимальные стволовые клетки обычно выполняют функцию структурной поддержки в различных органах, как упоминалось выше, и контролируют движение веществ. МСК могут дифференцироваться в многочисленные категории клеток, как иллюстрация адипоцитов, остеоцитов и хондроцитов, полученных из мезодермального слоя. [34] Где слой мезодермы обеспечивает увеличение скелетных элементов тела, таких как относящиеся к хрящу или кости. Термин «мезо» означает средний, инфузия происходит от греческого, означая, что мезенхимальные клетки способны располагаться и перемещаться в раннем эмбриональном росте между эктодермальными и энтодермальными слоями. Этот механизм помогает заполнять пространство, что является ключевым для заживления ран у взрослых организмов, которые связаны с мезенхимальными клетками в дерме (коже), костях или мышцах. [35]
Известно, что мезенхимальные стволовые клетки необходимы для регенеративной медицины. Они широко изучаются в клинических испытаниях . Поскольку они легко изолируются и получают высокий выход, высокую пластичность, что позволяет облегчить воспаление и стимулировать рост клеток, дифференцировку клеток и восстановление тканей, полученных в результате иммуномодуляции и иммуносупрессии. МСК поступают из костного мозга, что требует агрессивной процедуры, когда дело доходит до выделения количества и качества изолированной клетки, и это зависит от возраста донора. При сравнении показателей МСК в аспиратах костного мозга и строме костного мозга, аспираты, как правило, имеют более низкие показатели МСК, чем строма. МСК, как известно, неоднородны и экспрессируют высокий уровень плюрипотентных маркеров по сравнению с другими типами стволовых клеток, такими как эмбриональные стволовые клетки. [34] Инъекция МСК приводит к заживлению ран, в первую очередь, за счет стимуляции ангиогенеза. [36]
Эмбриональные стволовые клетки (ЭСК) обладают способностью делиться бесконечно, сохраняя при этом свою плюрипотентность , что становится возможным благодаря специализированным механизмам контроля клеточного цикла . [37] По сравнению с пролиферирующими соматическими клетками , ЭСК обладают уникальными характеристиками клеточного цикла, такими как быстрое деление клеток, вызванное укороченной фазой G1 , отсутствием фазы G0 и модификациями в контрольных точках клеточного цикла , что оставляет клетки в основном в фазе S в любой момент времени. [37] [38] Быстрое деление ЭСК демонстрируется их коротким временем удвоения, которое составляет от 8 до 10 часов, тогда как у соматических клеток время удвоения составляет приблизительно 20 часов или дольше. [39] По мере дифференциации клеток эти свойства изменяются: фазы G1 и G2 удлиняются, что приводит к более длительным циклам деления клеток. Это говорит о том, что определенная структура клеточного цикла может способствовать установлению плюрипотентности. [37]
В частности, поскольку фаза G1 является фазой, в которой клетки имеют повышенную чувствительность к дифференциации, укороченная фаза G1 является одной из ключевых характеристик эмбриональных стволовых клеток и играет важную роль в поддержании недифференцированного фенотипа . Хотя точный молекулярный механизм остается лишь частично понятым, несколько исследований показали понимание того, как эмбриональные стволовые клетки так быстро проходят через фазу G1 и, возможно, другие фазы. [38]
Клеточный цикл регулируется сложной сетью циклинов , циклин-зависимых киназ (Cdk), ингибиторов циклин-зависимых киназ (Cdkn), карманных белков семейства ретинобластомы (Rb) и других вспомогательных факторов. [39] Основополагающее понимание отличительной регуляции клеточного цикла эмбриональных стволовых клеток было получено в ходе исследований мышиных эмбриональных стволовых клеток (мЭСК). [38] МЭСК показали клеточный цикл с сильно сокращенной фазой G1, что позволило клеткам быстро переключаться между фазой M и фазой S. В соматическом клеточном цикле колебательная активность комплексов циклин-Cdk наблюдается в последовательном действии, которое контролирует важнейшие регуляторы клеточного цикла, вызывая однонаправленные переходы между фазами: циклин D и Cdk4/6 активны в фазе G1, в то время как циклин E и Cdk2 активны во время поздней фазы G1 и фазы S; и Циклин А и Cdk2 активны в фазе S и G2, в то время как Циклин В и Cdk1 активны в фазе G2 и M. [39] Однако в эмбриональных стволовых клетках мозга эта типично упорядоченная и колебательная активность комплексов циклин-Cdk отсутствует. Вместо этого комплекс циклин E/Cdk2 постоянно активен на протяжении всего цикла, сохраняя белок ретинобластомы (pRb) гиперфосфорилированным и, таким образом, неактивным. Это обеспечивает прямой переход из фазы M в позднюю фазу G1, что приводит к отсутствию циклинов D-типа и, следовательно, к сокращению фазы G1. [38] Активность Cdk2 имеет решающее значение как для регуляции клеточного цикла, так и для решений о судьбе клеток в эмбриональных стволовых клетках мозга; снижение активности Cdk2 продлевает прогрессирование фазы G1, устанавливает клеточный цикл, подобный соматическим клеткам, и вызывает экспрессию маркеров дифференциации. [40]
В человеческих эмбриональных стволовых клетках (hESC) продолжительность G1 резко сокращается. Это объясняется высокими уровнями мРНК генов циклина D2 и Cdk4, связанных с G1, и низкими уровнями регуляторных белков клеточного цикла, которые ингибируют прогрессирование клеточного цикла в G1, таких как p21 CipP1 , p27 Kip1 и p57 Kip2 . [37] [41] Кроме того, регуляторы активности Cdk4 и Cdk6, такие как члены семейства ингибиторов Ink (p15, p16, p18 и p19), экспрессируются на низких уровнях или вообще не экспрессируются. Таким образом, подобно mESC, hESC демонстрируют высокую активность Cdk, при этом Cdk2 демонстрирует самую высокую активность киназы. Также подобно эмбриональным стволовым клеткам мозга, эмбриональные стволовые клетки человека демонстрируют важность Cdk2 в регуляции фазы G1, показывая, что переход от G1 к S задерживается, когда активность Cdk2 ингибируется, а G1 останавливается, когда Cdk2 подавляется. [37] Однако в отличие от эмбриональных стволовых клеток мозга, эмбриональные стволовые клетки человека имеют функциональную фазу G1. В эмбриональных стволовых клетках человека показано, что активность комплексов циклин E/Cdk2 и циклин A/Cdk2 зависит от клеточного цикла, а контрольная точка Rb в G1 является функциональной. [39]
ESC также характеризуются нефункциональностью контрольной точки G1, хотя контрольная точка G1 имеет решающее значение для поддержания геномной стабильности. В ответ на повреждение ДНК ESC не останавливаются в G1 для восстановления повреждений ДНК, а вместо этого зависят от контрольных точек S и G2/M или подвергаются апоптозу. Отсутствие контрольной точки G1 в ESC позволяет удалять клетки с поврежденной ДНК, тем самым избегая потенциальных мутаций из-за неточного восстановления ДНК. [37] В соответствии с этой идеей ESC сверхчувствительны к повреждению ДНК, чтобы минимизировать мутации, передаваемые следующему поколению. [39]
Примитивные стволовые клетки, находящиеся в органах плода, называются фетальными стволовыми клетками. [42]
Существует два типа фетальных стволовых клеток:

Взрослые стволовые клетки, также называемые соматическими (от греч. σωματικóς, «тела») стволовыми клетками, представляют собой стволовые клетки, которые поддерживают и восстанавливают ткань, в которой они находятся. [44]
Известно три доступных источника аутологичных взрослых стволовых клеток человека:
Стволовые клетки также могут быть взяты из пуповинной крови сразу после рождения. Из всех типов стволовых клеток аутологичный сбор связан с наименьшим риском. По определению, аутологичные клетки получают из собственного тела, так же как можно сохранить собственную кровь для плановых хирургических процедур. [ необходима цитата ]
Плюрипотентные взрослые стволовые клетки редки и, как правило, немногочисленны, но их можно найти в пуповинной крови и других тканях. [48] Костный мозг является богатым источником взрослых стволовых клеток, [49] которые использовались при лечении нескольких состояний, включая цирроз печени, [50] хроническую ишемию конечностей [51] и терминальную стадию сердечной недостаточности. [52] Количество стволовых клеток костного мозга уменьшается с возрастом и больше у мужчин, чем у женщин в репродуктивном возрасте. [53] Большая часть исследований взрослых стволовых клеток на сегодняшний день была направлена на то, чтобы охарактеризовать их потенциал и возможности самообновления. [54] Повреждения ДНК накапливаются с возрастом как в стволовых клетках, так и в клетках, составляющих среду стволовых клеток. Считается, что это накопление отвечает, по крайней мере частично, за увеличение дисфункции стволовых клеток с возрастом (см. теорию повреждения ДНК при старении ). [55]
Большинство взрослых стволовых клеток ограничены линией ( мультипотентны ) и обычно называются по их тканевому происхождению ( мезенхимальная стволовая клетка , жировая стволовая клетка, эндотелиальная стволовая клетка , зубная пульпарная стволовая клетка и т. д.). [56] [57] Клетки Muse (мультилинейные дифференцирующиеся стрессоустойчивые клетки) — это недавно обнаруженный тип плюрипотентных стволовых клеток, обнаруженный во многих взрослых тканях, включая жировую, дермальные фибробласты и костный мозг. Хотя клетки Muse встречаются редко, их можно идентифицировать по экспрессии SSEA-3 , маркера недифференцированных стволовых клеток, и общих маркеров мезенхимальных стволовых клеток, таких как CD90, CD105 . При культивировании суспензионной культуры отдельных клеток клетки будут образовывать кластеры, которые по морфологии и экспрессии генов похожи на эмбриональные тельца, включая канонические маркеры плюрипотентности Oct4 , Sox2 и Nanog . [58]
Лечение взрослыми стволовыми клетками успешно применялось в течение многих лет для лечения лейкемии и связанных с ней видов рака костей/крови посредством трансплантации костного мозга. [59] Взрослые стволовые клетки также используются в ветеринарии для лечения травм сухожилий и связок у лошадей. [60]
Использование взрослых стволовых клеток в исследованиях и терапии не так спорно , как использование эмбриональных стволовых клеток , поскольку производство взрослых стволовых клеток не требует разрушения эмбриона . Кроме того, в случаях, когда взрослые стволовые клетки получают от предполагаемого реципиента (аутотрансплантат ) , риск отторжения по существу отсутствует. Следовательно, правительство США выделяет больше средств на исследования взрослых стволовых клеток. [61]
С ростом спроса на человеческие взрослые стволовые клетки как для исследовательских, так и для клинических целей (обычно требуется 1–5 миллионов клеток на кг веса тела для одного лечения) становится крайне важным преодолеть разрыв между необходимостью расширения клеток in vitro и возможностью использования факторов, лежащих в основе репликативного старения. Известно, что взрослые стволовые клетки имеют ограниченную продолжительность жизни in vitro и вступают в репликативное старение почти незаметно после начала культивирования in vitro. [62]
Гемопоэтические стволовые клетки (ГСК) уязвимы к повреждению ДНК и мутациям , которые увеличиваются с возрастом. [63] Эта уязвимость может объяснить повышенный риск медленно растущего рака крови (миелоидные злокачественные новообразования) у пожилых людей. [63] По-видимому, на старение ГСК влияют несколько факторов, включая реакции на выработку активных форм кислорода , которые могут вызывать повреждение ДНК и генетические мутации, а также измененное эпигенетическое профилирование. [64]
Также называемые перинатальными стволовыми клетками, эти мультипотентные стволовые клетки обнаруживаются в амниотической жидкости и пуповинной крови. Эти стволовые клетки очень активны, широко разрастаются без питателей и не являются онкогенными. Амниотические стволовые клетки мультипотентны и могут дифференцироваться в клетки адипогенных, остеогенных, миогенных, эндотелиальных, гепатических, а также нейрональных линий. [65] Амниотические стволовые клетки являются предметом активных исследований.
Использование стволовых клеток из амниотической жидкости преодолевает этические возражения против использования человеческих эмбрионов в качестве источника клеток. Римско-католическое учение запрещает использование эмбриональных стволовых клеток в экспериментах; соответственно, ватиканская газета " Osservatore Romano " назвала амниотические стволовые клетки "будущим медицины". [66]
Можно собирать амниотические стволовые клетки для доноров или для аутологичного использования: первый в США банк амниотических стволовых клеток [67] [68] был открыт в 2009 году в Медфорде, штат Массачусетс, корпорацией Biocell Center [69] [70] [71] и сотрудничает с различными больницами и университетами по всему миру. [72]
Взрослые стволовые клетки имеют ограничения по своей потенции; в отличие от эмбриональных стволовых клеток (ЭСК), они не способны дифференцироваться в клетки всех трех зародышевых слоев . Таким образом, они считаются мультипотентными .
Однако перепрограммирование позволяет создавать плюрипотентные клетки, индуцированные плюрипотентные стволовые клетки (iPSC) из взрослых клеток. Это не взрослые стволовые клетки, а соматические клетки (например, эпителиальные клетки), перепрограммированные для создания клеток с плюрипотентными возможностями. Используя генетическое перепрограммирование с белковыми факторами транскрипции , были получены плюрипотентные стволовые клетки с возможностями, подобными ESC. [73] [74] [75] Первая демонстрация индуцированных плюрипотентных стволовых клеток была проведена Шинья Яманакой и его коллегами из Киотского университета . [76] Они использовали факторы транскрипции Oct3/4 , Sox2 , c-Myc и Klf4 для репрограммирования клеток фибробластов мыши в плюрипотентные клетки. [73] [77] Последующие работы использовали эти факторы для индукции плюрипотентности в клетках фибробластов человека. [78] Джунинг Ю , Джеймс Томсон и их коллеги из Университета Висконсин-Мэдисон использовали другой набор факторов, Oct4, Sox2, Nanog и Lin28, и провели свои эксперименты с использованием клеток крайней плоти человека . [73] [79] Однако им удалось повторить открытие Яманаки о том, что индуцирование плюрипотентности в клетках человека возможно.
Индуцированные плюрипотентные стволовые клетки отличаются от эмбриональных стволовых клеток. Они имеют много схожих свойств, таких как плюрипотентность и потенциал дифференциации, экспрессия генов плюрипотентности , эпигенетические паттерны, образование эмбриональных телец и тератом , а также жизнеспособное образование химер , [76] [77] но есть много различий в этих свойствах. Хроматин iPSC, по-видимому, более «закрыт» или метилирован, чем у ESC. [76] [77] Аналогично, паттерн экспрессии генов между ESC и iPSC или даже iPSC, полученными из разных источников. [76] Таким образом, возникают вопросы о «полноте» перепрограммирования и соматической памяти индуцированных плюрипотентных стволовых клеток. Несмотря на это, индуцирование соматических клеток до плюрипотентности, по-видимому, жизнеспособно.
В результате успеха этих экспериментов Ян Уилмут , который помог создать первое клонированное животное овечку Долли , объявил, что он откажется от переноса ядра соматической клетки как от направления исследований. [80]
Способность индуцировать плюрипотентность приносит пользу разработкам в области тканевой инженерии . Обеспечивая подходящий каркас и микросреду, iPSC можно дифференцировать в клетки терапевтического применения, а также для моделей in vitro для изучения токсинов и патогенеза. [81]
Индуцированные плюрипотентные стволовые клетки обеспечивают несколько терапевтических преимуществ. Как и эмбриональные стволовые клетки, они плюрипотентны . Таким образом, они обладают большим потенциалом дифференциации; теоретически они могли бы производить любую клетку в организме человека (если бы перепрограммирование в плюрипотентность было «полным»). [76] Более того, в отличие от эмбриональных стволовых клеток, они потенциально могли бы позволить врачам создавать линию плюрипотентных стволовых клеток для каждого отдельного пациента. [82] Замороженные образцы крови могут использоваться в качестве ценного источника индуцированных плюрипотентных стволовых клеток. [83] Стволовые клетки, специфичные для пациента, позволяют проводить скрининг побочных эффектов перед медикаментозным лечением, а также снижать риск отторжения трансплантата. [82] Несмотря на их нынешнее ограниченное терапевтическое применение, iPSC имеют большой потенциал для будущего использования в медицинском лечении и исследованиях.
Ключевые факторы, контролирующие клеточный цикл, также регулируют плюрипотентность . Таким образом, манипуляция соответствующими генами может поддерживать плюрипотентность и перепрограммировать соматические клетки в индуцированное плюрипотентное состояние. [39] Однако перепрограммирование соматических клеток часто бывает малоэффективным и считается стохастическим . [84]
С идеей, что более быстрый клеточный цикл является ключевым компонентом плюрипотентности, эффективность перепрограммирования может быть улучшена. Методы улучшения плюрипотентности посредством манипуляции регуляторами клеточного цикла включают: сверхэкспрессию циклина D/Cdk4, фосфорилирование Sox2 на S39 и S253, сверхэкспрессию циклина A и циклина E, нокдаун Rb и нокдаун членов семейства Cip/Kip или семейства Ink. [39] Более того, эффективность перепрограммирования коррелирует с количеством клеточных делений, произошедших во время стохастической фазы, что предполагается растущей неэффективностью перепрограммирования старых или медленно ныряющих клеток. [85]
Линия — важная процедура для анализа развивающихся эмбрионов. Поскольку клеточные линии показывают взаимосвязь между клетками при каждом делении. Это помогает в анализе линий стволовых клеток по ходу дела, что помогает распознавать эффективность стволовых клеток, продолжительность жизни и другие факторы. С помощью техники клеточной линии мутантные гены могут быть проанализированы в клонах стволовых клеток, что может помочь в генетических путях. Эти пути могут регулировать работу стволовых клеток. [86]
Для обеспечения самообновления стволовые клетки подвергаются двум типам деления клеток (см. диаграмму деления и дифференциации стволовых клеток ). Симметричное деление дает начало двум идентичным дочерним клеткам, обе из которых наделены свойствами стволовых клеток. Асимметричное деление, с другой стороны, производит только одну стволовую клетку и клетку-предшественника с ограниченным потенциалом самообновления. Предшественники могут пройти через несколько раундов клеточного деления, прежде чем окончательно дифференцироваться в зрелую клетку. Возможно, что молекулярное различие между симметричным и асимметричным делением заключается в дифференциальной сегрегации белков клеточной мембраны (таких как рецепторы ) между дочерними клетками. [87]
Альтернативная теория заключается в том, что стволовые клетки остаются недифференцированными из-за экологических сигналов в их конкретной нише . Стволовые клетки дифференцируются, когда они покидают эту нишу или больше не получают эти сигналы. Исследования на Drosophila germarium выявили сигналы decapentaplegic и адгезивных соединений, которые не позволяют стволовым клеткам germarium дифференцироваться. [88] [89]
В Соединенных Штатах указом президента 13505 установлено, что федеральные деньги могут быть использованы для исследований, в которых используются одобренные линии человеческих эмбриональных стволовых клеток (hESC), но они не могут быть использованы для получения новых линий. [90] Руководящие принципы Национального института здравоохранения (NIH) по исследованиям человеческих стволовых клеток, вступившие в силу 7 июля 2009 года, реализовали указ президента 13505, установив критерии, которым должны соответствовать линии hESC, чтобы быть одобренными для финансирования. [91] Реестр человеческих эмбриональных стволовых клеток NIH доступен в Интернете и содержит обновленную информацию о клеточных линиях, имеющих право на финансирование NIH. [92] По состоянию на январь 2022 года имеется 486 одобренных линий. [93]
Терапия стволовыми клетками — это использование стволовых клеток для лечения или профилактики заболеваний или состояний. Трансплантация костного мозга — это форма терапии стволовыми клетками, которая используется уже много лет, поскольку ее эффективность доказана в клинических испытаниях. [94] [95] Имплантация стволовых клеток может помочь в укреплении левого желудочка сердца, а также в сохранении сердечной ткани у пациентов, которые в прошлом перенесли сердечные приступы. [96]
На протяжении более 90 лет трансплантация гемопоэтических стволовых клеток (ТГСК) использовалась для лечения людей с такими заболеваниями, как лейкемия и лимфома ; это единственная широко практикуемая форма терапии стволовыми клетками. [94] [97] [98] По состоянию на 2016 год [обновлять]единственной устоявшейся терапией с использованием стволовых клеток является трансплантация гемопоэтических стволовых клеток . [99] Обычно это происходит в форме трансплантации костного мозга , но клетки также могут быть получены из пуповинной крови . Ведутся исследования по разработке различных источников стволовых клеток, а также по применению методов лечения стволовыми клетками нейродегенеративных заболеваний [100] [101] [102] и таких состояний, как диабет и болезни сердца .
Лечение стволовыми клетками может снизить симптомы заболевания или состояния, которое лечится. Снижение симптомов может позволить пациентам сократить прием лекарств от заболевания или состояния. Лечение стволовыми клетками также может предоставить обществу знания для дальнейшего понимания стволовых клеток и будущих методов лечения. [103] Кредо врачей — не причинять вреда, и стволовые клетки делают это проще, чем когда-либо прежде. Хирургические процессы по своей природе вредны. Ткань должна быть удалена как способ достижения успешного результата. Можно предотвратить опасности хирургических вмешательств, используя стволовые клетки. Кроме того, существует вероятность заболевания, и если процедура не удалась, может потребоваться дополнительная операция. Риски, связанные с анестезией, также могут быть устранены с помощью стволовых клеток. [104] Вдобавок ко всему, стволовые клетки были собраны из тела пациента и повторно использованы там, где они нужны. Поскольку они происходят из собственного тела пациента, это называется аутологичным лечением. Аутологичные методы лечения считаются наиболее безопасными, поскольку вероятность отторжения донорского материала практически равна нулю.
Лечение стволовыми клетками может потребовать иммуносупрессии из-за необходимости облучения перед трансплантацией для удаления предыдущих клеток человека или из-за того, что иммунная система пациента может нацеливаться на стволовые клетки. Один из подходов, чтобы избежать второй возможности, заключается в использовании стволовых клеток того же пациента, который проходит лечение.
Плюрипотентность в некоторых стволовых клетках также может затруднить получение определенного типа клеток. Также сложно получить точный необходимый тип клеток, поскольку не все клетки в популяции дифференцируются единообразно. Недифференцированные клетки могут создавать ткани, отличные от желаемых типов. [105]
Некоторые стволовые клетки образуют опухоли после трансплантации; [106] плюрипотентность связана с образованием опухолей, особенно в эмбриональных стволовых клетках, собственных стволовых клетках плода, индуцированных плюрипотентных стволовых клетках. Собственные стволовые клетки плода образуют опухоли, несмотря на мультипотентность. [107]
Этические проблемы также возникают в связи с практикой использования или исследования эмбриональных стволовых клеток. Извлечение клеток из бластоцисты приводит к ее смерти. Проблема заключается в том, следует ли считать бластоцисту человеческой жизнью. [108] Дискуссия по этому вопросу в основном носит философский, а не научный характер.
Туризм с целью лечения стволовыми клетками является частью индустрии медицинского туризма , в рамках которой пациенты путешествуют для получения процедур с использованием стволовых клеток. [109]
В США произошел взрыв «клиник стволовых клеток». [110] Процедуры со стволовыми клетками очень прибыльны для клиник. Реклама звучит авторитетно, но эффективность и безопасность процедур не доказаны. Иногда у пациентов возникают осложнения, такие как опухоли позвоночника [111] и смерть. Высокая стоимость также может привести к финансовым проблемам. [111] По мнению исследователей, необходимо информировать общественность, пациентов и врачей об этой проблеме. [112]
По данным Международного общества исследований стволовых клеток , крупнейшей академической организации, выступающей за исследования стволовых клеток, методы лечения стволовыми клетками находятся в стадии разработки и пока не могут считаться доказанными. [113] [114] Врачи должны информировать пациентов о том, что клинические испытания продолжают изучать, являются ли эти методы лечения безопасными и эффективными, но что неэтичные клиники представляют их как доказанные. [115]
Некоторые из основных патентов, охватывающих человеческие эмбриональные стволовые клетки, принадлежат Исследовательскому фонду выпускников Висконсина (WARF) – это патенты 5,843,780, 6,200,806 и 7,029,913, изобретенные Джеймсом А. Томсоном . WARF не применяет эти патенты против академических ученых, но применяет их против компаний. [116]
В 2006 году запрос в Патентное ведомство США (USPTO) о пересмотре трех патентов был подан Публичным патентным фондом от имени его клиента, некоммерческой группы по надзору за патентами Consumer Watchdog (ранее Фонд по правам налогоплательщиков и потребителей). [116] В процессе пересмотра, который включает несколько раундов обсуждений между USPTO и сторонами, USPTO изначально согласилось с Consumer Watchdog и отклонило все пункты формулы во всех трех патентах, [117] однако в ответ WARF изменил пункты формулы во всех трех патентах, сделав их более узкими, и в 2008 году USPTO постановило, что измененные пункты формулы во всех трех патентах являются патентоспособными. Решение по одному из патентов (7 029 913) подлежало обжалованию, тогда как решения по двум другим — нет. [118] [119] Consumer Watchdog подал апелляцию на выдачу патента '913 в Совет по патентным апелляциям и вмешательствам (BPAI) USPTO, который удовлетворил апелляцию, и в 2010 году BPAI постановил, что измененные пункты патента '913 не являются патентоспособными. [120] Однако WARF смог возобновить судебное преследование по делу и сделал это, снова изменив пункты патента '913, чтобы сделать их более узкими, и в январе 2013 года измененные пункты были разрешены. [121]
В июле 2013 года Consumer Watchdog объявила, что подаст апелляцию на решение о признании патента '913 приемлемым в Апелляционном суде США по федеральному округу (CAFC), федеральном апелляционном суде, который рассматривает патентные дела. [122] На слушании в декабре 2013 года CAFC подняла вопрос о том, имеет ли Consumer Watchdog юридическое право на апелляцию; дело не может быть продолжено, пока этот вопрос не будет решен. [123]

Заболевания и состояния, при которых изучается лечение стволовыми клетками, включают:
Ведутся исследования по разработке различных источников стволовых клеток и применению методов лечения стволовыми клетками нейродегенеративных заболеваний и состояний, диабета , болезней сердца и других состояний. [144] Также ведутся исследования по созданию органоидов с использованием стволовых клеток, что позволит глубже понять развитие человека, органогенез и моделирование заболеваний человека. [145]
В последние годы, с появлением у ученых возможности изолировать и культивировать эмбриональные стволовые клетки , а также с ростом возможностей ученых создавать стволовые клетки с помощью переноса ядер соматических клеток и методов создания индуцированных плюрипотентных стволовых клеток , возникли разногласия , связанные как с политикой абортов , так и с клонированием человека .
Гепатотоксичность и лекарственные поражения печени являются причиной значительного числа неудач новых препаратов в разработке и отзыва с рынка, что подчеркивает необходимость скрининговых анализов, таких как гепатоцитоподобные клетки, полученные из стволовых клеток, которые способны обнаруживать токсичность на ранних этапах процесса разработки препарата . [146]
В августе 2021 года исследователи из онкологического центра принцессы Маргарет при Университетской сети здравоохранения опубликовали свое открытие механизма покоя в ключевых стволовых клетках, которое может помочь в разработке методов лечения рака в будущем. [147]