Серебро — химический элемент ; его символ Ag (от латинского argentum «серебро», происходящего от протоиндоевропейского *h₂erǵ « блестящий, белый » ) и атомный номер 47. Мягкий, белый, блестящий переходный металл , он обладает самой высокой электропроводностью , теплопроводностью и отражательной способностью среди всех металлов . [9] Серебро встречается в земной коре в чистой, свободной элементарной форме (« самородное серебро»), в виде сплава с золотом и другими металлами, а также в таких минералах, как аргентит и хлораргирит . Большая часть серебра производится как побочный продукт при очистке меди , золота, свинца и цинка .
Серебро издавна ценилось как драгоценный металл . Серебряный металл используется во многих инвестиционных монетах , иногда вместе с золотом : [10] хотя его больше, чем золота, его гораздо меньше как самородного металла . [11] Его чистота обычно измеряется на основе промилле ; сплав с чистотой 94% описывается как «чистота 0,940». Как один из семи металлов древности , серебро играло неизменную роль в большинстве человеческих культур.
Помимо валюты и инвестиционного средства ( монеты и слитки ), серебро используется в солнечных батареях , фильтрации воды , ювелирных изделиях , украшениях, дорогостоящей посуде и утвари (отсюда термин « серебряные изделия »), в электрических контактах и проводниках , в специальных зеркалах, оконных покрытиях, в катализе химических реакций, в качестве красителя в витражах и в специальных кондитерских изделиях. Его соединения используются в фотографической и рентгеновской пленке. Разбавленные растворы нитрата серебра и других соединений серебра используются в качестве дезинфицирующих средств и микробиоцидов ( олигодинамический эффект ), добавляются в бинты , повязки для ран, катетеры и другие медицинские инструменты .

Серебро по своим физическим и химическим свойствам похоже на своих двух вертикальных соседей в группе 11 периодической таблицы : медь и золото . Его 47 электронов расположены в конфигурации [Kr]4d 10 5s 1 , подобно меди ([Ar]3d 10 4s 1 ) и золоту ([Xe]4f 14 5d 10 6s 1 ); группа 11 является одной из немногих групп в d-блоке , которая имеет полностью согласованный набор электронных конфигураций. [13] Эта отличительная электронная конфигурация с одним электроном в самой высокой занятой s- подоболочке над заполненной d-подоболочкой объясняет многие из особых свойств металлического серебра. [14]
Серебро — относительно мягкий и чрезвычайно пластичный и ковкий переходный металл , хотя он немного менее ковкий, чем золото. Серебро кристаллизуется в гранецентрированной кубической решетке с объемным координационным числом 12, где делокализован только один электрон 5s, подобно меди и золоту. [15] В отличие от металлов с неполными d-оболочками, металлические связи в серебре не имеют ковалентного характера и относительно слабы. Это наблюдение объясняет низкую твердость и высокую пластичность монокристаллов серебра. [16]
Серебро имеет блестящий, белый, металлический блеск, который можно полировать до блеска , [ 17] и который настолько характерен, что название металла само по себе стало названием цвета . [14] Защищенное серебро имеет большую оптическую отражательную способность , чем алюминий, на всех длинах волн длиннее ~450 нм. [18] На длинах волн короче 450 нм отражательная способность серебра уступает отражательной способности алюминия и падает до нуля около 310 нм. [19]
Очень высокая электро- и теплопроводность свойственна элементам группы 11, поскольку их единственный s-электрон свободен и не взаимодействует с заполненной d-подоболочкой, поскольку такие взаимодействия (которые происходят в предыдущих переходных металлах) снижают подвижность электронов. [20] Теплопроводность серебра является одной из самых высоких среди всех материалов, хотя теплопроводность углерода (в аллотропе алмаза ) и сверхтекучего гелия-4 выше. [13] Электропроводность серебра является самой высокой среди всех металлов, даже больше, чем у меди. Серебро также имеет самое низкое контактное сопротивление среди всех металлов. [13] Серебро редко используется из-за его электропроводности из-за его высокой стоимости, хотя исключением является радиочастотная техника , особенно на ОВЧ и более высоких частотах, где серебряное покрытие улучшает электропроводность, поскольку эти токи имеют тенденцию течь по поверхности проводников, а не через внутреннюю часть. Во время Второй мировой войны в США для электромагнитов в калютронах для обогащения урана было использовано 13540 тонн серебра , в основном из-за нехватки меди во время войны. [21] [22] [23]
Серебро легко образует сплавы с медью, золотом и цинком . Сплавы цинка и серебра с низкой концентрацией цинка можно рассматривать как гранецентрированные кубические твердые растворы цинка в серебре, поскольку структура серебра в значительной степени не меняется, в то время как концентрация электронов увеличивается по мере добавления большего количества цинка. Дальнейшее увеличение концентрации электронов приводит к объемно-центрированным кубическим (концентрация электронов 1,5), сложным кубическим (1,615) и гексагональным плотноупакованным фазам (1,75). [15]
Природное серебро состоит из двух стабильных изотопов , 107 Ag и 109 Ag, причем 107 Ag немного более распространен (51,839% естественного содержания ). Такое почти равное содержание редко встречается в периодической таблице. Атомный вес составляет 107,8682(2) u ; [24] [25] это значение очень важно из-за важности соединений серебра, особенно галогенидов, в гравиметрическом анализе . [24] Оба изотопа серебра производятся в звездах посредством s-процесса (медленный захват нейтронов), а также в сверхновых посредством r-процесса (быстрый захват нейтронов). [26]
Было охарактеризовано двадцать восемь радиоизотопов , наиболее стабильным из которых является 105 Ag с периодом полураспада 41,29 дня, 111 Ag с периодом полураспада 7,45 дня и 112 Ag с периодом полураспада 3,13 часа. Серебро имеет многочисленные ядерные изомеры , наиболее стабильными из которых являются 108m Ag ( t 1/2 = 418 лет), 110m Ag ( t 1/2 = 249,79 дня) и 106m Ag ( t 1/2 = 8,28 дня). Все остальные радиоактивные изотопы имеют период полураспада менее часа, и большинство из них имеют период полураспада менее трех минут. [27]
Изотопы серебра имеют относительную атомную массу от 92,950 u ( 93 Ag) до 129,950 u ( 130 Ag); [28] первичный режим распада до наиболее распространенного стабильного изотопа 107 Ag — это захват электронов , а первичный режим после — бета-распад . Первичные продукты распада до 107 Ag — это изотопы палладия (элемент 46), а первичные продукты после — изотопы кадмия (элемент 48). [27]
Изотоп палладия 107 Pd распадается путем бета-излучения до 107 Ag с периодом полураспада 6,5 миллионов лет. Железные метеориты являются единственными объектами с достаточно высоким отношением палладия к серебру, чтобы давать измеримые вариации в распространенности 107 Ag. Радиогенный 107 Ag был впервые обнаружен в метеорите Санта-Клара в 1978 году. [29] Корреляции 107 Pd– 107 Ag, наблюдаемые в телах, которые явно расплавились с момента аккреции Солнечной системы, должны отражать присутствие нестабильных нуклидов в ранней Солнечной системе. [30]
Серебро — довольно нереакционноспособный металл. Это связано с тем, что его заполненная 4d-оболочка не очень эффективна в экранировании электростатических сил притяжения от ядра к внешнему 5s-электрону, и, следовательно, серебро находится вблизи основания электрохимического ряда ( E0 (Ag + / Ag) = +0,799 В). [14] В группе 11 серебро имеет самую низкую первую энергию ионизации (демонстрируя нестабильность 5s-орбитали), но имеет более высокие вторую и третью энергии ионизации, чем медь и золото (демонстрируя стабильность 4d-орбиталей), так что химия серебра преимущественно соответствует степени окисления +1, что отражает все более ограниченный диапазон степеней окисления вдоль переходной серии по мере заполнения и стабилизации d-орбиталей. [32] В отличие от меди , для которой большая энергия гидратации Cu 2+ по сравнению с Cu + является причиной того, что первая является более стабильной в водном растворе и твердых веществах, несмотря на отсутствие стабильной заполненной d-подоболочки последнего, в случае серебра этот эффект тонет в его большей второй энергии ионизации. Следовательно, Ag + является стабильной разновидностью в водном растворе и твердых веществах, при этом Ag 2+ гораздо менее стабилен, поскольку он окисляет воду. [32]
Большинство соединений серебра имеют значительный ковалентный характер из-за малого размера и высокой первой энергии ионизации (730,8 кДж/моль) серебра. [14] Кроме того, электроотрицательность серебра по Полингу 1,93 выше, чем у свинца (1,87), а его электроотрицательность 125,6 кДж/моль намного выше, чем у водорода (72,8 кДж/моль) и не намного меньше, чем у кислорода (141,0 кДж/моль). [33] Благодаря своей полной d-подоболочке серебро в своей основной степени окисления +1 проявляет относительно мало свойств переходных металлов, собственно из групп 4-10, образуя довольно нестабильные металлоорганические соединения , образуя линейные комплексы, показывающие очень низкие координационные числа, такие как 2, и образуя амфотерный оксид [34], а также фазы Цинтля , как у постпереходных металлов . [35] В отличие от предыдущих переходных металлов, степень окисления серебра +1 стабильна даже в отсутствие π-акцепторных лигандов . [32]
Серебро не реагирует с воздухом, даже при красном калении, и поэтому алхимики считали его благородным металлом , наряду с золотом. Его реакционная способность является промежуточной между реакционными способностями меди (которая образует оксид меди(I) при нагревании на воздухе до красного каления) и золота. Как и медь, серебро реагирует с серой и ее соединениями; в их присутствии серебро тускнеет на воздухе, образуя черный сульфид серебра (медь образует зеленый сульфат вместо этого, в то время как золото не реагирует). Хотя серебро не подвергается воздействию неокисляющих кислот, металл легко растворяется в горячей концентрированной серной кислоте , а также в разбавленной или концентрированной азотной кислоте . В присутствии воздуха, и особенно в присутствии перекиси водорода , серебро легко растворяется в водных растворах цианида . [31]
Три основные формы ухудшения исторических серебряных артефактов — это потускнение, образование хлорида серебра из-за длительного погружения в соленую воду, а также реакция с ионами нитрата или кислородом. Свежий хлорид серебра бледно-желтый, становится пурпурным под воздействием света; он слегка выступает над поверхностью артефакта или монеты. Осаждение меди в древнем серебре может быть использовано для датирования артефактов, поскольку медь почти всегда является составной частью серебряных сплавов. [36]
Металлическое серебро подвергается воздействию сильных окислителей, таких как перманганат калия ( KMnO
4) и дихромат калия ( K
2Кр
2О
7), и в присутствии бромида калия ( KBr ). Эти соединения используются в фотографии для отбеливания серебряных изображений, преобразуя их в бромид серебра, который может быть либо зафиксирован тиосульфатом , либо повторно проявлен для усиления исходного изображения. Серебро образует цианидные комплексы ( цианид серебра ), которые растворимы в воде в присутствии избытка ионов цианида. Растворы цианида серебра используются при гальванопокрытии серебра. [37]
Обычные степени окисления серебра следующие (в порядке убывания): +1 (наиболее стабильное состояние; например, нитрат серебра , AgNO 3 ); +2 (высокоокислительное состояние; например, фторид серебра(II) , AgF 2 ); и даже очень редко +3 (экстремально окислительное состояние; например, тетрафтораргентат(III) калия, KAgF 4 ). [38] Для достижения состояния +3 требуются очень сильные окислители, такие как фтор или пероксодисульфат , а некоторые соединения серебра(III) реагируют с атмосферной влагой и разъедают стекло. [39] Действительно, фторид серебра(III) обычно получают путем реакции серебра или монофторида серебра с самым сильным известным окислителем, дифторидом криптона . [40]
Серебро и золото имеют довольно низкое химическое сродство к кислороду, ниже, чем у меди, и поэтому ожидается, что оксиды серебра термически довольно нестабильны. Растворимые соли серебра(I) осаждают темно-коричневый оксид серебра(I) , Ag2O , при добавлении щелочи. (Гидроксид AgOH существует только в растворе; в противном случае он спонтанно разлагается до оксида.) Оксид серебра(I) очень легко восстанавливается до металлического серебра и разлагается на серебро и кислород выше 160 °C. [41] Это и другие соединения серебра(I) могут быть окислены сильным окислителем пероксодисульфатом до черного AgO, смешанного оксида серебра (I,III) формулы AgI AgIIIO2 . Также известны некоторые другие смешанные оксиды с серебром в неинтегральных степенях окисления, а именно Ag2O3 и Ag3O4 , как и Ag3O , который ведет себя как металлический проводник. [41]
Сульфид серебра(I) , Ag2S , очень легко образуется из его составных элементов и является причиной черного налета на некоторых старых серебряных предметах. Он также может быть образован в результате реакции сероводорода с металлическим серебром или водными ионами Ag + . Известно много нестехиометрических селенидов и теллуридов ; в частности, AgTe ~3 является низкотемпературным сверхпроводником . [41]

Единственный известный дигалогенид серебра — это дифторид AgF 2 , который можно получить из элементов при нагревании. Сильный, но термически стабильный и, следовательно, безопасный фторирующий агент, фторид серебра(II) часто используется для синтеза гидрофторуглеродов . [42]
В резком контрасте с этим известны все четыре галогенида серебра(I). Фторид , хлорид и бромид имеют структуру хлорида натрия, но иодид имеет три известные стабильные формы при различных температурах; при комнатной температуре это кубическая структура цинковой обманки . Все они могут быть получены прямой реакцией соответствующих им элементов. [42] По мере понижения галогенной группы галогенид серебра приобретает все более и более ковалентный характер, растворимость уменьшается, а цвет меняется с белого хлорида на желтый иодид, поскольку энергия, необходимая для переноса заряда лиганд-металл (X − Ag + → XAg), уменьшается. [42] Фторид является аномальным, так как ион фторида настолько мал, что имеет значительную энергию сольватации и, следовательно, хорошо растворим в воде и образует ди- и тетрагидраты. [42] Остальные три галогенида серебра крайне нерастворимы в водных растворах и очень часто используются в гравиметрических аналитических методах. [24] Все четыре являются светочувствительными (хотя монофторид чувствителен только к ультрафиолетовому свету), особенно бромид и иодид, которые фоторазлагаются до металлического серебра и поэтому использовались в традиционной фотографии . [42] Реакция выглядит следующим образом: [43]
Этот процесс необратим, поскольку освобожденный атом серебра обычно находится в дефекте кристалла или в месте примеси, так что энергия электрона достаточно снижена, чтобы он оказался «захваченным». [43]

Белый нитрат серебра , AgNO 3 , является универсальным предшественником многих других соединений серебра, особенно галогенидов, и гораздо менее чувствителен к свету. Когда-то его называли лунной каустикой , потому что древние алхимики называли серебро луной , считая, что серебро связано с Луной. [44] [45] Его часто используют для гравиметрического анализа, используя нерастворимость более тяжелых галогенидов серебра, для которых он является обычным предшественником. [24] Нитрат серебра используется во многих отношениях в органическом синтезе , например, для снятия защиты и окисления. Ag + обратимо связывает алкены , и нитрат серебра использовался для разделения смесей алкенов путем селективной абсорбции. Полученный аддукт можно разложить аммиаком для высвобождения свободного алкена. [46]
Желтый карбонат серебра , Ag2CO3 , может быть легко получен путем реакции водных растворов карбоната натрия с дефицитом нитрата серебра. [47] Его основное применение — производство серебряного порошка для использования в микроэлектронике. Он восстанавливается формальдегидом , производя серебро, свободное от щелочных металлов: [48]
Карбонат серебра также используется в качестве реагента в органическом синтезе, таком как реакция Кёнигса-Кнорра . В окислении Фетизона карбонат серебра на целите действует как окислитель для образования лактонов из диолов . Он также используется для превращения алкилбромидов в спирты . [47]
Фульминат серебра , AgCNO, мощное, чувствительное к прикосновению взрывчатое вещество , используемое в капсюлях , производится путем реакции металлического серебра с азотной кислотой в присутствии этанола . Другие взрывоопасные соединения серебра — это азид серебра , AgN 3 , образующийся при реакции нитрата серебра с азидом натрия , [49] и ацетилид серебра , Ag 2 C 2 , образующийся при реакции серебра с ацетиленовым газом в растворе аммиака. [32] В своей наиболее характерной реакции азид серебра разлагается взрывчато, выделяя газообразный азот: учитывая фоточувствительность солей серебра, такое поведение может быть вызвано освещением его кристаллов. [32]

Комплексы серебра, как правило, похожи на комплексы его более легкого гомолога меди. Комплексы серебра(III) редки и очень легко восстанавливаются до более стабильных низших степеней окисления, хотя они немного более стабильны, чем комплексы меди(III). Например, квадратные плоские периодатные [Ag(IO 5 OH) 2 ] 5− и теллуратные [Ag{TeO 4 (OH) 2 } 2 ] 5− комплексы могут быть получены окислением серебра(I) щелочным пероксодисульфатом . Желтый диамагнитный [AgF 4 ] − гораздо менее стабилен, дымит во влажном воздухе и реагирует со стеклом. [39]
Комплексы серебра(II) более распространены. Как и валентные изоэлектронные комплексы меди(II), они обычно квадратные и парамагнитные, что увеличивается за счет большего расщепления поля для 4d-электронов, чем для 3d-электронов. Водный Ag2 + , полученный окислением Ag + озоном, является очень сильным окислителем, даже в кислых растворах: он стабилизируется в фосфорной кислоте из-за комплексообразования. Окисление пероксодисульфатом обычно необходимо для получения более стабильных комплексов с гетероциклическими аминами , такими как [Ag(py) 4 ] 2+ и [Ag(bipy) 2 ] 2+ : они стабильны при условии, что противоион не может восстановить серебро обратно до степени окисления +1. [AgF4 ] 2− также известен в своей фиолетовой бариевой соли, как и некоторые комплексы серебра(II) с N- или O -донорными лигандами, такими как карбоксилаты пиридина. [50]
Наиболее важной степенью окисления серебра в комплексах является +1. Катион Ag + диамагнитен, как и его гомологи Cu + и Au + , поскольку все три имеют электронные конфигурации с замкнутой оболочкой без неспаренных электронов: его комплексы бесцветны, если лиганды не слишком легко поляризуются, такие как I − . Ag + образует соли с большинством анионов, но он неохотно координируется с кислородом, и поэтому большинство этих солей нерастворимы в воде: исключениями являются нитрат, перхлорат и фторид. Известен тетракоординированный тетраэдрический водный ион [Ag(H 2 O) 4 ] + , но характерная геометрия для катиона Ag + является 2-координированной линейной. Например, хлорид серебра легко растворяется в избытке водного аммиака с образованием [Ag(NH 3 ) 2 ] + ; Соли серебра растворяются в фотографии из-за образования тиосульфатного комплекса [Ag(S 2 O 3 ) 2 ] 3− ; а цианидная экстракция серебра (и золота) работает путем образования комплекса [Ag(CN) 2 ] − . Цианид серебра образует линейный полимер {Ag–C≡N→Ag–C≡N→}; тиоцианат серебра имеет похожую структуру, но вместо этого образует зигзаг из-за sp 3 - гибридизированного атома серы. Хелатирующие лиганды не способны образовывать линейные комплексы, и поэтому комплексы серебра(I) с ними имеют тенденцию образовывать полимеры; существует несколько исключений, таких как почти тетраэдрические комплексы дифосфина и диарсина [Ag(L–L) 2 ] + . [51]
При стандартных условиях серебро не образует простых карбонилов из-за слабости связи Ag–C. Некоторые известны при очень низких температурах около 6–15 К, например, зеленый, плоский парамагнитный Ag(CO) 3 , который димеризуется при 25–30 К, вероятно, образуя связи Ag–Ag. Кроме того, известен карбонил серебра [Ag(CO)] [B(OTeF 5 ) 4 ]. Известны полимерные комплексы AgLX с алкенами и алкинами , но их связи термодинамически слабее, чем даже у комплексов платины (хотя они образуются легче, чем у аналогичных комплексов золота): они также довольно несимметричны, показывая слабую π- связь в группе 11. σ- связи Ag–C также могут быть образованы серебром(I), как медью(I) и золотом(I), но простые алкилы и арилы серебра(I) еще менее стабильны, чем у меди(I) (которые имеют тенденцию взрываться в условиях окружающей среды). Например, плохая термическая стабильность отражается в относительных температурах разложения AgMe (−50 °C) и CuMe (−15 °C), а также у PhAg (74 °C) и PhCu (100 °C). [52]
Связь C–Ag стабилизируется перфторалкильными лигандами, например, в AgCF(CF 3 ) 2 . [53] Алкенилсеребряные соединения также более стабильны, чем их алкилсеребряные аналоги. [54] Комплексы серебра -NHC легко готовятся и обычно используются для приготовления других комплексов NHC путем замещения лабильных лигандов. Например, реакция комплекса бис(NHC)серебра(I) с бис(ацетонитрил)палладийдихлоридом или хлоридо(диметилсульфид)золотом(I) : [55]

Серебро образует сплавы с большинством других элементов периодической таблицы. Элементы из групп 1–3, за исключением водорода , лития и бериллия , очень хорошо смешиваются с серебром в конденсированной фазе и образуют интерметаллические соединения; элементы из групп 4–9 смешиваются только плохо; элементы из групп 10–14 (за исключением бора и углерода ) имеют очень сложные фазовые диаграммы Ag–M и образуют наиболее коммерчески важные сплавы; а остальные элементы периодической таблицы не имеют последовательности в своих фазовых диаграммах Ag–M. Безусловно, наиболее важными такими сплавами являются сплавы с медью: большая часть серебра, используемого для чеканки монет и ювелирных изделий, на самом деле является сплавом серебра и меди, а эвтектическая смесь используется при вакуумной пайке . Эти два металла полностью смешиваются как жидкости, но не как твердые вещества; Их важность в промышленности обусловлена тем фактом, что их свойства, как правило, подходят для широкого диапазона изменений концентрации серебра и меди, хотя большинство полезных сплавов, как правило, богаче серебром, чем эвтектическая смесь (71,9% серебра и 28,1% меди по весу и 60,1% серебра и 28,1% меди по атомам). [56]
Большинство других бинарных сплавов малопригодны: например, сплавы серебра и золота слишком мягкие, а сплавы серебра и кадмия слишком токсичны. Тройные сплавы имеют гораздо большее значение: зубные амальгамы обычно представляют собой сплавы серебра, олова и ртути, сплавы серебра, меди и золота очень важны в ювелирном деле (обычно с высоким содержанием золота) и имеют широкий диапазон твердости и цветов, сплавы серебра, меди и цинка полезны в качестве легкоплавких припоев, а сплав серебра, кадмия и индия (включая три соседних элемента в периодической таблице) полезен в ядерных реакторах из-за его высокого сечения захвата тепловых нейтронов , хорошей проводимости тепла, механической стабильности и устойчивости к коррозии в горячей воде. [56]
Слово silver появляется в древнеанглийском языке в различных вариантах написания, таких как seolfor и siolfor . Оно родственно древневерхненемецкому silabar ; готскому silubr ; или древнескандинавскому silfr , все из которых в конечном итоге происходят от протогерманского *silubra . Балто-славянские слова для серебра довольно похожи на германские (например, русское серебро [ serebró ], польское srebro , литовское sidãbras ), как и кельтиберийская форма silabur . Они могут иметь общее индоевропейское происхождение, хотя их морфология скорее предполагает неиндоевропейский Wanderwort . [57] [58] Некоторые ученые, таким образом , предложили палеоиспанское происхождение, указывая на баскскую форму zilharr в качестве доказательства. [59]
Химический символ Ag происходит от латинского слова для серебра , argentum (сравните древнегреческое ἄργυρος , árgyros ), от протоиндоевропейского корня * h₂erǵ- (ранее реконструированного как *arǵ- ), что означает « белый » или « блестящий » . Это было обычное протоиндоевропейское слово для металла, рефлексы которого отсутствуют в германских и балто-славянских языках. [58]


Серебро было известно еще в доисторические времена: [60] три металла группы 11, медь, серебро и золото, встречаются в природе в элементарной форме и, вероятно, использовались в качестве первых примитивных форм денег в отличие от простого обмена. [61] В отличие от меди, серебро не привело к росту металлургии из-за своей низкой структурной прочности; его чаще использовали в качестве украшений или денег. [62] Поскольку серебро более реакционноспособно, чем золото, поставки самородного серебра были гораздо более ограниченными, чем поставки золота. [61] Например, серебро было дороже золота в Египте примерно до пятнадцатого века до нашей эры: [63] считается, что египтяне отделили золото от серебра, нагревая металлы с солью, а затем восстанавливая полученный хлорид серебра до металла. [64]
Ситуация изменилась с открытием купелирования , метода, который позволил извлекать металлическое серебро из руд. Хотя шлаковые отвалы, найденные в Малой Азии и на островах Эгейского моря, указывают на то, что серебро отделялось от свинца еще в 4-м тысячелетии до н. э. [ 13] и одним из самых ранних центров добычи серебра в Европе была Сардиния в ранний период халколита [65] , эти методы не получили широкого распространения до более позднего времени, когда они распространились по всему региону и за его пределами. [63] Истоки производства серебра в Индии , Китае и Японии, почти наверняка, были столь же древними, но не документированы из-за их большого возраста. [64]

Когда финикийцы впервые прибыли на территорию современной Испании , они получили так много серебра, что не смогли поместить его на своих кораблях, и в результате использовали серебро для утяжеления якорей вместо свинца. [63] Ко времени греческой и римской цивилизаций серебряные монеты были основным продуктом экономики: [61] греки уже добывали серебро из галенита к 7 веку до нашей эры, [63] а возвышение Афин отчасти стало возможным благодаря близлежащим серебряным рудникам в Лаврионе , из которых они добывали около 30 тонн в год с 600 по 300 год до нашей эры. [66] Стабильность римской валюты в значительной степени зависела от поставок серебряных слитков, в основном из Испании, которые римские шахтеры производили в масштабах, не имевших себе равных до открытия Нового Света . Достигнув пика производства в 200 тонн в год, предполагаемый запас серебра в 10 000 тонн обращался в римской экономике в середине второго века нашей эры, что в пять-десять раз больше, чем совокупное количество серебра, доступное средневековой Европе и Аббасидскому халифату около 800 года нашей эры. [67] [68] Римляне также зафиксировали добычу серебра в центральной и северной Европе в тот же период времени. Это производство почти полностью остановилось с падением Римской империи, и не возобновлялось до времен Карла Великого : к тому времени уже было извлечено десятки тысяч тонн серебра. [64]
Центральная Европа стала центром производства серебра в Средние века , поскольку средиземноморские месторождения, эксплуатируемые древними цивилизациями, были истощены. Серебряные рудники были открыты в Богемии , Саксонии , Эльзасе , регионе Лан , Зигерланде , Силезии , Венгрии , Норвегии , Штирии , Шваце и южном Шварцвальде . Большинство этих руд были довольно богаты серебром и могли быть просто отделены вручную от оставшейся породы, а затем выплавлены; также были обнаружены некоторые месторождения самородного серебра. Многие из этих рудников вскоре были истощены, но некоторые из них оставались активными до промышленной революции , до которой мировое производство серебра составляло около скудных 50 тонн в год. [64] В Америке технология высокотемпературной купелирования серебра и свинца была разработана доинкскими цивилизациями еще в 60–120 годах нашей эры; месторождения серебра в Индии, Китае, Японии и доколумбовой Америке продолжали добываться в это время. [64] [69]
С открытием Америки и разграблением серебра испанскими конкистадорами Центральная и Южная Америка стали доминирующими производителями серебра примерно до начала 18 века, в частности Перу , Боливия , Чили и Аргентина : [64] последняя из этих стран позже взяла свое название от металла, который составлял большую часть ее минеральных богатств. [66] Торговля серебром уступила место глобальной сети обмена . Как сказал один историк, серебро «обошло весь мир и заставило мир вращаться». [70] Большая часть этого серебра оказалась в руках китайцев. Португальский торговец в 1621 году заметил, что серебро «бродит по всему миру... прежде чем стекаться в Китай, где оно остается как бы в своем естественном центре». [71] Тем не менее, большая его часть ушла в Испанию, что позволило испанским правителям преследовать военные и политические амбиции как в Европе, так и в Америке. «Новые мировые рудники», заключили несколько историков, «поддерживали Испанскую империю». [72]
В 19 веке первичное производство серебра переместилось в Северную Америку, в частности в Канаду , Мексику и Неваду в Соединенных Штатах : некоторое вторичное производство из свинцовых и цинковых руд также имело место в Европе, а месторождения в Сибири и на Дальнем Востоке России, а также в Австралии были добыты. [64] Польша стала важным производителем в 1970-х годах после открытия месторождений меди, которые были богаты серебром, до того, как центр производства вернулся в Америку в следующем десятилетии. Сегодня Перу и Мексика по-прежнему являются одними из основных производителей серебра, но распределение производства серебра по всему миру довольно сбалансировано, и около одной пятой поставок серебра поступает из вторичного сырья, а не из нового производства. [64]

Серебро играет определенную роль в мифологии и нашло различное применение в качестве метафоры и в фольклоре. В «Трудах и днях » греческого поэта Гесиода (строки 109–201) перечисляются различные эпохи человека, названные в честь металлов, таких как золото, серебро, бронза и железо, чтобы объяснить последовательные эпохи человечества. [73] В «Метаморфозах » Овидия содержится еще один пересказ истории, содержащий иллюстрацию метафорического использования серебра для обозначения второго лучшего в ряду, лучшего, чем бронза, но худшего, чем золото:
Но когда добрый Сатурн , изгнанный сверху,
Был низвергнут в ад, мир оказался под властью Юпитера .
Последующие времена - век серебряный,
Превосходная медь, но более превосходная золотом.— Овидий, Метаморфозы , Книга I, перевод Джона Драйдена
В фольклоре серебро обычно считалось обладающим мистическими силами: например, пуля, отлитая из серебра, часто считается в таком фольклоре единственным оружием, которое эффективно против оборотня , ведьмы или других монстров . [74] [75] [76] Отсюда идиома серебряной пули превратилась в образное обозначение любого простого решения с очень высокой эффективностью или почти чудесными результатами, как в широко обсуждаемой статье по программной инженерии « Нет серебряной пули ». [77] Другие силы, приписываемые серебру, включают обнаружение яда и облегчение перехода в мифическое царство фей . [76]
Производство серебра также вдохновило образный язык. Явные ссылки на купелирование встречаются на протяжении всего Ветхого Завета Библии , например, в упреке Иеремии Иуде: «Раздувальные мехи обгорели, свинец истлел от огня; плавильщик плавил напрасно, ибо нечестивые не были вырваны. Люди назовут их нечестивым серебром, потому что Господь отверг их». (Иеремия 6:19–20) Иеремия также знал о листовом серебре, что является примером ковкости и пластичности металла: «Серебро, разложенное в листы, привезено из Фарсиса, а золото — из Уфаза, дело художника и рук плавильщика; одежда их — голубая и пурпурная: все это дело людей искусных». (Иеремия 10:9) [63]
Серебро также имеет более негативные культурные значения: идиома тридцать сребреников, относящаяся к награде за предательство, отсылает к взятке, которую, как говорится в Новом Завете, Иуда Искариот взял у иудейских лидеров в Иерусалиме, чтобы выдать Иисуса из Назарета солдатам первосвященника Каиафы. [78] С этической точки зрения серебро также символизирует жадность и деградацию сознания; это негативный аспект, извращение его ценности. [79]

Содержание серебра в земной коре составляет 0,08 частей на миллион , что почти соответствует содержанию ртути . В основном оно встречается в сульфидных рудах, особенно в акантите и аргентите , Ag2S . Аргентитовые месторождения иногда также содержат самородное серебро, когда они встречаются в восстановительных средах, а при контакте с соленой водой они превращаются в хлораргирит (включая роговое серебро ), AgCl, который распространен в Чили и Новом Южном Уэльсе . [80] Большинство других серебряных минералов представляют собой пниктиды или халькогениды серебра ; они, как правило, являются блестящими полупроводниками. Большинство настоящих серебряных месторождений, в отличие от содержащих серебро месторождений других металлов, возникли в результате вулканизма третичного периода . [81]
Основными источниками серебра являются руды меди, медно-никелевого сплава, свинца и свинца-цинка, добываемые в Перу , Боливии , Мексике , Китае , Австралии , Чили , Польше и Сербии . [13] Перу, Боливия и Мексика добывают серебро с 1546 года и по-прежнему являются основными мировыми производителями. Крупнейшими рудниками по добыче серебра являются Каннингтон (Австралия), Фреснильо (Мексика), Сан-Кристобаль (Боливия), Антамина (Перу), Рудна (Польша) и Пенаскито (Мексика). [82] Крупнейшими проектами по разработке рудников в ближайшей перспективе до 2015 года являются Паскуа-Лама (Чили), Навидад (Аргентина), Хаунисипио (Мексика), Малку-Хота (Боливия) [83] и Хакетт-Ривер (Канада). [82] В Центральной Азии , как известно, Таджикистан имеет некоторые из крупнейших месторождений серебра в мире. [84]
Серебро обычно встречается в природе в сочетании с другими металлами или в минералах, содержащих соединения серебра, как правило, в форме сульфидов, таких как галенит (сульфид свинца) или церуссит (карбонат свинца). Таким образом, первичное производство серебра требует плавки, а затем купелирования руд свинца, содержащих серебро, исторически важный процесс. [85] Свинец плавится при 327 °C, оксид свинца при 888 °C, а серебро плавится при 960 °C. Чтобы отделить серебро, сплав снова плавят при высокой температуре от 960 °C до 1000 °C в окислительной среде. Свинец окисляется до оксида свинца , тогда известного как глет , который захватывает кислород из других присутствующих металлов. Жидкий оксид свинца удаляется или поглощается капиллярным действием в футеровке горна. [86] [87] [88]
Сегодня металлическое серебро в основном производится вместо этого как вторичный побочный продукт электролитического рафинирования меди, свинца и цинка, а также путем применения процесса Паркса на свинцовом слитке из руды, которая также содержит серебро. [89] В таких процессах серебро следует за цветным металлом, о котором идет речь, через его концентрацию и плавку, а затем очищается. Например, при производстве меди очищенная медь электролитически осаждается на катоде, в то время как менее реактивные драгоценные металлы, такие как серебро и золото, собираются под анодом в виде так называемого «анодного шлама». Затем его отделяют и очищают от неблагородных металлов путем обработки горячей аэрированной разбавленной серной кислотой и нагревания с известковым или кремниевым флюсом, прежде чем серебро очищается до чистоты более 99,9% посредством электролиза в растворе нитрата . [80]
Чистое серебро коммерческого качества имеет чистоту не менее 99,9%, а чистота может превышать 99,999%. В 2022 году Мексика была крупнейшим производителем серебра (6300 тонн или 24,2% от общемирового объема в 26 000 тонн), за ней следовали Китай (3600 тонн) и Перу (3100 тонн). [89]
Концентрация серебра в морской воде низкая (пмоль/л). Уровни варьируются в зависимости от глубины и между водоемами. Концентрации растворенного серебра варьируются от 0,3 пмоль/л в прибрежных поверхностных водах до 22,8 пмоль/л в пелагических глубоких водах. [90] Анализ присутствия и динамики серебра в морской среде затруднен из-за этих особенно низких концентраций и сложных взаимодействий в окружающей среде. [91] Хотя это редкий следовой металл, на его концентрации сильно влияют речные, эоловые, атмосферные и апвеллинговые поступления, а также антропогенные поступления через сбросы, утилизацию отходов и выбросы промышленных компаний. [92] [93] Другие внутренние процессы, такие как разложение органического вещества, могут быть источником растворенного серебра в более глубоких водах, которое попадает в некоторые поверхностные воды через апвеллинг и вертикальное смешивание. [93]
В Атлантике и Тихом океане концентрации серебра минимальны на поверхности, но увеличиваются в более глубоких водах. [94] Серебро поглощается планктоном в фотической зоне, ремобилизуется с глубиной и обогащается в глубоких водах. Серебро переносится из Атлантики в другие океанические водные массы. [92] В водах северной части Тихого океана серебро ремобилизуется медленнее и все больше обогащается по сравнению с глубокими водами Атлантики. Концентрации серебра увеличиваются, следуя за основным океаническим конвейером, который переносит воду и питательные вещества из Северной Атлантики в Южную Атлантику и в Северную часть Тихого океана. [95]
Не существует обширного количества данных, посвященных тому, как серебро влияет на морскую жизнь, несмотря на вероятное пагубное воздействие, которое оно может оказывать на организмы посредством биоаккумуляции , ассоциации с твердыми частицами и сорбции . [90] Только около 1984 года ученые начали понимать химические характеристики серебра и его потенциальную токсичность. Фактически, ртуть является единственным другим следовым металлом, который превосходит токсическое воздействие серебра; полная степень токсичности серебра не ожидается в океанических условиях из-за его тенденции переходить в нереактивные биологические соединения. [96]
В одном исследовании присутствие избыточного ионного серебра и наночастиц серебра вызвало эффекты биоаккумуляции в органах данио-рерио и изменило химические пути в их жабрах. [97] Кроме того, очень ранние экспериментальные исследования продемонстрировали, как токсические эффекты серебра колеблются в зависимости от солености и других параметров, а также между стадиями жизни и различными видами, такими как рыбы, моллюски и ракообразные. [98] Другое исследование обнаружило повышенные концентрации серебра в мышцах и печени дельфинов и китов, что указывает на загрязнение этим металлом в течение последних десятилетий. Серебро — нелегкий металл для организма, и повышенные концентрации могут привести к смерти. [99]

Самые ранние известные монеты были отчеканены в царстве Лидия в Малой Азии около 600 г. до н. э. [100] Монеты Лидии были сделаны из электрума , который является естественным сплавом золота и серебра, который был доступен на территории Лидии. [100] С тех пор серебряные стандарты , в которых стандартной экономической единицей счета является фиксированный вес серебра, были широко распространены по всему миру до 20-го века. Известные серебряные монеты на протяжении веков включают греческую драхму , [101] римский денарий , [102] исламский дирхам , [103] каршапану из древней Индии и рупию со времен Империи Великих Моголов (сгруппированную с медными и золотыми монетами, чтобы создать триметаллический стандарт), [104] и испанский доллар . [105]
Соотношение между количеством серебра, используемого для чеканки монет, и количеством серебра, используемого для других целей, значительно колебалось с течением времени; например, во время войны больше серебра, как правило, использовалось для чеканки монет для финансирования войны. [106]
Сегодня серебряные слитки имеют валютный код ISO 4217 XAG, один из четырех драгоценных металлов , имеющих его (остальные — палладий , платина и золото). [107] Серебряные монеты производятся из литых прутков или слитков, прокатываются до нужной толщины, подвергаются термической обработке, а затем используются для вырезания заготовок . Затем эти заготовки фрезеруются и чеканятся на чеканочном прессе; современные чеканочные прессы могут производить 8000 серебряных монет в час. [106]
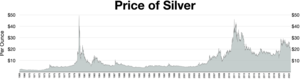
Цены на серебро обычно указываются в тройских унциях . Одна тройская унция равна 31,1034768 грамма. Лондонский серебряный фиксинг публикуется каждый рабочий день в полдень по лондонскому времени. [108] Эта цена определяется несколькими крупными международными банками и используется участниками лондонского рынка драгоценных металлов для торговли в этот день. Цены чаще всего указываются в долларах США (USD), фунтах стерлингов (GBP) и евро (EUR).


Основным применением серебра, помимо чеканки монет, на протяжении большей части истории было изготовление ювелирных изделий и других предметов общего пользования, и это продолжает оставаться основным применением и сегодня. Примерами служат столовое серебро для столовых приборов, для которых серебро очень подходит из-за его антибактериальных свойств. Западные концертные флейты обычно покрываются серебром или изготавливаются из него ; [ 110] на самом деле, большинство столовых приборов только покрываются серебром, а не изготавливаются из чистого серебра; серебро обычно наносится гальваническим способом . Посеребренное стекло (в отличие от металла) используется для зеркал, термосов и украшений рождественской елки. [111]
Поскольку чистое серебро очень мягкое, большую часть серебра, используемого для этих целей, сплавляют с медью, причем обычно используют пробы 925/1000, 835/1000 и 800/1000. Одним из недостатков является легкое потускнение серебра в присутствии сероводорода и его производных. Включение драгоценных металлов, таких как палладий, платина и золото, обеспечивает устойчивость к потускнению, но является довольно дорогостоящим; неблагородные металлы, такие как цинк , кадмий , кремний и германий, не полностью предотвращают коррозию и, как правило, влияют на блеск и цвет сплава. Электролитически очищенное чистое серебряное покрытие эффективно для повышения устойчивости к потускнению. Обычными решениями для восстановления блеска потускневшего серебра являются ванны для погружения, которые восстанавливают поверхность сульфида серебра до металлического серебра, и очистка слоя потускнения пастой; последний подход также имеет приятный побочный эффект одновременной полировки серебра. [110]
В медицине серебро включается в повязки на раны и используется в качестве антибиотического покрытия в медицинских устройствах. Повязки на раны, содержащие сульфадиазин серебра или наноматериалы серебра, используются для лечения внешних инфекций. Серебро также используется в некоторых медицинских целях, таких как мочевые катетеры (где предварительные данные указывают на то, что оно снижает инфекции мочевыводящих путей , связанные с катетером ) и в эндотрахеальных дыхательных трубках (где данные свидетельствуют о том, что оно снижает пневмонию , связанную с вентилятором ). [112] [113] Ион серебра является биоактивным и в достаточной концентрации легко убивает бактерии in vitro . Ионы серебра мешают ферментам бактерий, которые транспортируют питательные вещества, образуют структуры и синтезируют клеточные стенки; эти ионы также связываются с генетическим материалом бактерий. Серебро и наночастицы серебра используются в качестве противомикробного средства в различных промышленных, медицинских и бытовых целях: например, пропитка одежды наночастицами серебра позволяет ей дольше оставаться без запаха. [114] [115] Бактерии могут вырабатывать устойчивость к антимикробному действию серебра. [116] Соединения серебра поглощаются организмом, как и соединения ртути , но не обладают токсичностью последних. Серебро и его сплавы используются в черепной хирургии для замены кости, а амальгамы серебра, олова и ртути используются в стоматологии. [111] Диамминфторид серебра , фторидная соль координационного комплекса с формулой [Ag(NH 3 ) 2 ]F, является местным лекарственным средством (препаратом), используемым для лечения и профилактики кариеса зубов (полостей) и снятия гиперчувствительности дентина. [117]
Серебро очень важно в электронике для проводников и электродов из-за его высокой электропроводности даже в потускневшем состоянии. Массовое серебро и серебряная фольга использовались для изготовления вакуумных трубок и продолжают использоваться сегодня в производстве полупроводниковых приборов, схем и их компонентов. Например, серебро используется в высококачественных разъемах для радиочастот , ОВЧ и более высоких частот, особенно в настроенных схемах, таких как резонаторные фильтры , где проводники не могут быть масштабированы более чем на 6%. Печатные схемы и антенны RFID изготавливаются с использованием серебряных красок, [13] [118] Порошковое серебро и его сплавы используются в пастообразных препаратах для проводниковых слоев и электродов, керамических конденсаторов и других керамических компонентов. [119]
Припои , содержащие серебро , используются для пайки металлических материалов, в основном сплавов на основе кобальта , никеля и меди, инструментальных сталей и драгоценных металлов. Основными компонентами являются серебро и медь, а другие элементы выбираются в соответствии с конкретным желаемым применением: например, цинк, олово, кадмий, палладий, марганец и фосфор . Серебро обеспечивает повышенную обрабатываемость и коррозионную стойкость во время использования. [120]
Серебро полезно в производстве химического оборудования из-за его низкой химической реактивности, высокой теплопроводности и простоты обработки. Серебряные тигли (легированные 0,15% никеля, чтобы избежать перекристаллизации металла при красном калении) используются для проведения щелочной плавки. Медь и серебро также используются при проведении химии с фтором . Оборудование, предназначенное для работы при высоких температурах, часто покрывают серебром. Серебро и его сплавы с золотом используются в качестве проволочных или кольцевых уплотнений для кислородных компрессоров и вакуумного оборудования. [121]
Металлическое серебро является хорошим катализатором для реакций окисления ; на самом деле, оно даже слишком хорошо для большинства целей, так как мелкодисперсное серебро имеет тенденцию приводить к полному окислению органических веществ до углекислого газа и воды, и поэтому вместо него обычно используют более крупнозернистое серебро. Например, 15% серебра, нанесенное на α-Al2O3 или силикатах , является катализатором окисления этилена до этиленоксида при 230–270 °C. Дегидрирование метанола до формальдегида проводится при 600–720 °C над серебряной сеткой или кристаллами в качестве катализатора, как и дегидрирование изопропанола до ацетона . В газовой фазе гликоль дает глиоксаль , а этанол дает ацетальдегид , в то время как органические амины дегидрируются до нитрилов . [121]
До появления цифровой фотографии , которая сейчас доминирует, светочувствительность галогенидов серебра использовалась для использования в традиционной пленочной фотографии. Светочувствительная эмульсия, используемая в черно-белой фотографии, представляет собой суспензию кристаллов галогенида серебра в желатине , возможно, смешанную с некоторыми соединениями благородных металлов для улучшения светочувствительности, проявки и настройки [ уточнить ] .
Цветная фотография требует добавления специальных компонентов красителя и сенсибилизаторов, так что исходное черно-белое серебряное изображение соединяется с другим компонентом красителя. Исходные серебряные изображения отбеливаются, а затем серебро извлекается и перерабатывается. Нитрат серебра является исходным материалом во всех случаях. [122]
Рынок нитрата серебра и галогенидов серебра для фотографии быстро сократился с ростом цифровых камер. От пикового мирового спроса на фотографическое серебро в 1999 году (267 000 000 тройских унций или 8 304,6 тонн ) рынок сократился почти на 70% к 2013 году. [123]
Наносереберные частицы размером от 10 до 100 нанометров используются во многих приложениях. Они используются в проводящих чернилах для печатной электроники и имеют гораздо более низкую температуру плавления, чем более крупные серебряные частицы микрометрового размера. [124] Они также используются в медицине в антибактериальных и противогрибковых средствах во многом так же, как и более крупные серебряные частицы. [115] Кроме того, по данным Европейской обсерватории наноматериалов (EUON), серебряные наночастицы используются как в пигментах, так и в косметике. [125] [126]

Чистый металлический серебряный краситель используется в качестве пищевого красителя. Он имеет обозначение E174 и одобрен в Европейском Союзе . [127] Традиционные индийские и пакистанские блюда иногда включают декоративную серебряную фольгу, известную как варк , [128] а в различных других культурах серебряное драже используется для украшения тортов, печенья и других десертов. [129]
Фотохромные линзы включают галогениды серебра, так что ультрафиолетовый свет при естественном дневном свете высвобождает металлическое серебро, затемняя линзы. Галогениды серебра преобразуются при более низкой интенсивности света. Бесцветные пленки хлорида серебра используются в детекторах излучения . Цеолитовые сита, включающие ионы Ag +, используются для опреснения морской воды во время спасательных операций, используя ионы серебра для осаждения хлорида в виде хлорида серебра. Серебро также используется из-за его антибактериальных свойств для дезинфекции воды, но его применение ограничено ограничениями на потребление серебра. Коллоидное серебро аналогичным образом используется для дезинфекции закрытых плавательных бассейнов; хотя оно имеет преимущество в том, что не выделяет запах, как обработка гипохлоритом , коллоидное серебро недостаточно эффективно для более загрязненных открытых плавательных бассейнов. Небольшие кристаллы йодида серебра используются при засеве облаков , чтобы вызвать дождь. [115]
В 2007 году Законодательное собрание Техаса объявило серебро официальным драгоценным металлом Техаса. [130]
Соединения серебра обладают низкой токсичностью по сравнению с соединениями большинства других тяжелых металлов , поскольку они плохо усваиваются организмом человека при попадании внутрь, а то, что усваивается, быстро превращается в нерастворимые соединения серебра или образует комплексы с металлотионеином . Фторид серебра и нитрат серебра являются едкими и могут вызывать повреждение тканей, что приводит к гастроэнтериту , диарее , падению артериального давления , судорогам, параличу или остановке дыхания . Было замечено, что у животных, которым многократно вводили соли серебра, наблюдалась анемия , замедление роста, некроз печени и жировая дегенерация печени и почек; у крыс, которым имплантировали серебряную фольгу или вводили коллоидное серебро , наблюдалось развитие локализованных опухолей. Коллоидное серебро, вводимое парентерально, вызывает острое отравление серебром. [132] Некоторые водные виды особенно чувствительны к солям серебра и солям других драгоценных металлов; в большинстве случаев серебро не представляет серьезной экологической опасности. [132]
В больших дозах серебро и содержащие его соединения могут всасываться в кровеносную систему и откладываться в различных тканях организма, что приводит к аргирии , которая приводит к сине-серой пигментации кожи, глаз и слизистых оболочек . Аргирия встречается редко и, насколько известно, не наносит вреда здоровью человека, хотя она обезображивает и обычно постоянна. Легкие формы аргирии иногда ошибочно принимают за цианоз , синеватый оттенок кожи, вызванный недостатком кислорода. [132] [13]
Металлическое серебро, как и медь, является антибактериальным средством, которое было известно древним и впервые научно исследовано и названо олигодинамическим эффектом Карлом Негели . Ионы серебра повреждают метаболизм бактерий даже при таких низких концентрациях, как 0,01–0,1 миллиграмма на литр; металлическое серебро оказывает аналогичное действие из-за образования оксида серебра. Этот эффект теряется в присутствии серы из-за крайней нерастворимости сульфида серебра. [132]
Некоторые соединения серебра очень взрывоопасны, например, азотные соединения азид серебра, амид серебра и фульминат серебра, а также ацетилид серебра , оксалат серебра и оксид серебра (II). Они могут взрываться при нагревании, силе, сушке, освещении или иногда спонтанно. Чтобы избежать образования таких соединений, аммиак и ацетилен следует хранить вдали от серебряного оборудования. Соли серебра с сильно окисляющими кислотами, такими как хлорат серебра и нитрат серебра, могут взрываться при контакте с материалами, которые легко окисляются, такими как органические соединения, сера и сажа. [132]